江西省宜春市五校2023-2024学年高一上学期11月第一次联考化学试题(PDF版含解析)
文档属性
| 名称 | 江西省宜春市五校2023-2024学年高一上学期11月第一次联考化学试题(PDF版含解析) |  | |
| 格式 | |||
| 文件大小 | 651.8KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-11-18 19:04:57 | ||
图片预览



文档简介
江西省丰城九中、高安二中、万载中学
宜丰中学、樟树中学
高一年级上学期第一次联考化学学科试题
考试范围(必修一、必修二第五章一、二节)
一、单选题(每小题只有一个答案,每小题 3 分,共 42 分)
1.下列说法正确的是( )
A.我国自主研发的“龙芯 1 号”CPU 芯片与红宝石主要成份都含硅元素
B.过氧化钠可用作潜水艇中氧气的来源,表现了过氧化钠的强氧化性
C.氯气具有酸性,可与烧碱或石灰乳反应制备含氯消毒剂
D.洁厕灵和 84 消毒液不能混合使用
2.在元素周期表中,某些主族元素与其右下方的主族元素的有些性质是相似的,这称为“对
角线规则”。根据“对角线规则”,下列有关推断错误的是( )
A.BeO 是两性氧化物 B.Li 在空气中燃烧可生成 Li2O2和Li3N
C.B 的最高价氧化物对应的水化物为 H3BO3 D.碱性: NaOH>Be(OH)2
3. 在给定条件下,下列选项所示的物质间转化均能实现的是( )
N H3 ,CO2 NaHCO △A.饱和食盐水 3 Na2CO3 s
N g O 2 g NO g N aOH aq B. 2 NaNO3 aq放电
Al s N aOH aq NaAlO aq 过 量 HCl aq C. 2 Al OH s3
D.SO C aCl 2 aq 2 CaSO
O
3 2 CaSO4
4.下列离子方程式正确的是 ( )
A.Cl2 通入FeBr2溶液中反应,若有四分之一的溴元素被氧化:
2Fe2 2Br 2Cl 2Fe3 2 Br2 4Cl
B. NH4HSO4溶液与少量 NaOH 溶液混合加热:H
+ + OH-= H2O
2 2
C.NaHCO3 溶液中加过量的澄清石灰水:Ca 2OH 2HCO3 CaCO3 2H2 O CO3
D.NH4Al(SO4 )2与Ba(OH)2可能发生的反应:
2NH 4 Al
3 4SO2 4 4Ba
2 6OH 4BaSO4 2NH3 AlO
2 4H2O
宜春五校高一上学期第一次联考 化学试卷 第 1 页 共 7 页
{#{QQABLQAEogiAABJAARhCAw2wCAAQkBCACCoGBFAAMAIAQRFABCA=}#}
5.下列有关原子结构和元素周期律表述正确的是( )
①原子序数为 9的元素的最高化合价为+7
②ⅦA族元素是同周期中非金属性最强的元素
③元素的原子核电荷数和中子数一定相等
④原子序数为 12 的元素位于元素周期表的第三周期ⅡA 族
⑤同周期相邻主族元素的原子序数之差一定为 1
⑥同一元素的各种同位素的物理性质、化学性质均相同
⑦金属元素原子的最外层电子数一定≤4
A.②④ B.①②⑤ C.②⑤⑦ D.③④⑤⑥⑦
6.下列说法中正确的是( )
①酸性氧化物在一定条件下均能与碱发生反应
②金属氧化物不一定都是碱性氧化物,但碱性氧化物一定都是金属氧化物
③蔗糖、硫酸钡和水分别属于非电解质、强电解质和弱电解质
④硫酸、纯碱、醋酸钠和生石灰分别属于酸、碱、盐和氧化物
⑤因为胶体中分散质粒子直径比溶液中溶质粒子大,所以胶体可以用过滤的方法把胶粒分离
出来 ⑥胶体、溶液、浊液的本质区别是丁达尔效应
A.3 个 B.4个 C.5个 D.6个
7.取某固体样品,进行如下实验:
①取一定量的样品,加足量水充分溶解,过滤得到滤液和滤渣;
②取一定量滤液分成两份。一份加入 NaOH 溶液并加热,产生能使湿润的 pH 试纸变蓝的气体;
另外一份加入 BaCl2溶液,无明显现象产生;
③取少量滤渣,加入足量稀盐酸,滤渣部分溶解,再加入新制氯水和 KSCN 溶液,溶液显血
红色。 根据上述实验现象,该固体样品的成分可能是( )
A.Fe2O3、 (NH4)2CO3 、CaCl2 B.Fe、AgNO3、NH4NO3
C.FeO、NH4Cl、BaCO3 D.(NH4)2SO4 、SiO2、FeCl2
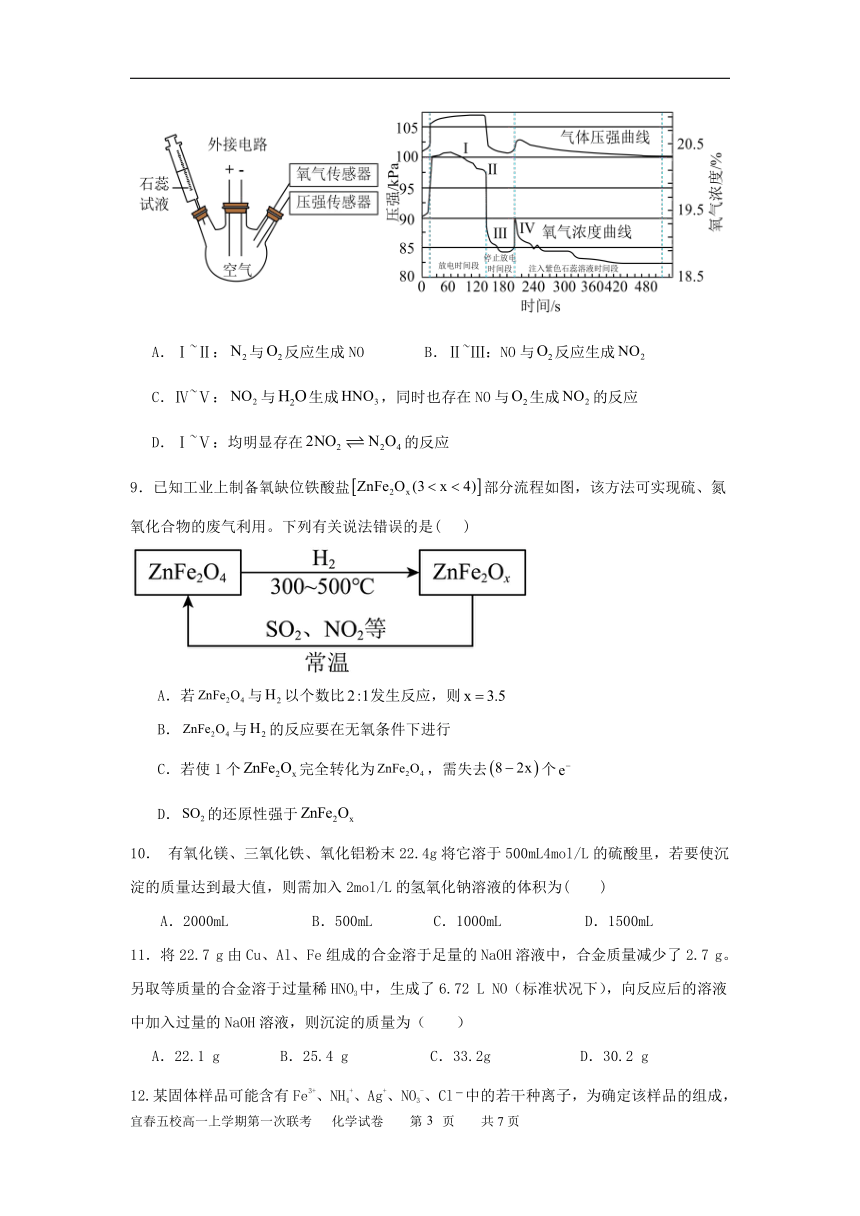
8.在密闭容器中,外接电路放电,研究压强与氧气的变化。实验操作如下:①外接电路放
电一段时间;②停止放电一段时间;③注入石蕊试液。得到压强、氧气浓度在以上时间段的
变化图像如下(忽略温度变化)。下列基于图像的推理或判断错误的是( )
宜春五校高一上学期第一次联考 化学试卷 第 2 页 共 7 页
{#{QQABLQAEogiAABJAARhCAw2wCAAQkBCACCoGBFAAMAIAQRFABCA=}#}
A.Ⅰ~Ⅱ: N2与O2反应生成 NO B.Ⅱ~Ⅲ:NO 与O2反应生成 NO2
C.Ⅳ~Ⅴ: NO2 与H2O生成HNO3,同时也存在 NO 与O2生成 NO2 的反应
D.Ⅰ~Ⅴ:均明显存在 2NO2 N2O4 的反应
9.已知工业上制备氧缺位铁酸盐 ZnFe2Ox (3 x 4) 部分流程如图,该方法可实现硫、氮
氧化合物的废气利用。下列有关说法错误的是( )
A.若 ZnFe2O4 与H2 以个数比 2 :1发生反应,则 x 3.5
B. ZnFe2O4 与H2 的反应要在无氧条件下进行
C.若使 1 个ZnFe O 2 x 完全转化为 ZnFe2O4 ,需失去 8 2x 个 e
D.SO2 的还原性强于ZnFe2Ox
10. 有氧化镁、三氧化铁、氧化铝粉末 22.4g 将它溶于 500mL4mol/L 的硫酸里,若要使沉
淀的质量达到最大值,则需加入 2mol/L 的氢氧化钠溶液的体积为( )
A.2000mL B.500mL C.1000mL D.1500mL
11.将 22.7 g 由 Cu、Al、Fe 组成的合金溶于足量的 NaOH 溶液中,合金质量减少了 2.7 g。
另取等质量的合金溶于过量稀 HNO3中,生成了 6.72 L NO(标准状况下),向反应后的溶液
中加入过量的 NaOH 溶液,则沉淀的质量为( )
A.22.1 g B.25.4 g C.33.2g D.30.2 g
3+ + + -
12.某固体样品可能含有 Fe 、NH4 、Ag 、NO3 、Cl 中的若干种离子,为确定该样品的组成,
宜春五校高一上学期第一次联考 化学试卷 第 3 页 共 7 页
{#{QQABLQAEogiAABJAARhCAw2wCAAQkBCACCoGBFAAMAIAQRFABCA=}#}
将样品用蒸馏水配成 100mL 分散系 A,进行了如下实验(假设气体全部逸出):
(提示:已知 AgOH + 2NH3·H2O=[Ag(NH3) ]
+
2 + OH
-+2H2O, 氯化银能溶于氨水,发生类似反
应) 下列说法正确的是( )
A.该样品中肯定含有 NH4NO3、AgNO 3 B.溶液 A 中 NO3 的物质的量浓度为 0.5mol/L
+
C.溶液 A 可能含有 Cl D.固体中含 NH4 物质的量 为 0.2mol
13.二氧化硫是我国工业大气主要污染物之一,但在严格遵守国家有关标准时,在食品生产
中也经常使用,某学习小组设计了如图装置用于制取SO2 并验证其性质。下列有关说法正确
的是( ) (提示氯气、二氧化硫都不能使干燥的有色布条褪色)
A.装置中连接管 a 完全多余,可以去掉
B.B 装置中未见品红褪色是因为该装置不能制得SO2
C.D 装置中不会出现大量白色沉淀
SO 2Fe3 SO 8OH 2Fe(OH) SO2 D.E 装置中 2 过量时的离子方程式为 2 2 4 2H2O
14.下列各分子中,所有原子都满足最外层为 8 电子结构的是 ( )
A.H2O B.BeCl2 C.CCl4 D.PCl5
二、非选题(除标记外,每空 2 分,共 58 分)
15.(每空 2 分,共 16 分)过硫酸钾( K 2S2O8 )可用作破胶剂、聚合促进剂、氧化剂、分
析试剂等,100℃时分解。实验小组对过硫酸钾进行相关探究。回答下列问题:
宜春五校高一上学期第一次联考 化学试卷 第 4 页 共 7 页
{#{QQABLQAEogiAABJAARhCAw2wCAAQkBCACCoGBFAAMAIAQRFABCA=}#}
(1)K 2S2O8 的结构式为 ,硫元素化合价为_____,该物质
检 验 酸 性 溶 液 中 的 Mn2 时 , 观 察 到 溶 液 变 为 红 色 , 反 应 的 离 子 方 程 式 为
______________________________________。
(2)小组同学预测过硫酸钾的分解产物有 K 2SO4、SO3、SO2 和O2 ,并用如图所示装置验
证分解产物中含有SO3 和SO2 (部分夹持及加热仪器已省略)。
①装置 D、E 中盛放的试剂依次为________(填字母)。
a.品红溶液 b.NaOH 溶液 c.BaCl2 溶液 d.Ba NO3 溶液 e.浓H 2SO2 4
②实验时,通入 He 排尽装置中的空气后,应先加热装置________(填“A”或“B”),其中
装置 B的作用是________。
③装置 B 中石棉绒的作用为____________(写一点即可);装置 C 的作用为________。
(3)工业上利用 K S O 能将低价氮氧化为 NO 2 2 8 3 ,来测定废水中氮元素的含量。取 100mL
含 NH4NO3 的废水,用 cmol L
1K2S2O8 标准溶液滴定(假设其他物质不参加反应),达到滴
定终点时消耗标准溶液的体积为VmL ,则废水中氮元素的含量为_____mg L 1 (用含 c、V
的代数式表示)。
16.(14 分、每空 2 分) 以黄铁矿(主要成分 FeS2)为原料生产硫酸,应将产出的炉渣和尾
气进行资源化综合利用,减轻对环境的污染。其中一种流程如下图所示。
(1)黄铁矿中硫元素的化合价为 。
(2)由炉渣制备还原铁粉的化学方程式为 。
宜春五校高一上学期第一次联考 化学试卷 第 5 页 共 7 页
{#{QQABLQAEogiAABJAARhCAw2wCAAQkBCACCoGBFAAMAIAQRFABCA=}#}
(3)欲得到更纯的 NaHSO3,反应①应通入_____ (填 “过量”或“不足量”)的气体。
(4)因为 Na2S2O5具有 性, 长期放置会导致商品 Na2S2O5中不可避免地存在
________杂质,检验杂质的方法是 。
(5)一般用 K2Cr2O7滴定分析法测定还原铁粉纯度。实验步骤:称取一定量样品,用过量稀
硫酸溶解,用标准 K2Cr2O7溶液滴定其中的亚铁离子,反应离子方程式如下
C r 2 O
2 2 + +
7 6 F e 1 4 H 2 C r
3 6 F e 3 7 H 2 O 。
某次实验称取 0.2800 g 样品,滴定时消耗浓度为 0.03000 mol·L-1的 K2Cr2O7溶液 25.10 mL,
则样品中铁含量为 %(精确到小数点后两位)。(假设杂质中无铁元素,杂
质也不与标准重铬酸钾溶液反应,铁的相对原子质量为 56)
17.(12 分,除标记外每空 2 分)将一定质量的 Mg、Al 合金投入 100mL 一定物质的量浓度
的 HCl 中,合金全部溶解,向所得溶液中滴加 5mol/L 的 NaOH 溶液至过量,生成的沉淀质量
与加入的 NaOH
溶液的体积关系如图所示。
①写出 A-B 段发生的离子反应方程式
______________________________________________
②原合金中 Mg、Al 的质量;Mg____克、Al_____克。
③ HCl 物质的量浓度为_______mol/L。(已知相对原子质
量 Mg 24、Al 27)
④将 0.4gNaOH 和 1.06g Na2CO3混合并配成溶液,向溶液中滴加 0.1mol·L
-1
稀盐酸。下列图像能正确表示加入盐酸的体积和生成 CO2的物质的量的关系的是( )
(相对原子质量: 钠 23 氧 16 碳 12 氢 1)
⑤向含 0.1mol 氢氧化钠、0.05 mol 偏铝酸钠、0.05 mol 碳酸钠溶液中逐滴加入 1mol/LHCl
溶液,若加入 HCl 溶液体积为 200mL 时,生成氢氧化铝物质的量为_______mol(精确到小数
点后两位)(已知:碳酸氢根与偏铝酸根离子会反应,铝离子和碳酸氢根、碳酸根都会反应)
宜春五校高一上学期第一次联考 化学试卷 第 6 页 共 7 页
{#{QQABLQAEogiAABJAARhCAw2wCAAQkBCACCoGBFAAMAIAQRFABCA=}#}
18.(16 分)三氟化氮(NF3)是一种无色、无味的气体,它是微电子工业技术的关键原料之一,三
氟化氮在潮湿的空气中与水蒸气能发生氧化还原反应,其反应的产物有 HF、NO 和 HNO3,请根据
要求回答下列问题:
(1)写出三氟化氮(NF3)的电子式______________,三氟化氮分子中所有的原子最外层
_____(填“满足”或“不满足”)8 电子稳定结构,反应过程中,被氧化与被还原的元素原子的
物质的量之比为_____________________。
(2)写出该反应的化学方程式:______________________________________。若反应中生成
0.2 mol HNO3,转移的电子数目为________。
(3)三氟化氮可由氨气和氟气反应得到:4NH3+3F2===NF3+3NH4F。据题意推测 NF3、F2、NO 三
种气体中,氧化性由弱到强的顺序为______________________________________。
(4)NF3是一种无色、无味的气体,一旦 NF3在空气中泄漏,却还是易于发现。你判断该气体
泄漏时的现象是_____________________________________________________(答一点即可)。
(5)一旦 NF3泄漏,可以用 NaOH 溶液喷淋的方法减少污染,其产物除 NaNO2、NaF、H2O 外,
还肯定有________(填化学式)。
宜春五校高一上学期第一次联考 化学试卷 第 7 页 共 7 页
{#{QQABLQAEogiAABJAARhCAw2wCAAQkBCACCoGBFAAMAIAQRFABCA=}#}
1.D 2.B 3.A 4.B 5.A 6.A 7.B 8.D 9.D 10.A 11.D 12. C
12【详解】100mL 分散系 A 加入 40mL 1mol/L 的氢氧化钠溶液,恰好完全反应,生成 448mL
0.448L +
氨气和无色澄清溶液,氨气的物质的量是 0.02mol,则原溶液一定含有 NH
22.4L/mol 4
,一
定不含 Fe3+;向无色澄清溶液中加入过量盐酸,生成 1.435g 白色沉淀,则白色沉淀一定是
1.435g
AgCl,物质的量是 143.5g/mol 0.01mol,则无色澄清溶液中含有 0.01mol Ag NH3 2 ,
原溶液含有 0.04mol NH +4 ,0.01mol Ag
+,AgCl 能溶于氨水,原溶液可能含 Cl 、NO ;
根据以上分析,A. 该样品中可能含有 NH4Cl、AgNO3,故 A错误;故 B 错误
C. AgCl 能溶于氨水,溶液 A可能含 Cl ,故 C 正确;
- 1
B. 若溶液中含有 Cl ,根据电荷守恒,溶液 A 中 NO3 物质的量浓度小于 0.5mol·L ,故 D
错误。
选 C。
13.C 14.C
15 答案:(1)+6, 5S O2 2Mn2 2 8 8H O 10SO
2
2 4 2MnO4 16H
(2)①c、a;生成白色沉淀、品红溶液褪色;②B;吸收氧气;③增大铁粉与O2 的接触面
积,使O2 被充分吸收,同时防止固体粉末堵塞导管;防倒吸
(3) 70cV
解析:(1)由题意可知,酸性条件下,溶液中过硫酸根离子与锰离子发生氧化还原反应生成
硫 酸 根 离 子 、 高 锰 酸 根 离 子 和 氢 离 子 , 反 应 的 离 子 方 程 式 为
宜春五校高一上学期第一次联考 化学试卷 第 8 页 共 7 页
{#{QQABLQAEogiAABJAARhCAw2wCAAQkBCACCoGBFAAMAIAQRFABCA=}#}
5S O2 2 2 8 2Mn 8H
2
2O 10SO4 2MnO
4 16H
。
(2)①装置 D中盛有的氯化钡溶液用于检验三氧化硫,二氧化硫与氯化钡溶液不反应,三
氧化硫与水反应生成硫酸,硫酸与氯化钡溶液反应生成硫酸钡白色沉淀和氯化钠;装置 E
中盛有的品红溶液用于检验二氧化硫,二氧化硫具有漂白性,能使品红溶液褪色。②实验时,
通入氦气排尽装置中的空气后,先加热装置 B 处酒精灯,再用沸水浴加热装置 A,有利于分
解生成的氧气被铁粉充分吸收,避免干扰硫的氧化物的检验。③装置 B 中铁粉分散到石棉绒
中可增大铁粉与氧气的接触面积,使氧气被充分吸收,避免干扰硫的氧化物的检验,同时可
防止气流速率过快,导致固体粉末堵塞导管;装置 C 为空载仪器,作安全瓶,能起到防倒吸
的作用。
(3)由元素守恒和得失电子守恒可得关系式: 4K 2S2O8 ~ NH4 NO3 ~ 2N ,则废水中氮元素
cmol L 1 10 3VL 2 14g mol 1 1000mg g 1
的含量为 4 70cVmg L 1 。
100 10 3 L
16
宜春五校高一上学期第一次联考 化学试卷 第 9 页 共 7 页
{#{QQABLQAEogiAABJAARhCAw2wCAAQkBCACCoGBFAAMAIAQRFABCA=}#}
17.I①略 ②4.8, 2.7 ③8mol/L ④C ⑤0.05
23
18.答案:(1)略,满足,1∶2 (2)3NF3+5H2O===2NO+HNO3+9HF 0.4NA(或 2.408×10 )
(3)NO解析:(1)NF3与水蒸气反应生成 HF、NO 和 HNO3,反应方程式为 3NF3+5H2O===2NO+HNO3
+9HF,2NF3→2NO,N 元素化合价降低,被还原,NF3→HNO3,N 元素化合价升高,被氧化,被氧
化与被还原的元素原子的物质的量之比为 1∶2。
(2)根据反应方程式 3NF3+5H2O===2NO+HNO3+9HF 可知,生成 1 mol HNO3,转移电子的物
质的量为 2 mol,则生成 0.2 mol HNO3时转移电子的物质的量为 0.4 mol,转移电子数目是 0.4NA
23
或 2.408×10 。
(3)根据 3NF3+5H2O===2NO+HNO3+9HF,NF3为氧化剂和还原剂,NO 为还原产物,则 NF3氧
化性强于 NO;根据 4NH3+3F2===NF3+3NH4F,F2为氧化剂,NF3为氧化产物,即 F2的氧化性强于 NF3,
综上所述,氧化性由弱到强的顺序是 NO(4)根据(2)的反应方程式,产物中有 NO,NO 与空气中的氧气反应生成 NO2,NO2为红棕
色,HNO3易挥发,凝结成小液滴,因此现象是产生红棕色气体,产生刺激性气味气体,产生白雾。
(5)根据(2)的反应方程式产物之一是 HNO3,HNO3与 NaOH 反应生成 NaNO3,即另一种物质
是 NaNO3。
宜春五校高一上学期第一次联考 化学试卷 第10 页 共 7 页
{#{QQABLQAEogiAABJAARhCAw2wCAAQkBCACCoGBFAAMAIAQRFABCA=}#}
宜丰中学、樟树中学
高一年级上学期第一次联考化学学科试题
考试范围(必修一、必修二第五章一、二节)
一、单选题(每小题只有一个答案,每小题 3 分,共 42 分)
1.下列说法正确的是( )
A.我国自主研发的“龙芯 1 号”CPU 芯片与红宝石主要成份都含硅元素
B.过氧化钠可用作潜水艇中氧气的来源,表现了过氧化钠的强氧化性
C.氯气具有酸性,可与烧碱或石灰乳反应制备含氯消毒剂
D.洁厕灵和 84 消毒液不能混合使用
2.在元素周期表中,某些主族元素与其右下方的主族元素的有些性质是相似的,这称为“对
角线规则”。根据“对角线规则”,下列有关推断错误的是( )
A.BeO 是两性氧化物 B.Li 在空气中燃烧可生成 Li2O2和Li3N
C.B 的最高价氧化物对应的水化物为 H3BO3 D.碱性: NaOH>Be(OH)2
3. 在给定条件下,下列选项所示的物质间转化均能实现的是( )
N H3 ,CO2 NaHCO △A.饱和食盐水 3 Na2CO3 s
N g O 2 g NO g N aOH aq B. 2 NaNO3 aq放电
Al s N aOH aq NaAlO aq 过 量 HCl aq C. 2 Al OH s3
D.SO C aCl 2 aq 2 CaSO
O
3 2 CaSO4
4.下列离子方程式正确的是 ( )
A.Cl2 通入FeBr2溶液中反应,若有四分之一的溴元素被氧化:
2Fe2 2Br 2Cl 2Fe3 2 Br2 4Cl
B. NH4HSO4溶液与少量 NaOH 溶液混合加热:H
+ + OH-= H2O
2 2
C.NaHCO3 溶液中加过量的澄清石灰水:Ca 2OH 2HCO3 CaCO3 2H2 O CO3
D.NH4Al(SO4 )2与Ba(OH)2可能发生的反应:
2NH 4 Al
3 4SO2 4 4Ba
2 6OH 4BaSO4 2NH3 AlO
2 4H2O
宜春五校高一上学期第一次联考 化学试卷 第 1 页 共 7 页
{#{QQABLQAEogiAABJAARhCAw2wCAAQkBCACCoGBFAAMAIAQRFABCA=}#}
5.下列有关原子结构和元素周期律表述正确的是( )
①原子序数为 9的元素的最高化合价为+7
②ⅦA族元素是同周期中非金属性最强的元素
③元素的原子核电荷数和中子数一定相等
④原子序数为 12 的元素位于元素周期表的第三周期ⅡA 族
⑤同周期相邻主族元素的原子序数之差一定为 1
⑥同一元素的各种同位素的物理性质、化学性质均相同
⑦金属元素原子的最外层电子数一定≤4
A.②④ B.①②⑤ C.②⑤⑦ D.③④⑤⑥⑦
6.下列说法中正确的是( )
①酸性氧化物在一定条件下均能与碱发生反应
②金属氧化物不一定都是碱性氧化物,但碱性氧化物一定都是金属氧化物
③蔗糖、硫酸钡和水分别属于非电解质、强电解质和弱电解质
④硫酸、纯碱、醋酸钠和生石灰分别属于酸、碱、盐和氧化物
⑤因为胶体中分散质粒子直径比溶液中溶质粒子大,所以胶体可以用过滤的方法把胶粒分离
出来 ⑥胶体、溶液、浊液的本质区别是丁达尔效应
A.3 个 B.4个 C.5个 D.6个
7.取某固体样品,进行如下实验:
①取一定量的样品,加足量水充分溶解,过滤得到滤液和滤渣;
②取一定量滤液分成两份。一份加入 NaOH 溶液并加热,产生能使湿润的 pH 试纸变蓝的气体;
另外一份加入 BaCl2溶液,无明显现象产生;
③取少量滤渣,加入足量稀盐酸,滤渣部分溶解,再加入新制氯水和 KSCN 溶液,溶液显血
红色。 根据上述实验现象,该固体样品的成分可能是( )
A.Fe2O3、 (NH4)2CO3 、CaCl2 B.Fe、AgNO3、NH4NO3
C.FeO、NH4Cl、BaCO3 D.(NH4)2SO4 、SiO2、FeCl2
8.在密闭容器中,外接电路放电,研究压强与氧气的变化。实验操作如下:①外接电路放
电一段时间;②停止放电一段时间;③注入石蕊试液。得到压强、氧气浓度在以上时间段的
变化图像如下(忽略温度变化)。下列基于图像的推理或判断错误的是( )
宜春五校高一上学期第一次联考 化学试卷 第 2 页 共 7 页
{#{QQABLQAEogiAABJAARhCAw2wCAAQkBCACCoGBFAAMAIAQRFABCA=}#}
A.Ⅰ~Ⅱ: N2与O2反应生成 NO B.Ⅱ~Ⅲ:NO 与O2反应生成 NO2
C.Ⅳ~Ⅴ: NO2 与H2O生成HNO3,同时也存在 NO 与O2生成 NO2 的反应
D.Ⅰ~Ⅴ:均明显存在 2NO2 N2O4 的反应
9.已知工业上制备氧缺位铁酸盐 ZnFe2Ox (3 x 4) 部分流程如图,该方法可实现硫、氮
氧化合物的废气利用。下列有关说法错误的是( )
A.若 ZnFe2O4 与H2 以个数比 2 :1发生反应,则 x 3.5
B. ZnFe2O4 与H2 的反应要在无氧条件下进行
C.若使 1 个ZnFe O 2 x 完全转化为 ZnFe2O4 ,需失去 8 2x 个 e
D.SO2 的还原性强于ZnFe2Ox
10. 有氧化镁、三氧化铁、氧化铝粉末 22.4g 将它溶于 500mL4mol/L 的硫酸里,若要使沉
淀的质量达到最大值,则需加入 2mol/L 的氢氧化钠溶液的体积为( )
A.2000mL B.500mL C.1000mL D.1500mL
11.将 22.7 g 由 Cu、Al、Fe 组成的合金溶于足量的 NaOH 溶液中,合金质量减少了 2.7 g。
另取等质量的合金溶于过量稀 HNO3中,生成了 6.72 L NO(标准状况下),向反应后的溶液
中加入过量的 NaOH 溶液,则沉淀的质量为( )
A.22.1 g B.25.4 g C.33.2g D.30.2 g
3+ + + -
12.某固体样品可能含有 Fe 、NH4 、Ag 、NO3 、Cl 中的若干种离子,为确定该样品的组成,
宜春五校高一上学期第一次联考 化学试卷 第 3 页 共 7 页
{#{QQABLQAEogiAABJAARhCAw2wCAAQkBCACCoGBFAAMAIAQRFABCA=}#}
将样品用蒸馏水配成 100mL 分散系 A,进行了如下实验(假设气体全部逸出):
(提示:已知 AgOH + 2NH3·H2O=[Ag(NH3) ]
+
2 + OH
-+2H2O, 氯化银能溶于氨水,发生类似反
应) 下列说法正确的是( )
A.该样品中肯定含有 NH4NO3、AgNO 3 B.溶液 A 中 NO3 的物质的量浓度为 0.5mol/L
+
C.溶液 A 可能含有 Cl D.固体中含 NH4 物质的量 为 0.2mol
13.二氧化硫是我国工业大气主要污染物之一,但在严格遵守国家有关标准时,在食品生产
中也经常使用,某学习小组设计了如图装置用于制取SO2 并验证其性质。下列有关说法正确
的是( ) (提示氯气、二氧化硫都不能使干燥的有色布条褪色)
A.装置中连接管 a 完全多余,可以去掉
B.B 装置中未见品红褪色是因为该装置不能制得SO2
C.D 装置中不会出现大量白色沉淀
SO 2Fe3 SO 8OH 2Fe(OH) SO2 D.E 装置中 2 过量时的离子方程式为 2 2 4 2H2O
14.下列各分子中,所有原子都满足最外层为 8 电子结构的是 ( )
A.H2O B.BeCl2 C.CCl4 D.PCl5
二、非选题(除标记外,每空 2 分,共 58 分)
15.(每空 2 分,共 16 分)过硫酸钾( K 2S2O8 )可用作破胶剂、聚合促进剂、氧化剂、分
析试剂等,100℃时分解。实验小组对过硫酸钾进行相关探究。回答下列问题:
宜春五校高一上学期第一次联考 化学试卷 第 4 页 共 7 页
{#{QQABLQAEogiAABJAARhCAw2wCAAQkBCACCoGBFAAMAIAQRFABCA=}#}
(1)K 2S2O8 的结构式为 ,硫元素化合价为_____,该物质
检 验 酸 性 溶 液 中 的 Mn2 时 , 观 察 到 溶 液 变 为 红 色 , 反 应 的 离 子 方 程 式 为
______________________________________。
(2)小组同学预测过硫酸钾的分解产物有 K 2SO4、SO3、SO2 和O2 ,并用如图所示装置验
证分解产物中含有SO3 和SO2 (部分夹持及加热仪器已省略)。
①装置 D、E 中盛放的试剂依次为________(填字母)。
a.品红溶液 b.NaOH 溶液 c.BaCl2 溶液 d.Ba NO3 溶液 e.浓H 2SO2 4
②实验时,通入 He 排尽装置中的空气后,应先加热装置________(填“A”或“B”),其中
装置 B的作用是________。
③装置 B 中石棉绒的作用为____________(写一点即可);装置 C 的作用为________。
(3)工业上利用 K S O 能将低价氮氧化为 NO 2 2 8 3 ,来测定废水中氮元素的含量。取 100mL
含 NH4NO3 的废水,用 cmol L
1K2S2O8 标准溶液滴定(假设其他物质不参加反应),达到滴
定终点时消耗标准溶液的体积为VmL ,则废水中氮元素的含量为_____mg L 1 (用含 c、V
的代数式表示)。
16.(14 分、每空 2 分) 以黄铁矿(主要成分 FeS2)为原料生产硫酸,应将产出的炉渣和尾
气进行资源化综合利用,减轻对环境的污染。其中一种流程如下图所示。
(1)黄铁矿中硫元素的化合价为 。
(2)由炉渣制备还原铁粉的化学方程式为 。
宜春五校高一上学期第一次联考 化学试卷 第 5 页 共 7 页
{#{QQABLQAEogiAABJAARhCAw2wCAAQkBCACCoGBFAAMAIAQRFABCA=}#}
(3)欲得到更纯的 NaHSO3,反应①应通入_____ (填 “过量”或“不足量”)的气体。
(4)因为 Na2S2O5具有 性, 长期放置会导致商品 Na2S2O5中不可避免地存在
________杂质,检验杂质的方法是 。
(5)一般用 K2Cr2O7滴定分析法测定还原铁粉纯度。实验步骤:称取一定量样品,用过量稀
硫酸溶解,用标准 K2Cr2O7溶液滴定其中的亚铁离子,反应离子方程式如下
C r 2 O
2 2 + +
7 6 F e 1 4 H 2 C r
3 6 F e 3 7 H 2 O 。
某次实验称取 0.2800 g 样品,滴定时消耗浓度为 0.03000 mol·L-1的 K2Cr2O7溶液 25.10 mL,
则样品中铁含量为 %(精确到小数点后两位)。(假设杂质中无铁元素,杂
质也不与标准重铬酸钾溶液反应,铁的相对原子质量为 56)
17.(12 分,除标记外每空 2 分)将一定质量的 Mg、Al 合金投入 100mL 一定物质的量浓度
的 HCl 中,合金全部溶解,向所得溶液中滴加 5mol/L 的 NaOH 溶液至过量,生成的沉淀质量
与加入的 NaOH
溶液的体积关系如图所示。
①写出 A-B 段发生的离子反应方程式
______________________________________________
②原合金中 Mg、Al 的质量;Mg____克、Al_____克。
③ HCl 物质的量浓度为_______mol/L。(已知相对原子质
量 Mg 24、Al 27)
④将 0.4gNaOH 和 1.06g Na2CO3混合并配成溶液,向溶液中滴加 0.1mol·L
-1
稀盐酸。下列图像能正确表示加入盐酸的体积和生成 CO2的物质的量的关系的是( )
(相对原子质量: 钠 23 氧 16 碳 12 氢 1)
⑤向含 0.1mol 氢氧化钠、0.05 mol 偏铝酸钠、0.05 mol 碳酸钠溶液中逐滴加入 1mol/LHCl
溶液,若加入 HCl 溶液体积为 200mL 时,生成氢氧化铝物质的量为_______mol(精确到小数
点后两位)(已知:碳酸氢根与偏铝酸根离子会反应,铝离子和碳酸氢根、碳酸根都会反应)
宜春五校高一上学期第一次联考 化学试卷 第 6 页 共 7 页
{#{QQABLQAEogiAABJAARhCAw2wCAAQkBCACCoGBFAAMAIAQRFABCA=}#}
18.(16 分)三氟化氮(NF3)是一种无色、无味的气体,它是微电子工业技术的关键原料之一,三
氟化氮在潮湿的空气中与水蒸气能发生氧化还原反应,其反应的产物有 HF、NO 和 HNO3,请根据
要求回答下列问题:
(1)写出三氟化氮(NF3)的电子式______________,三氟化氮分子中所有的原子最外层
_____(填“满足”或“不满足”)8 电子稳定结构,反应过程中,被氧化与被还原的元素原子的
物质的量之比为_____________________。
(2)写出该反应的化学方程式:______________________________________。若反应中生成
0.2 mol HNO3,转移的电子数目为________。
(3)三氟化氮可由氨气和氟气反应得到:4NH3+3F2===NF3+3NH4F。据题意推测 NF3、F2、NO 三
种气体中,氧化性由弱到强的顺序为______________________________________。
(4)NF3是一种无色、无味的气体,一旦 NF3在空气中泄漏,却还是易于发现。你判断该气体
泄漏时的现象是_____________________________________________________(答一点即可)。
(5)一旦 NF3泄漏,可以用 NaOH 溶液喷淋的方法减少污染,其产物除 NaNO2、NaF、H2O 外,
还肯定有________(填化学式)。
宜春五校高一上学期第一次联考 化学试卷 第 7 页 共 7 页
{#{QQABLQAEogiAABJAARhCAw2wCAAQkBCACCoGBFAAMAIAQRFABCA=}#}
1.D 2.B 3.A 4.B 5.A 6.A 7.B 8.D 9.D 10.A 11.D 12. C
12【详解】100mL 分散系 A 加入 40mL 1mol/L 的氢氧化钠溶液,恰好完全反应,生成 448mL
0.448L +
氨气和无色澄清溶液,氨气的物质的量是 0.02mol,则原溶液一定含有 NH
22.4L/mol 4
,一
定不含 Fe3+;向无色澄清溶液中加入过量盐酸,生成 1.435g 白色沉淀,则白色沉淀一定是
1.435g
AgCl,物质的量是 143.5g/mol 0.01mol,则无色澄清溶液中含有 0.01mol Ag NH3 2 ,
原溶液含有 0.04mol NH +4 ,0.01mol Ag
+,AgCl 能溶于氨水,原溶液可能含 Cl 、NO ;
根据以上分析,A. 该样品中可能含有 NH4Cl、AgNO3,故 A错误;故 B 错误
C. AgCl 能溶于氨水,溶液 A可能含 Cl ,故 C 正确;
- 1
B. 若溶液中含有 Cl ,根据电荷守恒,溶液 A 中 NO3 物质的量浓度小于 0.5mol·L ,故 D
错误。
选 C。
13.C 14.C
15 答案:(1)+6, 5S O2 2Mn2 2 8 8H O 10SO
2
2 4 2MnO4 16H
(2)①c、a;生成白色沉淀、品红溶液褪色;②B;吸收氧气;③增大铁粉与O2 的接触面
积,使O2 被充分吸收,同时防止固体粉末堵塞导管;防倒吸
(3) 70cV
解析:(1)由题意可知,酸性条件下,溶液中过硫酸根离子与锰离子发生氧化还原反应生成
硫 酸 根 离 子 、 高 锰 酸 根 离 子 和 氢 离 子 , 反 应 的 离 子 方 程 式 为
宜春五校高一上学期第一次联考 化学试卷 第 8 页 共 7 页
{#{QQABLQAEogiAABJAARhCAw2wCAAQkBCACCoGBFAAMAIAQRFABCA=}#}
5S O2 2 2 8 2Mn 8H
2
2O 10SO4 2MnO
4 16H
。
(2)①装置 D中盛有的氯化钡溶液用于检验三氧化硫,二氧化硫与氯化钡溶液不反应,三
氧化硫与水反应生成硫酸,硫酸与氯化钡溶液反应生成硫酸钡白色沉淀和氯化钠;装置 E
中盛有的品红溶液用于检验二氧化硫,二氧化硫具有漂白性,能使品红溶液褪色。②实验时,
通入氦气排尽装置中的空气后,先加热装置 B 处酒精灯,再用沸水浴加热装置 A,有利于分
解生成的氧气被铁粉充分吸收,避免干扰硫的氧化物的检验。③装置 B 中铁粉分散到石棉绒
中可增大铁粉与氧气的接触面积,使氧气被充分吸收,避免干扰硫的氧化物的检验,同时可
防止气流速率过快,导致固体粉末堵塞导管;装置 C 为空载仪器,作安全瓶,能起到防倒吸
的作用。
(3)由元素守恒和得失电子守恒可得关系式: 4K 2S2O8 ~ NH4 NO3 ~ 2N ,则废水中氮元素
cmol L 1 10 3VL 2 14g mol 1 1000mg g 1
的含量为 4 70cVmg L 1 。
100 10 3 L
16
宜春五校高一上学期第一次联考 化学试卷 第 9 页 共 7 页
{#{QQABLQAEogiAABJAARhCAw2wCAAQkBCACCoGBFAAMAIAQRFABCA=}#}
17.I①略 ②4.8, 2.7 ③8mol/L ④C ⑤0.05
23
18.答案:(1)略,满足,1∶2 (2)3NF3+5H2O===2NO+HNO3+9HF 0.4NA(或 2.408×10 )
(3)NO
+9HF,2NF3→2NO,N 元素化合价降低,被还原,NF3→HNO3,N 元素化合价升高,被氧化,被氧
化与被还原的元素原子的物质的量之比为 1∶2。
(2)根据反应方程式 3NF3+5H2O===2NO+HNO3+9HF 可知,生成 1 mol HNO3,转移电子的物
质的量为 2 mol,则生成 0.2 mol HNO3时转移电子的物质的量为 0.4 mol,转移电子数目是 0.4NA
23
或 2.408×10 。
(3)根据 3NF3+5H2O===2NO+HNO3+9HF,NF3为氧化剂和还原剂,NO 为还原产物,则 NF3氧
化性强于 NO;根据 4NH3+3F2===NF3+3NH4F,F2为氧化剂,NF3为氧化产物,即 F2的氧化性强于 NF3,
综上所述,氧化性由弱到强的顺序是 NO
色,HNO3易挥发,凝结成小液滴,因此现象是产生红棕色气体,产生刺激性气味气体,产生白雾。
(5)根据(2)的反应方程式产物之一是 HNO3,HNO3与 NaOH 反应生成 NaNO3,即另一种物质
是 NaNO3。
宜春五校高一上学期第一次联考 化学试卷 第10 页 共 7 页
{#{QQABLQAEogiAABJAARhCAw2wCAAQkBCACCoGBFAAMAIAQRFABCA=}#}
同课章节目录
