二轮复习 专题 新型化学电源 课件(共21张PPT)
文档属性
| 名称 | 二轮复习 专题 新型化学电源 课件(共21张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 1.9MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-11-18 22:53:00 | ||
图片预览





文档简介
(共21张PPT)
新型化学电源
2024
1
2
3
4
5
6
7
8
9
10
命题角度1 新型燃料电池及分析
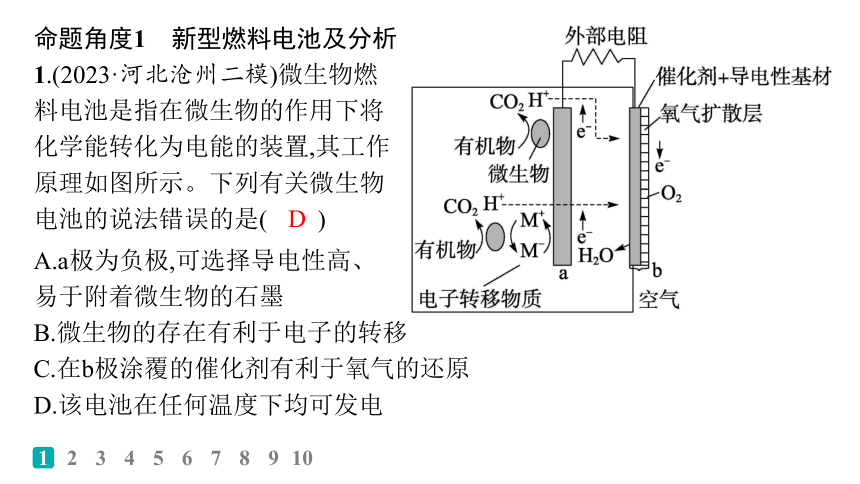
1.(2023·河北沧州二模)微生物燃料电池是指在微生物的作用下将化学能转化为电能的装置,其工作原理如图所示。下列有关微生物电池的说法错误的是( )
A.a极为负极,可选择导电性高、
易于附着微生物的石墨
B.微生物的存在有利于电子的转移
C.在b极涂覆的催化剂有利于氧气的还原
D.该电池在任何温度下均可发电
D
1
2
3
4
5
6
7
8
9
10
解析 由题图可知,a极为负极,不参与反应,可选择导电性高、易于附着微生物的石墨,A正确;微生物的作用促进了有机物转变为CO2,即促进了电子的转移,B正确;催化剂可以加快氧气的还原,C正确;该电池利用微生物促进电子转移而发电,温度过高可能导致微生物失活,D错误。
1
2
3
4
5
6
7
8
9
10
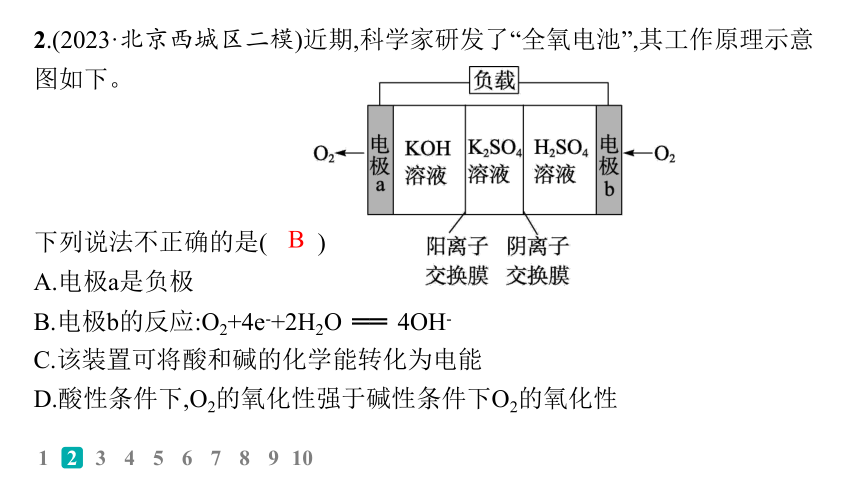
2.(2023·北京西城区二模)近期,科学家研发了“全氧电池”,其工作原理示意图如下。
下列说法不正确的是( )
A.电极a是负极
B.电极b的反应:O2+4e-+2H2O ══ 4OH-
C.该装置可将酸和碱的化学能转化为电能
D.酸性条件下,O2的氧化性强于碱性条件下O2的氧化性
B
1
2
3
4
5
6
7
8
9
10
解析 a为负极,电极反应为4OH--4e- ══ O2↑+2H2O,A正确;b为原电池的正极,电极反应为O2+4e-+4H+ ══ 2H2O,B错误;该反应的总反应为H++OH- ══ H2O,可将酸和碱的化学能转化为电能,C正确;酸性条件下发生反应O2+4e-+4H+ ══ 2H2O,碱性条件下发生反应4OH--4e- ══ O2↑+2H2O,故酸性条件下O2的氧化性强于碱性条件下O2的氧化性,D正确。
1
2
3
4
5
6
7
8
9
10
命题角度2 锂(或锂离子)电池及分析
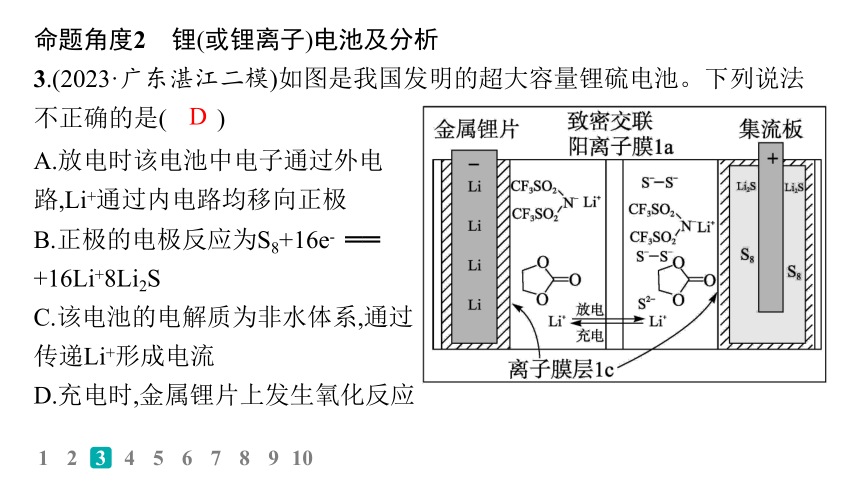
3.(2023·广东湛江二模)如图是我国发明的超大容量锂硫电池。下列说法不正确的是( )
A.放电时该电池中电子通过外电路,Li+通过内电路均移向正极
B.正极的电极反应为S8+16e- ══ +16Li+8Li2S
C.该电池的电解质为非水体系,通过传递Li+形成电流
D.充电时,金属锂片上发生氧化反应
D
1
2
3
4
5
6
7
8
9
10
解析 放电时,该电池中电子通过外电路,Li+通过内电路均移向正极,A正确;正极S8放电生成Li2S,正极的电极反应为S8+16e-+16Li+ ══ 8Li2S,B正确;锂和水能反应,锂硫电池中电解质不能为水溶液,该电池的电解质为非水体系,通过传递Li+形成电流,C正确;金属锂片为负极,充电时,金属锂片连接外加电源的负极,金属锂片上发生Li+得电子的过程,属于还原反应,D错误。
1
2
3
4
5
6
7
8
9
10
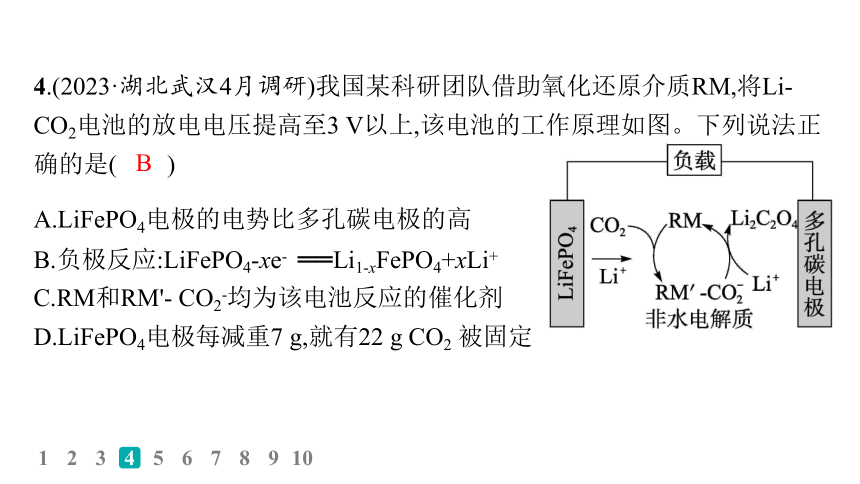
4.(2023·湖北武汉4月调研)我国某科研团队借助氧化还原介质RM,将Li-CO2电池的放电电压提高至3 V以上,该电池的工作原理如图。下列说法正确的是( )
A.LiFePO4电极的电势比多孔碳电极的高
B.负极反应:LiFePO4-xe- ══Li1-xFePO4+xLi+
C.RM和RM'- CO2-均为该电池反应的催化剂
D.LiFePO4电极每减重7 g,就有22 g CO2 被固定
B
解析 LiFePO4电极为负极、多孔碳电极为正极,故LiFePO4电极的电势比多孔碳电极的低,A错误;左侧电极为负极,LiFePO4失去电子发生氧化反应,负极反应:LiFePO4-xe- ══ Li1-xFePO4+xLi+,B正确;RM为该电池反应的催化剂,RM'- CO2-为该电池反应的中间产物,C错误;由负极电极反应可知,LiFePO4电极每减重7 g则转移1 mol电子,反应中碳元素化合价由+4价变为+3价,则根据电子守恒可知,有1 mol即44 g CO2被固定,D错误。
1
2
3
4
5
6
7
8
9
10
1
2
3
4
5
6
7
8
9
10
命题角度3 钠离子电池及分析
5.(2023·陕西铜川二模)我国科研人员研制出以钠箔和多壁碳纳米管为电极的可充电“Na-CO2”电池,工作过程中,Na2CO3与C均
沉积在多壁碳纳米管电极。其工作原理如图所示。下列叙述错误的是( )
A.充电时,多壁碳纳米管为阳极,Na+向钠箔电极方向移动
B.放电时,电路中转移0.1 mol e-,多壁碳纳米管电极增重1.1 g
C.采用多壁碳纳米管作电极可以增强吸附CO2的能力
D.充电时,阳极反应为2Na2CO3+C-4e- ══ 3CO2+4Na+
B
1
2
3
4
5
6
7
8
9
10
解析 充电时,电源电极a为正极,多壁碳纳米管为阳极,Na+向阴极钠箔电极移动,A正确;放电时,Na2CO3与C均沉积在多壁碳纳米管电极上,多壁碳纳米管上的电极反应为3CO2+4e-+4Na+ ══ 2Na2CO3+C,电路中转移0.1 mol e-,多壁碳纳米管电极增重质量为106 g·mol-1×0.05 mol+ ×12 g·mol-1=5.6 g,B错误;多壁碳纳米管表面积大,吸附能力强,用其作电极可以增强吸附CO2的能力,C正确;充电时,阳极碳失电子发生氧化反应,阳极反应为2Na2CO3+C-4e- ══ 3CO2+4Na+,D正确。
1
2
3
4
5
6
7
8
9
10
6.(2023·河北张家口二模)我国新能源汽车上有望推广钠离子电池,一种钠离子电池工作示意图如下,充电时Na+经电解液嵌入石墨(C6),下列说法错误的是( )
A.放电时,电势:电极a>电极b
B.放电时,电子从电极b经外电路流向电极a,再经电解液流回电极b
C.放电过程中,导线上每通过1 mol e-,负极质量减少23 g
D.充电时,电极a上发生反应的电极反应为NaFePO4-xe-══Na1-xFePO4+xNa+
B
1
2
3
4
5
6
7
8
9
10
解析 根据电池工作示意图分析可知,放电时,电极a为正极,电极b为负极,正极的电势高于负极,则电势:电极a>电极b,A正确;放电时,电子从电极b经外电路流向电极a,电子不能通过电解液,B错误;放电过程中,导线上每通过1 mol e-,负极上Na+转移至正极,减小1 mol钠离子,质量减少23 g,C正确;充电时,电极a为阳极,该电极的电极反应为NaFePO4-xe- ══ Na1-xFePO4 +xNa+,D正确。
1
2
3
4
5
6
7
8
9
10
命题角度4 二次锌电池及分析
7.(2023·山西运城二模)我国科研人员利用双极膜技术构造出一类具有能量密度高、循环性能优异的新型水系电池,模拟装置如图所示。已知电极材料分别为Zn和MnO2,相应的产物为[Zn(OH)4]2-和Mn2+。下列说法错误的是( )
A.双极膜中的OH-通过膜a移向M极
B.电池工作一段时间后,NaOH溶液的pH不变
C.N电极的反应为MnO2+4H++2e- ══ Mn2++2H2O
D.若电路中通过2 mol e-,则稀硫酸质量增加89 g
B
1
2
3
4
5
6
7
8
9
10
解析 由题给信息Zn生成[Zn(OH)4]2-,MnO2生成Mn2+可知,M极为Zn电极,N电极材料为MnO2,即M极为负极,N极为正极,OH-移向负极,A正确;负极的电极反应为Zn+4OH--2e- ══[Zn(OH)4]2-,每转移2 mol e-,有2 mol OH-移向NaOH溶液,而消耗4 mol OH-,NaOH溶液的pH变小,B错误;N电极材料为MnO2,MnO2在正极得到电子生成Mn2+,电极反应为MnO2+4H++2e- ══ Mn2++2H2O,C正确;若电路中通过2 mol e-,双极膜中有2 mol H+移向稀硫酸,同时溶解1 mol MnO2,稀硫酸质量增加2 mol×1 g·mol-1+1 mol×87 g·mol-1=89 g,D正确。
1
2
3
4
5
6
7
8
9
10
8.(2023·山东潍坊二模)三维多孔海绵状Zn(3D-Zn)可以高效沉积ZnO,强碱性3D-Zn-NiOOH二次电池结构如图所示,放电时电池反应为Zn+2NiOOH+H2O ══ ZnO+2Ni(OH)2,下列说法正确的是( )
A.充电时阳极反应为Ni(OH)2+OH--e-══NiOOH+H2O
B.充电时导电线圈应与外接直流电源的负极相连
C.放电时电解质溶液碱性减弱
D.放电时每沉积0.1 mol ZnO,有0.1 mol OH-通过隔膜
A
1
2
3
4
5
6
7
8
9
10
解析 充电时,导电线圈做阳极,碱性条件下,氢氧化镍在阳极失去电子发生氧化反应生成碱式氧化镍和水:Ni(OH)2+OH--e- ══ NiOOH+H2O,A正确;充电时,与外接直流电源的正极相连的导电线圈做阳极,B错误;由放电时电池反应可知,强碱性溶液中水的量减少,则溶液中氢氧根离子浓度增大,电解质溶液的碱性增强,C错误;放电时三维多孔海绵状锌为原电池的负极,碱性条件下,锌失去电子发生氧化反应生成氧化锌,电极反应为Zn+2OH--2e- ══ ZnO+H2O,导电线圈为正极,水分子作用下,碱式氧化镍得到电子发生还原反应生成氢氧化镍和氢氧根离子,电极反应为NiOOH+H2O+e- ══ Ni(OH)2+OH-,则放电时每沉积0.1 mol氧化锌,有0.2 mol氢氧根离子通过阴离子交换隔膜,D错误。
1
2
3
4
5
6
7
8
9
10
命题角度5 其他二次电池及分析
9.(2023·齐鲁名校第二次联考)光催化钠离子二次电池的应用研究取得重大进展,该电池工作原理如图所示。下列有关说法不正确的是( )
A.充电时,电子从光催化电极流出通过导线流向
石墨电极
B.放电时,每消耗1 mol NaI3,左室电解质溶液
质量减少46 g
C.充电时,S2-通过离子交换膜进入右室
D.放电时,石墨电极的电极反应为4S2--6e- ══
C
1
2
3
4
5
6
7
8
9
10
1
2
3
4
5
6
7
8
9
10
10.(2023·广东湛江二模)一种FeCl3/FeCl2-Cl2双膜二次电池放电时的工作原理如图所示,下列说法错误的是( )
A.充电时,M极的电极反应为Fe3++e- ══ Fe2+
B.X为阳离子交换膜,Y为阴离子交换膜
C.充电时的总反应:2FeCl3 2FeCl2+Cl2↑
D.放电时,每消耗2.24 L Cl2(标准状况),理论上有0.2 mol电子通过用电器
B
1
2
3
4
5
6
7
8
9
10
解析 放电时,Fe2+在M极失去电子生成Fe3+,M是负极,则充电时,Fe3+在M极得到电子生成Fe2+,电极反应为Fe3++e- ══ Fe2+,A正确;放电时,Fe2+在M极失去电子生成Fe3+,即FeCl2转化为FeCl3,NaCl溶液中的Cl-要通过X进入M极区,X为阴离子交换膜;Cl2在N极得到电子生成Cl-,由电荷守恒可知,NaCl溶液中的Na+要通过Y进入N极区,Y为阳离子交换膜,B错误;放电时,Fe2+在M极失去电子生成Fe3+,Cl2在N极得到电子生成Cl-,则充电时,FeCl3转化为FeCl2和Cl2,总反应为2FeCl3 2FeCl2+Cl2↑,C正确;放电时,Cl2在N极得到电子生成Cl-,电极反应为Cl2+2e- ══ 2Cl-,标准状况下2.24 L Cl2的物质的量为0.1 mol,转移0.2 mol e-,理论上有0.2 mol电子通过用电器,D正确。
新型化学电源
2024
1
2
3
4
5
6
7
8
9
10
命题角度1 新型燃料电池及分析
1.(2023·河北沧州二模)微生物燃料电池是指在微生物的作用下将化学能转化为电能的装置,其工作原理如图所示。下列有关微生物电池的说法错误的是( )
A.a极为负极,可选择导电性高、
易于附着微生物的石墨
B.微生物的存在有利于电子的转移
C.在b极涂覆的催化剂有利于氧气的还原
D.该电池在任何温度下均可发电
D
1
2
3
4
5
6
7
8
9
10
解析 由题图可知,a极为负极,不参与反应,可选择导电性高、易于附着微生物的石墨,A正确;微生物的作用促进了有机物转变为CO2,即促进了电子的转移,B正确;催化剂可以加快氧气的还原,C正确;该电池利用微生物促进电子转移而发电,温度过高可能导致微生物失活,D错误。
1
2
3
4
5
6
7
8
9
10
2.(2023·北京西城区二模)近期,科学家研发了“全氧电池”,其工作原理示意图如下。
下列说法不正确的是( )
A.电极a是负极
B.电极b的反应:O2+4e-+2H2O ══ 4OH-
C.该装置可将酸和碱的化学能转化为电能
D.酸性条件下,O2的氧化性强于碱性条件下O2的氧化性
B
1
2
3
4
5
6
7
8
9
10
解析 a为负极,电极反应为4OH--4e- ══ O2↑+2H2O,A正确;b为原电池的正极,电极反应为O2+4e-+4H+ ══ 2H2O,B错误;该反应的总反应为H++OH- ══ H2O,可将酸和碱的化学能转化为电能,C正确;酸性条件下发生反应O2+4e-+4H+ ══ 2H2O,碱性条件下发生反应4OH--4e- ══ O2↑+2H2O,故酸性条件下O2的氧化性强于碱性条件下O2的氧化性,D正确。
1
2
3
4
5
6
7
8
9
10
命题角度2 锂(或锂离子)电池及分析
3.(2023·广东湛江二模)如图是我国发明的超大容量锂硫电池。下列说法不正确的是( )
A.放电时该电池中电子通过外电路,Li+通过内电路均移向正极
B.正极的电极反应为S8+16e- ══ +16Li+8Li2S
C.该电池的电解质为非水体系,通过传递Li+形成电流
D.充电时,金属锂片上发生氧化反应
D
1
2
3
4
5
6
7
8
9
10
解析 放电时,该电池中电子通过外电路,Li+通过内电路均移向正极,A正确;正极S8放电生成Li2S,正极的电极反应为S8+16e-+16Li+ ══ 8Li2S,B正确;锂和水能反应,锂硫电池中电解质不能为水溶液,该电池的电解质为非水体系,通过传递Li+形成电流,C正确;金属锂片为负极,充电时,金属锂片连接外加电源的负极,金属锂片上发生Li+得电子的过程,属于还原反应,D错误。
1
2
3
4
5
6
7
8
9
10
4.(2023·湖北武汉4月调研)我国某科研团队借助氧化还原介质RM,将Li-CO2电池的放电电压提高至3 V以上,该电池的工作原理如图。下列说法正确的是( )
A.LiFePO4电极的电势比多孔碳电极的高
B.负极反应:LiFePO4-xe- ══Li1-xFePO4+xLi+
C.RM和RM'- CO2-均为该电池反应的催化剂
D.LiFePO4电极每减重7 g,就有22 g CO2 被固定
B
解析 LiFePO4电极为负极、多孔碳电极为正极,故LiFePO4电极的电势比多孔碳电极的低,A错误;左侧电极为负极,LiFePO4失去电子发生氧化反应,负极反应:LiFePO4-xe- ══ Li1-xFePO4+xLi+,B正确;RM为该电池反应的催化剂,RM'- CO2-为该电池反应的中间产物,C错误;由负极电极反应可知,LiFePO4电极每减重7 g则转移1 mol电子,反应中碳元素化合价由+4价变为+3价,则根据电子守恒可知,有1 mol即44 g CO2被固定,D错误。
1
2
3
4
5
6
7
8
9
10
1
2
3
4
5
6
7
8
9
10
命题角度3 钠离子电池及分析
5.(2023·陕西铜川二模)我国科研人员研制出以钠箔和多壁碳纳米管为电极的可充电“Na-CO2”电池,工作过程中,Na2CO3与C均
沉积在多壁碳纳米管电极。其工作原理如图所示。下列叙述错误的是( )
A.充电时,多壁碳纳米管为阳极,Na+向钠箔电极方向移动
B.放电时,电路中转移0.1 mol e-,多壁碳纳米管电极增重1.1 g
C.采用多壁碳纳米管作电极可以增强吸附CO2的能力
D.充电时,阳极反应为2Na2CO3+C-4e- ══ 3CO2+4Na+
B
1
2
3
4
5
6
7
8
9
10
解析 充电时,电源电极a为正极,多壁碳纳米管为阳极,Na+向阴极钠箔电极移动,A正确;放电时,Na2CO3与C均沉积在多壁碳纳米管电极上,多壁碳纳米管上的电极反应为3CO2+4e-+4Na+ ══ 2Na2CO3+C,电路中转移0.1 mol e-,多壁碳纳米管电极增重质量为106 g·mol-1×0.05 mol+ ×12 g·mol-1=5.6 g,B错误;多壁碳纳米管表面积大,吸附能力强,用其作电极可以增强吸附CO2的能力,C正确;充电时,阳极碳失电子发生氧化反应,阳极反应为2Na2CO3+C-4e- ══ 3CO2+4Na+,D正确。
1
2
3
4
5
6
7
8
9
10
6.(2023·河北张家口二模)我国新能源汽车上有望推广钠离子电池,一种钠离子电池工作示意图如下,充电时Na+经电解液嵌入石墨(C6),下列说法错误的是( )
A.放电时,电势:电极a>电极b
B.放电时,电子从电极b经外电路流向电极a,再经电解液流回电极b
C.放电过程中,导线上每通过1 mol e-,负极质量减少23 g
D.充电时,电极a上发生反应的电极反应为NaFePO4-xe-══Na1-xFePO4+xNa+
B
1
2
3
4
5
6
7
8
9
10
解析 根据电池工作示意图分析可知,放电时,电极a为正极,电极b为负极,正极的电势高于负极,则电势:电极a>电极b,A正确;放电时,电子从电极b经外电路流向电极a,电子不能通过电解液,B错误;放电过程中,导线上每通过1 mol e-,负极上Na+转移至正极,减小1 mol钠离子,质量减少23 g,C正确;充电时,电极a为阳极,该电极的电极反应为NaFePO4-xe- ══ Na1-xFePO4 +xNa+,D正确。
1
2
3
4
5
6
7
8
9
10
命题角度4 二次锌电池及分析
7.(2023·山西运城二模)我国科研人员利用双极膜技术构造出一类具有能量密度高、循环性能优异的新型水系电池,模拟装置如图所示。已知电极材料分别为Zn和MnO2,相应的产物为[Zn(OH)4]2-和Mn2+。下列说法错误的是( )
A.双极膜中的OH-通过膜a移向M极
B.电池工作一段时间后,NaOH溶液的pH不变
C.N电极的反应为MnO2+4H++2e- ══ Mn2++2H2O
D.若电路中通过2 mol e-,则稀硫酸质量增加89 g
B
1
2
3
4
5
6
7
8
9
10
解析 由题给信息Zn生成[Zn(OH)4]2-,MnO2生成Mn2+可知,M极为Zn电极,N电极材料为MnO2,即M极为负极,N极为正极,OH-移向负极,A正确;负极的电极反应为Zn+4OH--2e- ══[Zn(OH)4]2-,每转移2 mol e-,有2 mol OH-移向NaOH溶液,而消耗4 mol OH-,NaOH溶液的pH变小,B错误;N电极材料为MnO2,MnO2在正极得到电子生成Mn2+,电极反应为MnO2+4H++2e- ══ Mn2++2H2O,C正确;若电路中通过2 mol e-,双极膜中有2 mol H+移向稀硫酸,同时溶解1 mol MnO2,稀硫酸质量增加2 mol×1 g·mol-1+1 mol×87 g·mol-1=89 g,D正确。
1
2
3
4
5
6
7
8
9
10
8.(2023·山东潍坊二模)三维多孔海绵状Zn(3D-Zn)可以高效沉积ZnO,强碱性3D-Zn-NiOOH二次电池结构如图所示,放电时电池反应为Zn+2NiOOH+H2O ══ ZnO+2Ni(OH)2,下列说法正确的是( )
A.充电时阳极反应为Ni(OH)2+OH--e-══NiOOH+H2O
B.充电时导电线圈应与外接直流电源的负极相连
C.放电时电解质溶液碱性减弱
D.放电时每沉积0.1 mol ZnO,有0.1 mol OH-通过隔膜
A
1
2
3
4
5
6
7
8
9
10
解析 充电时,导电线圈做阳极,碱性条件下,氢氧化镍在阳极失去电子发生氧化反应生成碱式氧化镍和水:Ni(OH)2+OH--e- ══ NiOOH+H2O,A正确;充电时,与外接直流电源的正极相连的导电线圈做阳极,B错误;由放电时电池反应可知,强碱性溶液中水的量减少,则溶液中氢氧根离子浓度增大,电解质溶液的碱性增强,C错误;放电时三维多孔海绵状锌为原电池的负极,碱性条件下,锌失去电子发生氧化反应生成氧化锌,电极反应为Zn+2OH--2e- ══ ZnO+H2O,导电线圈为正极,水分子作用下,碱式氧化镍得到电子发生还原反应生成氢氧化镍和氢氧根离子,电极反应为NiOOH+H2O+e- ══ Ni(OH)2+OH-,则放电时每沉积0.1 mol氧化锌,有0.2 mol氢氧根离子通过阴离子交换隔膜,D错误。
1
2
3
4
5
6
7
8
9
10
命题角度5 其他二次电池及分析
9.(2023·齐鲁名校第二次联考)光催化钠离子二次电池的应用研究取得重大进展,该电池工作原理如图所示。下列有关说法不正确的是( )
A.充电时,电子从光催化电极流出通过导线流向
石墨电极
B.放电时,每消耗1 mol NaI3,左室电解质溶液
质量减少46 g
C.充电时,S2-通过离子交换膜进入右室
D.放电时,石墨电极的电极反应为4S2--6e- ══
C
1
2
3
4
5
6
7
8
9
10
1
2
3
4
5
6
7
8
9
10
10.(2023·广东湛江二模)一种FeCl3/FeCl2-Cl2双膜二次电池放电时的工作原理如图所示,下列说法错误的是( )
A.充电时,M极的电极反应为Fe3++e- ══ Fe2+
B.X为阳离子交换膜,Y为阴离子交换膜
C.充电时的总反应:2FeCl3 2FeCl2+Cl2↑
D.放电时,每消耗2.24 L Cl2(标准状况),理论上有0.2 mol电子通过用电器
B
1
2
3
4
5
6
7
8
9
10
解析 放电时,Fe2+在M极失去电子生成Fe3+,M是负极,则充电时,Fe3+在M极得到电子生成Fe2+,电极反应为Fe3++e- ══ Fe2+,A正确;放电时,Fe2+在M极失去电子生成Fe3+,即FeCl2转化为FeCl3,NaCl溶液中的Cl-要通过X进入M极区,X为阴离子交换膜;Cl2在N极得到电子生成Cl-,由电荷守恒可知,NaCl溶液中的Na+要通过Y进入N极区,Y为阳离子交换膜,B错误;放电时,Fe2+在M极失去电子生成Fe3+,Cl2在N极得到电子生成Cl-,则充电时,FeCl3转化为FeCl2和Cl2,总反应为2FeCl3 2FeCl2+Cl2↑,C正确;放电时,Cl2在N极得到电子生成Cl-,电极反应为Cl2+2e- ══ 2Cl-,标准状况下2.24 L Cl2的物质的量为0.1 mol,转移0.2 mol e-,理论上有0.2 mol电子通过用电器,D正确。
同课章节目录
