专题复习 电解质溶液中的图像及分析 课件(共29张PPT)
文档属性
| 名称 | 专题复习 电解质溶液中的图像及分析 课件(共29张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 2.3MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-11-18 22:54:21 | ||
图片预览







文档简介
(共29张PPT)
专题复习 电解质溶液中的图像及分析
2024
1
2
3
4
5
6
7
8
9
命题角度1 滴定过程曲线图像及分析
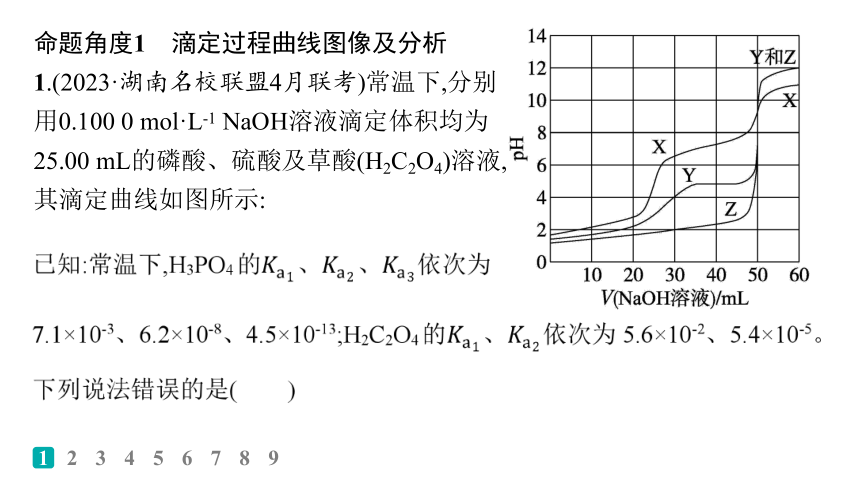
1.(2023·湖南名校联盟4月联考)常温下,分别用0.100 0 mol·L-1 NaOH溶液滴定体积均为25.00 mL的磷酸、硫酸及草酸(H2C2O4)溶液,其滴定曲线如图所示:
A.曲线X、Y、Z分别代表磷酸、草酸、硫酸的pH变化
B.溶液pH=7时,消耗V(NaOH溶液):硫酸>草酸>磷酸
1
2
3
4
5
6
7
8
9
答案 C
1
2
3
4
5
6
7
8
9
解析 当加入的NaOH溶液达到50 mL时,曲线X、Y的pH发生两次突变,Z发生一次突变,则曲线Z代表的应为强酸,即H2SO4;继续滴加NaOH溶液,曲线Y和Z重合,则Y也应是二元酸,即H2C2O4,而X的pH小于二者,说明X中还含有能电离出氢离子的物质,即X为三元酸,即H3PO4,A正确。pH=7时,溶液显中性,硫酸和氢氧化钠刚好完全反应生成强酸强碱盐,而磷酸和草酸为弱酸,要使溶液显中性,则酸要过量,即加入氢氧化钠溶液体积小于50 mL,且酸越弱,消耗氢氧化钠越少,则消耗氢氧化钠溶液体积硫酸>草酸>磷酸,B正确。当V(NaOH溶液)=25 mL时,草酸溶液中的溶质是NaHC2O4,由题图可知,此时溶液显酸性,则草酸氢根离子的电离程度大于水解程度,故
1
2
3
4
5
6
7
8
9
1
2
3
4
5
6
7
8
9
D
1
2
3
4
5
6
7
8
9
1
2
3
4
5
6
7
8
9
1
2
3
4
5
6
7
8
9
命题角度2 滴定中分布分数图像及分析
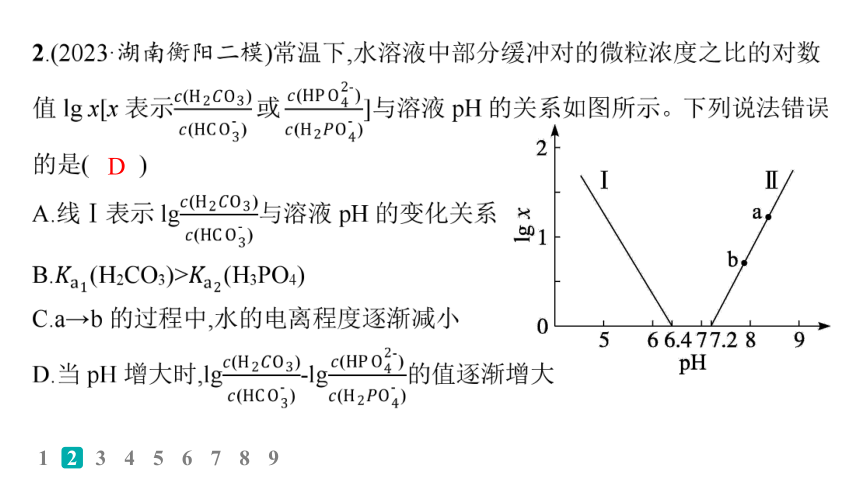
3.(2023·辽宁鞍山二模)常温下,用0.100 0 mol·L-1的NaOH溶液滴定20.00 mL 0.100 0 mol·L-1的二元酸H2A溶液。溶液中,分布分数(δ)随pH的变化关系如图所示[例如A2-的分布分数:δ(A2-)= ]。下列叙述正确的是( )
A.曲线①代表δ(H2A)
B.滴加NaOH溶液体积为30.00 mL时,
溶液中c(HA-)+2c(H+)=c(A2-)+2c(OH-)
C.A2-的水解常数Kh=1.0×10-2
D.a点时溶液中c(Na+)>2c(A2-)+c(HA-)+c(H2A)
B
1
2
3
4
5
6
7
8
9
解析 在未加NaOH溶液时,曲线①的分布分数与曲线②的分布分数之和等于1,且曲线①一直在减小,曲线②一直在增加,说明H2A第一步完全电离,第二步存在电离平衡,即H2A ══ H++HA-,HA- ══ H++A2-,曲线①代表δ(HA-),曲线②代表δ(A2-),A错误;由电荷守恒可得:c(Na+)+c(H+)=2c(A2-) +c(OH-)+c(HA-),滴加NaOH溶液体积为30.00 mL时,根据元素守恒可得:2c(Na+)=3c(A2-) +3c(HA-),联立两式可得:c(HA-)+2c(H+)=c(A2-)+2c(OH-), B正确;A2-的水解常数 ,结合题图中a点数据可知此时c(HA-) =c(A2-),pH=2.0,c(OH-) =1.0×10-12 mol·L-1,Kh=1.0×10-12,C错误;a点时溶液中存在电荷守恒: c(Na+)+c(H+)=2c(A2-)+c(HA-)+c(OH-),此时溶液显酸性,则有c(Na+)<2c(A2-) +c(HA-),c(H2A)=0,从而可得c(Na+)<2c(A2-)+c(HA-) +c(H2A),D错误。
1
2
3
4
5
6
7
8
9
4.(2023·湖北荆州二模)25 ℃时,向0.1 mol·L-1的丙三羧酸(用H3A表示)溶液中滴加0.1 mol·L-1 NaOH溶液,如图所示。
①δ(分布分数)为某种含A微粒占所有含A微粒的物质的量分数。
②醋酸的pKa=4.76(pKa=-lg Ka)。
下列叙述正确的是( )
A.分别向a、b、c各点代表的溶液中滴加少量酸或碱溶液,溶液的pH变化均较大
B.c点溶液中:c(Na+)>c(H2A-)+5c(A3-)
C.0.1 mol·L-1和0.2 mol·L-1的H3A溶液中HA2-的浓度都约为10-4.58 mol·L-1
D.醋酸与少量丙三羧酸钠反应的离子方程式为3CH3COOH+A3- ══ 3CH3COO-+H3A
1
2
3
4
5
6
7
8
9
答案 C
1
2
3
4
5
6
7
8
9
解析 a、b、c均存在电离平衡,滴加少量酸或碱溶液引起平衡正向或逆向移动,可以减弱溶液pH的变化,故pH变化不大,A错误;根据电荷守恒:c(Na+)+c(H+)=c(OH-)+c(H2A-)+2c(HA2-)+3c(A3-),由题图可知c点时c(HA2-)=c(A3-),则有:c(Na+)+c(H+)=c(OH-)+c(H2A-)+5c(A3-),此时溶液pH小于7,即c(H+)>c(OH-),则有c(Na+)1
2
3
4
5
6
7
8
9
等于起始浓度,多元弱酸电离以第一步电离为主,则氢离子浓度约等于第一步电离出氢离子浓度,在第一步电离中c(H+)≈c(H2A-),则c2(H+)≈ c(H3A)②,联立①②得:c(HA2-)≈ ,由b点数据得 =10-4.58,则c(HA2-)≈10-4.58 mol·L-1,与H3A的初始浓度无关,C正确;当c(H3A)=c(H2A-)时,
(H3A)=c(H+)=10-3.49,醋酸pKa=4.76(pKa=-lg Ka),Ka=10-4.76< (H3A),可知醋酸酸性比H3A弱,故该反应不能发生,D错误。
1
2
3
4
5
6
7
8
9
5.(2023·山东潍坊二模)常温下,用Hg(NO3)2测定NaCl溶液中的c(Cl-)时,含Hg微粒的分布分数与lg c(Cl-)的关系如图所示。Hg2+与Cl-的配合物存在如下平衡:
A.K1=10-1,K2=10-0.85
B.在X点:c(HgCl2)∶c(HgCl+)∶c(Hg2+)=2∶1∶1
1
2
3
4
5
6
7
8
9
答案 B
1
2
3
4
5
6
7
8
9
1
2
3
4
5
6
7
8
9
1
2
3
4
5
6
7
8
9
1
2
3
4
5
6
7
8
9
答案 D
1
2
3
4
5
6
7
8
9
1
2
3
4
5
6
7
8
9
1
2
3
4
5
6
7
8
9
命题角度3 沉淀溶解平衡图像及分析
7.(2023·辽宁名校联盟联考)25 ℃时,BaSO4与BaCO3在水中的沉淀溶解平衡曲线如图所示:
已知101.4=25。下列说法错误的是( )
A.298 K时,BaSO4的溶解度小于BaCO3
的溶解度
B.U点坐标为(4,4.8)
C.作为分散质BaSO4,W点v(沉淀)D.对于沉淀溶解平衡
B
1
2
3
4
5
6
7
8
9
1
2
3
4
5
6
7
8
9
8.(2023·北京朝阳区二模)室温下,将Na2CO3溶液与过量CaSO4固体混合,溶液pH随时间变化如图所示。
已知:Ksp(CaSO4)=4.9×10-5、
Ksp(CaCO3)=3.4×10-9。下列说法不正确的是( )
D
1
2
3
4
5
6
7
8
9
1
2
3
4
5
6
7
8
9
9.(2023·山东泰安二模)二元有机酸(H2X)的电离常数 =1.67×10-8、
=3.34×10-17。BaX难溶于水,常温下,将BaX溶解在一定浓度的HY溶液中,直至不再溶解,测得混合液中c2(H+)与c2(Ba2+)的关系如图所示。
已知:①HY是一元强酸,BaY2易溶于水;
②0.192=0.036 1,0.382=0.144 4。
下列说法错误的是( )
A.NaHX溶液显碱性
B.溶度积Ksp(BaX)≈6.18×10-21
C.b点:2c(Ba2+)+c(H+)=2c(X2-)+c(HX-)+c(OH-)+c(Y-)
D.若0.1 mol BaX溶于25 mL x mol·L-1 HY溶液中得到c点溶液,则x≈8.38
B
1
2
3
4
5
6
7
8
9
1
2
3
4
5
6
7
8
9
专题复习 电解质溶液中的图像及分析
2024
1
2
3
4
5
6
7
8
9
命题角度1 滴定过程曲线图像及分析
1.(2023·湖南名校联盟4月联考)常温下,分别用0.100 0 mol·L-1 NaOH溶液滴定体积均为25.00 mL的磷酸、硫酸及草酸(H2C2O4)溶液,其滴定曲线如图所示:
A.曲线X、Y、Z分别代表磷酸、草酸、硫酸的pH变化
B.溶液pH=7时,消耗V(NaOH溶液):硫酸>草酸>磷酸
1
2
3
4
5
6
7
8
9
答案 C
1
2
3
4
5
6
7
8
9
解析 当加入的NaOH溶液达到50 mL时,曲线X、Y的pH发生两次突变,Z发生一次突变,则曲线Z代表的应为强酸,即H2SO4;继续滴加NaOH溶液,曲线Y和Z重合,则Y也应是二元酸,即H2C2O4,而X的pH小于二者,说明X中还含有能电离出氢离子的物质,即X为三元酸,即H3PO4,A正确。pH=7时,溶液显中性,硫酸和氢氧化钠刚好完全反应生成强酸强碱盐,而磷酸和草酸为弱酸,要使溶液显中性,则酸要过量,即加入氢氧化钠溶液体积小于50 mL,且酸越弱,消耗氢氧化钠越少,则消耗氢氧化钠溶液体积硫酸>草酸>磷酸,B正确。当V(NaOH溶液)=25 mL时,草酸溶液中的溶质是NaHC2O4,由题图可知,此时溶液显酸性,则草酸氢根离子的电离程度大于水解程度,故
1
2
3
4
5
6
7
8
9
1
2
3
4
5
6
7
8
9
D
1
2
3
4
5
6
7
8
9
1
2
3
4
5
6
7
8
9
1
2
3
4
5
6
7
8
9
命题角度2 滴定中分布分数图像及分析
3.(2023·辽宁鞍山二模)常温下,用0.100 0 mol·L-1的NaOH溶液滴定20.00 mL 0.100 0 mol·L-1的二元酸H2A溶液。溶液中,分布分数(δ)随pH的变化关系如图所示[例如A2-的分布分数:δ(A2-)= ]。下列叙述正确的是( )
A.曲线①代表δ(H2A)
B.滴加NaOH溶液体积为30.00 mL时,
溶液中c(HA-)+2c(H+)=c(A2-)+2c(OH-)
C.A2-的水解常数Kh=1.0×10-2
D.a点时溶液中c(Na+)>2c(A2-)+c(HA-)+c(H2A)
B
1
2
3
4
5
6
7
8
9
解析 在未加NaOH溶液时,曲线①的分布分数与曲线②的分布分数之和等于1,且曲线①一直在减小,曲线②一直在增加,说明H2A第一步完全电离,第二步存在电离平衡,即H2A ══ H++HA-,HA- ══ H++A2-,曲线①代表δ(HA-),曲线②代表δ(A2-),A错误;由电荷守恒可得:c(Na+)+c(H+)=2c(A2-) +c(OH-)+c(HA-),滴加NaOH溶液体积为30.00 mL时,根据元素守恒可得:2c(Na+)=3c(A2-) +3c(HA-),联立两式可得:c(HA-)+2c(H+)=c(A2-)+2c(OH-), B正确;A2-的水解常数 ,结合题图中a点数据可知此时c(HA-) =c(A2-),pH=2.0,c(OH-) =1.0×10-12 mol·L-1,Kh=1.0×10-12,C错误;a点时溶液中存在电荷守恒: c(Na+)+c(H+)=2c(A2-)+c(HA-)+c(OH-),此时溶液显酸性,则有c(Na+)<2c(A2-) +c(HA-),c(H2A)=0,从而可得c(Na+)<2c(A2-)+c(HA-) +c(H2A),D错误。
1
2
3
4
5
6
7
8
9
4.(2023·湖北荆州二模)25 ℃时,向0.1 mol·L-1的丙三羧酸(用H3A表示)溶液中滴加0.1 mol·L-1 NaOH溶液,如图所示。
①δ(分布分数)为某种含A微粒占所有含A微粒的物质的量分数。
②醋酸的pKa=4.76(pKa=-lg Ka)。
下列叙述正确的是( )
A.分别向a、b、c各点代表的溶液中滴加少量酸或碱溶液,溶液的pH变化均较大
B.c点溶液中:c(Na+)>c(H2A-)+5c(A3-)
C.0.1 mol·L-1和0.2 mol·L-1的H3A溶液中HA2-的浓度都约为10-4.58 mol·L-1
D.醋酸与少量丙三羧酸钠反应的离子方程式为3CH3COOH+A3- ══ 3CH3COO-+H3A
1
2
3
4
5
6
7
8
9
答案 C
1
2
3
4
5
6
7
8
9
解析 a、b、c均存在电离平衡,滴加少量酸或碱溶液引起平衡正向或逆向移动,可以减弱溶液pH的变化,故pH变化不大,A错误;根据电荷守恒:c(Na+)+c(H+)=c(OH-)+c(H2A-)+2c(HA2-)+3c(A3-),由题图可知c点时c(HA2-)=c(A3-),则有:c(Na+)+c(H+)=c(OH-)+c(H2A-)+5c(A3-),此时溶液pH小于7,即c(H+)>c(OH-),则有c(Na+)
2
3
4
5
6
7
8
9
等于起始浓度,多元弱酸电离以第一步电离为主,则氢离子浓度约等于第一步电离出氢离子浓度,在第一步电离中c(H+)≈c(H2A-),则c2(H+)≈ c(H3A)②,联立①②得:c(HA2-)≈ ,由b点数据得 =10-4.58,则c(HA2-)≈10-4.58 mol·L-1,与H3A的初始浓度无关,C正确;当c(H3A)=c(H2A-)时,
(H3A)=c(H+)=10-3.49,醋酸pKa=4.76(pKa=-lg Ka),Ka=10-4.76< (H3A),可知醋酸酸性比H3A弱,故该反应不能发生,D错误。
1
2
3
4
5
6
7
8
9
5.(2023·山东潍坊二模)常温下,用Hg(NO3)2测定NaCl溶液中的c(Cl-)时,含Hg微粒的分布分数与lg c(Cl-)的关系如图所示。Hg2+与Cl-的配合物存在如下平衡:
A.K1=10-1,K2=10-0.85
B.在X点:c(HgCl2)∶c(HgCl+)∶c(Hg2+)=2∶1∶1
1
2
3
4
5
6
7
8
9
答案 B
1
2
3
4
5
6
7
8
9
1
2
3
4
5
6
7
8
9
1
2
3
4
5
6
7
8
9
1
2
3
4
5
6
7
8
9
答案 D
1
2
3
4
5
6
7
8
9
1
2
3
4
5
6
7
8
9
1
2
3
4
5
6
7
8
9
命题角度3 沉淀溶解平衡图像及分析
7.(2023·辽宁名校联盟联考)25 ℃时,BaSO4与BaCO3在水中的沉淀溶解平衡曲线如图所示:
已知101.4=25。下列说法错误的是( )
A.298 K时,BaSO4的溶解度小于BaCO3
的溶解度
B.U点坐标为(4,4.8)
C.作为分散质BaSO4,W点v(沉淀)
B
1
2
3
4
5
6
7
8
9
1
2
3
4
5
6
7
8
9
8.(2023·北京朝阳区二模)室温下,将Na2CO3溶液与过量CaSO4固体混合,溶液pH随时间变化如图所示。
已知:Ksp(CaSO4)=4.9×10-5、
Ksp(CaCO3)=3.4×10-9。下列说法不正确的是( )
D
1
2
3
4
5
6
7
8
9
1
2
3
4
5
6
7
8
9
9.(2023·山东泰安二模)二元有机酸(H2X)的电离常数 =1.67×10-8、
=3.34×10-17。BaX难溶于水,常温下,将BaX溶解在一定浓度的HY溶液中,直至不再溶解,测得混合液中c2(H+)与c2(Ba2+)的关系如图所示。
已知:①HY是一元强酸,BaY2易溶于水;
②0.192=0.036 1,0.382=0.144 4。
下列说法错误的是( )
A.NaHX溶液显碱性
B.溶度积Ksp(BaX)≈6.18×10-21
C.b点:2c(Ba2+)+c(H+)=2c(X2-)+c(HX-)+c(OH-)+c(Y-)
D.若0.1 mol BaX溶于25 mL x mol·L-1 HY溶液中得到c点溶液,则x≈8.38
B
1
2
3
4
5
6
7
8
9
1
2
3
4
5
6
7
8
9
同课章节目录
