专题 化学常用计算方法 课件(共26张PPT)
文档属性
| 名称 | 专题 化学常用计算方法 课件(共26张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 1.3MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-11-19 09:29:41 | ||
图片预览







文档简介
(共26张PPT)
专题 化学常用计算方法
突破点1 热重分析及应用
核心归纳
高考指引:近几年,高考试题在选择题、化工流程题、实验综合题中考查了热重分析法及其应用,根据加热过程中,固体物质的质量变化,确定物质的组成、含量等,突出对“宏观辨识与微观探析”“证据推理与模型认知”等化学学科核心素养的考查。
1.热重分析法的原理
使待测样品处于一定的温度程序(升/降/恒温)控制下,观察样品的质量随温度或时间的变化过程,获取失重比例、失重温度(起始点、峰值、终止点……)以及分解残留量等相关信息,进行分析计算,确定剩余物质的成分。
2.热重曲线
热重曲线是指使用热天平记录的热分析曲线,纵坐标为试样质量或残留率,横坐标为温度或时间。通过对热重曲线的分析,我们可以知道样品及其可能产生的中间产物的组成、热稳定性、分解情况及生成的产物等与质量相联系的信息。
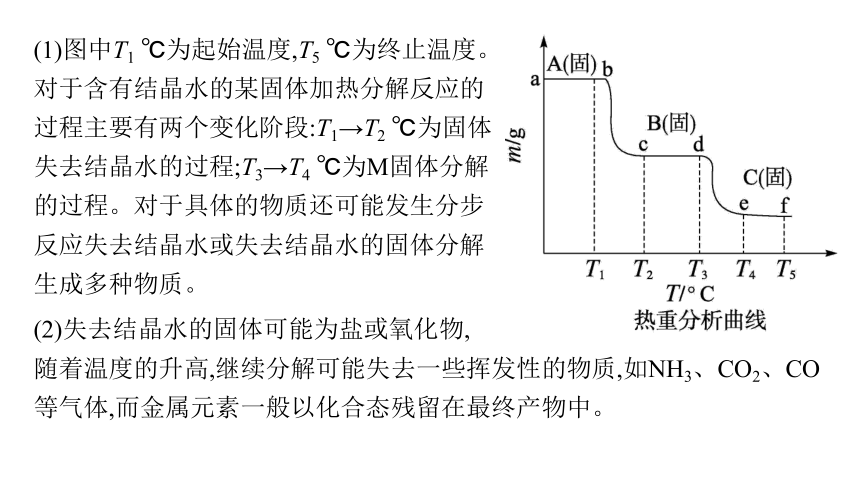
(1)图中T1 ℃为起始温度,T5 ℃为终止温度。对于含有结晶水的某固体加热分解反应的过程主要有两个变化阶段:T1→T2 ℃为固体失去结晶水的过程;T3→T4 ℃为M固体分解的过程。对于具体的物质还可能发生分步反应失去结晶水或失去结晶水的固体分解生成多种物质。
(2)失去结晶水的固体可能为盐或氧化物,
随着温度的升高,继续分解可能失去一些挥发性的物质,如NH3、CO2、CO等气体,而金属元素一般以化合态残留在最终产物中。
解析 根据题意分析可知,W为H、X为B、Y为N、Z为O。X(B)的单质常温下为固体,A错误;根据元素非金属性越强,其最高价氧化物的水化物酸性越强,则最高价氧化物的水化物酸性:X(H3BO3)200 ℃以下热分解时无刺激性气体逸出,则说明失去的是水,若100~200 ℃阶段热分解失去4个H2O,则质量保留百分数为
真题感悟
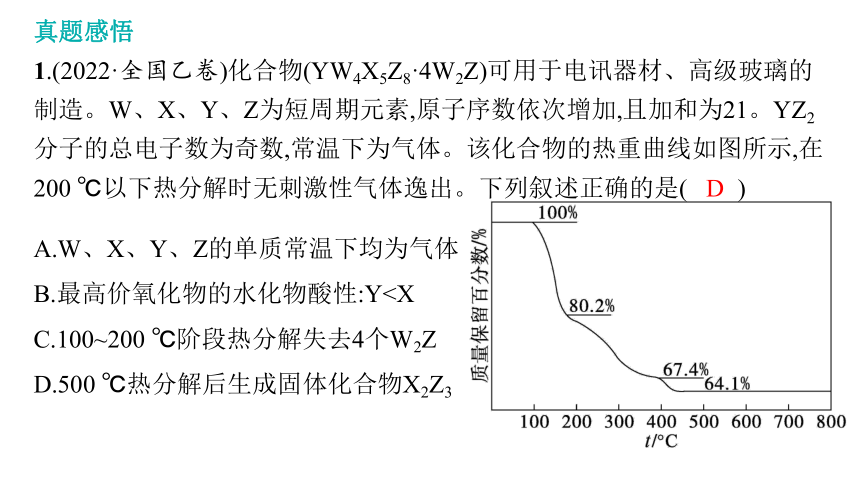
1.(2022·全国乙卷)化合物(YW4X5Z8·4W2Z)可用于电讯器材、高级玻璃的制造。W、X、Y、Z为短周期元素,原子序数依次增加,且加和为21。YZ2分子的总电子数为奇数,常温下为气体。该化合物的热重曲线如图所示,在200 ℃以下热分解时无刺激性气体逸出。下列叙述正确的是( )
A.W、X、Y、Z的单质常温下均为气体
B.最高价氧化物的水化物酸性:YC.100~200 ℃阶段热分解失去4个W2Z
D.500 ℃热分解后生成固体化合物X2Z3
D
思路剖析推断W、X、Y、Z四种元素的思路如下:
(1)W、X、Y、Z为短周期元素,原子序数依次增加,且加和为21。
(2)化合物(YW4X5Z8·4W2Z)的热重曲线中,在200 ℃以下热分解时无刺激性气体逸出,推测失去水,即W为H,Z为O。
(3)YZ2分子的总电子数为奇数,常温下为气体,则Y为N;四种元素的原子序数依次增加,且加和为21,则X为B。
2.(2023·山东卷,18节选)三氯甲硅烷(SiHCl3)是制取高纯硅的重要原料,常温下为无色液体,沸点为31.8 ℃,熔点为-126.5 ℃,易水解。
采用如下方法测定溶有少量HCl的SiHCl3的纯度。
m1 g样品经水解、干燥等预处理过程得硅酸水合物后,进行如下实验操作:① ,② (填操作名称),③称量等操作,测得所得固体氧化物质量为m2g,从下列仪器中选出①、②中需使用的仪器,依次为 (填大写字母)。
测得样品纯度为 (用含m1、m2的代数式表示)。
灼烧
干燥
A、C
解析 样品经水解、干燥等预处理后,得到H2SiO3;再将H2SiO3置于坩埚中灼烧,转化为SiO2,然后将坩埚放入干燥器中干燥,反复2~3次后称量,m2 g即为所得固体氧化物SiO2的质量。依据上述分析,实验操作①为灼烧,②为干燥,①、②中需使用的仪器分别为A、C。
SiHCl3纯度测定过程中有以下关系式:SiHCl3~H2SiO3~SiO2,由此可知
【思维建模】
解答热重曲线及分析类题目的方法
分析图像,明确坐标含义 分析失重图像,横坐标一般是分解的温度,纵坐标一般为剩余固体的质量或固体残留率
依据性质,猜测各段反应 含结晶水的盐加热失重时一般先失去部分或全部结晶水,再失去非金属氧化物,失重最后一般为金属氧化物或金属,晶体中金属质量不减少,仍在残留固体中
整合数据,验证猜测结果 根据纵坐标的数据变化或题目给定的数据,根据金属原子守恒,即可求出失重后物质的化学式,或者判断出发生的化学反应
。
考向预测
(2023·江苏盐城模拟)CO2的资源化利用能有效减少CO2排放,充分利用碳资源。CaO可在较高温度下捕集CO2,在更高温度下将捕集的CO2释放并利用。CaC2O4·H2O热分解可制备CaO,CaC2O4·H2O加
热升温过程中固体的质量变化如图所示。
(1)写出400~600 ℃范围内分解反应的化学方程式:
。
(2)与CaCO3热分解制备的CaO相比,CaC2O4·H2O热分解制备的CaO具有更好的CO2捕集性能,其原因是
CaC2O4·H2O热分解放出更多的气体,制得的CaO更加疏松多孔
(2)CaC2O4·H2O分解产生更多的气体,导致制得的CaO更加疏松多孔,接触面积更大,捕集CO2的性能更好。
突破点2 物质含量及滴定计算
核心归纳
高考指引:近几年,高考试题在综合实验题、化工流程题中重点考查了滴定法的原理及应用,以氧化还原滴定为主,兼顾考查氧化还原反应的计算、“关系式”法的应用等,突出对“证据推理与模型认知”化学学科核心素养的考查。
1.滴定计算中的“关系式”法
(1)“关系式”法表示两种或多种物质之间物质的量关系的一种简化式子。在多步反应中,可以将最初反应物与最终生成物之间的物质的量关系表示出来,把多步计算简化成一步计算。
(2)确定“关系式”的依据
①依据多个反应方程式,根据某物质(或元素)确定关系式;
②根据守恒关系(如原子守恒、得失电子守恒等)确定关系式。
2.滴定计算中的“守恒”法
(1)元素守恒:根据化学反应的实质是原子的重新组合,反应前后各原子的种类和数目保持不变。
(2)得失电子守恒:利用滴定法测定物质含量时,多步连续氧化还原反应可以通过得失电子守恒建立关系式,并进行相关计算。
真题感悟
1.(2023·湖北卷,18节选)学习小组探究了铜的氧化过程及铜的氧化物的组成。回答下列问题。
(1)用足量NaOH处理某实验新制的溶液得到沉淀X,元素分析表明X为铜的氧化物,提纯干燥后的X在惰性氛围下加热,m g X完全分解为n g黑色氧化物Y, 。X的化学式为 。
CuO2
(2)取含X粗品0.050 0 g(杂质不参加反应)与过量的酸性KI完全反应后,调节溶液至弱酸性。以淀粉为指示剂,用0.100 0 mol·L-1 Na2S2O3标准溶液滴定,滴定终点时消耗Na2S2O3标准溶液15.00 mL。
标志滴定终点的现象是__________________________________________
,粗品中X的相对含量为 。
当滴入最后半滴Na2S2O3溶液,锥形瓶中溶液蓝色消失,且在半分钟内不变色,说明到达滴定终点
96%
2.(2022·重庆卷,15节选)电子印制工业产生的某退锡废液含硝酸、锡化合物及少量Fe3+和Cu2+等,对其处理的流程如图。
Na2SnO3产品中锡含量的测定:
称取产品1.500 g,用大量盐酸溶解,在CO2保护下,先用Al片将Sn4+还原为Sn2+,再用0.100 0 mol·L-1 KIO3标准溶液滴定,以淀粉作指示剂。滴定过程中I被还原为I-,终点时消耗KIO3溶液20.00 mL。
(1)终点时的现象为____________________________________________
,产生I2的离子反应方程式为
。
(2)产品中Sn元素的质量分数为 %。(可能用到的相对原子质量:Sn-119)
滴入最后半滴KIO3标准溶液,溶液由无色变为蓝色,
且半分钟内不褪色
+5I-+6H+ ══ 3I2+3H2O
47.60
思路剖析计算产品中Sn元素的质量分数的思路如下:
(2)根据滴定反应原理,确定Sn2+与KIO3的关系式,并结合滴定数据进行计算。
【思维建模】
利用“关系式”法解答滴定计算题的步骤
考向预测
1.(2023·四川绵阳模拟)测定三草酸合铁酸钾
K3[Fe(C2O4)3]·3H2O中铁的含量。
(1)称量m g样品置于锥形瓶中,溶解后加稀硫酸酸化,用c mol·L-1 KMnO4溶液滴定至终点。滴定终点的现象是_______________________________
。
(2)向上述溶液中加入过量铜粉至反应完全后,过滤、洗涤,将滤液及洗涤液全部收集到锥形瓶中。加稀硫酸酸化,用c mol·L-1 KMnO4溶液滴定至终点,消耗KMnO4溶液V mL。该晶体中铁元素的质量分数的表达式
为 。
滴入最后半滴KMnO4溶液,溶液出现
粉红色,且半分钟内不褪色
2.(2023·河南新乡模拟)为测定V2O5产品的纯度,某同学准确称取V2O5产品2.000 g,加入足量稀硫酸使其完全反应生成(VO2)2SO4,并配成250 mL溶液。取出25.00 mL溶液用0.100 0 mol·L-1的H2C2O4标准溶液滴定,滴定到终点时消耗标准液10.00 mL。
(1)已知滴定过程中H2C2O4被氧化为CO2, (黄色)被还原为VO2+(蓝色),该反应的离子方程式为 。
(2)该产品的纯度为 。
91.00%
专题 化学常用计算方法
突破点1 热重分析及应用
核心归纳
高考指引:近几年,高考试题在选择题、化工流程题、实验综合题中考查了热重分析法及其应用,根据加热过程中,固体物质的质量变化,确定物质的组成、含量等,突出对“宏观辨识与微观探析”“证据推理与模型认知”等化学学科核心素养的考查。
1.热重分析法的原理
使待测样品处于一定的温度程序(升/降/恒温)控制下,观察样品的质量随温度或时间的变化过程,获取失重比例、失重温度(起始点、峰值、终止点……)以及分解残留量等相关信息,进行分析计算,确定剩余物质的成分。
2.热重曲线
热重曲线是指使用热天平记录的热分析曲线,纵坐标为试样质量或残留率,横坐标为温度或时间。通过对热重曲线的分析,我们可以知道样品及其可能产生的中间产物的组成、热稳定性、分解情况及生成的产物等与质量相联系的信息。
(1)图中T1 ℃为起始温度,T5 ℃为终止温度。对于含有结晶水的某固体加热分解反应的过程主要有两个变化阶段:T1→T2 ℃为固体失去结晶水的过程;T3→T4 ℃为M固体分解的过程。对于具体的物质还可能发生分步反应失去结晶水或失去结晶水的固体分解生成多种物质。
(2)失去结晶水的固体可能为盐或氧化物,
随着温度的升高,继续分解可能失去一些挥发性的物质,如NH3、CO2、CO等气体,而金属元素一般以化合态残留在最终产物中。
解析 根据题意分析可知,W为H、X为B、Y为N、Z为O。X(B)的单质常温下为固体,A错误;根据元素非金属性越强,其最高价氧化物的水化物酸性越强,则最高价氧化物的水化物酸性:X(H3BO3)
真题感悟
1.(2022·全国乙卷)化合物(YW4X5Z8·4W2Z)可用于电讯器材、高级玻璃的制造。W、X、Y、Z为短周期元素,原子序数依次增加,且加和为21。YZ2分子的总电子数为奇数,常温下为气体。该化合物的热重曲线如图所示,在200 ℃以下热分解时无刺激性气体逸出。下列叙述正确的是( )
A.W、X、Y、Z的单质常温下均为气体
B.最高价氧化物的水化物酸性:Y
D.500 ℃热分解后生成固体化合物X2Z3
D
思路剖析推断W、X、Y、Z四种元素的思路如下:
(1)W、X、Y、Z为短周期元素,原子序数依次增加,且加和为21。
(2)化合物(YW4X5Z8·4W2Z)的热重曲线中,在200 ℃以下热分解时无刺激性气体逸出,推测失去水,即W为H,Z为O。
(3)YZ2分子的总电子数为奇数,常温下为气体,则Y为N;四种元素的原子序数依次增加,且加和为21,则X为B。
2.(2023·山东卷,18节选)三氯甲硅烷(SiHCl3)是制取高纯硅的重要原料,常温下为无色液体,沸点为31.8 ℃,熔点为-126.5 ℃,易水解。
采用如下方法测定溶有少量HCl的SiHCl3的纯度。
m1 g样品经水解、干燥等预处理过程得硅酸水合物后,进行如下实验操作:① ,② (填操作名称),③称量等操作,测得所得固体氧化物质量为m2g,从下列仪器中选出①、②中需使用的仪器,依次为 (填大写字母)。
测得样品纯度为 (用含m1、m2的代数式表示)。
灼烧
干燥
A、C
解析 样品经水解、干燥等预处理后,得到H2SiO3;再将H2SiO3置于坩埚中灼烧,转化为SiO2,然后将坩埚放入干燥器中干燥,反复2~3次后称量,m2 g即为所得固体氧化物SiO2的质量。依据上述分析,实验操作①为灼烧,②为干燥,①、②中需使用的仪器分别为A、C。
SiHCl3纯度测定过程中有以下关系式:SiHCl3~H2SiO3~SiO2,由此可知
【思维建模】
解答热重曲线及分析类题目的方法
分析图像,明确坐标含义 分析失重图像,横坐标一般是分解的温度,纵坐标一般为剩余固体的质量或固体残留率
依据性质,猜测各段反应 含结晶水的盐加热失重时一般先失去部分或全部结晶水,再失去非金属氧化物,失重最后一般为金属氧化物或金属,晶体中金属质量不减少,仍在残留固体中
整合数据,验证猜测结果 根据纵坐标的数据变化或题目给定的数据,根据金属原子守恒,即可求出失重后物质的化学式,或者判断出发生的化学反应
。
考向预测
(2023·江苏盐城模拟)CO2的资源化利用能有效减少CO2排放,充分利用碳资源。CaO可在较高温度下捕集CO2,在更高温度下将捕集的CO2释放并利用。CaC2O4·H2O热分解可制备CaO,CaC2O4·H2O加
热升温过程中固体的质量变化如图所示。
(1)写出400~600 ℃范围内分解反应的化学方程式:
。
(2)与CaCO3热分解制备的CaO相比,CaC2O4·H2O热分解制备的CaO具有更好的CO2捕集性能,其原因是
CaC2O4·H2O热分解放出更多的气体,制得的CaO更加疏松多孔
(2)CaC2O4·H2O分解产生更多的气体,导致制得的CaO更加疏松多孔,接触面积更大,捕集CO2的性能更好。
突破点2 物质含量及滴定计算
核心归纳
高考指引:近几年,高考试题在综合实验题、化工流程题中重点考查了滴定法的原理及应用,以氧化还原滴定为主,兼顾考查氧化还原反应的计算、“关系式”法的应用等,突出对“证据推理与模型认知”化学学科核心素养的考查。
1.滴定计算中的“关系式”法
(1)“关系式”法表示两种或多种物质之间物质的量关系的一种简化式子。在多步反应中,可以将最初反应物与最终生成物之间的物质的量关系表示出来,把多步计算简化成一步计算。
(2)确定“关系式”的依据
①依据多个反应方程式,根据某物质(或元素)确定关系式;
②根据守恒关系(如原子守恒、得失电子守恒等)确定关系式。
2.滴定计算中的“守恒”法
(1)元素守恒:根据化学反应的实质是原子的重新组合,反应前后各原子的种类和数目保持不变。
(2)得失电子守恒:利用滴定法测定物质含量时,多步连续氧化还原反应可以通过得失电子守恒建立关系式,并进行相关计算。
真题感悟
1.(2023·湖北卷,18节选)学习小组探究了铜的氧化过程及铜的氧化物的组成。回答下列问题。
(1)用足量NaOH处理某实验新制的溶液得到沉淀X,元素分析表明X为铜的氧化物,提纯干燥后的X在惰性氛围下加热,m g X完全分解为n g黑色氧化物Y, 。X的化学式为 。
CuO2
(2)取含X粗品0.050 0 g(杂质不参加反应)与过量的酸性KI完全反应后,调节溶液至弱酸性。以淀粉为指示剂,用0.100 0 mol·L-1 Na2S2O3标准溶液滴定,滴定终点时消耗Na2S2O3标准溶液15.00 mL。
标志滴定终点的现象是__________________________________________
,粗品中X的相对含量为 。
当滴入最后半滴Na2S2O3溶液,锥形瓶中溶液蓝色消失,且在半分钟内不变色,说明到达滴定终点
96%
2.(2022·重庆卷,15节选)电子印制工业产生的某退锡废液含硝酸、锡化合物及少量Fe3+和Cu2+等,对其处理的流程如图。
Na2SnO3产品中锡含量的测定:
称取产品1.500 g,用大量盐酸溶解,在CO2保护下,先用Al片将Sn4+还原为Sn2+,再用0.100 0 mol·L-1 KIO3标准溶液滴定,以淀粉作指示剂。滴定过程中I被还原为I-,终点时消耗KIO3溶液20.00 mL。
(1)终点时的现象为____________________________________________
,产生I2的离子反应方程式为
。
(2)产品中Sn元素的质量分数为 %。(可能用到的相对原子质量:Sn-119)
滴入最后半滴KIO3标准溶液,溶液由无色变为蓝色,
且半分钟内不褪色
+5I-+6H+ ══ 3I2+3H2O
47.60
思路剖析计算产品中Sn元素的质量分数的思路如下:
(2)根据滴定反应原理,确定Sn2+与KIO3的关系式,并结合滴定数据进行计算。
【思维建模】
利用“关系式”法解答滴定计算题的步骤
考向预测
1.(2023·四川绵阳模拟)测定三草酸合铁酸钾
K3[Fe(C2O4)3]·3H2O中铁的含量。
(1)称量m g样品置于锥形瓶中,溶解后加稀硫酸酸化,用c mol·L-1 KMnO4溶液滴定至终点。滴定终点的现象是_______________________________
。
(2)向上述溶液中加入过量铜粉至反应完全后,过滤、洗涤,将滤液及洗涤液全部收集到锥形瓶中。加稀硫酸酸化,用c mol·L-1 KMnO4溶液滴定至终点,消耗KMnO4溶液V mL。该晶体中铁元素的质量分数的表达式
为 。
滴入最后半滴KMnO4溶液,溶液出现
粉红色,且半分钟内不褪色
2.(2023·河南新乡模拟)为测定V2O5产品的纯度,某同学准确称取V2O5产品2.000 g,加入足量稀硫酸使其完全反应生成(VO2)2SO4,并配成250 mL溶液。取出25.00 mL溶液用0.100 0 mol·L-1的H2C2O4标准溶液滴定,滴定到终点时消耗标准液10.00 mL。
(1)已知滴定过程中H2C2O4被氧化为CO2, (黄色)被还原为VO2+(蓝色),该反应的离子方程式为 。
(2)该产品的纯度为 。
91.00%
同课章节目录
