专题 物质的量浓度及溶液配制 课件(共30张PPT)
文档属性
| 名称 | 专题 物质的量浓度及溶液配制 课件(共30张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 1.5MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-11-19 09:32:32 | ||
图片预览






文档简介
(共30张PPT)
专题 物质的量浓度及溶液配制
聚焦核心要点
要点1一定物质的量浓度溶液的配制及误差分析
课标指引:初步学会配制一定物质的量浓度的溶液等化学实验基础知识和基本技能。
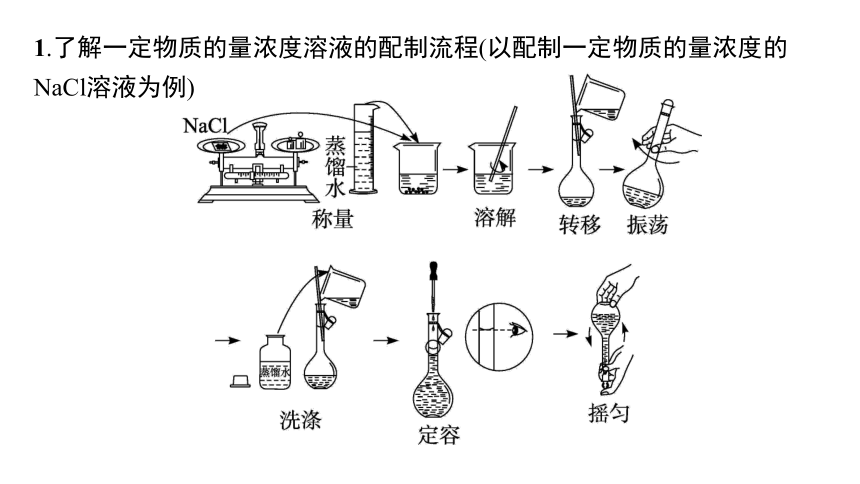
1.了解一定物质的量浓度溶液的配制流程(以配制一定物质的量浓度的NaCl溶液为例)
微点归纳
配制一定质量分数溶液的步骤及仪器
步骤:计算溶质、溶剂的质量→称量或量取→搅拌、溶解→装瓶、贴标签等。
所需仪器:托盘天平(电子天平)、药匙、量筒、烧杯、玻璃棒、细口瓶。
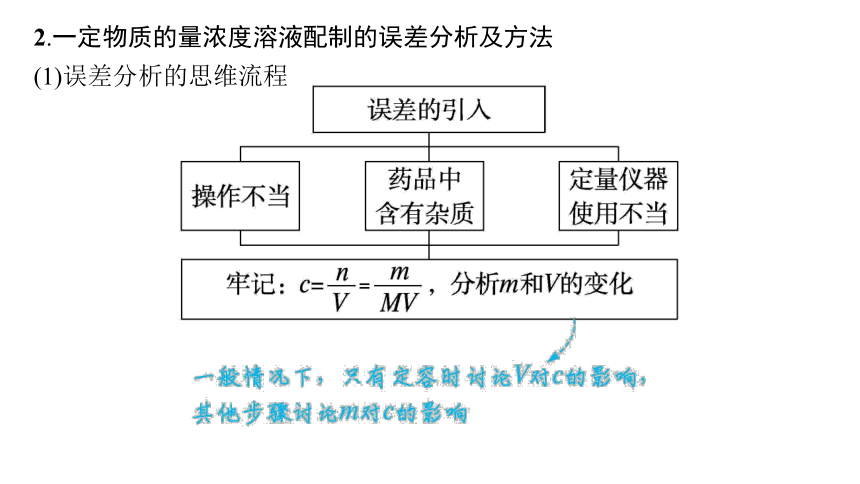
2.一定物质的量浓度溶液配制的误差分析及方法
(1)误差分析的思维流程
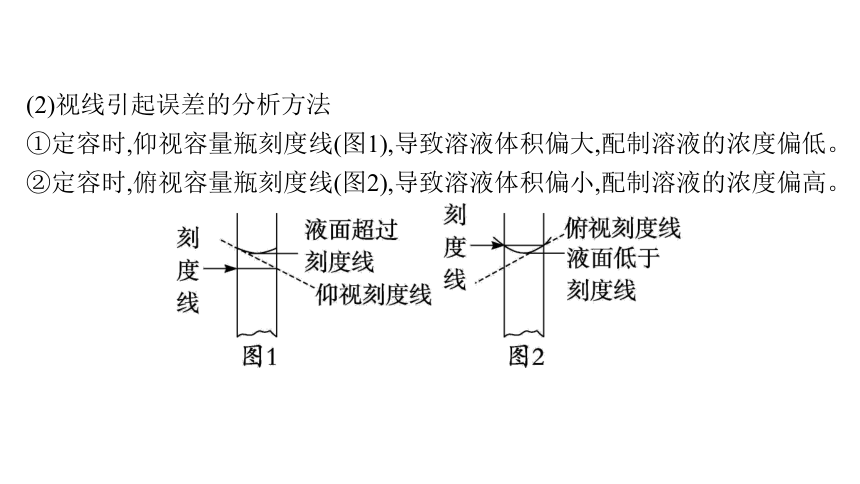
(2)视线引起误差的分析方法
①定容时,仰视容量瓶刻度线(图1),导致溶液体积偏大,配制溶液的浓度偏低。
②定容时,俯视容量瓶刻度线(图2),导致溶液体积偏小,配制溶液的浓度偏高。
要点2有关物质的量浓度的计算
课标指引:运用物质的量、摩尔质量、气体摩尔体积、物质的量浓度之间的相互关系进行简单计算。
1.计算物质的量浓度的基本方法
2.计算物质的量浓度的三个技巧
换算 公式 溶液中溶质的质量分数与物质的量浓度之间的换算: ;c为溶质的物质的量浓度,单位为mol·L-1;ρ为溶液的密度,单位为g·cm-3,w为溶质的质量分数,M为溶质的摩尔质量,单位为g·mol-1
质量 守恒 ①化学反应前后,反应物和生成物的总质量相等(即元素的种类和质量不变);
②稀释前后,溶质的质量(或物质的量)保持不变:
c(浓)×V(浓)=c(稀)×V(稀)
电荷 守恒 溶液呈电中性,溶液中阳离子所带正电荷总数等于阴离子所带负电荷总数
精研核心命题
命题点1配制溶液的操作及仪器的选择
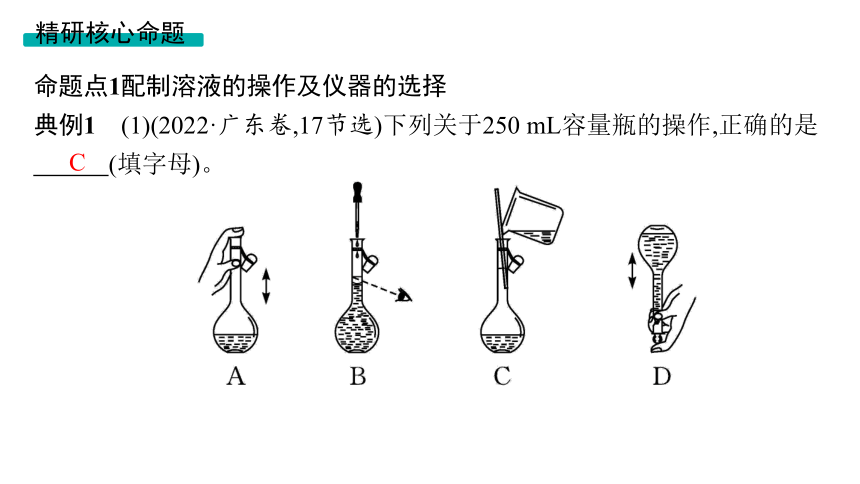
典例1 (1)(2022·广东卷,17节选)下列关于250 mL容量瓶的操作,正确的是
(填字母)。
C
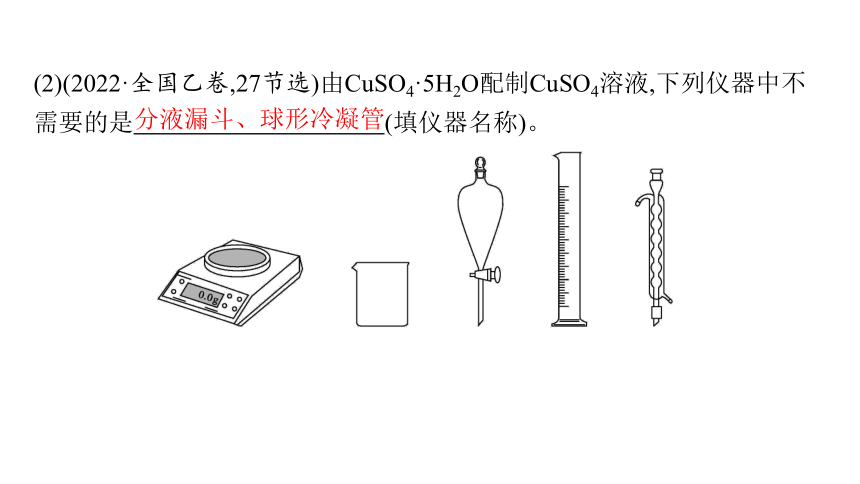
(2)(2022·全国乙卷,27节选)由CuSO4·5H2O配制CuSO4溶液,下列仪器中不需要的是 (填仪器名称)。
分液漏斗、球形冷凝管
解析 (1)使用容量瓶过程中,不能用手等触碰瓶口,以免污染试剂,A错误;定容时,不能仰视或俯视,B错误;向容量瓶中转移液体时,需用玻璃棒引流,玻璃棒下端位于刻度线以下,同时玻璃棒不能接触容量瓶口,C正确;定容完成后,盖上瓶塞,将容量瓶来回颠倒,将溶液摇匀,颠倒过程中,左手食指抵住瓶塞,防止瓶塞脱落,右手扶住容量瓶底部,防止容量瓶从左手掉落,D错误。
(2)由CuSO4·5H2O固体配制硫酸铜溶液时,需用天平称量一定质量的CuSO4·5H2O固体,将称量好的固体放入烧杯中,用量筒量取一定体积的水溶解CuSO4·5H2O,故用不到的仪器有分液漏斗和球形冷凝管。
变式演练(2023·广东深圳一模)稀硫酸的配制:
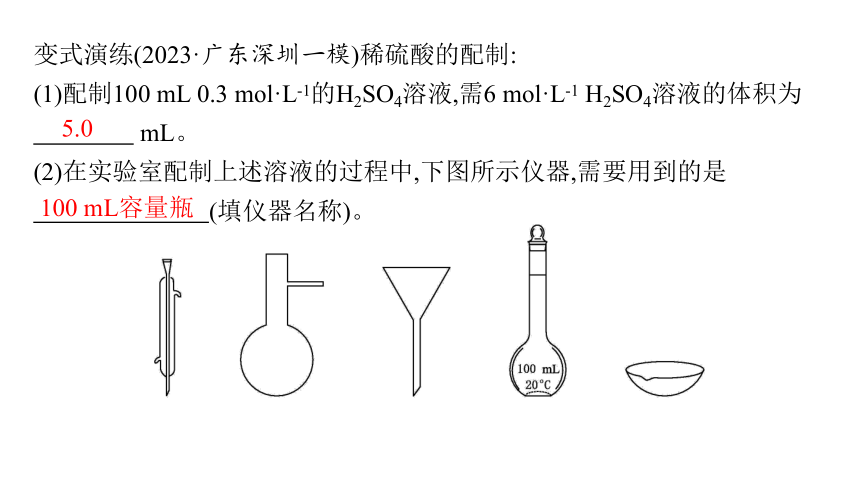
(1)配制100 mL 0.3 mol·L-1的H2SO4溶液,需6 mol·L-1 H2SO4溶液的体积为
mL。
(2)在实验室配制上述溶液的过程中,下图所示仪器,需要用到的是
(填仪器名称)。
5.0
100 mL容量瓶
解析 (1)根据稀释规律c1V1=c2V2可知,配制100 mL 0.3 mol·L-1的H2SO4溶液,需6 mol·L-1 H2SO4溶液的体积为
命题点2有关物质的量浓度的计算
典例2 (2022·海南卷)在2.8 g Fe中加入100 mL 3 mol·L-1 HCl溶液,Fe完全溶解。设NA代表阿伏加德罗常数的值,下列说法正确的是( )
A.反应转移电子为0.1 mol
B.HCl溶液中Cl-数为3NA
C.2.8 g 56Fe含有的中子数为1.3NA
D.反应生成标准状况下气体3.36 L
A
解析 Fe与HCl溶液发生反应:Fe+2HCl ══ FeCl2+H2↑, n(Fe)= =0.05 mol,n(HCl)=0.1 L×3 mol·L-1=0.3 mol,而0.05 mol Fe完全反应需要0.1 mol HCl,故Fe不足量,按Fe进行计算。1 mol Fe反应时转移2 mol电子,则0.05 mol Fe反应转移电子为0.1 mol,A正确;HCl完全电离,则HCl溶液中Cl-数目为0.3NA,B错误;1个56Fe含有28个中子,2.8 g 56Fe为0.05 mol,则含有中子数为1.4NA,C错误;0.05 mol Fe完全反应生成0.05 mol H2,0.05 mol H2在标准状况下的体积为0.05 mol×22.4 L·mol-1=1.12 L,D错误。
思路剖析解答本题的思路如下:
(1)写出化学方程式:Fe+2HCl ══ FeCl2+H2↑,计算n(Fe)和n(HCl)的值。
(2)结合化学方程式进行过量计算,按不足量物质进行相关计算,对各选项进行合理判断。
典例3 (2022·广东卷,17节选)食醋是烹饪美食的调味品,有效成分主要为醋酸(用HAc表示)。配制250 mL 0.1 mol·L-1的HAc溶液,需5 mol·L-1 HAc溶液的体积为 mL。
5.0
解析 配制0.1 mol·L-1HAc溶液过程中n(HAc)保持不变,根据稀释定律可得: 0.250 L×0.1 mol·L-1=5 mol·L-1×V(HAc),解得V(HAc)=5×10-3 L=5.0 mL。
变式演练(2023·河北邯郸模拟)(1)配制250 mL 0.10 mol·L-1 CH3COONa溶液,需要称量醋酸钠晶体(CH3COONa·3H2O,M=136 g·mol-1)的质量为 。
(2)实验需要的仪器有天平、药匙、玻璃棒、量筒、
(从下列图中选择,写出名称)。
3.4 g
烧杯、胶头滴管、250 mL容量瓶
解析 (1)配制250 mL 0.10 mol·L-1 CH3COONa溶液,需要称量醋酸钠晶体的质量为0.250 L×0.10 mol·L-1×136 g·mol-1=3.4 g。
【思维建模】
解答物质的量浓度及溶液配制类题目的方法
(1)结合一定物质的量浓度溶液的配制步骤选择仪器,依据
(2)选择合适的依据计算物质的量浓度,分析题中提供的数据,确定依据定义式、换算关系、稀释定律还是电荷守恒来计算物质的量浓度。
训练分层落实
练真题·明考向
1.(2023·全国甲卷)实验室将粗盐提纯并配制0.100 0 mol·L-1的NaCl溶液。下列仪器中,本实验必须用到的有( )
①天平 ②温度计 ③坩埚 ④分液漏斗 ⑤容量瓶 ⑥烧杯 ⑦滴定管 ⑧酒精灯
A.①②④⑥ B.①④⑤⑥
C.②③⑦⑧ D.①⑤⑥⑧
D
解析 粗盐提纯过程中涉及的实验操作包括溶解、过滤、蒸发和结晶,题给仪器中要用到的有⑥⑧;由固体NaCl配制0.100 0 mol·L-1的NaCl溶液,题给仪器中要用到的有①⑤⑥。
2.(2020·全国卷Ⅰ,27节选)由FeSO4·7H2O固体配制0.10 mol·L-1FeSO4溶液,需要的仪器有药匙、玻璃棒、 (从下列图中选择,写出名称)。
烧杯、量筒、托盘天平
练易错·避陷阱
3.(2023·湖北黄冈中学模拟)配制100 mL 1.0 mol·L-1 NaOH溶液的操作如图所示。下列说法正确的是( )
A.操作1前可用托盘天平、称量纸、药匙称取质量为4.0 g的NaOH固体
B.操作1中NaOH完全溶解后,为避免吸收空气中CO2,应立刻进行操作2
C.操作4中如果俯视刻度线定容,所配NaOH溶液浓度偏大
D.将100 mL 1.0 mol·L-1的NaOH溶液加热蒸发50 g水后,物质的量浓度变为2.0 mol·L-1
C
解析 应在小烧杯中称取质量为4.0 g的NaOH固体,A错误;操作1中NaOH完全溶解后,应冷却到室温,再进行操作2,B错误;操作4中如果俯视刻度线定容,加入水的体积偏少,所配NaOH溶液浓度偏大,C正确;将100 mL 1.0 mol·L-1的NaOH溶液加热蒸发50 g水后,剩余溶液的密度不是1 g·mL-1,溶液的体积不为50 mL,则物质的量浓度不是2.0 mol·L-1,D错误。
4.(2023·上海杨浦区二模)室温下,甲同学配制5%的NaCl溶液100 g,乙同学配制0.5 mol·L-1的NaCl溶液100 mL(已知室温下NaCl的溶解度为36 g/100 g水),下列说法正确的是( )
A.所需溶质的质量相同
B.所需仪器均包括100 mL容量瓶
C.所配溶液均为不饱和溶液
D.所配溶液质量相同
C
解析 100 g 5%氯化钠溶液中氯化钠的质量为100 g×5%=5 g,100 mL 0.5 mol·L-1氯化钠溶液中氯化钠的质量为0.5 mol·L-1×0.1 L×58.5 g·mol-1≈
2.9 g,100 g氯化钠饱和溶液中氯化钠的质量为 ≈26.5 g,则5%氯化钠溶液和0.5 mol·L-1氯化钠溶液均为不饱和溶液,C正确;5%氯化钠溶液和0.5 mol·L-1氯化钠溶液中氯化钠的质量不同,A错误;配制100 g 5%氯化钠溶液不需要用到100 mL容量瓶,B错误;氯化钠溶液的密度大于1 g·mL-1,则100 mL氯化钠溶液的质量大于100 g,D错误。
练预测·押考向
5.某营养液中含有KCl、K2SO4、NaCl三种溶质,实验测得部分离子的浓度如图甲所示。取200 mL该营养液加水稀释,测得Na+的浓度(c)随溶液体积(V)的变化如图乙曲线所示。下列判断错误的是( )
A.图甲中X离子是
B.图乙中c1=8.0
C.营养液中NaCl与K2SO4的物质的量之比为2∶1
D.营养液中KCl的浓度为2.0 mol·L-1
D
解析 取200 mL该营养液加水稀释,由图乙可得:c1 mol·L-1×0.2 L=1.6 mol·L-1×1 L,则有c1=8.0,即该营养液中c(Na+)=8.0 mol·L-1,B正确;图甲中X的浓度为4.0 mol·L-1,则X离子是 ,A正确;营养液中,n(NaCl)=8.0 mol·L-1 ×V L=8.0V mol(V为营养液的体积数值),n(K2SO4)=4.0 mol·L-1×V L=4.0V mol,则其物质的量之比为2∶1,C正确;营养液中c(K2SO4)=c( )=4.0 mol·L-1,则由K2SO4提供的c(K+)=8.0 mol·L-1,图甲中c(K+)=9.0 mol·L-1,推知c(KCl)=9.0 mol·L-1-8.0 mol·L-1=1.0 mol·L-1,D错误。
6.测定食醋中总酸度有以下步骤:①将食醋精确稀释到原来体积的10倍;②用烧碱固体配制100 mL浓度约为0.1 mol·L-1的溶液;③用邻苯二甲酸氢钾固体标定步骤②所得溶液;④用移液管取20.00 mL待测液;⑤用已知浓度NaOH溶液滴定。以下对应步骤中的操作及选用仪器均正确的是( )
B
解析 将食醋精确稀释到原来体积的10倍,配制一定体积的溶液需要用到的仪器是容量瓶等,A错误;因为需要标定,步骤②是粗配溶液,0.4 g NaOH的物质的量为0.01 mol,100 mL蒸馏水为0.1 L,则浓度约为0.1 mol·L-1,B正确;用邻苯二甲酸氢钾标定NaOH时,终点溶液显碱性,应用酚酞作指示剂,C错误;步骤⑤是用NaOH溶液进行滴定,滴定管的刻度从上到下逐渐增大,而图中仪器刻度从上到下逐渐减小,D错误。
专题 物质的量浓度及溶液配制
聚焦核心要点
要点1一定物质的量浓度溶液的配制及误差分析
课标指引:初步学会配制一定物质的量浓度的溶液等化学实验基础知识和基本技能。
1.了解一定物质的量浓度溶液的配制流程(以配制一定物质的量浓度的NaCl溶液为例)
微点归纳
配制一定质量分数溶液的步骤及仪器
步骤:计算溶质、溶剂的质量→称量或量取→搅拌、溶解→装瓶、贴标签等。
所需仪器:托盘天平(电子天平)、药匙、量筒、烧杯、玻璃棒、细口瓶。
2.一定物质的量浓度溶液配制的误差分析及方法
(1)误差分析的思维流程
(2)视线引起误差的分析方法
①定容时,仰视容量瓶刻度线(图1),导致溶液体积偏大,配制溶液的浓度偏低。
②定容时,俯视容量瓶刻度线(图2),导致溶液体积偏小,配制溶液的浓度偏高。
要点2有关物质的量浓度的计算
课标指引:运用物质的量、摩尔质量、气体摩尔体积、物质的量浓度之间的相互关系进行简单计算。
1.计算物质的量浓度的基本方法
2.计算物质的量浓度的三个技巧
换算 公式 溶液中溶质的质量分数与物质的量浓度之间的换算: ;c为溶质的物质的量浓度,单位为mol·L-1;ρ为溶液的密度,单位为g·cm-3,w为溶质的质量分数,M为溶质的摩尔质量,单位为g·mol-1
质量 守恒 ①化学反应前后,反应物和生成物的总质量相等(即元素的种类和质量不变);
②稀释前后,溶质的质量(或物质的量)保持不变:
c(浓)×V(浓)=c(稀)×V(稀)
电荷 守恒 溶液呈电中性,溶液中阳离子所带正电荷总数等于阴离子所带负电荷总数
精研核心命题
命题点1配制溶液的操作及仪器的选择
典例1 (1)(2022·广东卷,17节选)下列关于250 mL容量瓶的操作,正确的是
(填字母)。
C
(2)(2022·全国乙卷,27节选)由CuSO4·5H2O配制CuSO4溶液,下列仪器中不需要的是 (填仪器名称)。
分液漏斗、球形冷凝管
解析 (1)使用容量瓶过程中,不能用手等触碰瓶口,以免污染试剂,A错误;定容时,不能仰视或俯视,B错误;向容量瓶中转移液体时,需用玻璃棒引流,玻璃棒下端位于刻度线以下,同时玻璃棒不能接触容量瓶口,C正确;定容完成后,盖上瓶塞,将容量瓶来回颠倒,将溶液摇匀,颠倒过程中,左手食指抵住瓶塞,防止瓶塞脱落,右手扶住容量瓶底部,防止容量瓶从左手掉落,D错误。
(2)由CuSO4·5H2O固体配制硫酸铜溶液时,需用天平称量一定质量的CuSO4·5H2O固体,将称量好的固体放入烧杯中,用量筒量取一定体积的水溶解CuSO4·5H2O,故用不到的仪器有分液漏斗和球形冷凝管。
变式演练(2023·广东深圳一模)稀硫酸的配制:
(1)配制100 mL 0.3 mol·L-1的H2SO4溶液,需6 mol·L-1 H2SO4溶液的体积为
mL。
(2)在实验室配制上述溶液的过程中,下图所示仪器,需要用到的是
(填仪器名称)。
5.0
100 mL容量瓶
解析 (1)根据稀释规律c1V1=c2V2可知,配制100 mL 0.3 mol·L-1的H2SO4溶液,需6 mol·L-1 H2SO4溶液的体积为
命题点2有关物质的量浓度的计算
典例2 (2022·海南卷)在2.8 g Fe中加入100 mL 3 mol·L-1 HCl溶液,Fe完全溶解。设NA代表阿伏加德罗常数的值,下列说法正确的是( )
A.反应转移电子为0.1 mol
B.HCl溶液中Cl-数为3NA
C.2.8 g 56Fe含有的中子数为1.3NA
D.反应生成标准状况下气体3.36 L
A
解析 Fe与HCl溶液发生反应:Fe+2HCl ══ FeCl2+H2↑, n(Fe)= =0.05 mol,n(HCl)=0.1 L×3 mol·L-1=0.3 mol,而0.05 mol Fe完全反应需要0.1 mol HCl,故Fe不足量,按Fe进行计算。1 mol Fe反应时转移2 mol电子,则0.05 mol Fe反应转移电子为0.1 mol,A正确;HCl完全电离,则HCl溶液中Cl-数目为0.3NA,B错误;1个56Fe含有28个中子,2.8 g 56Fe为0.05 mol,则含有中子数为1.4NA,C错误;0.05 mol Fe完全反应生成0.05 mol H2,0.05 mol H2在标准状况下的体积为0.05 mol×22.4 L·mol-1=1.12 L,D错误。
思路剖析解答本题的思路如下:
(1)写出化学方程式:Fe+2HCl ══ FeCl2+H2↑,计算n(Fe)和n(HCl)的值。
(2)结合化学方程式进行过量计算,按不足量物质进行相关计算,对各选项进行合理判断。
典例3 (2022·广东卷,17节选)食醋是烹饪美食的调味品,有效成分主要为醋酸(用HAc表示)。配制250 mL 0.1 mol·L-1的HAc溶液,需5 mol·L-1 HAc溶液的体积为 mL。
5.0
解析 配制0.1 mol·L-1HAc溶液过程中n(HAc)保持不变,根据稀释定律可得: 0.250 L×0.1 mol·L-1=5 mol·L-1×V(HAc),解得V(HAc)=5×10-3 L=5.0 mL。
变式演练(2023·河北邯郸模拟)(1)配制250 mL 0.10 mol·L-1 CH3COONa溶液,需要称量醋酸钠晶体(CH3COONa·3H2O,M=136 g·mol-1)的质量为 。
(2)实验需要的仪器有天平、药匙、玻璃棒、量筒、
(从下列图中选择,写出名称)。
3.4 g
烧杯、胶头滴管、250 mL容量瓶
解析 (1)配制250 mL 0.10 mol·L-1 CH3COONa溶液,需要称量醋酸钠晶体的质量为0.250 L×0.10 mol·L-1×136 g·mol-1=3.4 g。
【思维建模】
解答物质的量浓度及溶液配制类题目的方法
(1)结合一定物质的量浓度溶液的配制步骤选择仪器,依据
(2)选择合适的依据计算物质的量浓度,分析题中提供的数据,确定依据定义式、换算关系、稀释定律还是电荷守恒来计算物质的量浓度。
训练分层落实
练真题·明考向
1.(2023·全国甲卷)实验室将粗盐提纯并配制0.100 0 mol·L-1的NaCl溶液。下列仪器中,本实验必须用到的有( )
①天平 ②温度计 ③坩埚 ④分液漏斗 ⑤容量瓶 ⑥烧杯 ⑦滴定管 ⑧酒精灯
A.①②④⑥ B.①④⑤⑥
C.②③⑦⑧ D.①⑤⑥⑧
D
解析 粗盐提纯过程中涉及的实验操作包括溶解、过滤、蒸发和结晶,题给仪器中要用到的有⑥⑧;由固体NaCl配制0.100 0 mol·L-1的NaCl溶液,题给仪器中要用到的有①⑤⑥。
2.(2020·全国卷Ⅰ,27节选)由FeSO4·7H2O固体配制0.10 mol·L-1FeSO4溶液,需要的仪器有药匙、玻璃棒、 (从下列图中选择,写出名称)。
烧杯、量筒、托盘天平
练易错·避陷阱
3.(2023·湖北黄冈中学模拟)配制100 mL 1.0 mol·L-1 NaOH溶液的操作如图所示。下列说法正确的是( )
A.操作1前可用托盘天平、称量纸、药匙称取质量为4.0 g的NaOH固体
B.操作1中NaOH完全溶解后,为避免吸收空气中CO2,应立刻进行操作2
C.操作4中如果俯视刻度线定容,所配NaOH溶液浓度偏大
D.将100 mL 1.0 mol·L-1的NaOH溶液加热蒸发50 g水后,物质的量浓度变为2.0 mol·L-1
C
解析 应在小烧杯中称取质量为4.0 g的NaOH固体,A错误;操作1中NaOH完全溶解后,应冷却到室温,再进行操作2,B错误;操作4中如果俯视刻度线定容,加入水的体积偏少,所配NaOH溶液浓度偏大,C正确;将100 mL 1.0 mol·L-1的NaOH溶液加热蒸发50 g水后,剩余溶液的密度不是1 g·mL-1,溶液的体积不为50 mL,则物质的量浓度不是2.0 mol·L-1,D错误。
4.(2023·上海杨浦区二模)室温下,甲同学配制5%的NaCl溶液100 g,乙同学配制0.5 mol·L-1的NaCl溶液100 mL(已知室温下NaCl的溶解度为36 g/100 g水),下列说法正确的是( )
A.所需溶质的质量相同
B.所需仪器均包括100 mL容量瓶
C.所配溶液均为不饱和溶液
D.所配溶液质量相同
C
解析 100 g 5%氯化钠溶液中氯化钠的质量为100 g×5%=5 g,100 mL 0.5 mol·L-1氯化钠溶液中氯化钠的质量为0.5 mol·L-1×0.1 L×58.5 g·mol-1≈
2.9 g,100 g氯化钠饱和溶液中氯化钠的质量为 ≈26.5 g,则5%氯化钠溶液和0.5 mol·L-1氯化钠溶液均为不饱和溶液,C正确;5%氯化钠溶液和0.5 mol·L-1氯化钠溶液中氯化钠的质量不同,A错误;配制100 g 5%氯化钠溶液不需要用到100 mL容量瓶,B错误;氯化钠溶液的密度大于1 g·mL-1,则100 mL氯化钠溶液的质量大于100 g,D错误。
练预测·押考向
5.某营养液中含有KCl、K2SO4、NaCl三种溶质,实验测得部分离子的浓度如图甲所示。取200 mL该营养液加水稀释,测得Na+的浓度(c)随溶液体积(V)的变化如图乙曲线所示。下列判断错误的是( )
A.图甲中X离子是
B.图乙中c1=8.0
C.营养液中NaCl与K2SO4的物质的量之比为2∶1
D.营养液中KCl的浓度为2.0 mol·L-1
D
解析 取200 mL该营养液加水稀释,由图乙可得:c1 mol·L-1×0.2 L=1.6 mol·L-1×1 L,则有c1=8.0,即该营养液中c(Na+)=8.0 mol·L-1,B正确;图甲中X的浓度为4.0 mol·L-1,则X离子是 ,A正确;营养液中,n(NaCl)=8.0 mol·L-1 ×V L=8.0V mol(V为营养液的体积数值),n(K2SO4)=4.0 mol·L-1×V L=4.0V mol,则其物质的量之比为2∶1,C正确;营养液中c(K2SO4)=c( )=4.0 mol·L-1,则由K2SO4提供的c(K+)=8.0 mol·L-1,图甲中c(K+)=9.0 mol·L-1,推知c(KCl)=9.0 mol·L-1-8.0 mol·L-1=1.0 mol·L-1,D错误。
6.测定食醋中总酸度有以下步骤:①将食醋精确稀释到原来体积的10倍;②用烧碱固体配制100 mL浓度约为0.1 mol·L-1的溶液;③用邻苯二甲酸氢钾固体标定步骤②所得溶液;④用移液管取20.00 mL待测液;⑤用已知浓度NaOH溶液滴定。以下对应步骤中的操作及选用仪器均正确的是( )
B
解析 将食醋精确稀释到原来体积的10倍,配制一定体积的溶液需要用到的仪器是容量瓶等,A错误;因为需要标定,步骤②是粗配溶液,0.4 g NaOH的物质的量为0.01 mol,100 mL蒸馏水为0.1 L,则浓度约为0.1 mol·L-1,B正确;用邻苯二甲酸氢钾标定NaOH时,终点溶液显碱性,应用酚酞作指示剂,C错误;步骤⑤是用NaOH溶液进行滴定,滴定管的刻度从上到下逐渐增大,而图中仪器刻度从上到下逐渐减小,D错误。
同课章节目录
