专题 化学计量及其应用 课件(共29张PPT) 基础巩固练
文档属性
| 名称 | 专题 化学计量及其应用 课件(共29张PPT) 基础巩固练 |  | |
| 格式 | pptx | ||
| 文件大小 | 1.5MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-11-19 09:35:56 | ||
图片预览







文档简介
(共29张PPT)
------基础巩固练
2024
化学计量及其应用
基础巩固练
1.(高考题组合)设NA为阿伏加德罗常数的值。下列说法中正确的是( )
A.1 mol CO中含有6.02×1024个电子(2022·广东卷,9C)
B.22.4 L CO2被还原生成1 mol CO(2022·广东卷,9D)
C.1 L 0.05 mol·L-1的NH4HSO4溶液中 的微粒数小于0.05NA(2022·湖南卷,6C)
D.1 mol SO3与1 mol NO2分别通入1 L水中可产生相同浓度的H2SO4和HNO3(2022·重庆卷,3C)
C
解析 1个CO分子含有14个电子,则1 mol CO含有14 mol电子,即含有14×6.02×1023个电子,A错误;题目未指明22.4 L CO2是否处于标准状况下,不能计算其物质的量及还原生成CO的量,B错误;1 L 0.05 mol·L-1的NH4HSO4溶液中含0.05 mol ,由于 发生水解反应,故溶液中 的微粒数小于0.05NA,C正确;SO3、NO2溶于1 L水后,所得溶液的体积并非1 L,故不能计算和比较所得溶液中H2SO4和HNO3的浓度大小,D错误。
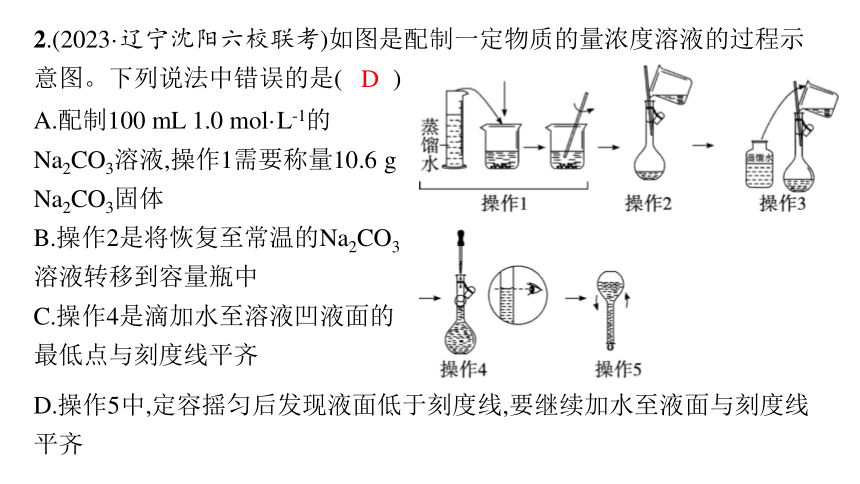
2.(2023·辽宁沈阳六校联考)如图是配制一定物质的量浓度溶液的过程示意图。下列说法中错误的是( )
A.配制100 mL 1.0 mol·L-1的Na2CO3溶液,操作1需要称量10.6 g Na2CO3固体
B.操作2是将恢复至常温的Na2CO3溶液转移到容量瓶中
C.操作4是滴加水至溶液凹液面的最低点与刻度线平齐
D.操作5中,定容摇匀后发现液面低于刻度线,要继续加水至液面与刻度线平齐
D
解析 配制100 mL 1.0 mol·L-1的Na2CO3溶液,需要溶质的物质的量n(Na2CO3)=1.0 mol·L-1×0.1 L=0.1 mol,则需称量其质量为0.1 mol×106 g·mol-1=10.6 g,A正确;容量瓶配制溶液要求温度是室温,则操作2是将恢复至常温的Na2CO3溶液转移到容量瓶中,B正确;操作4是定容,向容量瓶中加水至离刻度线1~2 cm时改用胶头滴管滴加水,应加水至溶液凹液面的最低点与刻度线平齐,C正确;操作5中,定容摇匀后发现液面低于刻度线,继续加水至液面与刻度线平齐,待颈部液体回流,溶液浓度会偏低,D错误。
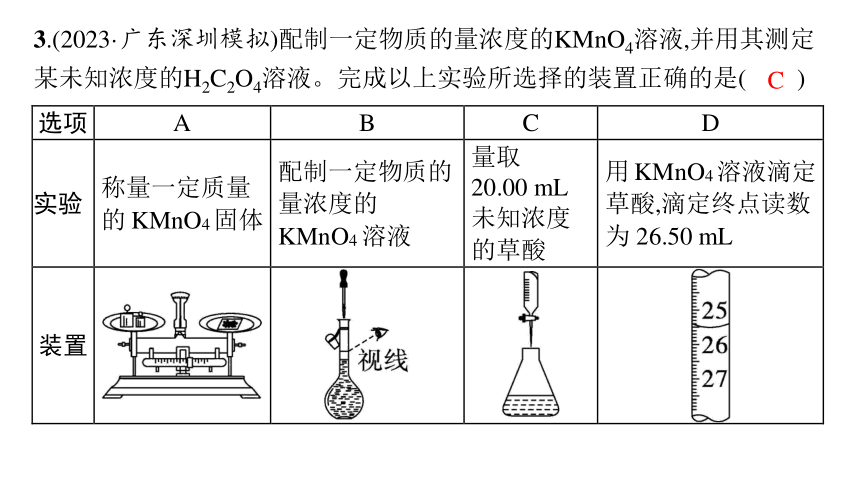
3.(2023·广东深圳模拟)配制一定物质的量浓度的KMnO4溶液,并用其测定某未知浓度的H2C2O4溶液。完成以上实验所选择的装置正确的是( )
C
解析 称量一定质量的KMnO4固体时,药品放在左盘,砝码放在右盘,A错误;配制一定物质的量浓度的KMnO4溶液,定容时眼睛应平视刻度线,B错误;滴定管的“0”刻度在上方,终点读数应为25.50 mL,D错误。
4.(2023·江西南昌一模)设NA为阿伏加德罗常数的值。下列说法正确的是
( )
A.常温下,1 mol NO与0.5 mol O2混合后分子数为NA
B.H2O(g)通过Na2O2(s)使其增重2 g时,反应中转移的电子数为NA
C.过量Cl2通入1.5 L 0.1 mol·L-1KI溶液中发生反应,转移的电子数为0.15NA
D.0.2 mol乙酸与0.1 mol乙醇在浓硫酸催化下充分反应,生成乙酸乙酯的分子数为0.1NA
B
解析 NO和O2反应生成NO2,NO2可部分转化为N2O4,故1 mol NO与0.5 mol O2混合后分子数小于NA,A错误;由反应2Na2O2+2H2O ══ 4NaOH+O2↑可知,固体增重2 g时消耗1 mol Na2O2(s),则转移电子数为NA,B正确;Cl2除与KI反应外,部分Cl2还能与水反应,故转移的电子数大于0.15NA,C错误;乙醇与乙酸的酯化反应为可逆反应,反应物不能充分反应,故生成乙酸乙酯的分子数小于0.1NA,D错误。
5.(2023·安徽淮北一模)设NA为阿伏加德罗常数的值。下列说法正确的是
( )
A.常温下,1 L pH=9的CH3COONa溶液中,由水电离出的OH-数目为10-9NA
B.2.0 g重水(D2O)中所含质子数、中子数各为NA
C.标准状况下,22.4 L HF中H+数目为NA
D.0.1 mol N2和0.3 mol H2于密闭容器中充分反应后,生成NH3的分子数为0.2NA
B
解析 CH3COONa溶液促进水的电离,1 L pH=9的CH3COONa溶液中由水电离出的OH-数目为10-5NA,A错误;1个重水(D2O)分子含有10个质子和10个中子,2.0 g重水(D2O)为0.1 mol,故质子数、中子数均为NA,B正确;标准状况下HF不是气体,不能用气体摩尔体积进行计算,C错误;合成氨反应是可逆反应,不能进行完全,故生成NH3的分子数小于0.2NA,D错误。
6.(2023·浙江杭州模拟)次磷酸钠(NaH2PO2)可用作药物和镀镍时的还原剂,反应原理为CuSO4+2NaH2PO2+2NaOH ══ Cu↓+2NaH2PO3+Na2SO4+H2↑。下列说法错误的是( )
A.参加反应的NaH2PO2有一半被CuSO4氧化
B.若1 mol H3PO3最多消耗2 mol NaOH,则Na2HPO3是正盐
C.反应中每转移6.02×1023个电子,则生成标准状况下5.6 L H2
D.氧化产物与还原产物的物质的量之比为2∶1
D
解析 P元素化合价从+1价升高到+3价,铜元素化合价从+2价降低到0价,部分氢元素化合价从+1价降低到0价,根据电子得失守恒可知参加反应的NaH2PO2有一半被CuSO4氧化,A正确;若1 mol H3PO3最多消耗2 mol NaOH,说明H3PO3是二元酸,则Na2HPO3是正盐,B正确;据A分析可知,转移4 mol电子时生成1 mol氢气,则反应中每转移6.02×1023个电子(1 mol)时生成0.25 mol氢气,在标准状况下的体积为5.6 L,C正确;NaH2PO3是氧化产物,Cu和H2均是还原产物,则氧化产物与还原产物的物质的量之比为1∶1,D错误。
7.(2023·福建福州一模)制备Na2S2O3的反应为2Na2S+Na2CO3+4SO2 ══ CO2+3Na2S2O3。设NA为阿伏加德罗常数的值,下列说法正确的是( )
A.2 L 0.5 mol·L-1 Na2S溶液中含S2-的数目为NA
B.5.6 L CO2(标准状况下)中含电子数目为11NA
C.15.8 g Na2S2O3中含非极性共价键的数目为0.1NA
D.1 mol SO2完全参加反应,转移电子数为NA
C
解析 S2-会发生水解,2 L 0.5 mol·L-1 Na2S溶液中含S2-的数目小于NA,A错误;5.6 L CO2(标准状况下)为0.25 mol,含电子数目为5.5NA,B错误;Na2S2O3中含有硫硫非极性键,15.8 g Na2S2O3为0.1 mol,含非极性共价键的数目为0.1NA,C正确;SO2中S元素化合价由+4价降低到+2价,1 mol SO2完全参加反应,转移电子数为2NA,D错误。
8.(2023·江西上饶一模)设NA为阿伏加德罗常数的值,下列说法不正确的是
( )
A.1 L 1 mol·L-1 CH3COONa溶液中CH3COO-与OH-离子数之和等于NA
B.1 mol N(C2H5)3中含有的极性键的数目为18NA
C.0.25 mol Zn与一定量浓硫酸反应后完全溶解,生成气体的分子数一定等于0.25NA
D.室温下,1 L 0.1 mol·L-1盐酸中H+的数目约为0.1NA
A
解析 1 L 1 mol·L-1 CH3COONa溶液中根据电荷守恒可得:c(CH3COO-) +c(OH-)=c(Na+)+c(H+),c(Na+)=1 mol·L-1,则c(CH3COO-)+c(OH-) =c(Na+)+c(H+)>1 mol·L-1,CH3COO-与OH-离子数之和大于NA,A错误;N(C2H5)3分子中C—H和C—N均为极性键,1 mol N(C2H5)3中含有18 mol极性键,则极性键的数目为18NA,B正确;Zn与浓硫酸发生反应: Zn+2H2SO4(浓) ══ ZnSO4+SO2↑+2H2O,Zn与稀硫酸反应:Zn+H2SO4(稀) ══ ZnSO4+H2↑,1 mol Zn生成1 mol气体,则0.25 mol Zn生成气体的分子数等于0.25NA,C正确;0.1 mol·L-1盐酸中H+的浓度为0.1 mol·L-1,溶液的体积为1 L,则H+的数目约为0.1NA,D正确。
9.(2023·天津河东区模拟)将23.0 g Na溶于一定量的水中,反应后溶液的体积为1.00 L,设NA为阿伏加德罗常数的值,下列叙述错误的是( )
A.反应后溶液中c(OH-)为1.00 mol·L-1
B.反应后溶液中Na+数目为NA
C.反应生成标准状况下气体22.4 L
D.反应转移的电子数为NA
C
解析 23.0 g Na的物质的量为1 mol,将23.0 g Na溶于一定量水中,发生反应2Na+2H2O ══ 2NaOH+H2↑。1 mol Na和水反应生成1 mol氢氧化钠,反应后溶液中c(OH-)=1.00 mol·L-1,A正确;反应后溶液中Na+的数目为NA,B正确;1 mol Na可生成0.5 mol氢气,反应生成标准状况下气体11.2 L,C错误;钠元素化合价由0价升高为+1价,则1 mol钠反应转移的电子数为NA,D正确。
10.(2023·浙江宁波十校联考)在0.1 L由NaCl、MgCl2、BaCl2组成的混合溶液中,部分离子浓度大小如图所示,下列对该溶液成分说法不正确的是( )
A.NaCl的物质的量为0.1 mol
B.溶质MgCl2的质量为4.75 g
C.该混合溶液中BaCl2的物质的量为0.05 mol
D.将该混合溶液加水稀释至体积为1 L,稀释后溶液中Na+的物质的量浓度为0.5 mol·L-1
D
解析 由图可知,Na+、Mg2+、Cl-的物质的量浓度分别为1.0 mol·L-1、0.5 mol·L-1和3.0 mol·L-1,则0.1 L该混合溶液中含有NaCl为1.0 mol·L-1×0.1 L =0.1 mol,A正确;含MgCl2的物质的量为0.5 mol·L-1×0.1 L=0.05 mol,其质量为0.05 mol×95 g·mol-1=4.75 g,B正确;据电荷守恒可得:c(Na+)+2c(Mg2+)+2c(Ba2+)=c(Cl-),则有1.0 mol·L-1+0.5 mol·L-1 ×2+2c(Ba2+)=3.0 mol·L-1,c(Ba2+)=0.5 mol·L-1,故该混合溶液中含有BaCl2的物质的量为0.5 mol·L-1×0.1 L=0.05 mol,C正确;据稀释定律可得:
0.1 L×1.0 mol·L-1=1 L×c(Na+),c(Na+)=0.1 mol·L-1,D错误。
11.(2023·湖南郴州三模)设NA为阿伏加德罗常数的值,下列说法正确的是
( )
A.1 L 1 mol·L-1盐酸中含有NA个HCl分子
C.0.25 mol Zn与一定量浓硫酸恰好完全反应后,生成SO2的数目小于0.25NA
D.1 L 1 mol·L-1 NaF溶液中F-与OH-离子数之和小于NA
C
解析 HCl在水中完全电离,不存在HCl分子,A错误;核反应表示式必须遵循核电荷数和质量数守恒,即可推算出A=36,Z=89,1 mol ZM中含中子(89-36)NA=53NA,B错误;由得失电子数目守恒可知,1 mol锌与浓硫酸反应生成1 mol二氧化硫,1 mol 锌与稀硫酸反应生成1 mol氢气,则0.25 mol Zn与一定量浓硫酸恰好完全反应生成SO2和H2的总分子数为0.25NA,即生成SO2的数目小于0.25NA,C正确;1 L 1 mol·L-1 NaF溶液中n(Na+)=1 mol,根据电荷守恒可得n(F-)+n(OH-)=n(Na+)+n(H+),则F-与OH-离子数之和大于NA,D错误。
12.(2023·辽宁丹东一模)设NA为阿伏加德罗常数的值,下列有关叙述正确的是( )
A.31 g白磷(P4)中含有磷原子数为NA
B.10 g 中含有的中子数为6NA
C.标准状况下,2.24 L苯完全燃烧生成的CO2分子数为0.6NA
D.1 mol Na2O2与足量的水反应转移电子数为2NA
A
13.(2023·四川巴中一模)设NA是阿伏加德罗常数的值,下列说法错误的是
( )
A.1 mol甲苯中碳碳双键的数目为0.3NA
B.标准状况下,2.24 L SO3中原子数目大于0.4NA
C.1 L 0.1 mol·L-1 Na2S溶液中S2-的数目小于0.1NA
D.2.0 g重水(D2O)中质子数目为NA
A
解析 甲苯中不存在碳碳双键,A错误;标准状况下SO3不是气体,2.24 L SO3的物质的量大于0.1 mol,故原子数目大于0.4NA,B正确;1 L 0.1 mol·L-1 Na2S溶液中含0.1 mol Na2S,由于S2-发生水解,则S2-的数目小于0.1NA,C正确;1个D2O含10个质子,2.0 g重水(D2O)的物质的量为0.1 mol,则质子数目为NA,D正确。
14.(1)测定某固体产品中Na2Cr2O7含量的方法如下:称取产品试样2.50 g配成250 mL溶液,用移液管取出25.00 mL置于锥形瓶中,加入足量稀硫酸酸化后,再加入几滴指示剂,用0.100 0 mol·L-1硫酸亚铁铵(NH4)2Fe(SO4)2标准溶液进行滴定,再重复进行两次实验。(已知 被还原为Cr3+)
①氧化还原滴定过程中的离子方程式为 。
②若三次实验消耗(NH4)2Fe(SO4)2标准溶液的平均体积为25.00 mL,则所得产品中Na2Cr2O7的纯度为 %。[已知M(Na2Cr2O7)=262 g·mol-1,计算结果保留三位有效数字]
(2)通过碘量法可测定某产品中钴的含量。称取0.10 g [Co(NH3)6]Cl3产品,将其转化成Co3+后,加入过量KI和2~3滴淀粉溶液,再用0.010 0 mol·L-1 Na2S2O3标准溶液滴定,达到滴定终点时消耗Na2S2O3溶液20 mL,则产品中钴的百分含量为 。反应原理:
43.7
11.8%
------基础巩固练
2024
化学计量及其应用
基础巩固练
1.(高考题组合)设NA为阿伏加德罗常数的值。下列说法中正确的是( )
A.1 mol CO中含有6.02×1024个电子(2022·广东卷,9C)
B.22.4 L CO2被还原生成1 mol CO(2022·广东卷,9D)
C.1 L 0.05 mol·L-1的NH4HSO4溶液中 的微粒数小于0.05NA(2022·湖南卷,6C)
D.1 mol SO3与1 mol NO2分别通入1 L水中可产生相同浓度的H2SO4和HNO3(2022·重庆卷,3C)
C
解析 1个CO分子含有14个电子,则1 mol CO含有14 mol电子,即含有14×6.02×1023个电子,A错误;题目未指明22.4 L CO2是否处于标准状况下,不能计算其物质的量及还原生成CO的量,B错误;1 L 0.05 mol·L-1的NH4HSO4溶液中含0.05 mol ,由于 发生水解反应,故溶液中 的微粒数小于0.05NA,C正确;SO3、NO2溶于1 L水后,所得溶液的体积并非1 L,故不能计算和比较所得溶液中H2SO4和HNO3的浓度大小,D错误。
2.(2023·辽宁沈阳六校联考)如图是配制一定物质的量浓度溶液的过程示意图。下列说法中错误的是( )
A.配制100 mL 1.0 mol·L-1的Na2CO3溶液,操作1需要称量10.6 g Na2CO3固体
B.操作2是将恢复至常温的Na2CO3溶液转移到容量瓶中
C.操作4是滴加水至溶液凹液面的最低点与刻度线平齐
D.操作5中,定容摇匀后发现液面低于刻度线,要继续加水至液面与刻度线平齐
D
解析 配制100 mL 1.0 mol·L-1的Na2CO3溶液,需要溶质的物质的量n(Na2CO3)=1.0 mol·L-1×0.1 L=0.1 mol,则需称量其质量为0.1 mol×106 g·mol-1=10.6 g,A正确;容量瓶配制溶液要求温度是室温,则操作2是将恢复至常温的Na2CO3溶液转移到容量瓶中,B正确;操作4是定容,向容量瓶中加水至离刻度线1~2 cm时改用胶头滴管滴加水,应加水至溶液凹液面的最低点与刻度线平齐,C正确;操作5中,定容摇匀后发现液面低于刻度线,继续加水至液面与刻度线平齐,待颈部液体回流,溶液浓度会偏低,D错误。
3.(2023·广东深圳模拟)配制一定物质的量浓度的KMnO4溶液,并用其测定某未知浓度的H2C2O4溶液。完成以上实验所选择的装置正确的是( )
C
解析 称量一定质量的KMnO4固体时,药品放在左盘,砝码放在右盘,A错误;配制一定物质的量浓度的KMnO4溶液,定容时眼睛应平视刻度线,B错误;滴定管的“0”刻度在上方,终点读数应为25.50 mL,D错误。
4.(2023·江西南昌一模)设NA为阿伏加德罗常数的值。下列说法正确的是
( )
A.常温下,1 mol NO与0.5 mol O2混合后分子数为NA
B.H2O(g)通过Na2O2(s)使其增重2 g时,反应中转移的电子数为NA
C.过量Cl2通入1.5 L 0.1 mol·L-1KI溶液中发生反应,转移的电子数为0.15NA
D.0.2 mol乙酸与0.1 mol乙醇在浓硫酸催化下充分反应,生成乙酸乙酯的分子数为0.1NA
B
解析 NO和O2反应生成NO2,NO2可部分转化为N2O4,故1 mol NO与0.5 mol O2混合后分子数小于NA,A错误;由反应2Na2O2+2H2O ══ 4NaOH+O2↑可知,固体增重2 g时消耗1 mol Na2O2(s),则转移电子数为NA,B正确;Cl2除与KI反应外,部分Cl2还能与水反应,故转移的电子数大于0.15NA,C错误;乙醇与乙酸的酯化反应为可逆反应,反应物不能充分反应,故生成乙酸乙酯的分子数小于0.1NA,D错误。
5.(2023·安徽淮北一模)设NA为阿伏加德罗常数的值。下列说法正确的是
( )
A.常温下,1 L pH=9的CH3COONa溶液中,由水电离出的OH-数目为10-9NA
B.2.0 g重水(D2O)中所含质子数、中子数各为NA
C.标准状况下,22.4 L HF中H+数目为NA
D.0.1 mol N2和0.3 mol H2于密闭容器中充分反应后,生成NH3的分子数为0.2NA
B
解析 CH3COONa溶液促进水的电离,1 L pH=9的CH3COONa溶液中由水电离出的OH-数目为10-5NA,A错误;1个重水(D2O)分子含有10个质子和10个中子,2.0 g重水(D2O)为0.1 mol,故质子数、中子数均为NA,B正确;标准状况下HF不是气体,不能用气体摩尔体积进行计算,C错误;合成氨反应是可逆反应,不能进行完全,故生成NH3的分子数小于0.2NA,D错误。
6.(2023·浙江杭州模拟)次磷酸钠(NaH2PO2)可用作药物和镀镍时的还原剂,反应原理为CuSO4+2NaH2PO2+2NaOH ══ Cu↓+2NaH2PO3+Na2SO4+H2↑。下列说法错误的是( )
A.参加反应的NaH2PO2有一半被CuSO4氧化
B.若1 mol H3PO3最多消耗2 mol NaOH,则Na2HPO3是正盐
C.反应中每转移6.02×1023个电子,则生成标准状况下5.6 L H2
D.氧化产物与还原产物的物质的量之比为2∶1
D
解析 P元素化合价从+1价升高到+3价,铜元素化合价从+2价降低到0价,部分氢元素化合价从+1价降低到0价,根据电子得失守恒可知参加反应的NaH2PO2有一半被CuSO4氧化,A正确;若1 mol H3PO3最多消耗2 mol NaOH,说明H3PO3是二元酸,则Na2HPO3是正盐,B正确;据A分析可知,转移4 mol电子时生成1 mol氢气,则反应中每转移6.02×1023个电子(1 mol)时生成0.25 mol氢气,在标准状况下的体积为5.6 L,C正确;NaH2PO3是氧化产物,Cu和H2均是还原产物,则氧化产物与还原产物的物质的量之比为1∶1,D错误。
7.(2023·福建福州一模)制备Na2S2O3的反应为2Na2S+Na2CO3+4SO2 ══ CO2+3Na2S2O3。设NA为阿伏加德罗常数的值,下列说法正确的是( )
A.2 L 0.5 mol·L-1 Na2S溶液中含S2-的数目为NA
B.5.6 L CO2(标准状况下)中含电子数目为11NA
C.15.8 g Na2S2O3中含非极性共价键的数目为0.1NA
D.1 mol SO2完全参加反应,转移电子数为NA
C
解析 S2-会发生水解,2 L 0.5 mol·L-1 Na2S溶液中含S2-的数目小于NA,A错误;5.6 L CO2(标准状况下)为0.25 mol,含电子数目为5.5NA,B错误;Na2S2O3中含有硫硫非极性键,15.8 g Na2S2O3为0.1 mol,含非极性共价键的数目为0.1NA,C正确;SO2中S元素化合价由+4价降低到+2价,1 mol SO2完全参加反应,转移电子数为2NA,D错误。
8.(2023·江西上饶一模)设NA为阿伏加德罗常数的值,下列说法不正确的是
( )
A.1 L 1 mol·L-1 CH3COONa溶液中CH3COO-与OH-离子数之和等于NA
B.1 mol N(C2H5)3中含有的极性键的数目为18NA
C.0.25 mol Zn与一定量浓硫酸反应后完全溶解,生成气体的分子数一定等于0.25NA
D.室温下,1 L 0.1 mol·L-1盐酸中H+的数目约为0.1NA
A
解析 1 L 1 mol·L-1 CH3COONa溶液中根据电荷守恒可得:c(CH3COO-) +c(OH-)=c(Na+)+c(H+),c(Na+)=1 mol·L-1,则c(CH3COO-)+c(OH-) =c(Na+)+c(H+)>1 mol·L-1,CH3COO-与OH-离子数之和大于NA,A错误;N(C2H5)3分子中C—H和C—N均为极性键,1 mol N(C2H5)3中含有18 mol极性键,则极性键的数目为18NA,B正确;Zn与浓硫酸发生反应: Zn+2H2SO4(浓) ══ ZnSO4+SO2↑+2H2O,Zn与稀硫酸反应:Zn+H2SO4(稀) ══ ZnSO4+H2↑,1 mol Zn生成1 mol气体,则0.25 mol Zn生成气体的分子数等于0.25NA,C正确;0.1 mol·L-1盐酸中H+的浓度为0.1 mol·L-1,溶液的体积为1 L,则H+的数目约为0.1NA,D正确。
9.(2023·天津河东区模拟)将23.0 g Na溶于一定量的水中,反应后溶液的体积为1.00 L,设NA为阿伏加德罗常数的值,下列叙述错误的是( )
A.反应后溶液中c(OH-)为1.00 mol·L-1
B.反应后溶液中Na+数目为NA
C.反应生成标准状况下气体22.4 L
D.反应转移的电子数为NA
C
解析 23.0 g Na的物质的量为1 mol,将23.0 g Na溶于一定量水中,发生反应2Na+2H2O ══ 2NaOH+H2↑。1 mol Na和水反应生成1 mol氢氧化钠,反应后溶液中c(OH-)=1.00 mol·L-1,A正确;反应后溶液中Na+的数目为NA,B正确;1 mol Na可生成0.5 mol氢气,反应生成标准状况下气体11.2 L,C错误;钠元素化合价由0价升高为+1价,则1 mol钠反应转移的电子数为NA,D正确。
10.(2023·浙江宁波十校联考)在0.1 L由NaCl、MgCl2、BaCl2组成的混合溶液中,部分离子浓度大小如图所示,下列对该溶液成分说法不正确的是( )
A.NaCl的物质的量为0.1 mol
B.溶质MgCl2的质量为4.75 g
C.该混合溶液中BaCl2的物质的量为0.05 mol
D.将该混合溶液加水稀释至体积为1 L,稀释后溶液中Na+的物质的量浓度为0.5 mol·L-1
D
解析 由图可知,Na+、Mg2+、Cl-的物质的量浓度分别为1.0 mol·L-1、0.5 mol·L-1和3.0 mol·L-1,则0.1 L该混合溶液中含有NaCl为1.0 mol·L-1×0.1 L =0.1 mol,A正确;含MgCl2的物质的量为0.5 mol·L-1×0.1 L=0.05 mol,其质量为0.05 mol×95 g·mol-1=4.75 g,B正确;据电荷守恒可得:c(Na+)+2c(Mg2+)+2c(Ba2+)=c(Cl-),则有1.0 mol·L-1+0.5 mol·L-1 ×2+2c(Ba2+)=3.0 mol·L-1,c(Ba2+)=0.5 mol·L-1,故该混合溶液中含有BaCl2的物质的量为0.5 mol·L-1×0.1 L=0.05 mol,C正确;据稀释定律可得:
0.1 L×1.0 mol·L-1=1 L×c(Na+),c(Na+)=0.1 mol·L-1,D错误。
11.(2023·湖南郴州三模)设NA为阿伏加德罗常数的值,下列说法正确的是
( )
A.1 L 1 mol·L-1盐酸中含有NA个HCl分子
C.0.25 mol Zn与一定量浓硫酸恰好完全反应后,生成SO2的数目小于0.25NA
D.1 L 1 mol·L-1 NaF溶液中F-与OH-离子数之和小于NA
C
解析 HCl在水中完全电离,不存在HCl分子,A错误;核反应表示式必须遵循核电荷数和质量数守恒,即可推算出A=36,Z=89,1 mol ZM中含中子(89-36)NA=53NA,B错误;由得失电子数目守恒可知,1 mol锌与浓硫酸反应生成1 mol二氧化硫,1 mol 锌与稀硫酸反应生成1 mol氢气,则0.25 mol Zn与一定量浓硫酸恰好完全反应生成SO2和H2的总分子数为0.25NA,即生成SO2的数目小于0.25NA,C正确;1 L 1 mol·L-1 NaF溶液中n(Na+)=1 mol,根据电荷守恒可得n(F-)+n(OH-)=n(Na+)+n(H+),则F-与OH-离子数之和大于NA,D错误。
12.(2023·辽宁丹东一模)设NA为阿伏加德罗常数的值,下列有关叙述正确的是( )
A.31 g白磷(P4)中含有磷原子数为NA
B.10 g 中含有的中子数为6NA
C.标准状况下,2.24 L苯完全燃烧生成的CO2分子数为0.6NA
D.1 mol Na2O2与足量的水反应转移电子数为2NA
A
13.(2023·四川巴中一模)设NA是阿伏加德罗常数的值,下列说法错误的是
( )
A.1 mol甲苯中碳碳双键的数目为0.3NA
B.标准状况下,2.24 L SO3中原子数目大于0.4NA
C.1 L 0.1 mol·L-1 Na2S溶液中S2-的数目小于0.1NA
D.2.0 g重水(D2O)中质子数目为NA
A
解析 甲苯中不存在碳碳双键,A错误;标准状况下SO3不是气体,2.24 L SO3的物质的量大于0.1 mol,故原子数目大于0.4NA,B正确;1 L 0.1 mol·L-1 Na2S溶液中含0.1 mol Na2S,由于S2-发生水解,则S2-的数目小于0.1NA,C正确;1个D2O含10个质子,2.0 g重水(D2O)的物质的量为0.1 mol,则质子数目为NA,D正确。
14.(1)测定某固体产品中Na2Cr2O7含量的方法如下:称取产品试样2.50 g配成250 mL溶液,用移液管取出25.00 mL置于锥形瓶中,加入足量稀硫酸酸化后,再加入几滴指示剂,用0.100 0 mol·L-1硫酸亚铁铵(NH4)2Fe(SO4)2标准溶液进行滴定,再重复进行两次实验。(已知 被还原为Cr3+)
①氧化还原滴定过程中的离子方程式为 。
②若三次实验消耗(NH4)2Fe(SO4)2标准溶液的平均体积为25.00 mL,则所得产品中Na2Cr2O7的纯度为 %。[已知M(Na2Cr2O7)=262 g·mol-1,计算结果保留三位有效数字]
(2)通过碘量法可测定某产品中钴的含量。称取0.10 g [Co(NH3)6]Cl3产品,将其转化成Co3+后,加入过量KI和2~3滴淀粉溶液,再用0.010 0 mol·L-1 Na2S2O3标准溶液滴定,达到滴定终点时消耗Na2S2O3溶液20 mL,则产品中钴的百分含量为 。反应原理:
43.7
11.8%
同课章节目录
