化学人教版(2019)必修第一册2.3.1物质的量 课件(共21张ppt)
文档属性
| 名称 | 化学人教版(2019)必修第一册2.3.1物质的量 课件(共21张ppt) |  | |
| 格式 | pptx | ||
| 文件大小 | 2.2MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-11-19 20:22:19 | ||
图片预览








文档简介
(共21张PPT)
1.DBB
第二章 海水中的重要元素
——钠和氯
第三节 物质的量
第一课时: 物质的量
核心素养发展目标
1.宏观辨识与微观探析:通过对物质的量及其单位摩尔的学习,从微观上理解物质由不同粒子构成,进而从宏观上明确物质的量的应用。
2.证据推理与模型认知:通过完成物质的量的学习,使学生体会物理量建立的推理过程,并形成物理概念的认知模型。
3.科学态度与社会责任:通过物质的量概念的建立过程,理解化学家从微观研究到宏观概念的哲学思想和科学态度,进而培养学生学习化学的兴趣,树立良好的社会责任感。
4.能基于物质的量认识物质组成及其化学变化,运用物质的量、摩尔质量之间的相互关系进行简单计算。
教学重点:物质的量及其单位
教学难点:物质的量的概念建立及理解、应用
比一比:大家一口气能喝多少水?
老师:我一口气能喝下约7000万亿亿个水分子
夸父:我追赶太阳,口渴极了,我跑到了黄河边,一口气把黄河水喝完了,还是渴,我又跑到渭河边,一口气把渭河水也喝完了。
任务一 认识计量微观粒子的物理量——物质的量
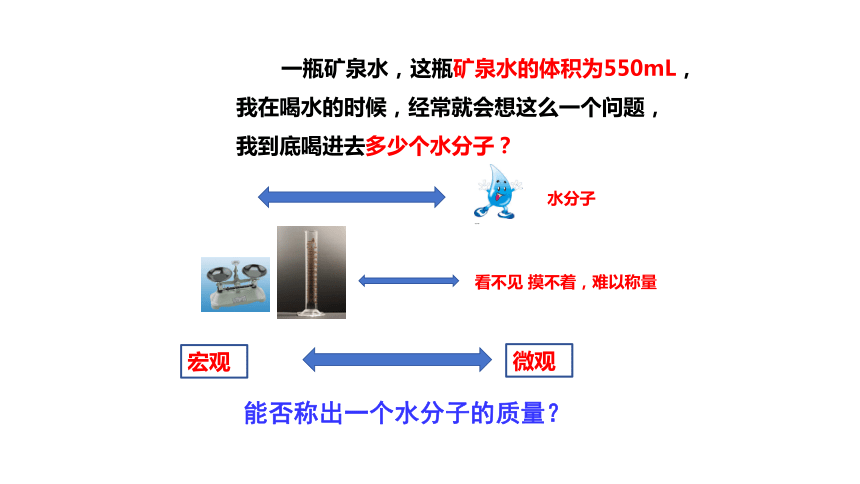
一瓶矿泉水,这瓶矿泉水的体积为550mL,我在喝水的时候,经常就会想这么一个问题,我到底喝进去多少个水分子?
能否称出一个水分子的质量?
宏观
微观
水分子个数?
水分子
看不见 摸不着,难以称量
≈ 1.67 1021 个 H2O
1670000000000000000000
假如让10亿人来数一滴水里的水分子,每人每分钟数100个,日夜不停,需要3万多年才能数清。
结论:微观粒子不便以个数来计量!
想办法在水分子数和水的质量之间找到一个桥梁
——集体单位。
这个桥梁就是本节课标题:化学中常用的物理量
——物质的量
一、物质的量的单位——摩尔
1.物质的量
概念:是用来解决宏观物质和微观粒子之间关系问题的,表示含有一定数目粒子的集体的物理量。
a、是七个国际基本物理量之一
b、是一个专有名词,由固定字数组成,不能分割、不能增减。
c、符号为“n”
d、单位:摩尔(mol),简称摩
e、微粒是指:分子、原子、离子、中子、电子等
f、粒子必须十分明确,且用化学式表示
物质的量:表示含有一定数目粒子的集合体的物理量
专有化:“物质的量”是一个整体,不可拆开。
微观化:物质的量仅用于计量原子、分子、离子、原子团、电子、质子、中子等微观粒子,不适用于宏观物质。
具体化:物质的量描述的对象是微观粒子的集合体,但没有限定是何种粒子集合体,因此,我们在使用物质的量时,要指明微观粒子的种类。
任务二:理解物质的量的单位——摩尔
1箱可乐
4捆衣架
1打鸡蛋
6盒粉笔
1袋糖果
【展示交流】
生活中常见的集合体
“打包”
形成一个集合体
mol
微观粒子的集合体
7个基本单位之一:摩尔(简称摩) 符号:mol
如:1 mol O表示 1 mol氧原子 ;1 mol O2表示1 mol氧气分子 。
能不能说有1 mol大米?
如果把 6.02×1023 粒米给全球60亿人吃,每人每天吃一斤,要吃14万年。显然,用物质的量来表示宏观粒子是没有意义的。
在1971年,由41个国家派代表参加的第14届国际计量大会,决定新增国际单位制的第7个基本物理量——物质的量,来计量原子、分子或离子等微观粒子。
物 理 量 单位 单位符号
√长 度 米 m
√质 量 千克(公斤) kg
√时 间 秒 s
√电 流 安[培] A
热力学温度 开[尔文] K
发光强度 坎[德拉] cd
物质的量
摩[尔]
mol
2、摩尔
(1)概念:是物质的量的单位,简称摩。
(2)符号:mol
(3)基准:每摩尔物质中含有6.02×1023个微粒
(4)摩尔这一单位,通常用来表示原子、分子、离子、电子等特定对象。
不能计量宏观物质,如“1mol汽车”、1mol人等。
(5)摩尔定义中的每摩尔物质,通常指某种微粒。使用摩尔时,微粒的名称应予以指出,通常是将微粒的符号写在摩尔名称或符号的后面。
如“1molO(指原子)”、“1.5molSO42-离子”、“2molO2分子中含4molO原子、16mol质子”。
任务三:理解阿伏伽德罗常数
摩尔的标准:国际上规定,任何物质所含有的粒子数与0.012kg12C中所含的碳原子数相同——每摩尔物质中含有6.02×1023个微粒,则其物质的量就为1mol。
阿伏加德罗常数(原意):以12g 12C中所含的原子数目为标准的,也就是说,如果在一定量的粒子集体中所含有的粒子数与12g 12C中所含的碳原子数目相同,则它的物质的量为1mol,而这个数值(粒子数)就叫阿伏加德罗常数
(1)质量的单位是千克,1千克=1000克,物质的量的单位是摩尔,1mol含有多少个微粒?
【提示】国际上规定,1mol粒子集合体所含的粒子数与0.012 kg 12C中所含的碳原子数相同。
指质子数为6,中子数为6的碳原子
(2)0.012 kg12C中所含的碳原子数到底有多少个?已知一个碳原子的质量为 1.993 × 10-23g
碳原子数=
解:
≈ 6.02×1023
12g
1.993×10-23g
3、阿伏伽德罗常数
(1)定义:1 mol任何粒子的粒子数叫做 ,符号为_______,通常用6.02×1023 mol-1表示。
阿伏加德罗常数
NA
(2)物质的量、阿伏加德罗常数与粒子数(符号为N)之间的关系:
或
N = n × NA
n = N ÷ NA
物质的量之比等于所含粒子数之比。
注:①此处“6.02×1023”是阿伏加德罗常数的近似值。
②阿伏加德罗常数的基准是0.012 kg12C中所含的碳原子数。
③阿伏加德罗常数是一个物理量,单位是mol-1。
(3)规律:
n1/n2 = N1/N2
思考: 1 mol CO2中,含有____mol C,____mol O
1个
1个
2个
10个
10个
20个
2NA个
NA个
NA个
1CO2 ~ 1C + 2O
1 mol
1 mol
2 mol
物质的量之比等于微粒数之比
N1
N2
n1
n2
=
判断正误:1.摩尔是7个基本物理量之一( )
×
错误。摩尔是物质的量的单位,
物质的量才是基本物理量之一。
摩尔是7个基本单位之一。
2.“物质的量”可表示为:
物质的质量( )
物质量( )
物质的数量( )
×
×
×
物质的量是一个统一的整体,由四个字组成,不能分割,也不可加字、减字。
3.物质的量将一定数目微观粒子与可称量的宏观物质之间联系起来了,以后我们就可以让“质量”这一个物理量“下岗”了( )
×
能力提升
化学方程式中,物质的物质的量之比等于其计量数之比
(1)书写氯气和铁反应的化学反应方程式,并用双线桥表示该反应的电子转移
(2)该反应转移电子数是多少?
(3)每6个氯气分子参加反应,转移电子数是多少?
(4)每6mol Cl2参加反应,转移的电子的物质的量是多少?
被氧化的Fe的物质的量是多少?生成FeCl3的物质的量是多少?
2Fe+3Cl2= 2FeCl3
失去2×3e-
得到2×3e-
6e-
12e-
6mol Cl2 ~ 转移12mol电子,被氧化的Fe的物质的量是4mol,生成FeCl3的物质的量是4mol。
判断下列说法是否正确,并加以说明理由
2、3 mol O
3、1 mol 氧
4、3 mol H2O
8、1 mol 钠元素
9、4 mol NaCl
5、5 mol e-
6、11 mol 质子
7、2.5 mol OH-
10、1 mol 细菌
1、2 mol 苹果
对
不对,指代不明,可指氧原子也可指氧分子
对,特定组合
对,指氧原子
对
不对,不能指宏观物质
不对,元素是宏观概念,只能说种类
对
不对,不能指宏观物质
对
牛刀小试:
练习:
2、1molC中约含有 个碳原子
3、0.3 mol H2SO4含有 个硫酸分子
4、1molNa2CO3中约含有_____molNa+、____molCO32-离子,共含有离子的个数为______________个。
6.02 × 1023
0.3× 6.02 × 1023
2
1
3×6.02×1023
1、1molH2O中含有多少mol的H,多少mol 的O
1个水分子中有2个氢原子和1个氧原子,当同时扩大阿佛加德罗常数倍之后,有如下关系:
H2O——2H——O 即H2O——2H——O
1 2 1 1mol 2mol 1mol
NA 2NA NA
作业:
1、下列叙述中正确的是( )
A、1 mol氢有6.02×1023个H2 B、阿伏加德罗常数等于6.02×1023
C、1 mol CO有6.02×1023个原子 D、3.01×1023个SO2分子约是0.5 mol
2、下列关于阿伏加德罗常数的说法中正确的是( )
A、6.02×1023叫做阿伏加德罗常数
B、12 g12C含有的碳原子数就是阿伏加德罗常数值
C、1摩尔氯含有6.02×1023个氯分子
D、1摩尔氧气所含原子数目为NA
3、a mol N2和a mol NO相比较,下列叙述中正确的是( )
A.所含分子数不相等 B.所含原子数总数相等
C.所含电子数相等 D.所含氮原子数相等
再见!
谢谢观看
1.DBB
第二章 海水中的重要元素
——钠和氯
第三节 物质的量
第一课时: 物质的量
核心素养发展目标
1.宏观辨识与微观探析:通过对物质的量及其单位摩尔的学习,从微观上理解物质由不同粒子构成,进而从宏观上明确物质的量的应用。
2.证据推理与模型认知:通过完成物质的量的学习,使学生体会物理量建立的推理过程,并形成物理概念的认知模型。
3.科学态度与社会责任:通过物质的量概念的建立过程,理解化学家从微观研究到宏观概念的哲学思想和科学态度,进而培养学生学习化学的兴趣,树立良好的社会责任感。
4.能基于物质的量认识物质组成及其化学变化,运用物质的量、摩尔质量之间的相互关系进行简单计算。
教学重点:物质的量及其单位
教学难点:物质的量的概念建立及理解、应用
比一比:大家一口气能喝多少水?
老师:我一口气能喝下约7000万亿亿个水分子
夸父:我追赶太阳,口渴极了,我跑到了黄河边,一口气把黄河水喝完了,还是渴,我又跑到渭河边,一口气把渭河水也喝完了。
任务一 认识计量微观粒子的物理量——物质的量
一瓶矿泉水,这瓶矿泉水的体积为550mL,我在喝水的时候,经常就会想这么一个问题,我到底喝进去多少个水分子?
能否称出一个水分子的质量?
宏观
微观
水分子个数?
水分子
看不见 摸不着,难以称量
≈ 1.67 1021 个 H2O
1670000000000000000000
假如让10亿人来数一滴水里的水分子,每人每分钟数100个,日夜不停,需要3万多年才能数清。
结论:微观粒子不便以个数来计量!
想办法在水分子数和水的质量之间找到一个桥梁
——集体单位。
这个桥梁就是本节课标题:化学中常用的物理量
——物质的量
一、物质的量的单位——摩尔
1.物质的量
概念:是用来解决宏观物质和微观粒子之间关系问题的,表示含有一定数目粒子的集体的物理量。
a、是七个国际基本物理量之一
b、是一个专有名词,由固定字数组成,不能分割、不能增减。
c、符号为“n”
d、单位:摩尔(mol),简称摩
e、微粒是指:分子、原子、离子、中子、电子等
f、粒子必须十分明确,且用化学式表示
物质的量:表示含有一定数目粒子的集合体的物理量
专有化:“物质的量”是一个整体,不可拆开。
微观化:物质的量仅用于计量原子、分子、离子、原子团、电子、质子、中子等微观粒子,不适用于宏观物质。
具体化:物质的量描述的对象是微观粒子的集合体,但没有限定是何种粒子集合体,因此,我们在使用物质的量时,要指明微观粒子的种类。
任务二:理解物质的量的单位——摩尔
1箱可乐
4捆衣架
1打鸡蛋
6盒粉笔
1袋糖果
【展示交流】
生活中常见的集合体
“打包”
形成一个集合体
mol
微观粒子的集合体
7个基本单位之一:摩尔(简称摩) 符号:mol
如:1 mol O表示 1 mol氧原子 ;1 mol O2表示1 mol氧气分子 。
能不能说有1 mol大米?
如果把 6.02×1023 粒米给全球60亿人吃,每人每天吃一斤,要吃14万年。显然,用物质的量来表示宏观粒子是没有意义的。
在1971年,由41个国家派代表参加的第14届国际计量大会,决定新增国际单位制的第7个基本物理量——物质的量,来计量原子、分子或离子等微观粒子。
物 理 量 单位 单位符号
√长 度 米 m
√质 量 千克(公斤) kg
√时 间 秒 s
√电 流 安[培] A
热力学温度 开[尔文] K
发光强度 坎[德拉] cd
物质的量
摩[尔]
mol
2、摩尔
(1)概念:是物质的量的单位,简称摩。
(2)符号:mol
(3)基准:每摩尔物质中含有6.02×1023个微粒
(4)摩尔这一单位,通常用来表示原子、分子、离子、电子等特定对象。
不能计量宏观物质,如“1mol汽车”、1mol人等。
(5)摩尔定义中的每摩尔物质,通常指某种微粒。使用摩尔时,微粒的名称应予以指出,通常是将微粒的符号写在摩尔名称或符号的后面。
如“1molO(指原子)”、“1.5molSO42-离子”、“2molO2分子中含4molO原子、16mol质子”。
任务三:理解阿伏伽德罗常数
摩尔的标准:国际上规定,任何物质所含有的粒子数与0.012kg12C中所含的碳原子数相同——每摩尔物质中含有6.02×1023个微粒,则其物质的量就为1mol。
阿伏加德罗常数(原意):以12g 12C中所含的原子数目为标准的,也就是说,如果在一定量的粒子集体中所含有的粒子数与12g 12C中所含的碳原子数目相同,则它的物质的量为1mol,而这个数值(粒子数)就叫阿伏加德罗常数
(1)质量的单位是千克,1千克=1000克,物质的量的单位是摩尔,1mol含有多少个微粒?
【提示】国际上规定,1mol粒子集合体所含的粒子数与0.012 kg 12C中所含的碳原子数相同。
指质子数为6,中子数为6的碳原子
(2)0.012 kg12C中所含的碳原子数到底有多少个?已知一个碳原子的质量为 1.993 × 10-23g
碳原子数=
解:
≈ 6.02×1023
12g
1.993×10-23g
3、阿伏伽德罗常数
(1)定义:1 mol任何粒子的粒子数叫做 ,符号为_______,通常用6.02×1023 mol-1表示。
阿伏加德罗常数
NA
(2)物质的量、阿伏加德罗常数与粒子数(符号为N)之间的关系:
或
N = n × NA
n = N ÷ NA
物质的量之比等于所含粒子数之比。
注:①此处“6.02×1023”是阿伏加德罗常数的近似值。
②阿伏加德罗常数的基准是0.012 kg12C中所含的碳原子数。
③阿伏加德罗常数是一个物理量,单位是mol-1。
(3)规律:
n1/n2 = N1/N2
思考: 1 mol CO2中,含有____mol C,____mol O
1个
1个
2个
10个
10个
20个
2NA个
NA个
NA个
1CO2 ~ 1C + 2O
1 mol
1 mol
2 mol
物质的量之比等于微粒数之比
N1
N2
n1
n2
=
判断正误:1.摩尔是7个基本物理量之一( )
×
错误。摩尔是物质的量的单位,
物质的量才是基本物理量之一。
摩尔是7个基本单位之一。
2.“物质的量”可表示为:
物质的质量( )
物质量( )
物质的数量( )
×
×
×
物质的量是一个统一的整体,由四个字组成,不能分割,也不可加字、减字。
3.物质的量将一定数目微观粒子与可称量的宏观物质之间联系起来了,以后我们就可以让“质量”这一个物理量“下岗”了( )
×
能力提升
化学方程式中,物质的物质的量之比等于其计量数之比
(1)书写氯气和铁反应的化学反应方程式,并用双线桥表示该反应的电子转移
(2)该反应转移电子数是多少?
(3)每6个氯气分子参加反应,转移电子数是多少?
(4)每6mol Cl2参加反应,转移的电子的物质的量是多少?
被氧化的Fe的物质的量是多少?生成FeCl3的物质的量是多少?
2Fe+3Cl2= 2FeCl3
失去2×3e-
得到2×3e-
6e-
12e-
6mol Cl2 ~ 转移12mol电子,被氧化的Fe的物质的量是4mol,生成FeCl3的物质的量是4mol。
判断下列说法是否正确,并加以说明理由
2、3 mol O
3、1 mol 氧
4、3 mol H2O
8、1 mol 钠元素
9、4 mol NaCl
5、5 mol e-
6、11 mol 质子
7、2.5 mol OH-
10、1 mol 细菌
1、2 mol 苹果
对
不对,指代不明,可指氧原子也可指氧分子
对,特定组合
对,指氧原子
对
不对,不能指宏观物质
不对,元素是宏观概念,只能说种类
对
不对,不能指宏观物质
对
牛刀小试:
练习:
2、1molC中约含有 个碳原子
3、0.3 mol H2SO4含有 个硫酸分子
4、1molNa2CO3中约含有_____molNa+、____molCO32-离子,共含有离子的个数为______________个。
6.02 × 1023
0.3× 6.02 × 1023
2
1
3×6.02×1023
1、1molH2O中含有多少mol的H,多少mol 的O
1个水分子中有2个氢原子和1个氧原子,当同时扩大阿佛加德罗常数倍之后,有如下关系:
H2O——2H——O 即H2O——2H——O
1 2 1 1mol 2mol 1mol
NA 2NA NA
作业:
1、下列叙述中正确的是( )
A、1 mol氢有6.02×1023个H2 B、阿伏加德罗常数等于6.02×1023
C、1 mol CO有6.02×1023个原子 D、3.01×1023个SO2分子约是0.5 mol
2、下列关于阿伏加德罗常数的说法中正确的是( )
A、6.02×1023叫做阿伏加德罗常数
B、12 g12C含有的碳原子数就是阿伏加德罗常数值
C、1摩尔氯含有6.02×1023个氯分子
D、1摩尔氧气所含原子数目为NA
3、a mol N2和a mol NO相比较,下列叙述中正确的是( )
A.所含分子数不相等 B.所含原子数总数相等
C.所含电子数相等 D.所含氮原子数相等
再见!
谢谢观看
