上海市宝山区2023-2024学年高三上学期期中考试化学试卷(含答案)
文档属性
| 名称 | 上海市宝山区2023-2024学年高三上学期期中考试化学试卷(含答案) |  | |
| 格式 | docx | ||
| 文件大小 | 294.0KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-11-19 20:56:11 | ||
图片预览



文档简介
上海市宝山区2023-2024学年高三上学期期中考试化学学科试卷
相对原子质量: H— 1 O— 16 S—32 Cu—64
一、走进神秘的太阳系
人类对星辰大海的向往从未停止,探索浩瀚宇宙的步伐永无尽头。
1. “祝融号”在火星上探测发现了大量矿物,含有原子序数依次增大的 4 种短周期元素 X、 Y、Z、W——X 的氢化物水溶液呈碱性,Y 元素原子最外层电子数是 Z 的 3 倍,Z 元素原子
M 层电子数等于K 层电子数,W 元素最高价和最低价代数和为零。下列叙述正确的是 。
A.原子半径: W > Z > X > Y B.ZY 和 WY2 都是离子化合物
C.X 的最高价氧化物对应水化物是强酸 D .最简单氢化物的沸点: X > Y
0 +2
2. 月球中的铁元素主要以 Fe 和 Fe 存在, 但是在嫦娥五号取回的微陨石撞击处的月壤样品中
+3 +3
存在大量的 Fe,推测在含该样品产生 Fe 的原因可能是 (铁元素以单质或氧化物表示) 。
A. 3FeO == Fe + Fe2O3 B. Fe3O4 == FeO + Fe2O3
C. Fe + FeO + O2 == Fe2O3 D. FeO + Fe2O3 == Fe3O4
詹姆斯·韦伯太空望远镜捕捉到第一批火星图像。火星本身不发光, 其红色的外观源于
表层土壤中丰富的铁元素及反射的太阳光。
3. 火星反射的光线通过气态原子后经过棱镜色散分光后得到了一系列不连续的暗线,该光谱
属于 (填“吸收”或“发射”)光谱。
4. 已知铁是第 26 号元素,铁在元素周期表中的位置是 ,基态铁原子价
电子轨道表示式为 ,其核外有 种不同运动状态的电子。
5. 某实验小组为探究 Fe 与 Fe3+能否发生氧化还原反应,试设计对应的双液原电池。
“天问一号”轨道飞行器近距离拍摄了火星北极,看到大量白色冰冻区域, 主要是二氧 化碳低温凝结形成的干冰,虽然看起来和地球两极很像,但实际温度却比地球两极冷多了! 6. 已知 25℃时, H2CO3 的 Ka1 = 4.2×10 -7 Ka2 = 4.8×10 - 11 ,HCN 的 Ka = 4.0×10 - 10 ,若向
NaCN 溶液中通入少量 CO2 ,发生反应的离子方程式为 。
7. 【不定项】 下列关于二氧化碳的说法正确的是 。
A. 电子式为 B. 空间填充模型为
C. CO2 是极性分子, 能溶于水 D. CO2 的水溶液能够导电,但 CO2 是非电解质
二、随时代更迭的含氮火箭燃料
过去, 联氨和四氧化二氮的组合是航天领域液体火箭发动机的重要燃料之一,但是不可
忽略的一点却是,联氨极不稳定、易挥发,且对人体有毒有害。
8. 根据下列实验操作及现象,得出结论正确的是 。
选项 操作及现象 结论
A 蘸有浓氨水的玻璃棒靠近浓硝酸,产生“ 白烟” 浓硝酸易分解
B 向紫色石蕊溶液中通入足量的 SO2 ,溶液只变红,不褪色 SO2 没有漂白性
C 向 NaHCO3 溶液中滴加盐酸,产生了 CO2 非金属性: Cl>C
D 向含淀粉的 KI 溶液中滴加少量氯水,溶液变蓝色 氧化性: Cl2>I2
9. 部分含氮物质的分类与相应化合价如图所示。下列推断不合理的是 。
(
A
.液态
a
可用作制冷剂,
g
是农业上常用的化肥
B
.
b
→
a
、
b
→
c
的转化都属于氮的固定
C
.工业上由
b
出发制备
e
的路线:
)
D .足量 e 的稀溶液与 6.4g 铜粉反应时,可以生成 4.48L 气体 d
联氨(N2H4)可用于处理锅炉水中的溶解氧, 一种反应机理如下图所示。
10. NH3 的电子式为 。
11. [Cu(NH3)4]2+中, 中心离子是 ,配位数是 。
12. 写出反应 I 的化学方程式,并用单线桥法表示电子转移的方向和数目: 。
13. 【不定项】 已知水合肼(N2H4 H2O)具有较强还原性,通常可被氧化为 N2 。现用如图流程
可制得较纯的单质 Pt,下列有关说法不正确的是 。
A .王水(由浓盐酸与浓硝酸组成)与粗 Pt 反应时仅体现氧化作用
B.NO3— 中 N 原子的杂化轨道类型为 sp2 ,空间结构为平面三角形
C .脱硝除去残余的 HNO3 和氮氧化物,主要目的是防止其污染环境
D .由 PtO2 制得 1mol 纯 Pt ,除脱销过程外理论上只需要 1mol N2H4 H2O 作还原剂
三、生命元素——硫
不管是与蛋白质合成密切相关的氨基酸,还是维生素中能找到 S 元素的身影。
14. 有一瓶 Na2 SO3 溶液, 它可能部分被氧化。某同学取少量该溶液, 滴加 BaCl2 溶液, 产生
白色沉淀;再加入足量稀硫酸,充分振荡后仍有白色沉淀。下述结论中,正确的是 。
A. 亚硫酸钠已部分被氧化
B. 加入 BaCl2 溶液后, 沉淀中一定含有 BaSO4
C. 加稀硫酸后,不溶的沉淀一定是 BaSO4
D. 此实验能确定 Na2 SO3 是否部分被氧化
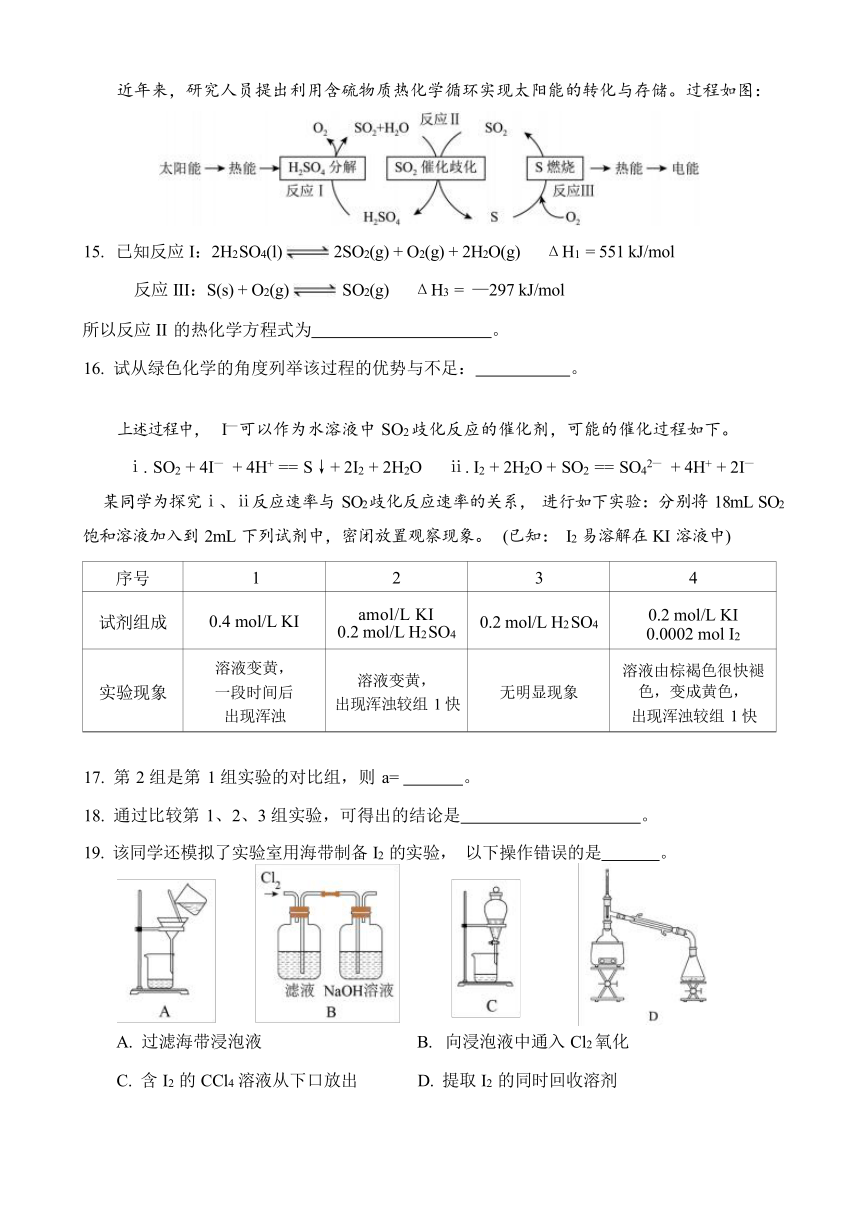
近年来,研究人员提出利用含硫物质热化学循环实现太阳能的转化与存储。过程如图:
15. 已知反应 I:2H2 SO4(l) 2SO2(g) + O2(g) + 2H2O(g) ΔH1 = 551 kJ/mol
反应 III:S(s) + O2(g) SO2(g) ΔH3 = —297 kJ/mol
所以反应 II 的热化学方程式为 。
16. 试从绿色化学的角度列举该过程的优势与不足: 。
上述过程中, I— 可以作为水溶液中 SO2 歧化反应的催化剂,可能的催化过程如下。
ⅰ. SO2 + 4I— + 4H+ == S↓+ 2I2 + 2H2O ⅱ. I2 + 2H2O + SO2 == SO42— + 4H+ + 2I—
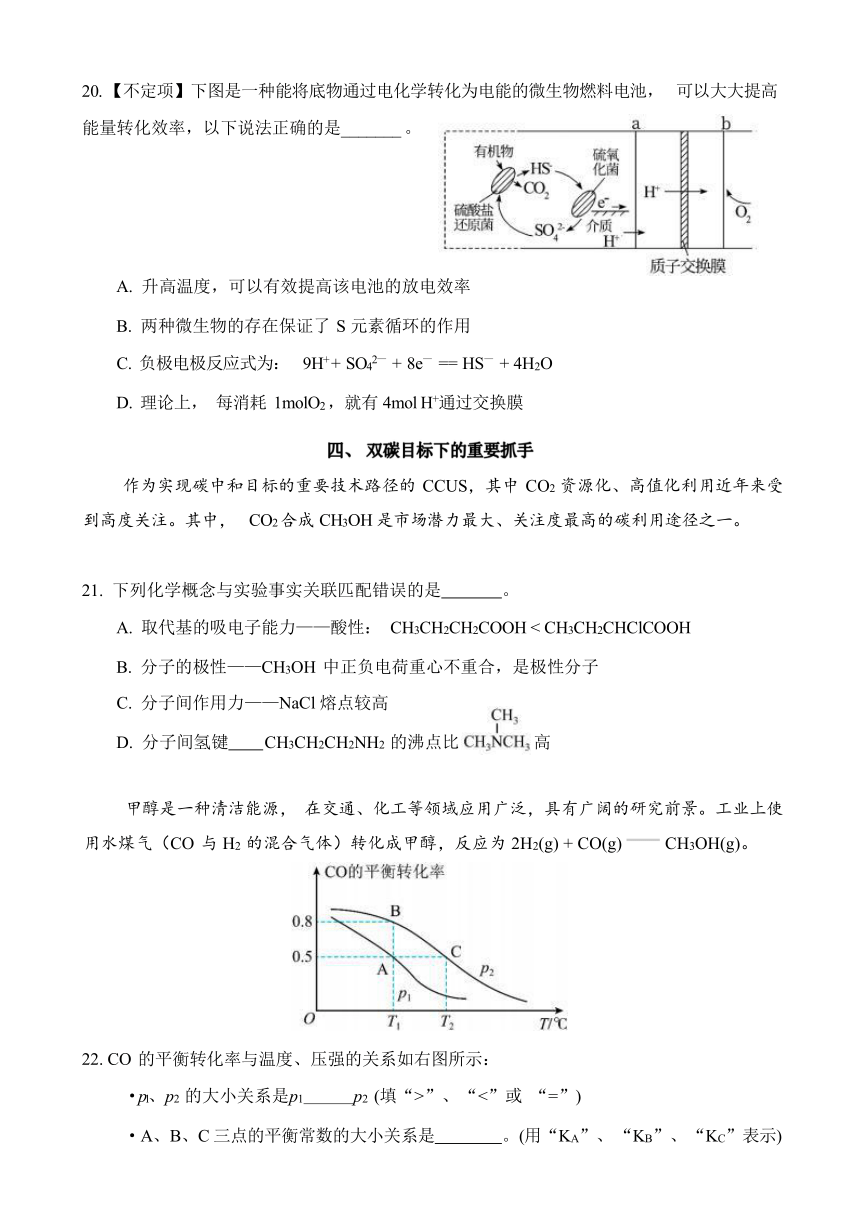
某同学为探究ⅰ、ⅱ反应速率与 SO2 歧化反应速率的关系, 进行如下实验:分别将 18mL SO2
饱和溶液加入到 2mL 下列试剂中,密闭放置观察现象。 (已知: I2 易溶解在 KI 溶液中)
序号 1 2 3 4
试剂组成 0.4 mol/L KI amol/L KI 0.2 mol/L H2 SO4 0.2 mol/L H2 SO4 0.2 mol/L KI 0.0002 mol I2
实验现象 溶液变黄, 一段时间后 出现浑浊 溶液变黄, 出现浑浊较组 1 快 无明显现象 溶液由棕褐色很快褪 色,变成黄色, 出现浑浊较组 1 快
17. 第 2 组是第 1 组实验的对比组,则 a= 。
18. 通过比较第 1、2、3 组实验,可得出的结论是 。
19. 该同学还模拟了实验室用海带制备 I2 的实验, 以下操作错误的是 。
A. 过滤海带浸泡液 B. 向浸泡液中通入 Cl2 氧化
C. 含 I2 的 CCl4 溶液从下口放出 D. 提取 I2 的同时回收溶剂
20. 【不定项】下图是一种能将底物通过电化学转化为电能的微生物燃料电池, 可以大大提高
能量转化效率,以下说法正确的是_______ 。
A. 升高温度,可以有效提高该电池的放电效率
B. 两种微生物的存在保证了 S 元素循环的作用
C. 负极电极反应式为: 9H+ + SO42— + 8e— == HS— + 4H2O
D. 理论上, 每消耗 1molO2 ,就有 4mol H+通过交换膜
四、 双碳目标下的重要抓手
作为实现碳中和目标的重要技术路径的 CCUS,其中 CO2 资源化、高值化利用近年来受
到高度关注。其中, CO2 合成 CH3OH 是市场潜力最大、关注度最高的碳利用途径之一。
21. 下列化学概念与实验事实关联匹配错误的是 。
A. 取代基的吸电子能力——酸性: CH3CH2CH2COOH < CH3CH2CHClCOOH
B. 分子的极性——CH3OH 中正负电荷重心不重合,是极性分子
(
C.
分子间作用力——
NaCl
熔点较高
)D. 分子间氢键 CH3CH2CH2NH2 的沸点比 高
甲醇是一种清洁能源, 在交通、化工等领域应用广泛,具有广阔的研究前景。工业上使
用水煤气(CO 与 H2 的混合气体)转化成甲醇,反应为 2H2(g) + CO(g) — CH3OH(g)。
22. CO 的平衡转化率与温度、压强的关系如右图所示:
·p1、p2 的大小关系是p1 p2 (填“>”、 “<”或 “=”)
·A、B、C 三点的平衡常数的大小关系是 。(用“KA”、 “KB”、 “KC”表示)
23.【多选】能说明恒容容器中上述反应达到化学平衡状态的是 。
A. v 正(H2) = 2v 逆(CH3OH)
B. 容器内的压强不再改变
C. 混合气体的平均摩尔质量不再改变
D. 容器中氧元素的质量分数不再改变
24. 该反应平衡常数的表达式为 。
25. 【不定项】某工厂进行了另外的实验,向某密闭容器中按 n(H2):n(CO) =2:1 的比例投入 反应物, 测量了 15min 后 H2 在四种不同温度下的转化率如下表所示,且 T1 < T2 < T3 < T4,
则下列说法正确的是 。
温度 T1 T2 T3 T4
转化率 10% 70% 70% 60%
A. 该反应 ΔH > 0
B. T 温度时(T2 < T < T3 ),相同时间内 H2 的转化率为 70%
C. T3 温度下,若反应在 15 min 后继续进行,则 H2 的转化率会增大
D. T4 温度下,若 15 min 后, [CO] = 0.5 mol/L,则 T4 时的 K=1.5
五、 智力之源
锌一般能够起到促进食欲、促进生长发育等作用,属于人体不可缺少的微量元素。除了人
体内,在电镀、合金、电池领域都能找到 Zn 元素的身影。
“湿法炼锌”是现代炼锌的主要方法,下列是以硫化锌精矿制备单质锌的工业流程:
26. ZnS 精矿在空气中焙烧时,通常会将硫化锌精矿粉碎,其目的是 。
27. 已知电解时 Cl—会腐蚀阳极板,因此实际生产会同时加入 Cu 和 CuSO4 从而生成 CuCl 沉 淀以降低对电解的影响, 原理为: 2Cl—(aq) + Cu(s) + Cu2+(aq) — 2CuCl(s) ΔH < 0,实验测
得电解液 pH 对溶液中 c(Cl—)的影响如图所示,下列说法正确的是 。
A .加入适当过量的 Cu,平衡正向移动
B. Ksp-CuCl 的表达式为 Ksp =
C. 向电解液中加入稀硫酸,不利于 Cl— 的去除
D. 若加入 1 mol Cu 单质,则完全反应后转移的电子总数为 NA
28. 在进行上述操作时,工厂对多余的铜粉进行了回收,为检验其表面的 Cl—是否已经洗净,
写出具体的实验步骤、现象和结论: 。
经员工检测发现仓库中 CuSO4·5H2O 晶体原材料存在被污染的情况(纯度大于 90%则可
以继续使用) ,因而安排了下列方法进行其纯度的测定:
①取 0.500 g 晶体样品,加入足量 KI 溶液
发生反应: 2Cu2+ + 4I— == 2CuI↓+ I2
②用 0.1000 mol/L 的 Na2 S2O3 标准溶液进行滴定
发生反应: I2 + 2S2O32- == 2I- + S4O62-
③以淀粉为指示剂,到达滴定终点时消耗标准溶液 15.00 mL。
29. 试通过计算,判断该批原材料是否能够继续使用(写出计算过程)。
30. 已知 CuI 能够吸附大量 I2 ,若不对其进行适当的处理,则会导致测得纯度的结果
(填“偏大” 、“偏小” 或“无影响”)。
采用氨浸法处理含锌物料回收有价金属,具有原料适应性广、工艺流程短、净化负担轻、
环境污染小、产品品种多、投资少等特点,对推动湿法炼锌技术的进步具有深远的意义。
31. 【不定项】控制温度不变,向 10mL 0.1mo/L HX 溶液中逐滴加入 0.1mol/L 的氨水, 其导
电能力、 pH 与所加氨水体积 V 的关系变化如图所示,下列说法不正确的是 。
A .水的电离程度: b > d ,a > c
B.Kb(NH3 ·H2O) = Ka(HX) = 10—4.6
C .d 点所得溶液的 pH < 7
D .a 点对应的溶液中存在:
[HX] + 2[H+] = [X—] + [NH3 ·H2O] + 2[OH—]
六、 有机化学与疾病研究
疟疾是由按蚊叮咬人体后而感染的一种血液寄生虫病,患者可口服青蒿素类复方制剂进
行治疗,他非诺喹是一种抗疟疾新药。其中间体合成路线如下(部分条件已省略):
(
①
②
)
32. A→B 反应的化学方程式为 。
33. D 中所含官能团的名称为 。
34. G→H 反应的类型为 。
A. 加成反应 B. 消去反应 C. 还原反应 D. 氧化反应
35. J 的结构简式为 。
36. X 是 D 的同分异构体, 请写出一种符合下列条件的 X 的结构简式: 。
i. 能发生水解和银镜反应 ii. X 的核磁共振氢谱中 3 组吸收峰, 且峰面积比为 1∶3∶6
37. 已知: ,以环己醇 和不多于 3 个碳
的物质为原料, 试参考中间体的合成路线制备 ,写出合成路线。
38. 从 C60 、C70 的混合物中纯化 C60 的过程如图,杯酚和 C60 之间通过 形成超分子。
A. 金属键 B. 范德华力 C. 氢键 D. 离子键
试卷答案
一、(7+13)
1. C (2 分) 2. A (2 分) 3. 吸收 (2 分)
4. 第 4 周期第 8 族(或第 VIII 族) (2 分) (2 分) 26 (2 分)
5.
(3 分,铁电极 1 分,铁离子对应溶液 1 分,
剩余导线、电流表、盐桥 1 分)
6. CO2 + H2O + CN— == HCO3— + HCN (2 分)
7. BD(3 分)
二、(7+10)
8. D (2 分)
9. D (2 分)
10.
(2 分)
11. Cu2+ (2 分) 4 (2 分)
12.
(物质 1 分,配平 1 分,电子转移 2 分)
13. AD (3 分)
三、(7+10)
14. C (2 分)
15. 3SO2(g) + 2H2O(g) 2H2 SO4(l) + S(s) (2 分) ΔH1 = —254 kJ/mol (2 分)
16. 优势:反应原料 H2 SO4 可以循环使用;充分利用并储存可再生的太阳能
不足:该过程涉及到对环境有害的 SO2 ,存在泄露的隐患;反应使用了催
化剂,可能出现催化剂中毒,降低转化效率低情况(2 分,各 1 分)
17. 0.4 (2 分)
18. H+单独存在不具有催化作用;酸性越强, I— 的催化效果更好 (2 分)
19. B (2 分)
20. BD (3 分)
四、(8+6)
21. C (2 分)
23. ABC (3 分)
25. D (3 分)
22. < (2 分) KA = KB > KC (2 分)
24. (2 分)
五、(5+11)
26. 增大接触面积,加快反应速率 (2 分) 27. C (2 分)
28. 取最后 1 次洗涤液,先加入足量稀硝酸,再加入 AgNO3 溶液,若未产生白
色沉淀,则说明已经洗净 (洗涤液 1 分,试剂 1 分,结论 1 分)
29. CuSO4 ·5H2O ~ Cu2+ ~ I2 ~ S2O32—
n(CuSO4 ·5H2O) = n(S2O32—) = c(S2O32—)×V(S2O32—)
= 0.015L × 0. 1000 mol/L = 0.0015 mol
m(晶体) = n(CuSO4 ·5H2O)×M(晶体) = 0.0015 mol × 250 g/mol = 0.375 g
纯度 = m(晶体) / m 总×100 % = 75 % < 90%
所以不能 (物质的量关系 1 分,公式 1 分,计算 1 分,结论 1 分)
30. 偏小 (2 分) 31. CD (3 分)
六、(4+12)
(
32.
33.
酮羰基、
酯基
(2
分
)
)(条件 1 分,物质 1 分)
34. C (2 分)
(
35.
)(2 分)
(
(2
分
)
)36.
37. (4 步 4 分)
38. B (3 分)
相对原子质量: H— 1 O— 16 S—32 Cu—64
一、走进神秘的太阳系
人类对星辰大海的向往从未停止,探索浩瀚宇宙的步伐永无尽头。
1. “祝融号”在火星上探测发现了大量矿物,含有原子序数依次增大的 4 种短周期元素 X、 Y、Z、W——X 的氢化物水溶液呈碱性,Y 元素原子最外层电子数是 Z 的 3 倍,Z 元素原子
M 层电子数等于K 层电子数,W 元素最高价和最低价代数和为零。下列叙述正确的是 。
A.原子半径: W > Z > X > Y B.ZY 和 WY2 都是离子化合物
C.X 的最高价氧化物对应水化物是强酸 D .最简单氢化物的沸点: X > Y
0 +2
2. 月球中的铁元素主要以 Fe 和 Fe 存在, 但是在嫦娥五号取回的微陨石撞击处的月壤样品中
+3 +3
存在大量的 Fe,推测在含该样品产生 Fe 的原因可能是 (铁元素以单质或氧化物表示) 。
A. 3FeO == Fe + Fe2O3 B. Fe3O4 == FeO + Fe2O3
C. Fe + FeO + O2 == Fe2O3 D. FeO + Fe2O3 == Fe3O4
詹姆斯·韦伯太空望远镜捕捉到第一批火星图像。火星本身不发光, 其红色的外观源于
表层土壤中丰富的铁元素及反射的太阳光。
3. 火星反射的光线通过气态原子后经过棱镜色散分光后得到了一系列不连续的暗线,该光谱
属于 (填“吸收”或“发射”)光谱。
4. 已知铁是第 26 号元素,铁在元素周期表中的位置是 ,基态铁原子价
电子轨道表示式为 ,其核外有 种不同运动状态的电子。
5. 某实验小组为探究 Fe 与 Fe3+能否发生氧化还原反应,试设计对应的双液原电池。
“天问一号”轨道飞行器近距离拍摄了火星北极,看到大量白色冰冻区域, 主要是二氧 化碳低温凝结形成的干冰,虽然看起来和地球两极很像,但实际温度却比地球两极冷多了! 6. 已知 25℃时, H2CO3 的 Ka1 = 4.2×10 -7 Ka2 = 4.8×10 - 11 ,HCN 的 Ka = 4.0×10 - 10 ,若向
NaCN 溶液中通入少量 CO2 ,发生反应的离子方程式为 。
7. 【不定项】 下列关于二氧化碳的说法正确的是 。
A. 电子式为 B. 空间填充模型为
C. CO2 是极性分子, 能溶于水 D. CO2 的水溶液能够导电,但 CO2 是非电解质
二、随时代更迭的含氮火箭燃料
过去, 联氨和四氧化二氮的组合是航天领域液体火箭发动机的重要燃料之一,但是不可
忽略的一点却是,联氨极不稳定、易挥发,且对人体有毒有害。
8. 根据下列实验操作及现象,得出结论正确的是 。
选项 操作及现象 结论
A 蘸有浓氨水的玻璃棒靠近浓硝酸,产生“ 白烟” 浓硝酸易分解
B 向紫色石蕊溶液中通入足量的 SO2 ,溶液只变红,不褪色 SO2 没有漂白性
C 向 NaHCO3 溶液中滴加盐酸,产生了 CO2 非金属性: Cl>C
D 向含淀粉的 KI 溶液中滴加少量氯水,溶液变蓝色 氧化性: Cl2>I2
9. 部分含氮物质的分类与相应化合价如图所示。下列推断不合理的是 。
(
A
.液态
a
可用作制冷剂,
g
是农业上常用的化肥
B
.
b
→
a
、
b
→
c
的转化都属于氮的固定
C
.工业上由
b
出发制备
e
的路线:
)
D .足量 e 的稀溶液与 6.4g 铜粉反应时,可以生成 4.48L 气体 d
联氨(N2H4)可用于处理锅炉水中的溶解氧, 一种反应机理如下图所示。
10. NH3 的电子式为 。
11. [Cu(NH3)4]2+中, 中心离子是 ,配位数是 。
12. 写出反应 I 的化学方程式,并用单线桥法表示电子转移的方向和数目: 。
13. 【不定项】 已知水合肼(N2H4 H2O)具有较强还原性,通常可被氧化为 N2 。现用如图流程
可制得较纯的单质 Pt,下列有关说法不正确的是 。
A .王水(由浓盐酸与浓硝酸组成)与粗 Pt 反应时仅体现氧化作用
B.NO3— 中 N 原子的杂化轨道类型为 sp2 ,空间结构为平面三角形
C .脱硝除去残余的 HNO3 和氮氧化物,主要目的是防止其污染环境
D .由 PtO2 制得 1mol 纯 Pt ,除脱销过程外理论上只需要 1mol N2H4 H2O 作还原剂
三、生命元素——硫
不管是与蛋白质合成密切相关的氨基酸,还是维生素中能找到 S 元素的身影。
14. 有一瓶 Na2 SO3 溶液, 它可能部分被氧化。某同学取少量该溶液, 滴加 BaCl2 溶液, 产生
白色沉淀;再加入足量稀硫酸,充分振荡后仍有白色沉淀。下述结论中,正确的是 。
A. 亚硫酸钠已部分被氧化
B. 加入 BaCl2 溶液后, 沉淀中一定含有 BaSO4
C. 加稀硫酸后,不溶的沉淀一定是 BaSO4
D. 此实验能确定 Na2 SO3 是否部分被氧化
近年来,研究人员提出利用含硫物质热化学循环实现太阳能的转化与存储。过程如图:
15. 已知反应 I:2H2 SO4(l) 2SO2(g) + O2(g) + 2H2O(g) ΔH1 = 551 kJ/mol
反应 III:S(s) + O2(g) SO2(g) ΔH3 = —297 kJ/mol
所以反应 II 的热化学方程式为 。
16. 试从绿色化学的角度列举该过程的优势与不足: 。
上述过程中, I— 可以作为水溶液中 SO2 歧化反应的催化剂,可能的催化过程如下。
ⅰ. SO2 + 4I— + 4H+ == S↓+ 2I2 + 2H2O ⅱ. I2 + 2H2O + SO2 == SO42— + 4H+ + 2I—
某同学为探究ⅰ、ⅱ反应速率与 SO2 歧化反应速率的关系, 进行如下实验:分别将 18mL SO2
饱和溶液加入到 2mL 下列试剂中,密闭放置观察现象。 (已知: I2 易溶解在 KI 溶液中)
序号 1 2 3 4
试剂组成 0.4 mol/L KI amol/L KI 0.2 mol/L H2 SO4 0.2 mol/L H2 SO4 0.2 mol/L KI 0.0002 mol I2
实验现象 溶液变黄, 一段时间后 出现浑浊 溶液变黄, 出现浑浊较组 1 快 无明显现象 溶液由棕褐色很快褪 色,变成黄色, 出现浑浊较组 1 快
17. 第 2 组是第 1 组实验的对比组,则 a= 。
18. 通过比较第 1、2、3 组实验,可得出的结论是 。
19. 该同学还模拟了实验室用海带制备 I2 的实验, 以下操作错误的是 。
A. 过滤海带浸泡液 B. 向浸泡液中通入 Cl2 氧化
C. 含 I2 的 CCl4 溶液从下口放出 D. 提取 I2 的同时回收溶剂
20. 【不定项】下图是一种能将底物通过电化学转化为电能的微生物燃料电池, 可以大大提高
能量转化效率,以下说法正确的是_______ 。
A. 升高温度,可以有效提高该电池的放电效率
B. 两种微生物的存在保证了 S 元素循环的作用
C. 负极电极反应式为: 9H+ + SO42— + 8e— == HS— + 4H2O
D. 理论上, 每消耗 1molO2 ,就有 4mol H+通过交换膜
四、 双碳目标下的重要抓手
作为实现碳中和目标的重要技术路径的 CCUS,其中 CO2 资源化、高值化利用近年来受
到高度关注。其中, CO2 合成 CH3OH 是市场潜力最大、关注度最高的碳利用途径之一。
21. 下列化学概念与实验事实关联匹配错误的是 。
A. 取代基的吸电子能力——酸性: CH3CH2CH2COOH < CH3CH2CHClCOOH
B. 分子的极性——CH3OH 中正负电荷重心不重合,是极性分子
(
C.
分子间作用力——
NaCl
熔点较高
)D. 分子间氢键 CH3CH2CH2NH2 的沸点比 高
甲醇是一种清洁能源, 在交通、化工等领域应用广泛,具有广阔的研究前景。工业上使
用水煤气(CO 与 H2 的混合气体)转化成甲醇,反应为 2H2(g) + CO(g) — CH3OH(g)。
22. CO 的平衡转化率与温度、压强的关系如右图所示:
·p1、p2 的大小关系是p1 p2 (填“>”、 “<”或 “=”)
·A、B、C 三点的平衡常数的大小关系是 。(用“KA”、 “KB”、 “KC”表示)
23.【多选】能说明恒容容器中上述反应达到化学平衡状态的是 。
A. v 正(H2) = 2v 逆(CH3OH)
B. 容器内的压强不再改变
C. 混合气体的平均摩尔质量不再改变
D. 容器中氧元素的质量分数不再改变
24. 该反应平衡常数的表达式为 。
25. 【不定项】某工厂进行了另外的实验,向某密闭容器中按 n(H2):n(CO) =2:1 的比例投入 反应物, 测量了 15min 后 H2 在四种不同温度下的转化率如下表所示,且 T1 < T2 < T3 < T4,
则下列说法正确的是 。
温度 T1 T2 T3 T4
转化率 10% 70% 70% 60%
A. 该反应 ΔH > 0
B. T 温度时(T2 < T < T3 ),相同时间内 H2 的转化率为 70%
C. T3 温度下,若反应在 15 min 后继续进行,则 H2 的转化率会增大
D. T4 温度下,若 15 min 后, [CO] = 0.5 mol/L,则 T4 时的 K=1.5
五、 智力之源
锌一般能够起到促进食欲、促进生长发育等作用,属于人体不可缺少的微量元素。除了人
体内,在电镀、合金、电池领域都能找到 Zn 元素的身影。
“湿法炼锌”是现代炼锌的主要方法,下列是以硫化锌精矿制备单质锌的工业流程:
26. ZnS 精矿在空气中焙烧时,通常会将硫化锌精矿粉碎,其目的是 。
27. 已知电解时 Cl—会腐蚀阳极板,因此实际生产会同时加入 Cu 和 CuSO4 从而生成 CuCl 沉 淀以降低对电解的影响, 原理为: 2Cl—(aq) + Cu(s) + Cu2+(aq) — 2CuCl(s) ΔH < 0,实验测
得电解液 pH 对溶液中 c(Cl—)的影响如图所示,下列说法正确的是 。
A .加入适当过量的 Cu,平衡正向移动
B. Ksp-CuCl 的表达式为 Ksp =
C. 向电解液中加入稀硫酸,不利于 Cl— 的去除
D. 若加入 1 mol Cu 单质,则完全反应后转移的电子总数为 NA
28. 在进行上述操作时,工厂对多余的铜粉进行了回收,为检验其表面的 Cl—是否已经洗净,
写出具体的实验步骤、现象和结论: 。
经员工检测发现仓库中 CuSO4·5H2O 晶体原材料存在被污染的情况(纯度大于 90%则可
以继续使用) ,因而安排了下列方法进行其纯度的测定:
①取 0.500 g 晶体样品,加入足量 KI 溶液
发生反应: 2Cu2+ + 4I— == 2CuI↓+ I2
②用 0.1000 mol/L 的 Na2 S2O3 标准溶液进行滴定
发生反应: I2 + 2S2O32- == 2I- + S4O62-
③以淀粉为指示剂,到达滴定终点时消耗标准溶液 15.00 mL。
29. 试通过计算,判断该批原材料是否能够继续使用(写出计算过程)。
30. 已知 CuI 能够吸附大量 I2 ,若不对其进行适当的处理,则会导致测得纯度的结果
(填“偏大” 、“偏小” 或“无影响”)。
采用氨浸法处理含锌物料回收有价金属,具有原料适应性广、工艺流程短、净化负担轻、
环境污染小、产品品种多、投资少等特点,对推动湿法炼锌技术的进步具有深远的意义。
31. 【不定项】控制温度不变,向 10mL 0.1mo/L HX 溶液中逐滴加入 0.1mol/L 的氨水, 其导
电能力、 pH 与所加氨水体积 V 的关系变化如图所示,下列说法不正确的是 。
A .水的电离程度: b > d ,a > c
B.Kb(NH3 ·H2O) = Ka(HX) = 10—4.6
C .d 点所得溶液的 pH < 7
D .a 点对应的溶液中存在:
[HX] + 2[H+] = [X—] + [NH3 ·H2O] + 2[OH—]
六、 有机化学与疾病研究
疟疾是由按蚊叮咬人体后而感染的一种血液寄生虫病,患者可口服青蒿素类复方制剂进
行治疗,他非诺喹是一种抗疟疾新药。其中间体合成路线如下(部分条件已省略):
(
①
②
)
32. A→B 反应的化学方程式为 。
33. D 中所含官能团的名称为 。
34. G→H 反应的类型为 。
A. 加成反应 B. 消去反应 C. 还原反应 D. 氧化反应
35. J 的结构简式为 。
36. X 是 D 的同分异构体, 请写出一种符合下列条件的 X 的结构简式: 。
i. 能发生水解和银镜反应 ii. X 的核磁共振氢谱中 3 组吸收峰, 且峰面积比为 1∶3∶6
37. 已知: ,以环己醇 和不多于 3 个碳
的物质为原料, 试参考中间体的合成路线制备 ,写出合成路线。
38. 从 C60 、C70 的混合物中纯化 C60 的过程如图,杯酚和 C60 之间通过 形成超分子。
A. 金属键 B. 范德华力 C. 氢键 D. 离子键
试卷答案
一、(7+13)
1. C (2 分) 2. A (2 分) 3. 吸收 (2 分)
4. 第 4 周期第 8 族(或第 VIII 族) (2 分) (2 分) 26 (2 分)
5.
(3 分,铁电极 1 分,铁离子对应溶液 1 分,
剩余导线、电流表、盐桥 1 分)
6. CO2 + H2O + CN— == HCO3— + HCN (2 分)
7. BD(3 分)
二、(7+10)
8. D (2 分)
9. D (2 分)
10.
(2 分)
11. Cu2+ (2 分) 4 (2 分)
12.
(物质 1 分,配平 1 分,电子转移 2 分)
13. AD (3 分)
三、(7+10)
14. C (2 分)
15. 3SO2(g) + 2H2O(g) 2H2 SO4(l) + S(s) (2 分) ΔH1 = —254 kJ/mol (2 分)
16. 优势:反应原料 H2 SO4 可以循环使用;充分利用并储存可再生的太阳能
不足:该过程涉及到对环境有害的 SO2 ,存在泄露的隐患;反应使用了催
化剂,可能出现催化剂中毒,降低转化效率低情况(2 分,各 1 分)
17. 0.4 (2 分)
18. H+单独存在不具有催化作用;酸性越强, I— 的催化效果更好 (2 分)
19. B (2 分)
20. BD (3 分)
四、(8+6)
21. C (2 分)
23. ABC (3 分)
25. D (3 分)
22. < (2 分) KA = KB > KC (2 分)
24. (2 分)
五、(5+11)
26. 增大接触面积,加快反应速率 (2 分) 27. C (2 分)
28. 取最后 1 次洗涤液,先加入足量稀硝酸,再加入 AgNO3 溶液,若未产生白
色沉淀,则说明已经洗净 (洗涤液 1 分,试剂 1 分,结论 1 分)
29. CuSO4 ·5H2O ~ Cu2+ ~ I2 ~ S2O32—
n(CuSO4 ·5H2O) = n(S2O32—) = c(S2O32—)×V(S2O32—)
= 0.015L × 0. 1000 mol/L = 0.0015 mol
m(晶体) = n(CuSO4 ·5H2O)×M(晶体) = 0.0015 mol × 250 g/mol = 0.375 g
纯度 = m(晶体) / m 总×100 % = 75 % < 90%
所以不能 (物质的量关系 1 分,公式 1 分,计算 1 分,结论 1 分)
30. 偏小 (2 分) 31. CD (3 分)
六、(4+12)
(
32.
33.
酮羰基、
酯基
(2
分
)
)(条件 1 分,物质 1 分)
34. C (2 分)
(
35.
)(2 分)
(
(2
分
)
)36.
37. (4 步 4 分)
38. B (3 分)
同课章节目录
