化学人教版(2019)必修第一册2.3.3物质的量浓度(共14张ppt)
文档属性
| 名称 | 化学人教版(2019)必修第一册2.3.3物质的量浓度(共14张ppt) |  | |
| 格式 | pptx | ||
| 文件大小 | 1.6MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-11-19 21:04:01 | ||
图片预览






文档简介
(共14张PPT)
第二章
海水中的重要元素
第三节 物质的量
课时 3 物质的量浓度
学习目标
1.能从宏观和微观的角度理解物质的量浓度的含义及其微观粒子间的关系;
2.掌握物质的量浓度的有关计算,逐步提升证据推理思维能力。。
回顾旧知
回顾旧知
【思考】什么是溶液?溶液是怎样组成的?如何表示溶液的组成?
溶液是由一种或几种物质分散在另一种物质里,组成的均一稳定的混合物。
溶液 = 溶质+溶剂
?
如何表示溶液浓度?
生活中的化学
体积分数
质量分数
溶液的量
溶质的量
m(溶质) 、 V(溶质)
m(溶液) 、V(溶液)
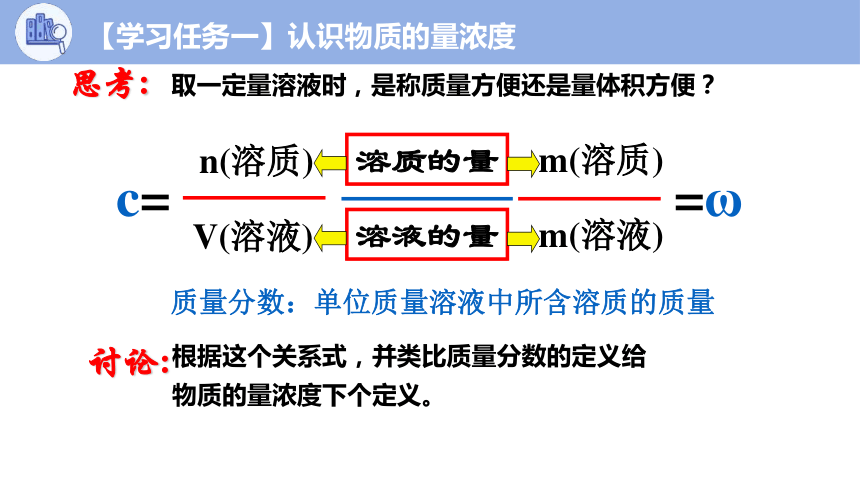
浓度=
溶液的量
溶质的量
m(溶质)
m(溶液)
=ω
n(溶质)
V(溶液)
c=
讨论:
根据这个关系式,并类比质量分数的定义给
物质的量浓度下个定义。
质量分数:单位质量溶液中所含溶质的质量
思考:
取一定量溶液时,是称质量方便还是量体积方便?
【学习任务一】认识物质的量浓度
单位:
c(B)
c(B)=
mol/L(或 mol·L-1)
单位体积 溶液中所含溶质B的物质的量.
定义:
符号:
数学表达式:
单位质量溶液中所含溶质的质量
一、物质的量浓度
思考:0.1 mol/L Na2SO4溶液的含义是什么?
1 L Na2SO4溶液中含有 0.1 mol Na2SO4
1L
n(B)
V
体检的一些指标常用物质的量浓度表示
质量浓度
【概念辨析】正误判断
(1)将1molNaOH溶于2L水中配成溶液,其物质的量浓度0.5mol/L。
不正确,1molNaOH溶于2L水后,溶液的体积并不是2L
注:1.计算物质的量浓度时,要用溶液的体积,而不是溶剂。
(2)从1L 3mol/L的NaOH溶液中取出500mL,则取出的溶液中溶质的物质的量浓度为1.5 mol/L ?
注:2.溶液的浓度与取出的溶液体积无关。
3mol/L
注:3.物质的量浓度不仅可以表示溶液中的物质浓度,也可以表示溶液中的离子浓度。
思考1:1 L 0.5 mol·L-1的Al2(SO4)3溶液中n(Al3+) = _____ ,c(Al3+)=_________, n(SO42- )=______, c(SO42- )=__________,c[Al2(SO4)3]∶c(Al3+)∶c(SO42- )=__________
由此可知,对于同一溶液中,不同微粒的浓度之比等于 ________________。
1mol/L
1.5mol/L
1:2:3
微粒个数之比
1mol
1.5mol
变式训练1:某BaCl2溶液中,测得c(Cl-)=0.5mol/L,则c(Ba2+)=_____________。
变式训练4:下列与0.2mol/L AlCl3溶液中c(Cl-)相同的是( )
①0.2mol/L NaCl溶液 ②0.3mol/L MgCl2溶液
③ 0.6mol/L KCl溶液 ④ 0.2mol/L BaCl2溶液
0.25mol/L
② ③
思考2:把250 g CuSO4·5H2O溶于水配成1L的溶液,所得溶质的成分是什么?
CuSO4
有关物质的量浓度的简单计算——正确判断溶质
注:4.如何正确判断溶液的溶质?
① 与水发生反应生成的新的物质为溶质,如Na、Na2O、Na2O2 NaOH,
SO3 H2SO4等。
②含结晶水的物质如CuSO4·5H2O溶于水,CuSO4为溶质。
有关物质的量浓度的简单计算——正确判断溶质
变式1:实验室欲配制250mL 1.0mol/L的CuSO4溶液,应称取CuSO4固体的质量为多少g?
变式2:实验室欲配制250mL1.0mol/L的CuSO4溶液,应称取胆矾(CuSO4·5H2O)固体的质量为多少g?
40.0g
62.5g
变式3:把2 mol Na2O溶于水配成1L的溶液,所得溶质的成分和物质的量浓度是多少?
Na2O+H2O==2NaOH
4mol/L NaOH
归纳总结
物质的量浓度
物质的量浓度
概念:单位体积的溶液里所含溶质B的物质的量
符号:CB
常用单位:mol/L(或 mol·L-1)
物质的量浓度的相关计算
第二章
海水中的重要元素
第三节 物质的量
课时 3 物质的量浓度
学习目标
1.能从宏观和微观的角度理解物质的量浓度的含义及其微观粒子间的关系;
2.掌握物质的量浓度的有关计算,逐步提升证据推理思维能力。。
回顾旧知
回顾旧知
【思考】什么是溶液?溶液是怎样组成的?如何表示溶液的组成?
溶液是由一种或几种物质分散在另一种物质里,组成的均一稳定的混合物。
溶液 = 溶质+溶剂
?
如何表示溶液浓度?
生活中的化学
体积分数
质量分数
溶液的量
溶质的量
m(溶质) 、 V(溶质)
m(溶液) 、V(溶液)
浓度=
溶液的量
溶质的量
m(溶质)
m(溶液)
=ω
n(溶质)
V(溶液)
c=
讨论:
根据这个关系式,并类比质量分数的定义给
物质的量浓度下个定义。
质量分数:单位质量溶液中所含溶质的质量
思考:
取一定量溶液时,是称质量方便还是量体积方便?
【学习任务一】认识物质的量浓度
单位:
c(B)
c(B)=
mol/L(或 mol·L-1)
单位体积 溶液中所含溶质B的物质的量.
定义:
符号:
数学表达式:
单位质量溶液中所含溶质的质量
一、物质的量浓度
思考:0.1 mol/L Na2SO4溶液的含义是什么?
1 L Na2SO4溶液中含有 0.1 mol Na2SO4
1L
n(B)
V
体检的一些指标常用物质的量浓度表示
质量浓度
【概念辨析】正误判断
(1)将1molNaOH溶于2L水中配成溶液,其物质的量浓度0.5mol/L。
不正确,1molNaOH溶于2L水后,溶液的体积并不是2L
注:1.计算物质的量浓度时,要用溶液的体积,而不是溶剂。
(2)从1L 3mol/L的NaOH溶液中取出500mL,则取出的溶液中溶质的物质的量浓度为1.5 mol/L ?
注:2.溶液的浓度与取出的溶液体积无关。
3mol/L
注:3.物质的量浓度不仅可以表示溶液中的物质浓度,也可以表示溶液中的离子浓度。
思考1:1 L 0.5 mol·L-1的Al2(SO4)3溶液中n(Al3+) = _____ ,c(Al3+)=_________, n(SO42- )=______, c(SO42- )=__________,c[Al2(SO4)3]∶c(Al3+)∶c(SO42- )=__________
由此可知,对于同一溶液中,不同微粒的浓度之比等于 ________________。
1mol/L
1.5mol/L
1:2:3
微粒个数之比
1mol
1.5mol
变式训练1:某BaCl2溶液中,测得c(Cl-)=0.5mol/L,则c(Ba2+)=_____________。
变式训练4:下列与0.2mol/L AlCl3溶液中c(Cl-)相同的是( )
①0.2mol/L NaCl溶液 ②0.3mol/L MgCl2溶液
③ 0.6mol/L KCl溶液 ④ 0.2mol/L BaCl2溶液
0.25mol/L
② ③
思考2:把250 g CuSO4·5H2O溶于水配成1L的溶液,所得溶质的成分是什么?
CuSO4
有关物质的量浓度的简单计算——正确判断溶质
注:4.如何正确判断溶液的溶质?
① 与水发生反应生成的新的物质为溶质,如Na、Na2O、Na2O2 NaOH,
SO3 H2SO4等。
②含结晶水的物质如CuSO4·5H2O溶于水,CuSO4为溶质。
有关物质的量浓度的简单计算——正确判断溶质
变式1:实验室欲配制250mL 1.0mol/L的CuSO4溶液,应称取CuSO4固体的质量为多少g?
变式2:实验室欲配制250mL1.0mol/L的CuSO4溶液,应称取胆矾(CuSO4·5H2O)固体的质量为多少g?
40.0g
62.5g
变式3:把2 mol Na2O溶于水配成1L的溶液,所得溶质的成分和物质的量浓度是多少?
Na2O+H2O==2NaOH
4mol/L NaOH
归纳总结
物质的量浓度
物质的量浓度
概念:单位体积的溶液里所含溶质B的物质的量
符号:CB
常用单位:mol/L(或 mol·L-1)
物质的量浓度的相关计算
