化学人教版(2019)选择性必修1 4.1.1原电池的工作原理(共12张ppt)
文档属性
| 名称 | 化学人教版(2019)选择性必修1 4.1.1原电池的工作原理(共12张ppt) |  | |
| 格式 | pptx | ||
| 文件大小 | 6.0MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-11-19 21:06:51 | ||
图片预览


文档简介
(共12张PPT)
第四章 ·化学反应与电能
第一节 原电池
第1课时 原电池的工作原理
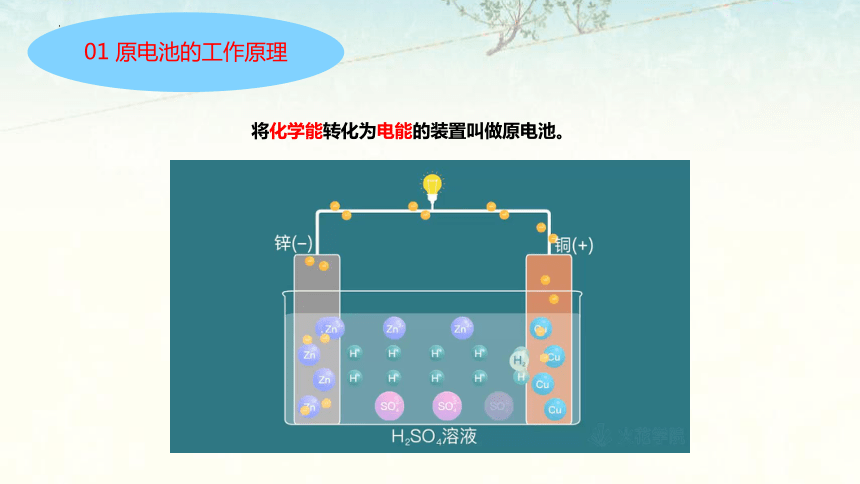
01 原电池的工作原理
将化学能转化为电能的装置叫做原电池。
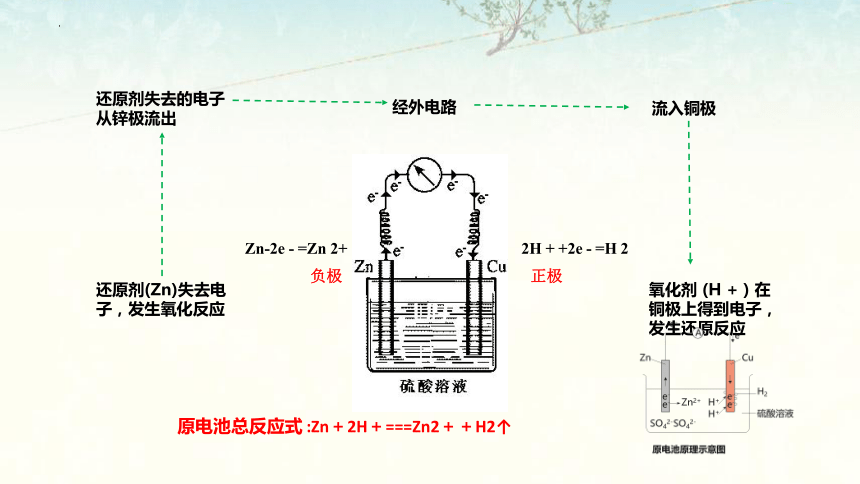
还原剂(Zn)失去电子,发生氧化反应
Zn-2e - =Zn 2+
负极
正极
2H + +2e - =H 2
还原剂失去的电子从锌极流出
经外电路
流入铜极
氧化剂 (H + ) 在铜极上得到电子,发生还原反应
原电池总反应式 :Zn+2H+===Zn2++H2↑
2.构成要素:
①有两个活泼性不同的电极。
②有电解质溶液或熔融电解质。
③能形成闭合回路。
A
1.本质:
自发进行的氧化还原反应。
两极一液一连线
在这种电解质溶液中能自发地进行氧化还原反应。
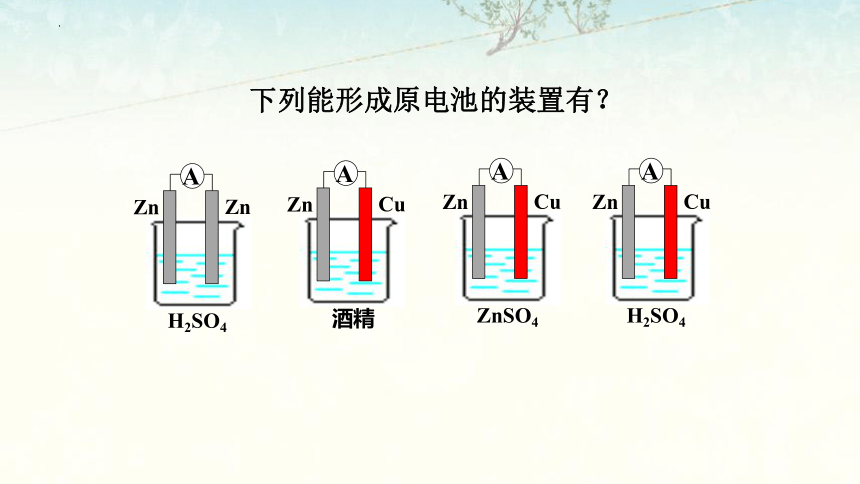
下列能形成原电池的装置有?
Zn
Zn
H2SO4
A
Zn
Cu
酒精
A
Zn
Cu
ZnSO4
A
Zn
Cu
H2SO4
A
锌
铜
硫酸铜
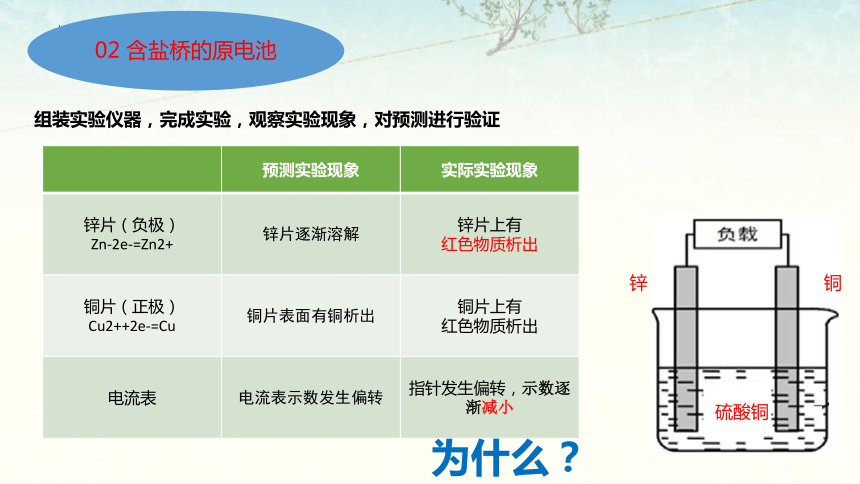
组装实验仪器,完成实验,观察实验现象,对预测进行验证
预测实验现象 实际实验现象
锌片(负极) Zn-2e-=Zn2+ 锌片逐渐溶解 锌片上有
红色物质析出
铜片(正极) Cu2++2e-=Cu 铜片表面有铜析出 铜片上有
红色物质析出
电流表 电流表示数发生偏转 指针发生偏转,示数逐渐减小
为什么?
02 含盐桥的原电池
铜锌原电池的工作原理
理想情况下 实际情况
电子路径 所有电子流经外 电路,形成电流 部分电子在锌片上
与铜离子结合
电池能量转化率低
电流不稳定
怎么办?
解决问题的关键:还原剂Zn与氧化剂CuSO4不直接接触
两个溶液间缺少离子导体,无法形成闭合回路。
为什么没有电流?该如何解决?
硫酸锌溶液
硫酸铜溶液
盐桥
装有饱和KCl饱和溶液的琼胶,离子可在其中自由移动,是一种离子导体
锌片 锌片腐蚀,不断溶解
铜片 铜片上有红色物质析出
电流表 指针发生偏转
K+
Cl-
e-
Zn2+
Zn
Cu2+
Cu
双液原电池工作原理
Zn - 2e- = Zn2+
Cu + 2e- = Cu
发生氧化反应
发生还原反应
负极
正极
盐桥的作用:
1、使整个装置构成通路,代替两溶液直接接触。(离子通路)
2、平衡电荷。(离子库,可以源源不断的供给需要的离子)
原电池正负极的判断
谢谢大家
第四章 ·化学反应与电能
第一节 原电池
第1课时 原电池的工作原理
01 原电池的工作原理
将化学能转化为电能的装置叫做原电池。
还原剂(Zn)失去电子,发生氧化反应
Zn-2e - =Zn 2+
负极
正极
2H + +2e - =H 2
还原剂失去的电子从锌极流出
经外电路
流入铜极
氧化剂 (H + ) 在铜极上得到电子,发生还原反应
原电池总反应式 :Zn+2H+===Zn2++H2↑
2.构成要素:
①有两个活泼性不同的电极。
②有电解质溶液或熔融电解质。
③能形成闭合回路。
A
1.本质:
自发进行的氧化还原反应。
两极一液一连线
在这种电解质溶液中能自发地进行氧化还原反应。
下列能形成原电池的装置有?
Zn
Zn
H2SO4
A
Zn
Cu
酒精
A
Zn
Cu
ZnSO4
A
Zn
Cu
H2SO4
A
锌
铜
硫酸铜
组装实验仪器,完成实验,观察实验现象,对预测进行验证
预测实验现象 实际实验现象
锌片(负极) Zn-2e-=Zn2+ 锌片逐渐溶解 锌片上有
红色物质析出
铜片(正极) Cu2++2e-=Cu 铜片表面有铜析出 铜片上有
红色物质析出
电流表 电流表示数发生偏转 指针发生偏转,示数逐渐减小
为什么?
02 含盐桥的原电池
铜锌原电池的工作原理
理想情况下 实际情况
电子路径 所有电子流经外 电路,形成电流 部分电子在锌片上
与铜离子结合
电池能量转化率低
电流不稳定
怎么办?
解决问题的关键:还原剂Zn与氧化剂CuSO4不直接接触
两个溶液间缺少离子导体,无法形成闭合回路。
为什么没有电流?该如何解决?
硫酸锌溶液
硫酸铜溶液
盐桥
装有饱和KCl饱和溶液的琼胶,离子可在其中自由移动,是一种离子导体
锌片 锌片腐蚀,不断溶解
铜片 铜片上有红色物质析出
电流表 指针发生偏转
K+
Cl-
e-
Zn2+
Zn
Cu2+
Cu
双液原电池工作原理
Zn - 2e- = Zn2+
Cu + 2e- = Cu
发生氧化反应
发生还原反应
负极
正极
盐桥的作用:
1、使整个装置构成通路,代替两溶液直接接触。(离子通路)
2、平衡电荷。(离子库,可以源源不断的供给需要的离子)
原电池正负极的判断
谢谢大家
