1.1.3能源的充分利用分层练习(含解析)-苏教版(2019)化学选择性必修1
文档属性
| 名称 | 1.1.3能源的充分利用分层练习(含解析)-苏教版(2019)化学选择性必修1 |

|
|
| 格式 | docx | ||
| 文件大小 | 1.1MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-11-19 22:47:25 | ||
图片预览


文档简介
1.1.3能源的充分利用
学校:___________姓名:___________班级:___________考号:___________
一、单选题
1.下列热化学方程式中的△H能表示物质燃烧热的是
A.2CO(g)+O2(g)═2CO2(g)△H=﹣56kJ/mol
B.CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=﹣890kJ/mol
C.2H2(g)+O2(g)═2H2O(l)△H=﹣571.6kJ/mol
D.H2(g)+Cl2(g)═2HCl(g)△H=﹣183kJ/mol
2.已知反应:①
②
③
则反应的为
A. B.
C. D.
3.下列热化学方程式正确的是
A.已知 , ,则
B.、下,将和置于密闭容器中充分反应生成,放热,其热化学方程式为
C.和反应的中和热,则和反应的中和热为
D.甲烷的燃烧热,则甲烷燃烧的热化学方程式可表示为:
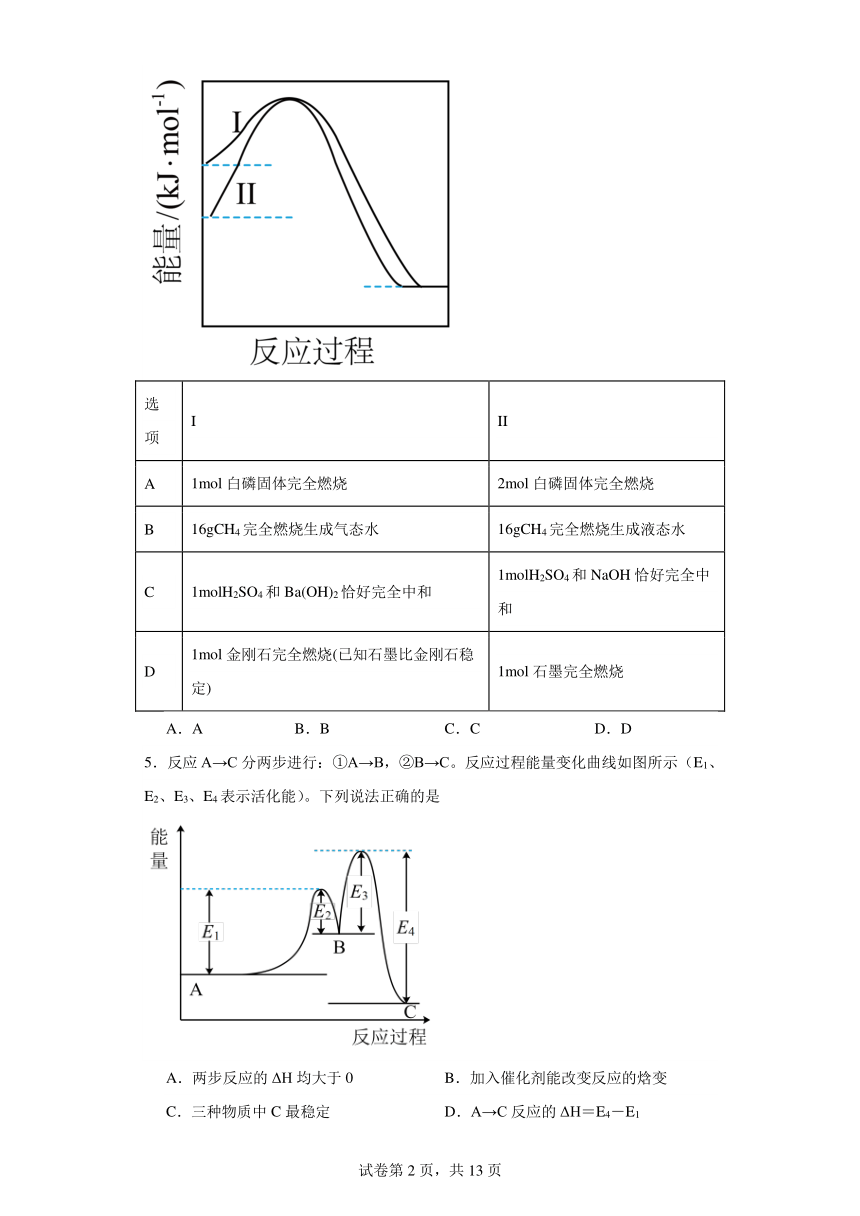
4.常温常压下,下列相关反应的能量变化与图中曲线变化相符的是
选项 I II
A 1mol白磷固体完全燃烧 2mol白磷固体完全燃烧
B 16gCH4完全燃烧生成气态水 16gCH4完全燃烧生成液态水
C 1molH2SO4和Ba(OH)2恰好完全中和 1molH2SO4和NaOH恰好完全中和
D 1mol金刚石完全燃烧(已知石墨比金刚石稳定) 1mol石墨完全燃烧
A.A B.B C.C D.D
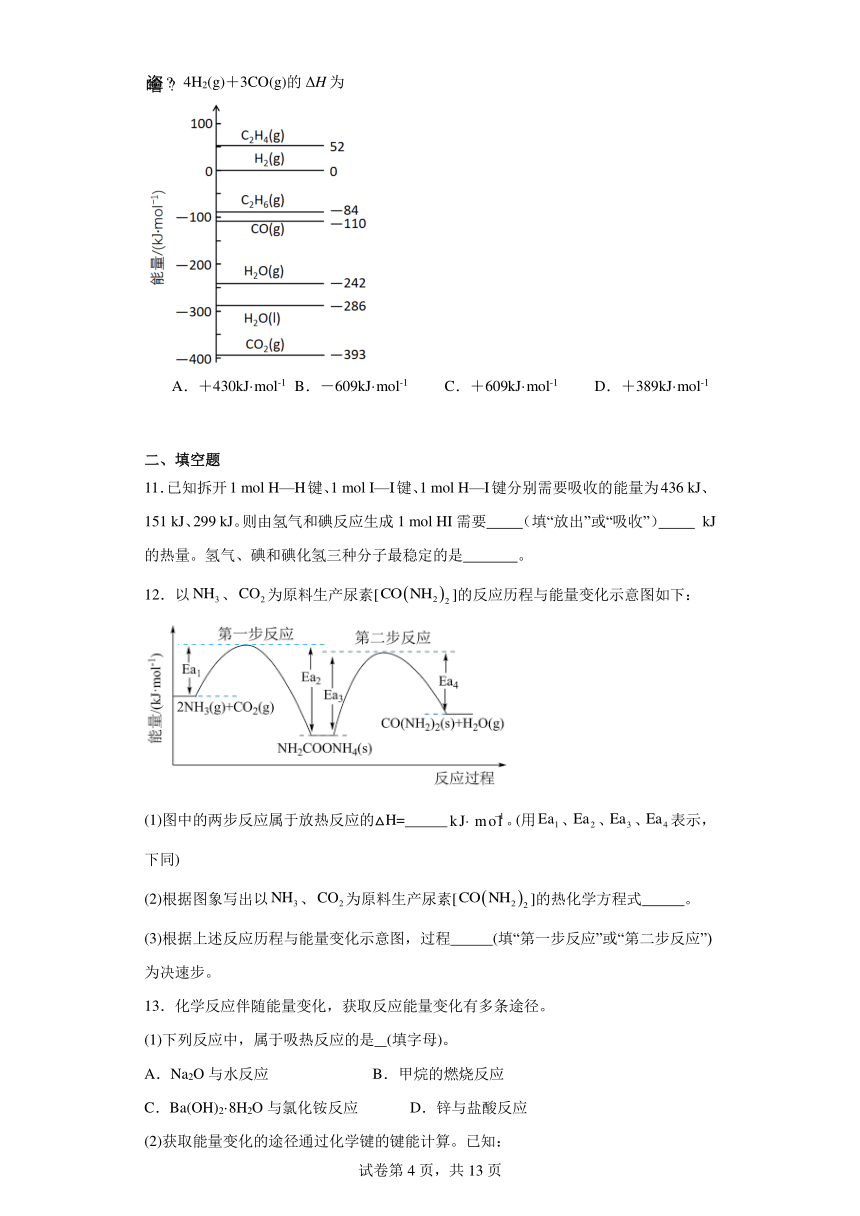
5.反应A→C分两步进行:①A→B,②B→C。反应过程能量变化曲线如图所示(E1、E2、E3、E4表示活化能)。下列说法正确的是
A.两步反应的ΔH均大于0 B.加入催化剂能改变反应的焓变
C.三种物质中C最稳定 D.A→C反应的ΔH=E4-E1
6.已知下列两个热化学方程式:
H2(g) + 1/2 O2(g) =H2O(l) △H=-300kJ·mol-1
C3H8(g) + 5O2(g) =3CO2(g) + 4H2O(l) △H =-2000.0 kJ·mol-1
实验测得氢气和丙烷的混合气体共5mol,完全燃烧时放热5000kJ,则混合气体中氢气和丙烷的体积比约为( )
A.7:10 B.3:1 C.10:7 D.1:3
7.用催化还原可以消除氮氧化物的污染。
已知:①
②
若在一定条件下,的恰好与一定量的反应生成、和,则整个过程中放出的热量为
A. B. C. D.
8.分析表中的3个热化学方程式,下列说法错误的是
2022年北京冬奥会“飞扬”火炬的燃料 H2 ①2H2(g)+O2(g)=2H2O(g) ΔH=-484kJ mol-1
2008年北京奥运会“祥云”火炬的燃料 C3H8 ②C3H8(g)+5O2(g)=3CO2(g)+4H2O(g) ΔH=-2039kJ mol-1 ③2C3H8(g)+7O2(g)=6CO(g)+8H2O(g) ΔH=-2380kJ mol-1
A.3CO(g)+7H2(g)=C3H8(g)+3H2O(g) ΔH=-504kJ mol-1
B.等质量的氢气与丙烷相比较,充分燃烧时,氢气放热更多
C.3CO2(g)+10H2(g)=C3H8(g)+6H2O(g) ΔH=-381kJ mol-1
D.丙烷的燃烧热为-2039kJ mol-1
9.质量相同的氢气,分别与足量的氧气点燃充分反应,在(1)生成液态水,(2)生成水蒸气两种情况下
A.反应(1)放出的热量多 B.反应(2)放出的热量多
C.(1)、(2)放出的热量一样多 D.无法比较两个反应放出的热量
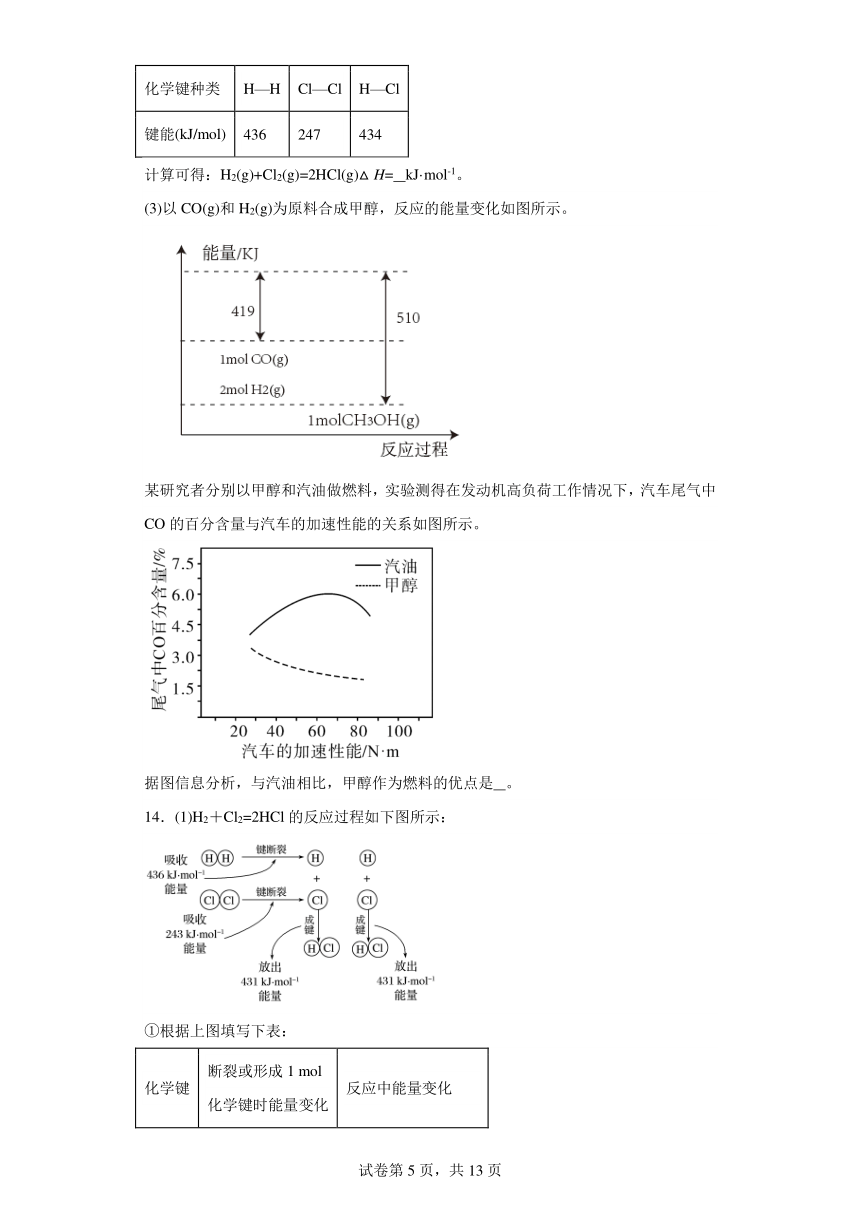
10.已知298K时,一些物质的相对能量(见图)。可根据相关物质的相对能量计算反应或变化的ΔH(ΔH随温度变化可忽略)。例如:H2O(g)H2O(l)ΔH=-286kJ·mol-1-(-242kJ·mol-1)=-44kJ·mol-1。则反应C2H6(g)+CO2(g)+H2O(g)4H2(g)+3CO(g)的ΔH为
A.+430kJ·mol-1 B.-609kJ·mol-1 C.+609kJ·mol-1 D.+389kJ·mol-1
二、填空题
11.已知拆开1 mol H—H键、1 mol I—I键、1 mol H—I键分别需要吸收的能量为436 kJ、151 kJ、299 kJ。则由氢气和碘反应生成1 mol HI需要 (填“放出”或“吸收”) kJ的热量。氢气、碘和碘化氢三种分子最稳定的是 。
12.以、为原料生产尿素[]的反应历程与能量变化示意图如下:
(1)图中的两步反应属于放热反应的△H= 。(用、、、表示,下同)
(2)根据图象写出以、为原料生产尿素[]的热化学方程式 。
(3)根据上述反应历程与能量变化示意图,过程 (填“第一步反应”或“第二步反应”)为决速步。
13.化学反应伴随能量变化,获取反应能量变化有多条途径。
(1)下列反应中,属于吸热反应的是 (填字母)。
A.Na2O与水反应 B.甲烷的燃烧反应
C.Ba(OH)2·8H2O与氯化铵反应 D.锌与盐酸反应
(2)获取能量变化的途径通过化学键的键能计算。已知:
化学键种类 H—H Cl—Cl H—Cl
键能(kJ/mol) 436 247 434
计算可得:H2(g)+Cl2(g)=2HCl(g)△H= kJ·mol-1。
(3)以CO(g)和H2(g)为原料合成甲醇,反应的能量变化如图所示。
某研究者分别以甲醇和汽油做燃料,实验测得在发动机高负荷工作情况下,汽车尾气中CO的百分含量与汽车的加速性能的关系如图所示。
据图信息分析,与汽油相比,甲醇作为燃料的优点是 。
14.(1)H2+Cl2=2HCl的反应过程如下图所示:
①根据上图填写下表:
化学键 断裂或形成1 mol 化学键时能量变化 反应中能量变化
Cl—Cl 吸收243 kJ 共吸收 kJ
H—H 吸收436 kJ
H—Cl 放出431 kJ 共放出 kJ
②该反应 (填“放出”或“吸收”) kJ热量。
(2)硅是太阳能电池的重要材料。工业冶炼纯硅的原理是:
粗硅冶炼:(a)SiO2+2CSi+2CO↑。
精炼硅:(b)Si+3HClSiHCl3+H2;
(c)SiHCl3+H2Si+3HCl。
化学反应与能量变化如图所示,回答下列问题:
①(a)是 反应,(b)是 反应,(c)是 反应(填“吸热”或“放热”)。
②反应(b)破坏反应物中的化学键所吸收的能量 (填“大于”或“小于”)形成生成物中化学键所放出的能量。
15.根据要求回答问题:
(1)如图是1 mol NO2(g)和1 mol CO(g)反应生成CO2和NO过程中的能量变化示意图,若在反应体系中加入催化剂,反应速率增大,E1的变化是 (填“增大”“减小”或“不变”,下同),ΔH的变化是 。
(2)0.1 mol Cl2与焦炭、TiO2完全反应,生成一种还原性气体和一种易水解成TiO2·xH2O的液态化合物,放热4.28 kJ,该反应的热化学方程式为 。
(3)甲醇质子交换膜燃料电池中将甲醇蒸气转化为氢气的两种反应的热化学方程式如下:
①CH3OH(g)+H2O(g)===CO2(g)+3H2(g) ΔH=+49.0 kJ·mol-1
②CH3OH(g)+O2(g)===CO2(g)+2H2(g) ΔH=-192.9 kJ·mol-1
又知③H2O(g)===H2O(l) ΔH=-44 kJ·mol-1,则甲醇蒸气燃烧为液态水的热化学方程式为 。
(4)在微生物作用的条件下,NH经过两步反应被氧化成NO。这两步的能量变化如图:
第二步反应是 反应(填“放热”或“吸热”)。1 mol NH(aq)全部氧化成NO(aq)的热化学方程式是 。
16.回答下列问题:
(1)完全燃烧生成液态水和,放出热量,写出燃烧的热化学方程式 。
(2)单斜硫和正交硫转化为的能量变化图如图。
单斜硫转化为正交硫的反应热为 ,单斜硫比正交硫的稳定性 (填“强”或“弱”)。
(3)和在一定条件下能发生反应:
已知:a、b、c均大于零
断开键所需能量为 。
17.请根据化学反应与热能的有关知识,填写下列空白:
I. (1)下列ΔH表示物质燃烧热的是 ;表示反应中和热ΔH=-57.3 kJ·mol-1的是 (填“ΔH1”“ΔH2”和“ΔH3”等)。
A.C(s)+O2(g)===CO(g) ΔH1
B.2H2(g)+O2(g)===2H2O(l) ΔH2
C.C(s)+O2(g)===CO2(g) ΔH3
D. Ba(OH)2(aq)+H2SO4(aq)=== BaSO4(s)+H2O(l) ΔH4
E.NaOH(aq)+HCl(aq)===NaCl(aq)+H2O(l) ΔH5
F.2NaOH(aq)+H2SO4(aq)===Na2SO4(aq)+2H2O(l) ΔH6
(2)化学反应的能量变化(ΔH)与反应物和生成物的键能有关(键能可以简单理解为断开1 mol化学键时所需吸收的能量),下表是部分化学键的键能数据:
化学键 P—P P—O O=O P=O
键能(kJ·mol-1) a 360 500 434
已知白磷(P4)的燃烧热为2 378 kJ·mol-1,白磷完全燃烧的产物(P4O10)的结构如上图所示,则上表中a= (保留到整数)。
II.已知2mol氢气燃烧生成液态水时放出572KJ热量,反应的热化学方程式是2H2(g)+O2(g)=2H2O(l) △H=-572KJ·mol-1。
(3)该反应生成物的能量总和 (填“大于”“小于”或“等于”)反应物的能量总和。
(4)若2mol氢气完全燃烧生成水蒸气,则放出的热量 (填“>”“<”或“=”)572KJ。
III.(5)已知16g固体硫完全燃烧时放出148.4KJ的热量,写出表示硫的燃烧热的热化学方程式: 。
(6)如图所示是1 mol NO2和CO反应生成CO2和NO过程中能量变化示意图,
请写出NO2和CO反应的热化学方程式: 。
18.已知C2H5OH(g)+3O2(g)=2CO2(g)+3H2O(g) △H1kJ·mol﹣1; H2O(g)=H2O(1) △H2kJ·mol﹣1; C2H5OH(g)=C2H5OH(1) △H3kJ·mol﹣1,若使23 g C2H5OH(1)完全燃烧生成H2O(1),则放出的热量为
19.按要求书写热化学方程式。
(1)[2022·河北,16(1)]298 K时,1 g H2燃烧生成H2O(g)放热121 kJ,1 mol H2O(l)蒸发吸热44 kJ,表示H2摩尔燃烧焓的热化学方程式为 。
(2)[2021·海南,16(1)]已知25 ℃,100 kPa时:1 mol葡萄糖[C6H12O6(s)]完全燃烧生成CO2(g)和H2O(l),放出2 804 kJ热量。则25 ℃时,CO2(g)与H2O(l)经光合作用生成葡萄糖[C6H12O6(s)]和O2(g)的热化学方程式为 。
(3)[2021·天津,13(3)]合成氨反应常使用铁触媒提高反应速率。如图为有、无铁触媒时,反应的能量变化示意图。写出该反应的热化学方程式: 。从能量角度分析,铁触媒的作用是 。
20.我国提出争取在2030年前实现碳达峰,2060年实现碳中和,这对于改善环境,实现绿色发展至关重要。如何降低大气中CO2的含量及有效地开发利用CO2引起了全世界的普遍重视。
(1)如图为C及其氧化物的变化关系图,若①变化是置换反应,则其化学方程式可以是 。
(2)把煤作为燃料可通过下列两种途径:
途径I:C(s)+O2(g)=CO2(g) △H1<0
途径II:先制成水煤气C(s)+H2O(g)=CO(g)+H2(g) △H2>0
再燃烧水煤气:
2CO(g)+O2(g)=2CO2(g) △H3<0
2H2(g)+O2(g)=2H2O(g) △H4<0
则途径I放出的热量 (填“大于”“等于”或“小于”)途径II放出的热量;△H1、△H2、△H3、△H4的数学关系式是 。
(3)我国在2004年起已利用焦炉煤气制取甲醇及二甲醚。
①已知CO中的C与O之间为三键连接,且合成甲醇的主要反应原理为CO(g)+2H2(g)=CH3OH(g) △H,表中所列为常见化学键的键能数据:
化学键 C-C C-H H-H C-O C≡O H-O
键能/kJ mol-1 348 414 436 326.8 1032 464
则该反应的△H= kJ mol-1。
②甲醇(CH3OH)也可由天然气来合成,已知:①2CH4(g)+O2(g)=2CO(g)+4H2(l) △H=-71kJ mol-1,②CO(g)+2H2(g)=CH3OH(l) △H=-90.5kJ mol-1,③CH4(g)+2O2(g)=CO2(g)+2H2O(l) △H=-890kJ mol-1,则甲醇的燃烧热为 。若CO的燃烧热为282.5kJ mol-1,则H2的燃烧热为 。
(4)金属钛冶炼过程中其中一步反应是将原料金红石转化:TiO2(金红石)+2C+2Cl2TiCl4+2CO。
已知:C(s)+O2(g)=CO2(g) △H=-393.5kJ mol-1
2CO(g)+O2(g)=2CO2(g) △H=-566kJ mol-1
TiO2(s)+2Cl2(g)=TiCl4(s)+O2(g) △H=+141kJ mol-1
则TiO2(s)+2C(s)+2Cl2(g)=TiCl4(s)+2CO(g)的△H= 。
三、实验探究题
21.为了探究化学能与热能的转化,某实验小组设计了如图所示的三套实验装置:
(1)上述3个装置中,不能证明“铜与浓硝酸反应是吸热反应还是放热反应”的是(不能用手触摸和使用温度计) 。
(2)某同学选用装置I进行实验(实验前U形管里液面左右相平),在甲试管里加入适量氢氧化钠溶液与稀盐酸,U形管中可观察到的现象是 ,说明该反应属于 (填“吸热反应”或“放热反应”)。
(3)为定量测定(2)中反应的反应热,使50mL0.50mol L-1盐酸与50mL0.55mol L-1NaOH溶液在简易量热计中进行中和反应。回答下列问题:
①该实验中NaOH的浓度大于盐酸的浓度的作用是 。
②实验中若改用60mL0.50mol L-1盐酸与50mL0.55mol L-1NaOH溶液进行反应,与上述实验相比,所求中和热 (填“相等”或“不相等”)。
(4)已知一些化学键的键能数据如表所示:
化学键 C-H C-F H-F F-F
键能/kJ mol-1 414 489 565 155
请根据键能数据估算CH4(g)和F2(g)反应生成CF4(g)和HF(g)的热化学方程式: 。
(5)已知反应:N2(g)+O2(g)=2NO(g) △H1
2H2(g)+O2(g)=2H2O(g) △H2
N2(g)+3H2(g)=2NH3(g) △H3
利用上述三个反应,计算4NH3(g)+5O2(g)=4NO(g)+6H2O(g)△H4的反应焓变为 (用含△H1、△H2、△H3的式子表示)。
22.为改变生橡胶受热发粘遇冷变硬的不良性能,工业上常将橡胶硫化来改善橡胶的性能,和均为改善橡胶性能的重要化工产品。
Ⅰ.已知下列化学键的键能及的结构式
化学键
键能() a b c
(1)已知反应:。与完全反应可放出热量,则a= (用含b,c,d的代数式表示)。
Ⅱ.资料卡片:
i.二氯化二硫常温下是一种黄红色液体,有窒息性 刺激性恶臭,熔点-80℃,沸点135.6℃;
ii.遇水强烈反应。
工业上可以用氯气和硫单质反应制得,实验室用下列装置模拟工业制取少量。
(2)制取少量
实验室可利用硫与少量氯气在110~140℃反应制得粗品。
①的电子式为 。A装置制取氯气的离子方程式为 。
②请补充完整实验装置连接顺序:A→ → →B→E→D.其中,F装置的作用是 ,D装置的作用是 。
③实验过程中,实验前和停止加热后,都需通一段时间的氮气,若停止加热后没有继续通氮气,的产率将 (填“偏高” “偏低”或“无影响”)。
(3)①遇水强烈反应,已知其中一种气体产物X能使品红溶液褪色,加热后又恢复原状,且反应过程中只有一种元素化合价发生变化,写出该反应的化学方程式 。
23.硫酸铵常温下是无色结晶或白色颗粒,无气味,280℃以上分解,500℃以上彻底分解为气体。某实验小组设计如下实验验证硫酸铵的分解产物。试回答下列问题。
(1)组装好装置加入药品前要进行的操作名称为 。
(2)当图1与图2连接后,进行实验观察到无水硫酸铜变蓝色,证明硫酸铵分解产物有 ;还观察到品红溶液褪色,KMnO4溶液紫色变浅不褪色,量气管中收集到一种气体单质(经检验该气体能使燃着的火柴熄灭),最后大试管中无固体剩余。写出KMnO4溶液紫色变浅发生反应的离子方程式: 。
(3)图1与图3连接后,可以观察到玻璃管中黑色固体变红色,玻璃管中反应的化学方程式为 。
(4)下图给出的是不同温度下13.2g硫酸铵固体加热过程中的固体质量变化。
写出290℃时硫酸铵分解的化学方程式 。350℃时分解产物的化学式为HxNySzOm,x:y:z:m= 。
(5)SO3(g)可以将NH3氧化为N2和水蒸气,SO3被还原为SO2,各物质中的平均键能数据如下表,写出该反应的热化学方程式: 。
化学键 S-O(SO3) S-O(SO2) N-H O-H N≡N
键能(kJ mol-1) a b c d e
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.B
【详解】A.书写燃烧反应的热化学方程式时可燃物必须是1 mol,故A错误;
B.书写燃烧反应的热化学方程式时可燃物一定是1 mol,反应物中C→CO2,H2→H2O(液),故B正确;
C.书写燃烧反应的热化学方程式时可燃物必须是1 mol,故C错误;
D.燃烧热指的是可燃物在氧气中的燃烧,故D错误.
2.D
【详解】由盖斯定律可知,①×3+②×2—③×2得到反应,则反应的=,故选D。
3.A
【详解】A.碳的燃烧为放热反应,焓变为负数,等量的C完全燃烧放出的热量大于不完全燃烧放出的热量,故aB.反应为可逆反应,0.5mol氮气分子和1.5mol氢气分子不能完全反应,故1mol氮气完全反应,放出的热量大于38.6kJ,故热化学方程式书写错误,B错误;
C.在稀溶液中,强酸跟强碱发生中和反应生成1 mol液态水时的反应热,叫做中和热;硫酸和氢氧化钙反应生成硫酸钙的过程放热,故该反应的反应热小于2×57.3kJ/mol,且中和反应的中和热与反应物的量无关,C错误;
D.在25℃、101 kPa时,1 mol 纯物质完全燃烧生成稳定的化合物时所放出的热量,叫做该物质的燃烧热,则甲烷燃烧的热化学方程式可表示为 ,D错误;
答案选A。
4.D
【详解】A.2mol白磷燃烧放出的能量比1mol白磷的多,则曲线I代表1mol白磷,曲线II代表2mol白磷,故A错误;
B.反应物都是16gCH4完全燃烧,则反应物的总能量相同,气态水转化为液态水放出热量,则气态水的能量高,图示不正确,故B错误;
C. H2SO4和Ba(OH)2完全反应生成水的同时还生成硫酸钡,则1molH2SO4和Ba(OH)2恰好完全中和放出的热量大于1molH2SO4和NaOH恰好完全中和,则生成物的总能量不相等,故C错误;
D.已知石墨比金刚石稳定,说明石墨能量低,则1mol石墨完全燃烧释放的能量小于1mol金刚石完全燃烧释放的能量,故曲线I代表金刚石,曲线II代表石墨,故D正确;
故选:D。
5.C
【详解】A.由图像可知A→B的反应,反应物总能量小于生成物总能量,反应吸热,B→C的反应,反应物的总能量大于生成物总能量,反应为放热反应,选项A错误;
B.加入催化剂,只改变反应的活化能,不改变反应热,选项B错误;
C.物质的总能量越低,越稳定,由图像可知C能量最低最稳定,选项C正确;
D.整个反应中△H=△HA→B+△HB→C=E1-E2+E3-E4,选项D错误;
答案选C。
6.C
【详解】设混合气中H2的物质的量为n,则C3H8的物质的量为5mol-n.根据题意,列方程为:
300kJ·mol-1×n+2000.0kJ·mol-1×(5mol-n)=5000kJ,解得 n=50/17mol;C3H8的物质的量为5mol-50/17mol=35/17mol,所以混合气体中H2与C3H8的体积比即物质的量之比为50/17 mol∶35/17mol=10∶7,故C正确。
故选C。
7.D
【详解】由盖斯定律可知,可得甲烷与二氧化氮反应的热化学方程式,则△H===867kJ/mol,3.2g甲烷的物质的量为0.2mol,由热化学方程式可知,0.2mol甲烷与二氧化氮反应放出的热量为0.2mol×867kJ/mol=173.4 kJ,故选D。
8.D
【详解】A.根据盖斯定律,①×-③可得3CO(g)+7H2(g)=C3H8(g)+3H2O(g) ΔH=(-484) ×-(-2380)=-504kJ/mol,故A正确;
B.由2H2(g)+O2(g)=2H2O(g) ΔH=-484kJ/mol可知4g氢气反应放出484kJ热量,由C3H8(g)+5O2(g)=3CO2(g)+4H2O(g) ΔH=-2039kJ/mol可知44g丙烷反应放出2039kJ热量,则4g丙烷反应放出185.4kJ热量,因此等质量的氢气与丙烷相比较,充分燃烧时,氢气放热更多,故B正确;
C.根据盖斯定律,①×5-②可得3CO2(g)+10H2(g)=C3H8(g)+6H2O(g) ΔH=5×(-484kJ/mol)-(- 2039kJ/mol)=-381kJ/mol,故C正确;
D.丙烷的燃烧热是指1mol丙烷完全燃烧生成二氧化碳与液态水放出热量,C3H8(g)+5O2(g)=3CO2(g)+4H2O(g) ΔH=-2039kJ/mol为生成气态水,则丙烷的燃烧热不是2039kJ/mol,故D错误;
故选D。
9.A
【详解】由于气态水的能量高于液态水的能量,所以氢气完全燃烧生成液态水时放热多,答案选A。
10.D
【详解】ΔH=生成物的总能量-反应物的总能量,则反应C2H6(g)+CO2(g)+H2O(g)4H2(g)+3CO(g)的ΔH=4×0+3×(-110kJ·mol-1)-( -84kJ·mol-1)- ( -393kJ·mol-1)- ( -242kJ·mol-1)=+389kJ·mol-1,故D正确;
故选D。
11. 放出 5.5 H2
【详解】反应热等于反应物中键能之和与生成物中键能之和的差值,则根据反应H2+I2=2HI可知形成2 molHI的反应热△H=(436 kJ/mol+151 kJ/mol) -2×299kJ/mol=-11 kJ/mol,反应为放热反应,所以由氢气和碘反应生成1 mol HI放出热量为5.5kJ。H—H键、I—I键、H—I键键能分别为436 kJ/mol、151 kJ/mol、299 kJ/mol。键能越大,分子越稳定,三种物质中键能最大的是H2,故H2分子最稳定。故答案为:放出;5.5;H2。
12.(1)
(2)
(3)第二步反应
【详解】(1)放热反应,反应物能量大于生成物能量,由图示可知,第一步反应是放热反应,故放热反应的 ;
(2)将第一步和第二步两步方程式相加得到氨气和二氧化碳气体为原料,合成尿素的热化学方程式2NH3(g)+CO2(g)=CO(NH2)2(s)+H2O(g) ΔH=Ea1 Ea2+Ea3 Ea4 kJ mol 1;
(3)反应的速率主要取决于最慢的反应,最慢的反应主要是反应物活化能大,所以第二步反应为决速步。
13. C -185 汽车的加速性能相同的情况下,CO排放量低,污染小
【详解】(1)常见的放热反应有:所有的物质燃烧、所有金属与酸反应、金属与水反应,所有中和反应、绝大多数化合反应和铝热反应等;常见的吸热反应有:绝大数分解反应,个别的化合反应(如C和CO2),少数分解、置换以及某些复分解(如铵盐和强碱);即A、B、D均为放热反应,C为吸热反应,故选C;
(2)ΔH=反应物键能之和-生成物键能之和,所以该反应的ΔH=436kJ/mol+247kJ/mol-2×434kJ/mol=-185kJ/mol;
(3)据图可知,当汽车的加速性能相同的情况下,甲醇作为燃料时CO排放量低,污染小。
14. 679 862 放出 183 吸热 放热 吸热 小于
【详解】(1)①断开H-H、Cl-Cl键,通过题目数据可知,共吸收243+436=679 kJ热量,形成H-Cl键共放出431+431=862kJ热量。
②根据放出和吸收热量数值的比较,可知该反应放出862-679=183 kJ热量。
(2)①根据化学反应与能量变化图可知,(a)是吸热反应,(b)是放热反应,(c)是吸热反应。
②反应(b)是个放热反应,所以破坏反应物中的化学键所吸收的能量小于形成生成物中化学键所放出的能量。
15. 减小 不变 2Cl2(g)+ TiO2(s)+2C(s)===TiCl4(l)+2CO(g) ΔH= 85.6 kJ·mol 1 CH3OH(l)+3/2O2(g)=CO2(g)+2H2O(l)△H=-764.7 kJ·mol-1 放热 NH(aq)+O2(g)===NO(aq)+2H+(aq)+H2O(l) ΔH=-273 kJ/mol
【详解】(1)加入催化剂能降低反应所需的活化能,则E1和E2都减小,催化剂不能改变反应物的总能量和生成物的总能量之差,即反应热不改变,所以催化剂对反应热无影响。E1的变化是减小,ΔH的变化是不变;(2)0.1 mol Cl2与焦炭、TiO2完全反应,生成一种还原性气体HCl和一种易水解成TiO2·xH2O的液态化合物TiCl4(l),放热4.28 kJ,反应方程式为2Cl2(g)+ TiO2(s)+2C(s)===TiCl4(l)+2CO(g),0.1 mol Cl2反应放热4.28 kJ,2 mol Cl2反应放热4.28 kJ×2/0.1=85.6 kJ,该反应的热化学方程式为2Cl2(g)+ TiO2(s)+2C(s)===TiCl4(l)+2CO(g) ΔH= 85.6 kJ·mol 1 ;(3)利用盖斯定律进行计算,①CH3OH(g)+H2O(g)===CO2(g)+3H2(g) ΔH=+49.0 kJ·mol-1,②CH3OH(g)+O2(g)===CO2(g)+2H2(g) ΔH=-192.9 kJ·mol-1,又知③H2O(g)===H2O(l) ΔH=-44 kJ·mol-1,依据盖斯定律计算(②×3-①×2+③×2)得:CH3OH(l)+3/2O2(g)=CO2(g)+2H2O(l)△H=3×(-192.9 kJ·mol-1)-2×49.0 kJ·mol-1+(-44 kJ·mol-1)×2=-764.7 KJ·mol-1;则甲醇蒸气燃烧为液态水的热化学方程式为:CH3OH(l)+3/2O2(g)=CO2(g)+2H2O(l)△H=-764.7 KJ·mol-1;(4)由图可知,第二步反应反应物能量高于生成物能量,是放热反应;由图可知,第一步热化学反应为NH4+(aq)+1.5O2(g)=2H+(aq)+NO2-(aq)+H2O(l)△H=-273 kJ·mol-1,即1 mol NH(aq)全部氧化成NO(aq)的热化学方程式。
16.(1)CH4(g) + 2O2(g) = CO2(g) + 2H2O(l) △H=-889.6kJ/mol
(2) -0.33 弱
(3)
【详解】(1)据题意可知1molCH4完全燃烧生成液态水和CO2,放出889.6kJ热量,故热化学方程式为:CH4(g) + 2O2(g) = CO2(g) + 2H2O(l) △H=-889.6kJ/mol;
(2)32g硫即为1mol硫,据图并结合盖斯定律可知1mol单斜硫转化为正交硫的反应热=-297.16kJ/mol-(-296.83kJ/mol)=-0.33kJ/mol;物质所具备的能量越低稳定性越强,故单斜硫的稳定性弱于正交硫;
(3)焓变等于反应物的总键能-生成物的总键能,设H-I键的键能为x,列式:b+c-2x=-a,解得x=。
17. ΔH3 ΔH5 196 小于 < S(s)+O2(g)=SO2(g) △H=-296.8kJ·mol-1 NO2(g)+CO(g)===CO2(g)+NO(g) ΔH=-234 kJ/mol
【详解】I.(1)根据燃烧热的定义:1mol可燃气体完全燃烧生成稳定的氧化物放出的热量,即属于燃烧热的是△H3;根据中和热的定义:酸与碱反应生成1mol水时放出的热量,即属于中和热的是△H5;
(2)根据△H等于反应物键能总和-生成物键能总和,△H=(6×a+5×500-12×360-4×434)=-2378kJ·mol-1,解得a=196kJ·mol-1;II.考查化学能与热能的转化,
(3)因为△H<0,说明此反应是放热反应,即反应物的总能量大于生成物的总能量,即反应生成物的总能量小于反应物的能量总和;
(4)液态水转化成水蒸气需要吸收热量,因此2mol氢气完全燃烧生辰水蒸气,放出的热量<572kJ;
III.(5)1molS完全燃烧放出的热量是kJ=296.8kJ,因此硫燃烧热的热化学方程式为 S(s)+O2(g)=SO2(g) △H=-296.8kJ·mol-1;
(6)NO2和CO反应的化学方程式为:NO2+CO=CO2+NO,根据能量与过程的图象,则热化学反应方程式为NO2(g)+CO(g)=CO2(g)+NO(g) ΔH=-234 kJ·mol-1。
【点睛】本题的易错点是燃烧热和中和热,根据燃烧热的定义,是1mol可燃物完全燃烧生成稳定的氧化物放出的热量,C生成CO2,S→SO2,H转化成液态水,A中生成的是CO,△H1不表示燃烧热,B中氢气是2mol,不是1mol,△H2不表示燃烧热,C、符合燃烧热的定义,△H3表示燃烧热;同理中和热也可以根据定义分析。
18.【答题空1】-(△H1-△H3+3△H2)/2 kJ
【详解】①C2H5OH(g)+3O2(g)=2CO2(g)+3H2O(g),△H1kJ/mol;②H2O(g)=H2O(1)△H2kJ/mol;③C2H5OH(g)=C2H5OH(1)△H3kJ/mol,根据盖斯定律,①-③-3②得到:C2H5OH(l)+3O2(g)=2CO2(g)+3H2O(l),△H=△H1-△H3+3△H2kJ/mol;23 g C2H5OH(1)(物质的量为0.5mol)完全燃烧时,放出的热量为-(△H1-△H3+3△H2)/2kJ;
【点睛】放热反应时,△H<0,热量值为正值,则-△H为正值。
19.(1)H2(g)+O2(g)=H2O(l) ΔH=-286 kJ·mol-1
(2)6CO2(g)+6H2O(l)=C6H12O6(s)+6O2(g) ΔH=+2 804 kJ·mol-1
(3) N2(g)+3H2(g)2NH3(g) ΔH=-(a-b) kJ·mol-1 降低反应的活化能
【详解】(1)298 K时,1 g H2燃烧生成H2O(g)放热121 kJ,1 mol H2O(l)蒸发吸热44 kJ,则1 mol H2燃烧生成1 mol H2O(l)放热286 kJ,表示H2摩尔燃烧焓的热化学方程式为H2(g)+O2(g)=H2O(l) ΔH=-286 kJ·mol-1;
(2)已知25 ℃,100 kPa时:1 mol葡萄糖[C6H12O6(s)]完全燃烧生成CO2(g)和H2O(l),放出2 804 kJ热量,CO2(g)与H2O(l)经光合作用生成葡萄糖[C6H12O6(s)]和O2(g)为葡萄糖燃烧的逆过程,反应热化学方程式:6CO2(g)+6H2O(l)=C6H12O6(s)+6O2(g) ΔH=+2 804 kJ·mol-1;
(3)根据能量变化图,可得热化学方程式:N2(g)+3H2(g)2NH3(g) ΔH=-(a-b) kJ·mol-1,从能量角度分析,铁触媒降低的反应的活化能;
20.(1)C+CuOCu+CO↑
(2) 等于 △H1=△H2+(△H3+△H4)
(3) -128.8 764kJ mol-1 286kJ mol-1
(4)-80kJ mol-1
【详解】(1)①是置换反应可以是碳和水蒸气反应生成一氧化碳和氢气,或与金属氧化物反应,反应的化学方程式为C+CuOCu+CO↑;
(2)根据盖斯定律可知,①=②+③×+④×,所以途径I放出的热量等于途径II放出的热量;ΔH1=ΔH2+(ΔH3+ΔH4);
(3)通过键能计算焓变,反应物总键能 生成物总键能,则反应的(1032+2×436-3×414-326.8-464)= -128.8;
根据盖斯定律,(③×2-①)÷2得:CO(g)+2H2(g)+O2(g)===CO2(g)+2H2O(l) ΔH=-854.5 kJ·mol-1④,④-②得:CH3OH(l)+O2(g)===CO2(g)+2H2O(l) ΔH=-764 kJ·mol-1,故甲醇的燃烧热为764 kJ·mol-1;
CO的燃烧热为282.5kJ mol-1,CO(g)+O2(g)===CO2(g) ΔH=-282.5 kJ·mol-1⑤,
④-⑤得2H2(g)+O2(g)=== 2H2O(l) ΔH=-572 kJ·mol-1,故氢气的燃烧热为286 kJ·mol-1;
(4)已知:反应I:C(s)+O2(g)=CO2(g) △H1=﹣393.5kJ mol-1,反应II:2CO(g)+O2(g)=2CO2(g) △H2=﹣566kJ mol-1,反应III:TiO2(s)+2Cl2(g)=TiCl4(s)+O2(g) △H3=+141kJ mol-1,目标反应TiO2(s)+2Cl2(g)+2C(s)=TiCl4(s)+2CO(g)可由III+2I-II,根据盖斯定律可知△H=△H3+2△H1-△H2=(+141kJ mol-1)+2×(﹣393.5kJ mol-1)-( ﹣566kJ mol-1)=-80 kJ mol-1。
21.(1)III
(2) 左端液柱降低,右端液柱升高 放热反应
(3) 保证盐酸完全被中和,使生成水的量更精确 相等
(4)CH4(g)+4F2(g)=CF4(g)+4HF(g) ΔH=-1940kJ mol-1
(5)2ΔH1+3ΔH2-2ΔH3
【详解】(1)III是个敞开体系,无法形成压强差,水不会发生倒吸
(2)该反应放热使空气受热膨胀,则U型管内左边液面下降,右边液面升高
(3)①实验中氢氧化钠稍稍过量,目的是保证盐酸完全被中和,使生成水的量更精确;
②中和热数值不会发生变化,故两者所求中和热相等。
(4)先写方程式CH4 (g)+4F2(g)=CF4(g)+4HF(g) ,该反应的反应热为4 ×414kJ mol-1+4×155kJ mol-1-4×565kJ mol-1-×489kJ mol-1=-1940kJ mol-1,故热化学方程式为:CH4(g)+4F2(g)=CF4(g)+4HF(g) ΔH=-1940kJ mol-1。
(5)根据盖斯定律,反应2乘以3-反应3乘以2得到3O2(g)+4NH3(g)=6H2O(g)+2N2(g),再加上反应1乘以2,即得到4NH3(g)+5O2(g)=4NO(g)+6H2O(g),则该反应的焓变为2ΔH1+3ΔH2-2ΔH3
22.(1)
(2) F C 除去气体 吸收空气中的水蒸气和尾气处理 偏低
(3)
【分析】A制取氯气,含有HCl和水蒸气,F装置的作用是除去气体,C是干燥氯气,B是在110~140℃反应制得粗品,E是收集产品,D装置的作用是吸收空气中的水蒸气和尾气处理。
【详解】(1)由反应:,与完全反应可放出热量, 拆开化学键吸热4aKJ+4cKJ,形成化学键放热8bKJ,8b-4a-ac=d,则a=(用含b,c,d的代数式表示)。故答案为:;
(2)①的电子式为。A装置二氧化锰和浓盐酸反应制取氯气,离子方程式为。故答案为:;;
②A制取氯气,含有HCl和水蒸气,F装置的作用是除去气体,C是干燥氯气,B是在110~140℃反应制得粗品,E是收集产品,D装置的作用是吸收空气中的水蒸气和尾气处理,实验装置连接顺序:A→F→C→B→E→D,故答案为:F;C;除去气体;吸收空气中的水蒸气和尾气处理;
③实验过程中,实验前和停止加热后,都需通一段时间的氮气,若停止加热后没有继续通氮气,装置中的没有赶入E中,的产率将偏低(填“偏高” “偏低”或“无影响”)。故答案为:偏低;
(3)①遇水强烈反应,已知其中一种气体产物X能使品红溶液褪色,加热后又恢复原状,X为二氧化硫,且反应过程中只有一种元素化合价发生变化,S由+1价变为+4价和0价,该反应的化学方程式。故答案为:。
23.(1)检查装置气密性
(2) 水 2MnO+2H2O+5SO2=2Mn2++5SO+4H+
(3)2NH3+3CuO3Cu+N2+3H2O
(4) (NH4)2SO4NH4HSO4+NH3↑ 8:2:2:7
(5)3SO3(g)+2NH3(g)=N2(g)+3H2O(g)+3SO2(g) ΔH=(9a+6c-e-6d-6b) kJ mol-1
【分析】硫酸铵分解生成的产物首先通过无水硫酸铜检验水蒸气,浓硫酸吸收氨气,品红溶液检验二氧化硫,酸性高锰酸钾溶液除去二氧化硫,最后测量剩余气体的体积,据此解答。
【详解】(1)反应中有气体生成,因此组装好装置加入药品前要进行的操作名称为检查装置气密性;
(2)实验中观察到无水硫酸铜变蓝色,证明硫酸铵分解产物有水生成;还观察到品红溶液褪色,KMnO4溶液紫色变浅不褪色,说明还有二氧化硫生成,量气管中收集到一种气体单质(经检验该气体能使燃着的火柴熄灭),说明气体是氮气,最后大试管中无固体剩余。KMnO4溶液紫色变浅是因为被二氧化硫还原,发生反应的离子方程式为2MnO+2H2O+5SO2=2Mn2++5SO+4H+;
(3)图1与图3连接后,可以观察到玻璃管中黑色固体变红色,说明氨气还原氧化铜,则玻璃管中反应的化学方程式为2NH3+3CuO3Cu+N2+3H2O;
(4)13.2g硫酸铵的物质的量是13.2g÷132g/mol=0.1mol,290℃时固体质量减少13.2g-11.5g=1.7g,说明生成0.1mol氨气,则硫酸铵分解的化学方程式为(NH4)2SO4NH4HSO4+NH3↑。从290℃到350℃时固体质量又减少11.5g-10.6g=0.9g,恰好是0.05mol水,290℃时固体是0.1mol NH4HSO4,根据原子守恒可知属于物质中H、N、S、O的物质的量分别是0.4mol、0.1mol、0.1mol、0.35mol,若分解产物的化学式为HxNySzOm,则x:y:z:m=0.4mol:0.1mol:0.1mol:0.35mol=8:2:2:7;
(5)SO3(g)可以将NH3氧化为N2和水蒸气,SO3被还原为SO2,方程式为3SO3+2NH3=N2+3H2O+3SO2,则焓变ΔH=(9a+6c-e-6d-6b) kJ mol-1,所以该反应的热化学方程式为3SO3(g)+2NH3(g)=N2(g)+3H2O(g)+3SO2(g) ΔH=(9a+6c-e-6d-6b) kJ mol-1。
答案第1页,共2页
答案第1页,共2页
学校:___________姓名:___________班级:___________考号:___________
一、单选题
1.下列热化学方程式中的△H能表示物质燃烧热的是
A.2CO(g)+O2(g)═2CO2(g)△H=﹣56kJ/mol
B.CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=﹣890kJ/mol
C.2H2(g)+O2(g)═2H2O(l)△H=﹣571.6kJ/mol
D.H2(g)+Cl2(g)═2HCl(g)△H=﹣183kJ/mol
2.已知反应:①
②
③
则反应的为
A. B.
C. D.
3.下列热化学方程式正确的是
A.已知 , ,则
B.、下,将和置于密闭容器中充分反应生成,放热,其热化学方程式为
C.和反应的中和热,则和反应的中和热为
D.甲烷的燃烧热,则甲烷燃烧的热化学方程式可表示为:
4.常温常压下,下列相关反应的能量变化与图中曲线变化相符的是
选项 I II
A 1mol白磷固体完全燃烧 2mol白磷固体完全燃烧
B 16gCH4完全燃烧生成气态水 16gCH4完全燃烧生成液态水
C 1molH2SO4和Ba(OH)2恰好完全中和 1molH2SO4和NaOH恰好完全中和
D 1mol金刚石完全燃烧(已知石墨比金刚石稳定) 1mol石墨完全燃烧
A.A B.B C.C D.D
5.反应A→C分两步进行:①A→B,②B→C。反应过程能量变化曲线如图所示(E1、E2、E3、E4表示活化能)。下列说法正确的是
A.两步反应的ΔH均大于0 B.加入催化剂能改变反应的焓变
C.三种物质中C最稳定 D.A→C反应的ΔH=E4-E1
6.已知下列两个热化学方程式:
H2(g) + 1/2 O2(g) =H2O(l) △H=-300kJ·mol-1
C3H8(g) + 5O2(g) =3CO2(g) + 4H2O(l) △H =-2000.0 kJ·mol-1
实验测得氢气和丙烷的混合气体共5mol,完全燃烧时放热5000kJ,则混合气体中氢气和丙烷的体积比约为( )
A.7:10 B.3:1 C.10:7 D.1:3
7.用催化还原可以消除氮氧化物的污染。
已知:①
②
若在一定条件下,的恰好与一定量的反应生成、和,则整个过程中放出的热量为
A. B. C. D.
8.分析表中的3个热化学方程式,下列说法错误的是
2022年北京冬奥会“飞扬”火炬的燃料 H2 ①2H2(g)+O2(g)=2H2O(g) ΔH=-484kJ mol-1
2008年北京奥运会“祥云”火炬的燃料 C3H8 ②C3H8(g)+5O2(g)=3CO2(g)+4H2O(g) ΔH=-2039kJ mol-1 ③2C3H8(g)+7O2(g)=6CO(g)+8H2O(g) ΔH=-2380kJ mol-1
A.3CO(g)+7H2(g)=C3H8(g)+3H2O(g) ΔH=-504kJ mol-1
B.等质量的氢气与丙烷相比较,充分燃烧时,氢气放热更多
C.3CO2(g)+10H2(g)=C3H8(g)+6H2O(g) ΔH=-381kJ mol-1
D.丙烷的燃烧热为-2039kJ mol-1
9.质量相同的氢气,分别与足量的氧气点燃充分反应,在(1)生成液态水,(2)生成水蒸气两种情况下
A.反应(1)放出的热量多 B.反应(2)放出的热量多
C.(1)、(2)放出的热量一样多 D.无法比较两个反应放出的热量
10.已知298K时,一些物质的相对能量(见图)。可根据相关物质的相对能量计算反应或变化的ΔH(ΔH随温度变化可忽略)。例如:H2O(g)H2O(l)ΔH=-286kJ·mol-1-(-242kJ·mol-1)=-44kJ·mol-1。则反应C2H6(g)+CO2(g)+H2O(g)4H2(g)+3CO(g)的ΔH为
A.+430kJ·mol-1 B.-609kJ·mol-1 C.+609kJ·mol-1 D.+389kJ·mol-1
二、填空题
11.已知拆开1 mol H—H键、1 mol I—I键、1 mol H—I键分别需要吸收的能量为436 kJ、151 kJ、299 kJ。则由氢气和碘反应生成1 mol HI需要 (填“放出”或“吸收”) kJ的热量。氢气、碘和碘化氢三种分子最稳定的是 。
12.以、为原料生产尿素[]的反应历程与能量变化示意图如下:
(1)图中的两步反应属于放热反应的△H= 。(用、、、表示,下同)
(2)根据图象写出以、为原料生产尿素[]的热化学方程式 。
(3)根据上述反应历程与能量变化示意图,过程 (填“第一步反应”或“第二步反应”)为决速步。
13.化学反应伴随能量变化,获取反应能量变化有多条途径。
(1)下列反应中,属于吸热反应的是 (填字母)。
A.Na2O与水反应 B.甲烷的燃烧反应
C.Ba(OH)2·8H2O与氯化铵反应 D.锌与盐酸反应
(2)获取能量变化的途径通过化学键的键能计算。已知:
化学键种类 H—H Cl—Cl H—Cl
键能(kJ/mol) 436 247 434
计算可得:H2(g)+Cl2(g)=2HCl(g)△H= kJ·mol-1。
(3)以CO(g)和H2(g)为原料合成甲醇,反应的能量变化如图所示。
某研究者分别以甲醇和汽油做燃料,实验测得在发动机高负荷工作情况下,汽车尾气中CO的百分含量与汽车的加速性能的关系如图所示。
据图信息分析,与汽油相比,甲醇作为燃料的优点是 。
14.(1)H2+Cl2=2HCl的反应过程如下图所示:
①根据上图填写下表:
化学键 断裂或形成1 mol 化学键时能量变化 反应中能量变化
Cl—Cl 吸收243 kJ 共吸收 kJ
H—H 吸收436 kJ
H—Cl 放出431 kJ 共放出 kJ
②该反应 (填“放出”或“吸收”) kJ热量。
(2)硅是太阳能电池的重要材料。工业冶炼纯硅的原理是:
粗硅冶炼:(a)SiO2+2CSi+2CO↑。
精炼硅:(b)Si+3HClSiHCl3+H2;
(c)SiHCl3+H2Si+3HCl。
化学反应与能量变化如图所示,回答下列问题:
①(a)是 反应,(b)是 反应,(c)是 反应(填“吸热”或“放热”)。
②反应(b)破坏反应物中的化学键所吸收的能量 (填“大于”或“小于”)形成生成物中化学键所放出的能量。
15.根据要求回答问题:
(1)如图是1 mol NO2(g)和1 mol CO(g)反应生成CO2和NO过程中的能量变化示意图,若在反应体系中加入催化剂,反应速率增大,E1的变化是 (填“增大”“减小”或“不变”,下同),ΔH的变化是 。
(2)0.1 mol Cl2与焦炭、TiO2完全反应,生成一种还原性气体和一种易水解成TiO2·xH2O的液态化合物,放热4.28 kJ,该反应的热化学方程式为 。
(3)甲醇质子交换膜燃料电池中将甲醇蒸气转化为氢气的两种反应的热化学方程式如下:
①CH3OH(g)+H2O(g)===CO2(g)+3H2(g) ΔH=+49.0 kJ·mol-1
②CH3OH(g)+O2(g)===CO2(g)+2H2(g) ΔH=-192.9 kJ·mol-1
又知③H2O(g)===H2O(l) ΔH=-44 kJ·mol-1,则甲醇蒸气燃烧为液态水的热化学方程式为 。
(4)在微生物作用的条件下,NH经过两步反应被氧化成NO。这两步的能量变化如图:
第二步反应是 反应(填“放热”或“吸热”)。1 mol NH(aq)全部氧化成NO(aq)的热化学方程式是 。
16.回答下列问题:
(1)完全燃烧生成液态水和,放出热量,写出燃烧的热化学方程式 。
(2)单斜硫和正交硫转化为的能量变化图如图。
单斜硫转化为正交硫的反应热为 ,单斜硫比正交硫的稳定性 (填“强”或“弱”)。
(3)和在一定条件下能发生反应:
已知:a、b、c均大于零
断开键所需能量为 。
17.请根据化学反应与热能的有关知识,填写下列空白:
I. (1)下列ΔH表示物质燃烧热的是 ;表示反应中和热ΔH=-57.3 kJ·mol-1的是 (填“ΔH1”“ΔH2”和“ΔH3”等)。
A.C(s)+O2(g)===CO(g) ΔH1
B.2H2(g)+O2(g)===2H2O(l) ΔH2
C.C(s)+O2(g)===CO2(g) ΔH3
D. Ba(OH)2(aq)+H2SO4(aq)=== BaSO4(s)+H2O(l) ΔH4
E.NaOH(aq)+HCl(aq)===NaCl(aq)+H2O(l) ΔH5
F.2NaOH(aq)+H2SO4(aq)===Na2SO4(aq)+2H2O(l) ΔH6
(2)化学反应的能量变化(ΔH)与反应物和生成物的键能有关(键能可以简单理解为断开1 mol化学键时所需吸收的能量),下表是部分化学键的键能数据:
化学键 P—P P—O O=O P=O
键能(kJ·mol-1) a 360 500 434
已知白磷(P4)的燃烧热为2 378 kJ·mol-1,白磷完全燃烧的产物(P4O10)的结构如上图所示,则上表中a= (保留到整数)。
II.已知2mol氢气燃烧生成液态水时放出572KJ热量,反应的热化学方程式是2H2(g)+O2(g)=2H2O(l) △H=-572KJ·mol-1。
(3)该反应生成物的能量总和 (填“大于”“小于”或“等于”)反应物的能量总和。
(4)若2mol氢气完全燃烧生成水蒸气,则放出的热量 (填“>”“<”或“=”)572KJ。
III.(5)已知16g固体硫完全燃烧时放出148.4KJ的热量,写出表示硫的燃烧热的热化学方程式: 。
(6)如图所示是1 mol NO2和CO反应生成CO2和NO过程中能量变化示意图,
请写出NO2和CO反应的热化学方程式: 。
18.已知C2H5OH(g)+3O2(g)=2CO2(g)+3H2O(g) △H1kJ·mol﹣1; H2O(g)=H2O(1) △H2kJ·mol﹣1; C2H5OH(g)=C2H5OH(1) △H3kJ·mol﹣1,若使23 g C2H5OH(1)完全燃烧生成H2O(1),则放出的热量为
19.按要求书写热化学方程式。
(1)[2022·河北,16(1)]298 K时,1 g H2燃烧生成H2O(g)放热121 kJ,1 mol H2O(l)蒸发吸热44 kJ,表示H2摩尔燃烧焓的热化学方程式为 。
(2)[2021·海南,16(1)]已知25 ℃,100 kPa时:1 mol葡萄糖[C6H12O6(s)]完全燃烧生成CO2(g)和H2O(l),放出2 804 kJ热量。则25 ℃时,CO2(g)与H2O(l)经光合作用生成葡萄糖[C6H12O6(s)]和O2(g)的热化学方程式为 。
(3)[2021·天津,13(3)]合成氨反应常使用铁触媒提高反应速率。如图为有、无铁触媒时,反应的能量变化示意图。写出该反应的热化学方程式: 。从能量角度分析,铁触媒的作用是 。
20.我国提出争取在2030年前实现碳达峰,2060年实现碳中和,这对于改善环境,实现绿色发展至关重要。如何降低大气中CO2的含量及有效地开发利用CO2引起了全世界的普遍重视。
(1)如图为C及其氧化物的变化关系图,若①变化是置换反应,则其化学方程式可以是 。
(2)把煤作为燃料可通过下列两种途径:
途径I:C(s)+O2(g)=CO2(g) △H1<0
途径II:先制成水煤气C(s)+H2O(g)=CO(g)+H2(g) △H2>0
再燃烧水煤气:
2CO(g)+O2(g)=2CO2(g) △H3<0
2H2(g)+O2(g)=2H2O(g) △H4<0
则途径I放出的热量 (填“大于”“等于”或“小于”)途径II放出的热量;△H1、△H2、△H3、△H4的数学关系式是 。
(3)我国在2004年起已利用焦炉煤气制取甲醇及二甲醚。
①已知CO中的C与O之间为三键连接,且合成甲醇的主要反应原理为CO(g)+2H2(g)=CH3OH(g) △H,表中所列为常见化学键的键能数据:
化学键 C-C C-H H-H C-O C≡O H-O
键能/kJ mol-1 348 414 436 326.8 1032 464
则该反应的△H= kJ mol-1。
②甲醇(CH3OH)也可由天然气来合成,已知:①2CH4(g)+O2(g)=2CO(g)+4H2(l) △H=-71kJ mol-1,②CO(g)+2H2(g)=CH3OH(l) △H=-90.5kJ mol-1,③CH4(g)+2O2(g)=CO2(g)+2H2O(l) △H=-890kJ mol-1,则甲醇的燃烧热为 。若CO的燃烧热为282.5kJ mol-1,则H2的燃烧热为 。
(4)金属钛冶炼过程中其中一步反应是将原料金红石转化:TiO2(金红石)+2C+2Cl2TiCl4+2CO。
已知:C(s)+O2(g)=CO2(g) △H=-393.5kJ mol-1
2CO(g)+O2(g)=2CO2(g) △H=-566kJ mol-1
TiO2(s)+2Cl2(g)=TiCl4(s)+O2(g) △H=+141kJ mol-1
则TiO2(s)+2C(s)+2Cl2(g)=TiCl4(s)+2CO(g)的△H= 。
三、实验探究题
21.为了探究化学能与热能的转化,某实验小组设计了如图所示的三套实验装置:
(1)上述3个装置中,不能证明“铜与浓硝酸反应是吸热反应还是放热反应”的是(不能用手触摸和使用温度计) 。
(2)某同学选用装置I进行实验(实验前U形管里液面左右相平),在甲试管里加入适量氢氧化钠溶液与稀盐酸,U形管中可观察到的现象是 ,说明该反应属于 (填“吸热反应”或“放热反应”)。
(3)为定量测定(2)中反应的反应热,使50mL0.50mol L-1盐酸与50mL0.55mol L-1NaOH溶液在简易量热计中进行中和反应。回答下列问题:
①该实验中NaOH的浓度大于盐酸的浓度的作用是 。
②实验中若改用60mL0.50mol L-1盐酸与50mL0.55mol L-1NaOH溶液进行反应,与上述实验相比,所求中和热 (填“相等”或“不相等”)。
(4)已知一些化学键的键能数据如表所示:
化学键 C-H C-F H-F F-F
键能/kJ mol-1 414 489 565 155
请根据键能数据估算CH4(g)和F2(g)反应生成CF4(g)和HF(g)的热化学方程式: 。
(5)已知反应:N2(g)+O2(g)=2NO(g) △H1
2H2(g)+O2(g)=2H2O(g) △H2
N2(g)+3H2(g)=2NH3(g) △H3
利用上述三个反应,计算4NH3(g)+5O2(g)=4NO(g)+6H2O(g)△H4的反应焓变为 (用含△H1、△H2、△H3的式子表示)。
22.为改变生橡胶受热发粘遇冷变硬的不良性能,工业上常将橡胶硫化来改善橡胶的性能,和均为改善橡胶性能的重要化工产品。
Ⅰ.已知下列化学键的键能及的结构式
化学键
键能() a b c
(1)已知反应:。与完全反应可放出热量,则a= (用含b,c,d的代数式表示)。
Ⅱ.资料卡片:
i.二氯化二硫常温下是一种黄红色液体,有窒息性 刺激性恶臭,熔点-80℃,沸点135.6℃;
ii.遇水强烈反应。
工业上可以用氯气和硫单质反应制得,实验室用下列装置模拟工业制取少量。
(2)制取少量
实验室可利用硫与少量氯气在110~140℃反应制得粗品。
①的电子式为 。A装置制取氯气的离子方程式为 。
②请补充完整实验装置连接顺序:A→ → →B→E→D.其中,F装置的作用是 ,D装置的作用是 。
③实验过程中,实验前和停止加热后,都需通一段时间的氮气,若停止加热后没有继续通氮气,的产率将 (填“偏高” “偏低”或“无影响”)。
(3)①遇水强烈反应,已知其中一种气体产物X能使品红溶液褪色,加热后又恢复原状,且反应过程中只有一种元素化合价发生变化,写出该反应的化学方程式 。
23.硫酸铵常温下是无色结晶或白色颗粒,无气味,280℃以上分解,500℃以上彻底分解为气体。某实验小组设计如下实验验证硫酸铵的分解产物。试回答下列问题。
(1)组装好装置加入药品前要进行的操作名称为 。
(2)当图1与图2连接后,进行实验观察到无水硫酸铜变蓝色,证明硫酸铵分解产物有 ;还观察到品红溶液褪色,KMnO4溶液紫色变浅不褪色,量气管中收集到一种气体单质(经检验该气体能使燃着的火柴熄灭),最后大试管中无固体剩余。写出KMnO4溶液紫色变浅发生反应的离子方程式: 。
(3)图1与图3连接后,可以观察到玻璃管中黑色固体变红色,玻璃管中反应的化学方程式为 。
(4)下图给出的是不同温度下13.2g硫酸铵固体加热过程中的固体质量变化。
写出290℃时硫酸铵分解的化学方程式 。350℃时分解产物的化学式为HxNySzOm,x:y:z:m= 。
(5)SO3(g)可以将NH3氧化为N2和水蒸气,SO3被还原为SO2,各物质中的平均键能数据如下表,写出该反应的热化学方程式: 。
化学键 S-O(SO3) S-O(SO2) N-H O-H N≡N
键能(kJ mol-1) a b c d e
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.B
【详解】A.书写燃烧反应的热化学方程式时可燃物必须是1 mol,故A错误;
B.书写燃烧反应的热化学方程式时可燃物一定是1 mol,反应物中C→CO2,H2→H2O(液),故B正确;
C.书写燃烧反应的热化学方程式时可燃物必须是1 mol,故C错误;
D.燃烧热指的是可燃物在氧气中的燃烧,故D错误.
2.D
【详解】由盖斯定律可知,①×3+②×2—③×2得到反应,则反应的=,故选D。
3.A
【详解】A.碳的燃烧为放热反应,焓变为负数,等量的C完全燃烧放出的热量大于不完全燃烧放出的热量,故a
C.在稀溶液中,强酸跟强碱发生中和反应生成1 mol液态水时的反应热,叫做中和热;硫酸和氢氧化钙反应生成硫酸钙的过程放热,故该反应的反应热小于2×57.3kJ/mol,且中和反应的中和热与反应物的量无关,C错误;
D.在25℃、101 kPa时,1 mol 纯物质完全燃烧生成稳定的化合物时所放出的热量,叫做该物质的燃烧热,则甲烷燃烧的热化学方程式可表示为 ,D错误;
答案选A。
4.D
【详解】A.2mol白磷燃烧放出的能量比1mol白磷的多,则曲线I代表1mol白磷,曲线II代表2mol白磷,故A错误;
B.反应物都是16gCH4完全燃烧,则反应物的总能量相同,气态水转化为液态水放出热量,则气态水的能量高,图示不正确,故B错误;
C. H2SO4和Ba(OH)2完全反应生成水的同时还生成硫酸钡,则1molH2SO4和Ba(OH)2恰好完全中和放出的热量大于1molH2SO4和NaOH恰好完全中和,则生成物的总能量不相等,故C错误;
D.已知石墨比金刚石稳定,说明石墨能量低,则1mol石墨完全燃烧释放的能量小于1mol金刚石完全燃烧释放的能量,故曲线I代表金刚石,曲线II代表石墨,故D正确;
故选:D。
5.C
【详解】A.由图像可知A→B的反应,反应物总能量小于生成物总能量,反应吸热,B→C的反应,反应物的总能量大于生成物总能量,反应为放热反应,选项A错误;
B.加入催化剂,只改变反应的活化能,不改变反应热,选项B错误;
C.物质的总能量越低,越稳定,由图像可知C能量最低最稳定,选项C正确;
D.整个反应中△H=△HA→B+△HB→C=E1-E2+E3-E4,选项D错误;
答案选C。
6.C
【详解】设混合气中H2的物质的量为n,则C3H8的物质的量为5mol-n.根据题意,列方程为:
300kJ·mol-1×n+2000.0kJ·mol-1×(5mol-n)=5000kJ,解得 n=50/17mol;C3H8的物质的量为5mol-50/17mol=35/17mol,所以混合气体中H2与C3H8的体积比即物质的量之比为50/17 mol∶35/17mol=10∶7,故C正确。
故选C。
7.D
【详解】由盖斯定律可知,可得甲烷与二氧化氮反应的热化学方程式,则△H===867kJ/mol,3.2g甲烷的物质的量为0.2mol,由热化学方程式可知,0.2mol甲烷与二氧化氮反应放出的热量为0.2mol×867kJ/mol=173.4 kJ,故选D。
8.D
【详解】A.根据盖斯定律,①×-③可得3CO(g)+7H2(g)=C3H8(g)+3H2O(g) ΔH=(-484) ×-(-2380)=-504kJ/mol,故A正确;
B.由2H2(g)+O2(g)=2H2O(g) ΔH=-484kJ/mol可知4g氢气反应放出484kJ热量,由C3H8(g)+5O2(g)=3CO2(g)+4H2O(g) ΔH=-2039kJ/mol可知44g丙烷反应放出2039kJ热量,则4g丙烷反应放出185.4kJ热量,因此等质量的氢气与丙烷相比较,充分燃烧时,氢气放热更多,故B正确;
C.根据盖斯定律,①×5-②可得3CO2(g)+10H2(g)=C3H8(g)+6H2O(g) ΔH=5×(-484kJ/mol)-(- 2039kJ/mol)=-381kJ/mol,故C正确;
D.丙烷的燃烧热是指1mol丙烷完全燃烧生成二氧化碳与液态水放出热量,C3H8(g)+5O2(g)=3CO2(g)+4H2O(g) ΔH=-2039kJ/mol为生成气态水,则丙烷的燃烧热不是2039kJ/mol,故D错误;
故选D。
9.A
【详解】由于气态水的能量高于液态水的能量,所以氢气完全燃烧生成液态水时放热多,答案选A。
10.D
【详解】ΔH=生成物的总能量-反应物的总能量,则反应C2H6(g)+CO2(g)+H2O(g)4H2(g)+3CO(g)的ΔH=4×0+3×(-110kJ·mol-1)-( -84kJ·mol-1)- ( -393kJ·mol-1)- ( -242kJ·mol-1)=+389kJ·mol-1,故D正确;
故选D。
11. 放出 5.5 H2
【详解】反应热等于反应物中键能之和与生成物中键能之和的差值,则根据反应H2+I2=2HI可知形成2 molHI的反应热△H=(436 kJ/mol+151 kJ/mol) -2×299kJ/mol=-11 kJ/mol,反应为放热反应,所以由氢气和碘反应生成1 mol HI放出热量为5.5kJ。H—H键、I—I键、H—I键键能分别为436 kJ/mol、151 kJ/mol、299 kJ/mol。键能越大,分子越稳定,三种物质中键能最大的是H2,故H2分子最稳定。故答案为:放出;5.5;H2。
12.(1)
(2)
(3)第二步反应
【详解】(1)放热反应,反应物能量大于生成物能量,由图示可知,第一步反应是放热反应,故放热反应的 ;
(2)将第一步和第二步两步方程式相加得到氨气和二氧化碳气体为原料,合成尿素的热化学方程式2NH3(g)+CO2(g)=CO(NH2)2(s)+H2O(g) ΔH=Ea1 Ea2+Ea3 Ea4 kJ mol 1;
(3)反应的速率主要取决于最慢的反应,最慢的反应主要是反应物活化能大,所以第二步反应为决速步。
13. C -185 汽车的加速性能相同的情况下,CO排放量低,污染小
【详解】(1)常见的放热反应有:所有的物质燃烧、所有金属与酸反应、金属与水反应,所有中和反应、绝大多数化合反应和铝热反应等;常见的吸热反应有:绝大数分解反应,个别的化合反应(如C和CO2),少数分解、置换以及某些复分解(如铵盐和强碱);即A、B、D均为放热反应,C为吸热反应,故选C;
(2)ΔH=反应物键能之和-生成物键能之和,所以该反应的ΔH=436kJ/mol+247kJ/mol-2×434kJ/mol=-185kJ/mol;
(3)据图可知,当汽车的加速性能相同的情况下,甲醇作为燃料时CO排放量低,污染小。
14. 679 862 放出 183 吸热 放热 吸热 小于
【详解】(1)①断开H-H、Cl-Cl键,通过题目数据可知,共吸收243+436=679 kJ热量,形成H-Cl键共放出431+431=862kJ热量。
②根据放出和吸收热量数值的比较,可知该反应放出862-679=183 kJ热量。
(2)①根据化学反应与能量变化图可知,(a)是吸热反应,(b)是放热反应,(c)是吸热反应。
②反应(b)是个放热反应,所以破坏反应物中的化学键所吸收的能量小于形成生成物中化学键所放出的能量。
15. 减小 不变 2Cl2(g)+ TiO2(s)+2C(s)===TiCl4(l)+2CO(g) ΔH= 85.6 kJ·mol 1 CH3OH(l)+3/2O2(g)=CO2(g)+2H2O(l)△H=-764.7 kJ·mol-1 放热 NH(aq)+O2(g)===NO(aq)+2H+(aq)+H2O(l) ΔH=-273 kJ/mol
【详解】(1)加入催化剂能降低反应所需的活化能,则E1和E2都减小,催化剂不能改变反应物的总能量和生成物的总能量之差,即反应热不改变,所以催化剂对反应热无影响。E1的变化是减小,ΔH的变化是不变;(2)0.1 mol Cl2与焦炭、TiO2完全反应,生成一种还原性气体HCl和一种易水解成TiO2·xH2O的液态化合物TiCl4(l),放热4.28 kJ,反应方程式为2Cl2(g)+ TiO2(s)+2C(s)===TiCl4(l)+2CO(g),0.1 mol Cl2反应放热4.28 kJ,2 mol Cl2反应放热4.28 kJ×2/0.1=85.6 kJ,该反应的热化学方程式为2Cl2(g)+ TiO2(s)+2C(s)===TiCl4(l)+2CO(g) ΔH= 85.6 kJ·mol 1 ;(3)利用盖斯定律进行计算,①CH3OH(g)+H2O(g)===CO2(g)+3H2(g) ΔH=+49.0 kJ·mol-1,②CH3OH(g)+O2(g)===CO2(g)+2H2(g) ΔH=-192.9 kJ·mol-1,又知③H2O(g)===H2O(l) ΔH=-44 kJ·mol-1,依据盖斯定律计算(②×3-①×2+③×2)得:CH3OH(l)+3/2O2(g)=CO2(g)+2H2O(l)△H=3×(-192.9 kJ·mol-1)-2×49.0 kJ·mol-1+(-44 kJ·mol-1)×2=-764.7 KJ·mol-1;则甲醇蒸气燃烧为液态水的热化学方程式为:CH3OH(l)+3/2O2(g)=CO2(g)+2H2O(l)△H=-764.7 KJ·mol-1;(4)由图可知,第二步反应反应物能量高于生成物能量,是放热反应;由图可知,第一步热化学反应为NH4+(aq)+1.5O2(g)=2H+(aq)+NO2-(aq)+H2O(l)△H=-273 kJ·mol-1,即1 mol NH(aq)全部氧化成NO(aq)的热化学方程式。
16.(1)CH4(g) + 2O2(g) = CO2(g) + 2H2O(l) △H=-889.6kJ/mol
(2) -0.33 弱
(3)
【详解】(1)据题意可知1molCH4完全燃烧生成液态水和CO2,放出889.6kJ热量,故热化学方程式为:CH4(g) + 2O2(g) = CO2(g) + 2H2O(l) △H=-889.6kJ/mol;
(2)32g硫即为1mol硫,据图并结合盖斯定律可知1mol单斜硫转化为正交硫的反应热=-297.16kJ/mol-(-296.83kJ/mol)=-0.33kJ/mol;物质所具备的能量越低稳定性越强,故单斜硫的稳定性弱于正交硫;
(3)焓变等于反应物的总键能-生成物的总键能,设H-I键的键能为x,列式:b+c-2x=-a,解得x=。
17. ΔH3 ΔH5 196 小于 < S(s)+O2(g)=SO2(g) △H=-296.8kJ·mol-1 NO2(g)+CO(g)===CO2(g)+NO(g) ΔH=-234 kJ/mol
【详解】I.(1)根据燃烧热的定义:1mol可燃气体完全燃烧生成稳定的氧化物放出的热量,即属于燃烧热的是△H3;根据中和热的定义:酸与碱反应生成1mol水时放出的热量,即属于中和热的是△H5;
(2)根据△H等于反应物键能总和-生成物键能总和,△H=(6×a+5×500-12×360-4×434)=-2378kJ·mol-1,解得a=196kJ·mol-1;II.考查化学能与热能的转化,
(3)因为△H<0,说明此反应是放热反应,即反应物的总能量大于生成物的总能量,即反应生成物的总能量小于反应物的能量总和;
(4)液态水转化成水蒸气需要吸收热量,因此2mol氢气完全燃烧生辰水蒸气,放出的热量<572kJ;
III.(5)1molS完全燃烧放出的热量是kJ=296.8kJ,因此硫燃烧热的热化学方程式为 S(s)+O2(g)=SO2(g) △H=-296.8kJ·mol-1;
(6)NO2和CO反应的化学方程式为:NO2+CO=CO2+NO,根据能量与过程的图象,则热化学反应方程式为NO2(g)+CO(g)=CO2(g)+NO(g) ΔH=-234 kJ·mol-1。
【点睛】本题的易错点是燃烧热和中和热,根据燃烧热的定义,是1mol可燃物完全燃烧生成稳定的氧化物放出的热量,C生成CO2,S→SO2,H转化成液态水,A中生成的是CO,△H1不表示燃烧热,B中氢气是2mol,不是1mol,△H2不表示燃烧热,C、符合燃烧热的定义,△H3表示燃烧热;同理中和热也可以根据定义分析。
18.【答题空1】-(△H1-△H3+3△H2)/2 kJ
【详解】①C2H5OH(g)+3O2(g)=2CO2(g)+3H2O(g),△H1kJ/mol;②H2O(g)=H2O(1)△H2kJ/mol;③C2H5OH(g)=C2H5OH(1)△H3kJ/mol,根据盖斯定律,①-③-3②得到:C2H5OH(l)+3O2(g)=2CO2(g)+3H2O(l),△H=△H1-△H3+3△H2kJ/mol;23 g C2H5OH(1)(物质的量为0.5mol)完全燃烧时,放出的热量为-(△H1-△H3+3△H2)/2kJ;
【点睛】放热反应时,△H<0,热量值为正值,则-△H为正值。
19.(1)H2(g)+O2(g)=H2O(l) ΔH=-286 kJ·mol-1
(2)6CO2(g)+6H2O(l)=C6H12O6(s)+6O2(g) ΔH=+2 804 kJ·mol-1
(3) N2(g)+3H2(g)2NH3(g) ΔH=-(a-b) kJ·mol-1 降低反应的活化能
【详解】(1)298 K时,1 g H2燃烧生成H2O(g)放热121 kJ,1 mol H2O(l)蒸发吸热44 kJ,则1 mol H2燃烧生成1 mol H2O(l)放热286 kJ,表示H2摩尔燃烧焓的热化学方程式为H2(g)+O2(g)=H2O(l) ΔH=-286 kJ·mol-1;
(2)已知25 ℃,100 kPa时:1 mol葡萄糖[C6H12O6(s)]完全燃烧生成CO2(g)和H2O(l),放出2 804 kJ热量,CO2(g)与H2O(l)经光合作用生成葡萄糖[C6H12O6(s)]和O2(g)为葡萄糖燃烧的逆过程,反应热化学方程式:6CO2(g)+6H2O(l)=C6H12O6(s)+6O2(g) ΔH=+2 804 kJ·mol-1;
(3)根据能量变化图,可得热化学方程式:N2(g)+3H2(g)2NH3(g) ΔH=-(a-b) kJ·mol-1,从能量角度分析,铁触媒降低的反应的活化能;
20.(1)C+CuOCu+CO↑
(2) 等于 △H1=△H2+(△H3+△H4)
(3) -128.8 764kJ mol-1 286kJ mol-1
(4)-80kJ mol-1
【详解】(1)①是置换反应可以是碳和水蒸气反应生成一氧化碳和氢气,或与金属氧化物反应,反应的化学方程式为C+CuOCu+CO↑;
(2)根据盖斯定律可知,①=②+③×+④×,所以途径I放出的热量等于途径II放出的热量;ΔH1=ΔH2+(ΔH3+ΔH4);
(3)通过键能计算焓变,反应物总键能 生成物总键能,则反应的(1032+2×436-3×414-326.8-464)= -128.8;
根据盖斯定律,(③×2-①)÷2得:CO(g)+2H2(g)+O2(g)===CO2(g)+2H2O(l) ΔH=-854.5 kJ·mol-1④,④-②得:CH3OH(l)+O2(g)===CO2(g)+2H2O(l) ΔH=-764 kJ·mol-1,故甲醇的燃烧热为764 kJ·mol-1;
CO的燃烧热为282.5kJ mol-1,CO(g)+O2(g)===CO2(g) ΔH=-282.5 kJ·mol-1⑤,
④-⑤得2H2(g)+O2(g)=== 2H2O(l) ΔH=-572 kJ·mol-1,故氢气的燃烧热为286 kJ·mol-1;
(4)已知:反应I:C(s)+O2(g)=CO2(g) △H1=﹣393.5kJ mol-1,反应II:2CO(g)+O2(g)=2CO2(g) △H2=﹣566kJ mol-1,反应III:TiO2(s)+2Cl2(g)=TiCl4(s)+O2(g) △H3=+141kJ mol-1,目标反应TiO2(s)+2Cl2(g)+2C(s)=TiCl4(s)+2CO(g)可由III+2I-II,根据盖斯定律可知△H=△H3+2△H1-△H2=(+141kJ mol-1)+2×(﹣393.5kJ mol-1)-( ﹣566kJ mol-1)=-80 kJ mol-1。
21.(1)III
(2) 左端液柱降低,右端液柱升高 放热反应
(3) 保证盐酸完全被中和,使生成水的量更精确 相等
(4)CH4(g)+4F2(g)=CF4(g)+4HF(g) ΔH=-1940kJ mol-1
(5)2ΔH1+3ΔH2-2ΔH3
【详解】(1)III是个敞开体系,无法形成压强差,水不会发生倒吸
(2)该反应放热使空气受热膨胀,则U型管内左边液面下降,右边液面升高
(3)①实验中氢氧化钠稍稍过量,目的是保证盐酸完全被中和,使生成水的量更精确;
②中和热数值不会发生变化,故两者所求中和热相等。
(4)先写方程式CH4 (g)+4F2(g)=CF4(g)+4HF(g) ,该反应的反应热为4 ×414kJ mol-1+4×155kJ mol-1-4×565kJ mol-1-×489kJ mol-1=-1940kJ mol-1,故热化学方程式为:CH4(g)+4F2(g)=CF4(g)+4HF(g) ΔH=-1940kJ mol-1。
(5)根据盖斯定律,反应2乘以3-反应3乘以2得到3O2(g)+4NH3(g)=6H2O(g)+2N2(g),再加上反应1乘以2,即得到4NH3(g)+5O2(g)=4NO(g)+6H2O(g),则该反应的焓变为2ΔH1+3ΔH2-2ΔH3
22.(1)
(2) F C 除去气体 吸收空气中的水蒸气和尾气处理 偏低
(3)
【分析】A制取氯气,含有HCl和水蒸气,F装置的作用是除去气体,C是干燥氯气,B是在110~140℃反应制得粗品,E是收集产品,D装置的作用是吸收空气中的水蒸气和尾气处理。
【详解】(1)由反应:,与完全反应可放出热量, 拆开化学键吸热4aKJ+4cKJ,形成化学键放热8bKJ,8b-4a-ac=d,则a=(用含b,c,d的代数式表示)。故答案为:;
(2)①的电子式为。A装置二氧化锰和浓盐酸反应制取氯气,离子方程式为。故答案为:;;
②A制取氯气,含有HCl和水蒸气,F装置的作用是除去气体,C是干燥氯气,B是在110~140℃反应制得粗品,E是收集产品,D装置的作用是吸收空气中的水蒸气和尾气处理,实验装置连接顺序:A→F→C→B→E→D,故答案为:F;C;除去气体;吸收空气中的水蒸气和尾气处理;
③实验过程中,实验前和停止加热后,都需通一段时间的氮气,若停止加热后没有继续通氮气,装置中的没有赶入E中,的产率将偏低(填“偏高” “偏低”或“无影响”)。故答案为:偏低;
(3)①遇水强烈反应,已知其中一种气体产物X能使品红溶液褪色,加热后又恢复原状,X为二氧化硫,且反应过程中只有一种元素化合价发生变化,S由+1价变为+4价和0价,该反应的化学方程式。故答案为:。
23.(1)检查装置气密性
(2) 水 2MnO+2H2O+5SO2=2Mn2++5SO+4H+
(3)2NH3+3CuO3Cu+N2+3H2O
(4) (NH4)2SO4NH4HSO4+NH3↑ 8:2:2:7
(5)3SO3(g)+2NH3(g)=N2(g)+3H2O(g)+3SO2(g) ΔH=(9a+6c-e-6d-6b) kJ mol-1
【分析】硫酸铵分解生成的产物首先通过无水硫酸铜检验水蒸气,浓硫酸吸收氨气,品红溶液检验二氧化硫,酸性高锰酸钾溶液除去二氧化硫,最后测量剩余气体的体积,据此解答。
【详解】(1)反应中有气体生成,因此组装好装置加入药品前要进行的操作名称为检查装置气密性;
(2)实验中观察到无水硫酸铜变蓝色,证明硫酸铵分解产物有水生成;还观察到品红溶液褪色,KMnO4溶液紫色变浅不褪色,说明还有二氧化硫生成,量气管中收集到一种气体单质(经检验该气体能使燃着的火柴熄灭),说明气体是氮气,最后大试管中无固体剩余。KMnO4溶液紫色变浅是因为被二氧化硫还原,发生反应的离子方程式为2MnO+2H2O+5SO2=2Mn2++5SO+4H+;
(3)图1与图3连接后,可以观察到玻璃管中黑色固体变红色,说明氨气还原氧化铜,则玻璃管中反应的化学方程式为2NH3+3CuO3Cu+N2+3H2O;
(4)13.2g硫酸铵的物质的量是13.2g÷132g/mol=0.1mol,290℃时固体质量减少13.2g-11.5g=1.7g,说明生成0.1mol氨气,则硫酸铵分解的化学方程式为(NH4)2SO4NH4HSO4+NH3↑。从290℃到350℃时固体质量又减少11.5g-10.6g=0.9g,恰好是0.05mol水,290℃时固体是0.1mol NH4HSO4,根据原子守恒可知属于物质中H、N、S、O的物质的量分别是0.4mol、0.1mol、0.1mol、0.35mol,若分解产物的化学式为HxNySzOm,则x:y:z:m=0.4mol:0.1mol:0.1mol:0.35mol=8:2:2:7;
(5)SO3(g)可以将NH3氧化为N2和水蒸气,SO3被还原为SO2,方程式为3SO3+2NH3=N2+3H2O+3SO2,则焓变ΔH=(9a+6c-e-6d-6b) kJ mol-1,所以该反应的热化学方程式为3SO3(g)+2NH3(g)=N2(g)+3H2O(g)+3SO2(g) ΔH=(9a+6c-e-6d-6b) kJ mol-1。
答案第1页,共2页
答案第1页,共2页
