二轮专题 离子反应课件(共42张PPT)
文档属性
| 名称 | 二轮专题 离子反应课件(共42张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 2.4MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-11-19 22:52:03 | ||
图片预览








文档简介
(共42张PPT)
专题 离子反应
2024
考情分析
高考命题分析
命 题 情 境 (1)日常生活情境:以日常生活中实例(如酿醋、食品膨松剂、环境消毒等)为载体,考查氧化还原反应的概念及相互关系。
(2)生产环保情境:以工业生产中反应原理、环境保护中物质的反应和转化等为载体,考查氧化还原反应的概念、规律及应用,以及离子方程式等。
(3)实验探究情境:以化学实验原理及物质的转化等为载体,考查氧化还原反应的概念、规律及简单计算,离子反应的应用等。
素 养 能 力 (1)分析与推测能力:判断物质组成与结构,分析物质的性质及反应,结合离子反应实质,判断离子方程式的正误或离子能否大量共存。
(2)理解与辨析能力:基于反应原理或事实,辨析氧化还原反应相关概念,从文本中获取有关信息,解决氧化还原反应的概念及关系、规律及应用等问题。
(3)思维方法:基于证据从离子反应和氧化还原反应角度对物质组成、结构及其变化进行分析,解释化学反应的本质和规律;基于已有模型或构建模型阐释物质结构、化学变化规律或转化过程,解释化学问题。
考题统计
(1)离子方程式的正误判断书写:
湖南卷(2023),广东卷(2022、2021),浙江卷(2023、2022、2021、2020),辽宁卷(2021),北京卷(2023、2021),湖北卷(2022、2021),天津卷(2020)
(2)溶液中离子共存的判断:
重庆卷(2022),湖北卷(2022),天津卷(2021),福建卷(2021),湖南卷(2021),江苏卷(2020)
聚焦核心要点
要点1离子反应发生的条件及应用
课标指引:1.通过实验事实认识离子反应及其发生的条件。 2.了解常见离子的检验方法。
1.规避离子共存的题设“陷阱”
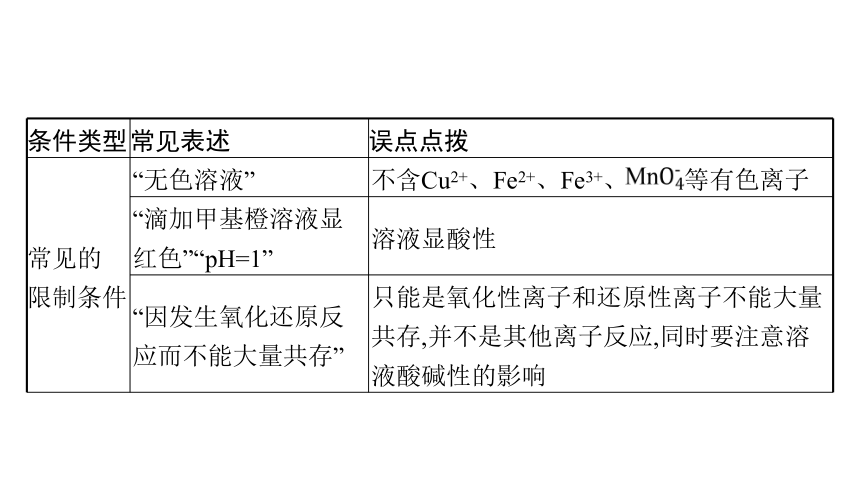
条件类型 常见表述 误点点拨
题设要求 ①“一定大量共存” ②“可能大量共存” ③“不能大量共存” 审清关键词
条件类型 常见表述 误点点拨
常见的 限制条件 “无色溶液” 不含Cu2+、Fe2+、Fe3+、 等有色离子
“滴加甲基橙溶液显红色”“pH=1” 溶液显酸性
“因发生氧化还原反应而不能大量共存” 只能是氧化性离子和还原性离子不能大量共存,并不是其他离子反应,同时要注意溶液酸碱性的影响
条件类型 常见表述 误点点拨
常见隐 含条件 “与Al反应放出H2” 溶液可能显强酸性或强碱性
“由水电离出的 c(H+)=1×10-12 mol·L-1”的溶液 溶液可能显强酸性或强碱性
含有大量Fe3+的溶液 酸性溶液并具有强氧化性
含有大量 的溶液 隐含H+与还原性离子不能同时大量共存
相互促 进水解 相互促进水解,生成沉淀或气体,不能大量共存
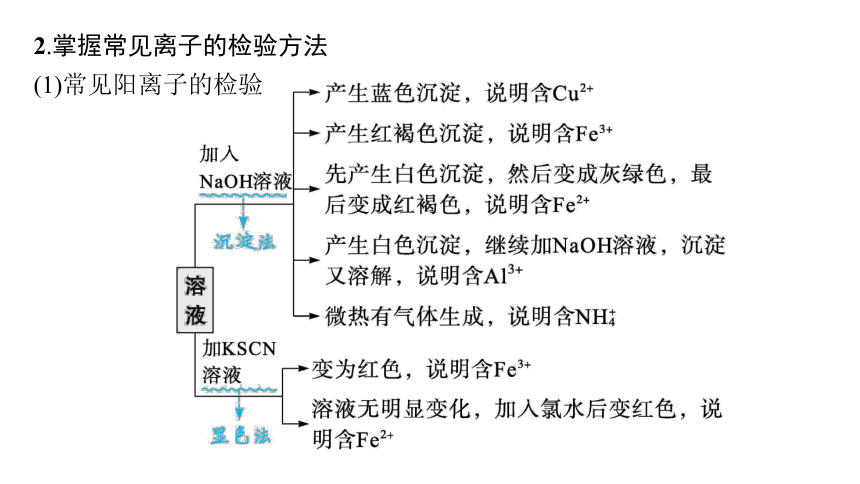
2.掌握常见离子的检验方法
(1)常见阳离子的检验
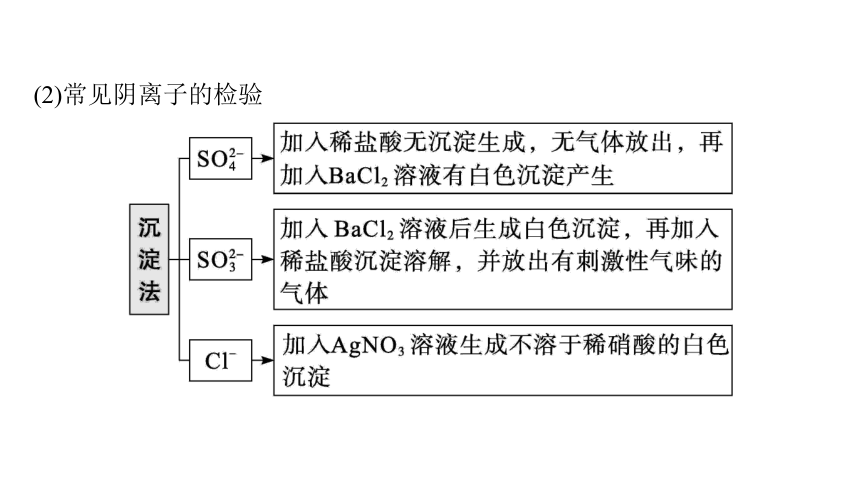
(2)常见阴离子的检验
易错辨析
×
Al3+与NH3·H2O反应产生Al(OH)3沉淀,不产生 。
√
3.Na+、Fe3+、 、H2O2能大量共存。( )
4.将铁锈溶于浓盐酸,再滴入KMnO4溶液,紫色褪去,说明铁锈中含有二价铁。( )
×
Fe3+可催化H2O2分解,不能大量共存。
×
浓盐酸也能与KMnO4发生反应,使溶液紫色褪去。
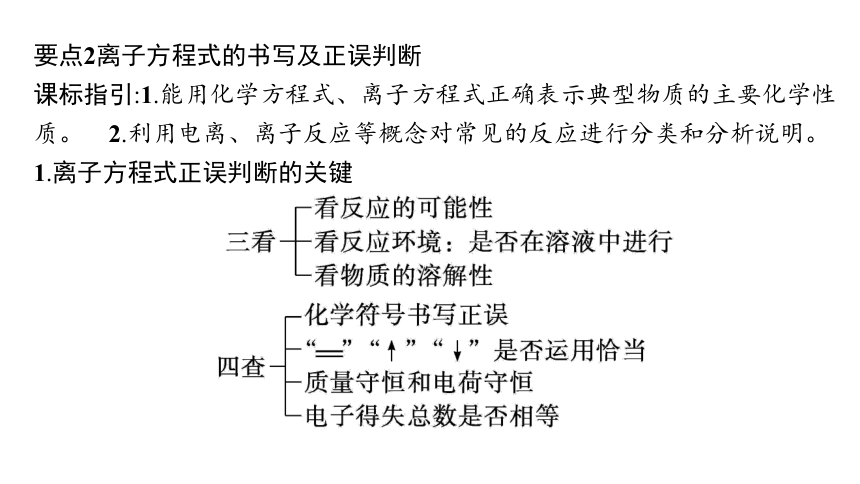
要点2离子方程式的书写及正误判断
课标指引:1.能用化学方程式、离子方程式正确表示典型物质的主要化学性质。 2.利用电离、离子反应等概念对常见的反应进行分类和分析说明。
1.离子方程式正误判断的关键
2.建立与量有关的离子方程式书写的思维模型
易错辨析
试判断下列离子方程式的正误。
√
×
铁和稀硝酸反应制得浅绿色溶液,离子方程式:3Fe+8H++2 ══ 3Fe2++2NO↑+4H2O。
3.向偏铝酸钠溶液中通入过量的CO2:
向偏铝酸钠溶液中通入过量的CO2,离子方程式:
×
同浓度同体积的NH4HSO4溶液与NaOH溶液混合,离子方程式:H++OH- ══ H2O。
×
精研核心命题
命题点1离子方程式的正误判断
典例1 (2023·浙江1月选考卷)下列反应的离子方程式不正确的是( )
D
解析 由于酸性:H2SO3变式演练(2023·浙江十校联盟高三联考)下列离子方程式不正确的是( )
C
命题点2离子共存的判断
典例2 (2022·湖北卷)下列各组离子在给定溶液中能大量共存的是( )
C
变式演练(2023·天津河西区一模)下列各组离子在指定溶液中能大量共存的是( )
D
解析 含Cu2+的溶液显蓝色,则无色溶液中Cu2+不能大量存在,A错误;酸性溶液中含大量H+,H+与ClO-结合生成弱电解质HClO,不能大量共存,B错误;碱性溶液中含大量OH-,Al3+与OH-反应而不能大量共存,C错误;KNO3溶液中含K+、 ,与Mg2+、Cl-、 相互不反应,可以大量共存,D正确。
【思维建模】
解答离子能否大量共存判断类题目的方法
(1)审清题目要求中的关键词语,如“一定大量共存”“可能大量共存”或“不能大量共存”等。
(2)考虑指定微粒(或物质)对溶液的酸碱性、氧化性和还原性的影响,如:
(3)正确分析水的电离程度:当由水电离出的c(H+)或c(OH-)小于1×10-7 mol·L-1时,水的电离受到抑制,溶液可能为酸性溶液或碱性溶液;当由水电离出的c(H+)或c(OH-)大于1×10-7 mol·L-1时,水的电离得到促进,溶液可能为弱酸盐溶液或弱碱盐溶液。
(4)综合考虑题给限制条件及离子之间的反应,对选项进行合理的判断。
命题点3离子的检验与物质推断
典例3 (2022·全国乙卷)某白色粉末样品,可能含有Na2SO4、Na2SO3、Na2S2O3和Na2CO3。取少量样品进行如下实验:
①溶于水,得到无色透明溶液。
②向①的溶液中滴加过量稀盐酸,溶液变浑浊,有刺激性气体逸出。离心
分离。
③取②的上层清液,向其中滴加BaCl2溶液有沉淀生成。
该样品中确定存在的是( )
A.Na2SO4、Na2S2O3 B.Na2SO3、Na2S2O3
C.Na2SO4、Na2CO3 D.Na2SO3、Na2CO3
A
解析 (1)①取少量样品溶于水得到无色透明溶液,说明固体溶于水且相互之间能大量共存。向①的溶液中滴加过量稀盐酸,溶液变浑浊,有刺激性气体放出,说明固体中存在Na2S2O3,发生反应:Na2S2O3+2HCl ══ 2NaCl+S↓+SO2↑+H2O,离心分离。(2)取②的上层清液,向其中滴加BaCl2溶液,有沉淀生成,则沉淀为BaSO4,说明固体中存在Na2SO4,不能确定是否有Na2SO3和Na2CO3,因为Na2SO3与过量盐酸反应生成二氧化硫,Na2CO3与过量盐酸反应生成二氧化碳,而这些现象可以被Na2S2O3与过量盐酸反应的现象掩盖,故该样品中确定存在的是Na2SO4和Na2S2O3。
思路剖析解答本题的思路如下:
实验 实验操作及现象 判断与结论
① 溶于水,得到无色透明溶液 四种钠盐均易溶于水
② 滴加过量稀盐酸,溶液变浑浊,有刺激性气体逸出 推测反应产生S和SO2,样品中含有Na2S2O3
③ 取②的上层清液,向其中滴加BaCl2溶液有沉淀生成 推测沉淀为BaSO4,样品中含有Na2SO4
变式演练(2023·河南濮阳一模)有一包固体粉末,由NaOH、Na2SO3、MgCl2、CaCO3、Ba(NO3)2、FeSO4中的几种组成,取少量样品进行如下实验:
①将样品加入水中,得到白色不溶物a和无色溶液
②向①中加入足量稀盐酸,产生气体,仍存在不溶物
该固体粉末一定含有的是( )
A.CaCO3、Ba(NO3)2
B.CaCO3、Na2SO3
C.Na2SO3、Ba(NO3)2
D.CaCO3、Na2SO3、Ba(NO3)2
C
解析 将样品加入水中,得到白色不溶物a和无色溶液,说明无FeSO4,白色沉淀可能是Mg(OH)2、CaCO3、BaSO3中的一种或几种。向①中加入足量稀盐酸,产生气体,仍存在不溶物,BaSO3在酸性条件下能被 氧化为BaSO4,同时产生NO气体,且BaSO3还能与HCl反应放出气体SO2,故原固体中一定含有Ba(NO3)2和Na2SO3,可能含有NaOH、MgCl2、CaCO3,一定不含FeSO4。
【思维建模】
解答离子的检验与物质推断类题目的方法
解答此类题目要抓住“四项基本原则”,防止出现“过检”或“漏检”等现象。
肯定性 原则 根据实验现象推出溶液中肯定存在或肯定不存在的离子(记住常见的有色离子:Fe2+、Fe3+、Cu2+、 )
互斥性 原则 在肯定某些离子的同时,结合离子共存规律,否定一些离子存在(要注意题目中的隐含条件,如酸性、碱性、指示剂的变化、与铝反应产生氢气、水的电离情况等)
电中性 原则 溶液呈电中性,一定既有阳离子、又有阴离子,且溶液中正、负电荷总数相等(利用这一原则可确定一些隐含的离子)
进出性 原则 通常是在实验过程中使用,是指在实验过程中反应生成的离子或引入的离子对后续实验的干扰
训练分层落实
练真题·明考向
1.(2023·北京卷)下列离子方程式与所给事实不相符的是( )
A.Cl2制备84消毒液(主要成分是NaClO):Cl2+2OH- ══ Cl-+ClO-+H2O
B.食醋去除水垢中的CaCO3:CaCO3+2H+ ══ Ca2++H2O+CO2↑
C.利用覆铜板制作印刷电路板:2Fe3++Cu ══ 2Fe2++Cu2+
D.Na2S去除废水中的Hg2+:Hg2++S2- ══ HgS↓
B
解析 食醋为弱酸,不能拆写为离子,正确的离子方程式应为2CH3COOH+CaCO3 ══ Ca2++2CH3COO-+CO2↑+H2O,B错误。
2.(2023·湖南卷)下列有关电极方程式或离子方程式错误的是( )
A.碱性锌锰电池的正极反应:MnO2+H2O+e- ══ MnO(OH)+OH-
B.铅酸蓄电池充电时的阳极反应:Pb2++2H2O-2e- ══ PbO2+4H+
C.K3[Fe(CN)6]溶液滴入FeCl2溶液中:K++Fe2++[Fe(CN)6]3- ══ KFe[Fe(CN)6]↓
D.TiCl4加入水中:TiCl4+(x+2)H2O ══ TiO2·xH2O↓+4H++4Cl-
B
解析 铅酸蓄电池充电时的阳极反应为PbSO4+2H2O-2e- ══ PbO2+4H++ ,B错误。
3.(2023·浙江6月选考卷)下列反应的离子方程式正确的是( )
A.碘化亚铁溶液与等物质的量的氯气:2Fe2++2I-+2Cl2 ══ 2Fe3++I2+4Cl-
B.向次氯酸钙溶液通入足量二氧化碳:ClO-+CO2+H2O ══ HClO+
C.铜与稀硝酸:Cu+4H++2 ══ Cu2++2NO2↑+2H2O
D.向硫化钠溶液通入足量二氧化硫:S2-+2SO2+2H2O ══ H2S+2
B
解析 碘化亚铁溶液与等物质的量的氯气,碘离子与氯气恰好完全反应:
2I-+Cl2 ══ I2+2Cl-,A错误;铜与稀硝酸反应生成硝酸铜、一氧化氮和水: 3Cu+8H++2 ══ 3Cu2++2NO↑+4H2O,C错误;向硫化钠溶液通入足量二氧化硫,溶液变浑浊,溶液中生成亚硫酸氢钠:2S2-+5SO2+2H2O ══ 3S↓+4 ,D错误。
4.(2022·重庆卷)下列操作中,不会影响溶液中K+、Al3+、Fe3+、Ba2+、Cl-、
等离子大量共存的是( )
A.加入ZnSO4 B.加入Fe粉
C.通入NH3 D.通入CO2
D
练易错·避陷阱
5.(2023·四川内江一模)常温下,下列溶液中一定能大量共存的离子组是
( )
A
6.(2023·辽宁辽阳一模)下列离子方程式书写错误的是( )
A.在Cu(OH)2浊液中加入浓氨水得到深蓝色溶液:Cu(OH)2+4NH3·H2O ══[Cu(NH3)4]2++2OH-+4H2O
B.向溴水中滴加乙醛溶液,溶液酸性增强:CH3CHO+Br2+H2O ―→ CH3COOH+2H++2Br-
C.向稀硝酸中加入少量Cu2O粉末,溶液变蓝:Cu2O+2H+ ══ Cu+Cu2++H2O
D.向补血剂的溶液中滴加K3[Fe(CN)6]溶液,产生蓝色沉淀: K++Fe2++[Fe(CN)6]3- ══KFe[Fe(CN)6]↓
C
解析 铜单质能与稀硝酸反应生成硝酸铜,最终不会存在铜单质,C错误。
7.下列物质的性质实验对应的离子方程式书写正确的是( )
A.铁与稀硫酸反应:2Fe+6H+ ══ 2Fe3++3H2↑
B.CuCl2溶液中通入硫化氢:Cu2++S2- ══ CuS↓
D
8.下列微粒在所给条件下,能大量共存的是( )
D
9.某白色固体样品,可能含有KNO3、Na2CO3、Na2SO4、BaCl2、SiO2中的一种或几种。对该样品进行如下实验:
①取少量固体加入足量水中,固体部分溶解;
②取①中滤液进行焰色试验,透过蓝色钴玻璃未观察到紫色;
③取①中滤渣,向其中加入足量的盐酸,产生气泡,固体部分溶解。
下列说法不正确的是( )
A.固体粉末中一定不含KNO3
B.固体粉末中一定含有BaCl2和Na2CO3
C.取①中滤液,加入硝酸酸化的Ba(NO3)2溶液,若未产生白色沉淀,则样品中无Na2SO4
D.为进一步确定原样品组成,可以向③未溶解的固体中加入KOH溶液
C
解析 ①取少量固体加入足量水中,固体部分溶解,不溶性物质可能为BaCO3、BaSO4、SiO2;②取①中滤液进行焰色试验,透过蓝色钴玻璃未观察到紫色,滤液中不存在K+,说明样品中一定没有KNO3;③取①中滤渣,向其中加入足量的盐酸,产生气泡,固体部分溶解,BaCO3溶于盐酸,可知样品中存在Na2CO3和BaCl2,无法确定未溶解的物质是BaSO4还是SiO2,或者二者均有。固体粉末中一定不含KNO3,A正确;固体粉末中一定含有BaCl2和Na2CO3,B正确;取①中滤液,加入硝酸酸化的Ba(NO3)2溶液,若未产生白色沉淀,有可能是加水溶解时,硫酸根恰好沉淀完全,不能确定样品中有无Na2SO4,C错误;SiO2可溶于KOH溶液,BaSO4不溶于KOH溶液,故为进一步确定原样品的组成,可以向③未溶解的固体中加入KOH溶液,D正确。
专题 离子反应
2024
考情分析
高考命题分析
命 题 情 境 (1)日常生活情境:以日常生活中实例(如酿醋、食品膨松剂、环境消毒等)为载体,考查氧化还原反应的概念及相互关系。
(2)生产环保情境:以工业生产中反应原理、环境保护中物质的反应和转化等为载体,考查氧化还原反应的概念、规律及应用,以及离子方程式等。
(3)实验探究情境:以化学实验原理及物质的转化等为载体,考查氧化还原反应的概念、规律及简单计算,离子反应的应用等。
素 养 能 力 (1)分析与推测能力:判断物质组成与结构,分析物质的性质及反应,结合离子反应实质,判断离子方程式的正误或离子能否大量共存。
(2)理解与辨析能力:基于反应原理或事实,辨析氧化还原反应相关概念,从文本中获取有关信息,解决氧化还原反应的概念及关系、规律及应用等问题。
(3)思维方法:基于证据从离子反应和氧化还原反应角度对物质组成、结构及其变化进行分析,解释化学反应的本质和规律;基于已有模型或构建模型阐释物质结构、化学变化规律或转化过程,解释化学问题。
考题统计
(1)离子方程式的正误判断书写:
湖南卷(2023),广东卷(2022、2021),浙江卷(2023、2022、2021、2020),辽宁卷(2021),北京卷(2023、2021),湖北卷(2022、2021),天津卷(2020)
(2)溶液中离子共存的判断:
重庆卷(2022),湖北卷(2022),天津卷(2021),福建卷(2021),湖南卷(2021),江苏卷(2020)
聚焦核心要点
要点1离子反应发生的条件及应用
课标指引:1.通过实验事实认识离子反应及其发生的条件。 2.了解常见离子的检验方法。
1.规避离子共存的题设“陷阱”
条件类型 常见表述 误点点拨
题设要求 ①“一定大量共存” ②“可能大量共存” ③“不能大量共存” 审清关键词
条件类型 常见表述 误点点拨
常见的 限制条件 “无色溶液” 不含Cu2+、Fe2+、Fe3+、 等有色离子
“滴加甲基橙溶液显红色”“pH=1” 溶液显酸性
“因发生氧化还原反应而不能大量共存” 只能是氧化性离子和还原性离子不能大量共存,并不是其他离子反应,同时要注意溶液酸碱性的影响
条件类型 常见表述 误点点拨
常见隐 含条件 “与Al反应放出H2” 溶液可能显强酸性或强碱性
“由水电离出的 c(H+)=1×10-12 mol·L-1”的溶液 溶液可能显强酸性或强碱性
含有大量Fe3+的溶液 酸性溶液并具有强氧化性
含有大量 的溶液 隐含H+与还原性离子不能同时大量共存
相互促 进水解 相互促进水解,生成沉淀或气体,不能大量共存
2.掌握常见离子的检验方法
(1)常见阳离子的检验
(2)常见阴离子的检验
易错辨析
×
Al3+与NH3·H2O反应产生Al(OH)3沉淀,不产生 。
√
3.Na+、Fe3+、 、H2O2能大量共存。( )
4.将铁锈溶于浓盐酸,再滴入KMnO4溶液,紫色褪去,说明铁锈中含有二价铁。( )
×
Fe3+可催化H2O2分解,不能大量共存。
×
浓盐酸也能与KMnO4发生反应,使溶液紫色褪去。
要点2离子方程式的书写及正误判断
课标指引:1.能用化学方程式、离子方程式正确表示典型物质的主要化学性质。 2.利用电离、离子反应等概念对常见的反应进行分类和分析说明。
1.离子方程式正误判断的关键
2.建立与量有关的离子方程式书写的思维模型
易错辨析
试判断下列离子方程式的正误。
√
×
铁和稀硝酸反应制得浅绿色溶液,离子方程式:3Fe+8H++2 ══ 3Fe2++2NO↑+4H2O。
3.向偏铝酸钠溶液中通入过量的CO2:
向偏铝酸钠溶液中通入过量的CO2,离子方程式:
×
同浓度同体积的NH4HSO4溶液与NaOH溶液混合,离子方程式:H++OH- ══ H2O。
×
精研核心命题
命题点1离子方程式的正误判断
典例1 (2023·浙江1月选考卷)下列反应的离子方程式不正确的是( )
D
解析 由于酸性:H2SO3
C
命题点2离子共存的判断
典例2 (2022·湖北卷)下列各组离子在给定溶液中能大量共存的是( )
C
变式演练(2023·天津河西区一模)下列各组离子在指定溶液中能大量共存的是( )
D
解析 含Cu2+的溶液显蓝色,则无色溶液中Cu2+不能大量存在,A错误;酸性溶液中含大量H+,H+与ClO-结合生成弱电解质HClO,不能大量共存,B错误;碱性溶液中含大量OH-,Al3+与OH-反应而不能大量共存,C错误;KNO3溶液中含K+、 ,与Mg2+、Cl-、 相互不反应,可以大量共存,D正确。
【思维建模】
解答离子能否大量共存判断类题目的方法
(1)审清题目要求中的关键词语,如“一定大量共存”“可能大量共存”或“不能大量共存”等。
(2)考虑指定微粒(或物质)对溶液的酸碱性、氧化性和还原性的影响,如:
(3)正确分析水的电离程度:当由水电离出的c(H+)或c(OH-)小于1×10-7 mol·L-1时,水的电离受到抑制,溶液可能为酸性溶液或碱性溶液;当由水电离出的c(H+)或c(OH-)大于1×10-7 mol·L-1时,水的电离得到促进,溶液可能为弱酸盐溶液或弱碱盐溶液。
(4)综合考虑题给限制条件及离子之间的反应,对选项进行合理的判断。
命题点3离子的检验与物质推断
典例3 (2022·全国乙卷)某白色粉末样品,可能含有Na2SO4、Na2SO3、Na2S2O3和Na2CO3。取少量样品进行如下实验:
①溶于水,得到无色透明溶液。
②向①的溶液中滴加过量稀盐酸,溶液变浑浊,有刺激性气体逸出。离心
分离。
③取②的上层清液,向其中滴加BaCl2溶液有沉淀生成。
该样品中确定存在的是( )
A.Na2SO4、Na2S2O3 B.Na2SO3、Na2S2O3
C.Na2SO4、Na2CO3 D.Na2SO3、Na2CO3
A
解析 (1)①取少量样品溶于水得到无色透明溶液,说明固体溶于水且相互之间能大量共存。向①的溶液中滴加过量稀盐酸,溶液变浑浊,有刺激性气体放出,说明固体中存在Na2S2O3,发生反应:Na2S2O3+2HCl ══ 2NaCl+S↓+SO2↑+H2O,离心分离。(2)取②的上层清液,向其中滴加BaCl2溶液,有沉淀生成,则沉淀为BaSO4,说明固体中存在Na2SO4,不能确定是否有Na2SO3和Na2CO3,因为Na2SO3与过量盐酸反应生成二氧化硫,Na2CO3与过量盐酸反应生成二氧化碳,而这些现象可以被Na2S2O3与过量盐酸反应的现象掩盖,故该样品中确定存在的是Na2SO4和Na2S2O3。
思路剖析解答本题的思路如下:
实验 实验操作及现象 判断与结论
① 溶于水,得到无色透明溶液 四种钠盐均易溶于水
② 滴加过量稀盐酸,溶液变浑浊,有刺激性气体逸出 推测反应产生S和SO2,样品中含有Na2S2O3
③ 取②的上层清液,向其中滴加BaCl2溶液有沉淀生成 推测沉淀为BaSO4,样品中含有Na2SO4
变式演练(2023·河南濮阳一模)有一包固体粉末,由NaOH、Na2SO3、MgCl2、CaCO3、Ba(NO3)2、FeSO4中的几种组成,取少量样品进行如下实验:
①将样品加入水中,得到白色不溶物a和无色溶液
②向①中加入足量稀盐酸,产生气体,仍存在不溶物
该固体粉末一定含有的是( )
A.CaCO3、Ba(NO3)2
B.CaCO3、Na2SO3
C.Na2SO3、Ba(NO3)2
D.CaCO3、Na2SO3、Ba(NO3)2
C
解析 将样品加入水中,得到白色不溶物a和无色溶液,说明无FeSO4,白色沉淀可能是Mg(OH)2、CaCO3、BaSO3中的一种或几种。向①中加入足量稀盐酸,产生气体,仍存在不溶物,BaSO3在酸性条件下能被 氧化为BaSO4,同时产生NO气体,且BaSO3还能与HCl反应放出气体SO2,故原固体中一定含有Ba(NO3)2和Na2SO3,可能含有NaOH、MgCl2、CaCO3,一定不含FeSO4。
【思维建模】
解答离子的检验与物质推断类题目的方法
解答此类题目要抓住“四项基本原则”,防止出现“过检”或“漏检”等现象。
肯定性 原则 根据实验现象推出溶液中肯定存在或肯定不存在的离子(记住常见的有色离子:Fe2+、Fe3+、Cu2+、 )
互斥性 原则 在肯定某些离子的同时,结合离子共存规律,否定一些离子存在(要注意题目中的隐含条件,如酸性、碱性、指示剂的变化、与铝反应产生氢气、水的电离情况等)
电中性 原则 溶液呈电中性,一定既有阳离子、又有阴离子,且溶液中正、负电荷总数相等(利用这一原则可确定一些隐含的离子)
进出性 原则 通常是在实验过程中使用,是指在实验过程中反应生成的离子或引入的离子对后续实验的干扰
训练分层落实
练真题·明考向
1.(2023·北京卷)下列离子方程式与所给事实不相符的是( )
A.Cl2制备84消毒液(主要成分是NaClO):Cl2+2OH- ══ Cl-+ClO-+H2O
B.食醋去除水垢中的CaCO3:CaCO3+2H+ ══ Ca2++H2O+CO2↑
C.利用覆铜板制作印刷电路板:2Fe3++Cu ══ 2Fe2++Cu2+
D.Na2S去除废水中的Hg2+:Hg2++S2- ══ HgS↓
B
解析 食醋为弱酸,不能拆写为离子,正确的离子方程式应为2CH3COOH+CaCO3 ══ Ca2++2CH3COO-+CO2↑+H2O,B错误。
2.(2023·湖南卷)下列有关电极方程式或离子方程式错误的是( )
A.碱性锌锰电池的正极反应:MnO2+H2O+e- ══ MnO(OH)+OH-
B.铅酸蓄电池充电时的阳极反应:Pb2++2H2O-2e- ══ PbO2+4H+
C.K3[Fe(CN)6]溶液滴入FeCl2溶液中:K++Fe2++[Fe(CN)6]3- ══ KFe[Fe(CN)6]↓
D.TiCl4加入水中:TiCl4+(x+2)H2O ══ TiO2·xH2O↓+4H++4Cl-
B
解析 铅酸蓄电池充电时的阳极反应为PbSO4+2H2O-2e- ══ PbO2+4H++ ,B错误。
3.(2023·浙江6月选考卷)下列反应的离子方程式正确的是( )
A.碘化亚铁溶液与等物质的量的氯气:2Fe2++2I-+2Cl2 ══ 2Fe3++I2+4Cl-
B.向次氯酸钙溶液通入足量二氧化碳:ClO-+CO2+H2O ══ HClO+
C.铜与稀硝酸:Cu+4H++2 ══ Cu2++2NO2↑+2H2O
D.向硫化钠溶液通入足量二氧化硫:S2-+2SO2+2H2O ══ H2S+2
B
解析 碘化亚铁溶液与等物质的量的氯气,碘离子与氯气恰好完全反应:
2I-+Cl2 ══ I2+2Cl-,A错误;铜与稀硝酸反应生成硝酸铜、一氧化氮和水: 3Cu+8H++2 ══ 3Cu2++2NO↑+4H2O,C错误;向硫化钠溶液通入足量二氧化硫,溶液变浑浊,溶液中生成亚硫酸氢钠:2S2-+5SO2+2H2O ══ 3S↓+4 ,D错误。
4.(2022·重庆卷)下列操作中,不会影响溶液中K+、Al3+、Fe3+、Ba2+、Cl-、
等离子大量共存的是( )
A.加入ZnSO4 B.加入Fe粉
C.通入NH3 D.通入CO2
D
练易错·避陷阱
5.(2023·四川内江一模)常温下,下列溶液中一定能大量共存的离子组是
( )
A
6.(2023·辽宁辽阳一模)下列离子方程式书写错误的是( )
A.在Cu(OH)2浊液中加入浓氨水得到深蓝色溶液:Cu(OH)2+4NH3·H2O ══[Cu(NH3)4]2++2OH-+4H2O
B.向溴水中滴加乙醛溶液,溶液酸性增强:CH3CHO+Br2+H2O ―→ CH3COOH+2H++2Br-
C.向稀硝酸中加入少量Cu2O粉末,溶液变蓝:Cu2O+2H+ ══ Cu+Cu2++H2O
D.向补血剂的溶液中滴加K3[Fe(CN)6]溶液,产生蓝色沉淀: K++Fe2++[Fe(CN)6]3- ══KFe[Fe(CN)6]↓
C
解析 铜单质能与稀硝酸反应生成硝酸铜,最终不会存在铜单质,C错误。
7.下列物质的性质实验对应的离子方程式书写正确的是( )
A.铁与稀硫酸反应:2Fe+6H+ ══ 2Fe3++3H2↑
B.CuCl2溶液中通入硫化氢:Cu2++S2- ══ CuS↓
D
8.下列微粒在所给条件下,能大量共存的是( )
D
9.某白色固体样品,可能含有KNO3、Na2CO3、Na2SO4、BaCl2、SiO2中的一种或几种。对该样品进行如下实验:
①取少量固体加入足量水中,固体部分溶解;
②取①中滤液进行焰色试验,透过蓝色钴玻璃未观察到紫色;
③取①中滤渣,向其中加入足量的盐酸,产生气泡,固体部分溶解。
下列说法不正确的是( )
A.固体粉末中一定不含KNO3
B.固体粉末中一定含有BaCl2和Na2CO3
C.取①中滤液,加入硝酸酸化的Ba(NO3)2溶液,若未产生白色沉淀,则样品中无Na2SO4
D.为进一步确定原样品组成,可以向③未溶解的固体中加入KOH溶液
C
解析 ①取少量固体加入足量水中,固体部分溶解,不溶性物质可能为BaCO3、BaSO4、SiO2;②取①中滤液进行焰色试验,透过蓝色钴玻璃未观察到紫色,滤液中不存在K+,说明样品中一定没有KNO3;③取①中滤渣,向其中加入足量的盐酸,产生气泡,固体部分溶解,BaCO3溶于盐酸,可知样品中存在Na2CO3和BaCl2,无法确定未溶解的物质是BaSO4还是SiO2,或者二者均有。固体粉末中一定不含KNO3,A正确;固体粉末中一定含有BaCl2和Na2CO3,B正确;取①中滤液,加入硝酸酸化的Ba(NO3)2溶液,若未产生白色沉淀,有可能是加水溶解时,硫酸根恰好沉淀完全,不能确定样品中有无Na2SO4,C错误;SiO2可溶于KOH溶液,BaSO4不溶于KOH溶液,故为进一步确定原样品的组成,可以向③未溶解的固体中加入KOH溶液,D正确。
同课章节目录
