二轮专题 氧化还原反应课件(共39张PPT)
文档属性
| 名称 | 二轮专题 氧化还原反应课件(共39张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 3.1MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-11-19 22:52:45 | ||
图片预览






文档简介
(共39张PPT)
专题 氧化还原反应
2024
聚焦核心要点
要点1氧化还原反应的概念及相互关系
课标指引:1.认识有化合价变化的反应是氧化还原反应。 2.了解氧化还原反应的本质是电子的转移,知道常见的氧化剂和还原剂。
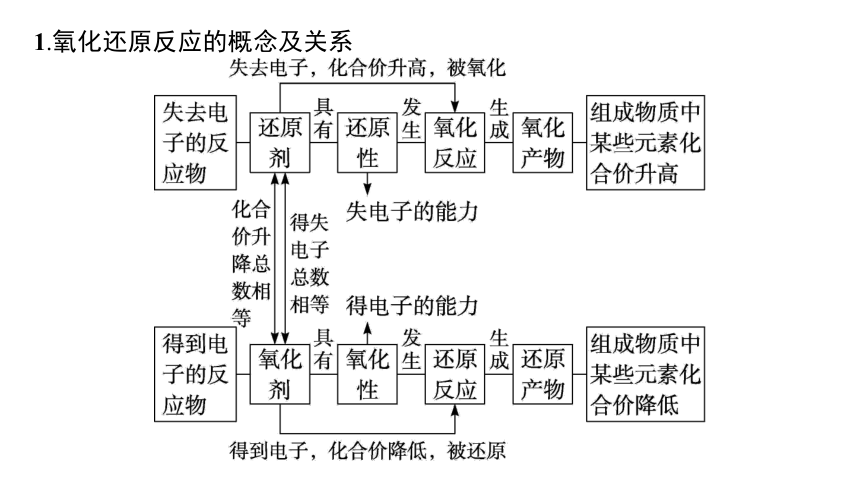
1.氧化还原反应的概念及关系
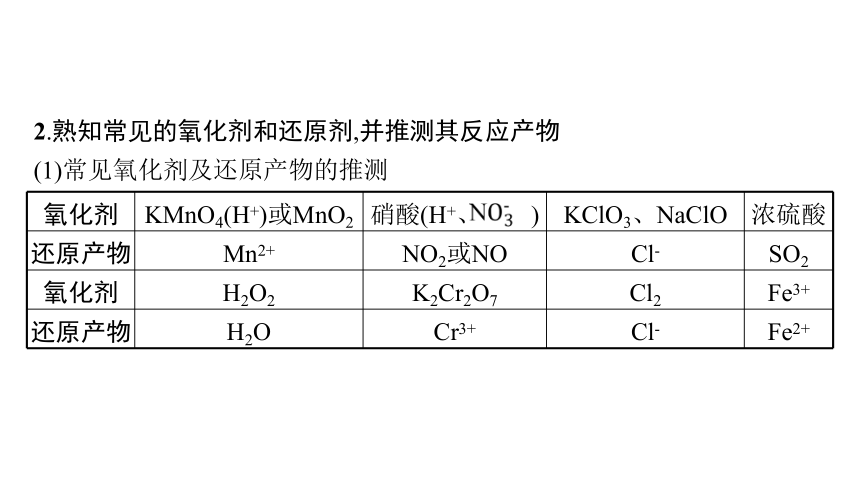
2.熟知常见的氧化剂和还原剂,并推测其反应产物
(1)常见氧化剂及还原产物的推测
氧化剂 KMnO4(H+)或MnO2 硝酸(H+、 ) KClO3、NaClO 浓硫酸
还原产物 Mn2+ NO2或NO Cl- SO2
氧化剂 H2O2 K2Cr2O7 Cl2 Fe3+
还原产物 H2O Cr3+ Cl- Fe2+
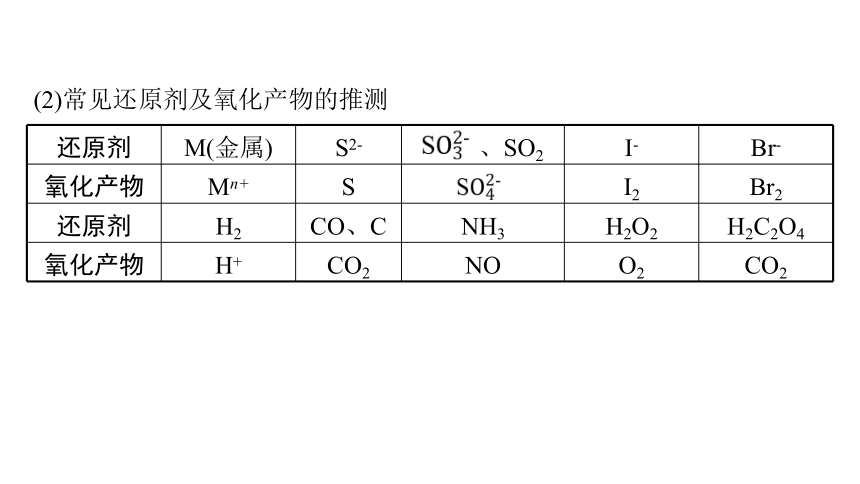
(2)常见还原剂及氧化产物的推测
还原剂 M(金属) S2- 、SO2 I- Br-
氧化产物 Mn+ S I2 Br2
还原剂 H2 CO、C NH3 H2O2 H2C2O4
氧化产物 H+ CO2 NO O2 CO2
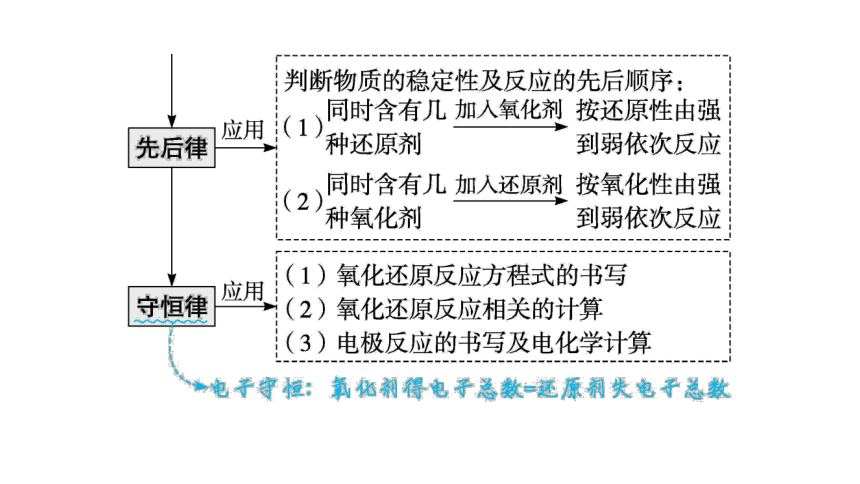
要点2氧化还原反应的规律及其应用
课标指引:1.通过氧化还原反应实现含有不同价态同种元素的物质的相互转化。 2.能从物质类别、元素价态的角度,依据复分解反应和氧化还原反应原理,预测物质的化学性质和变化。
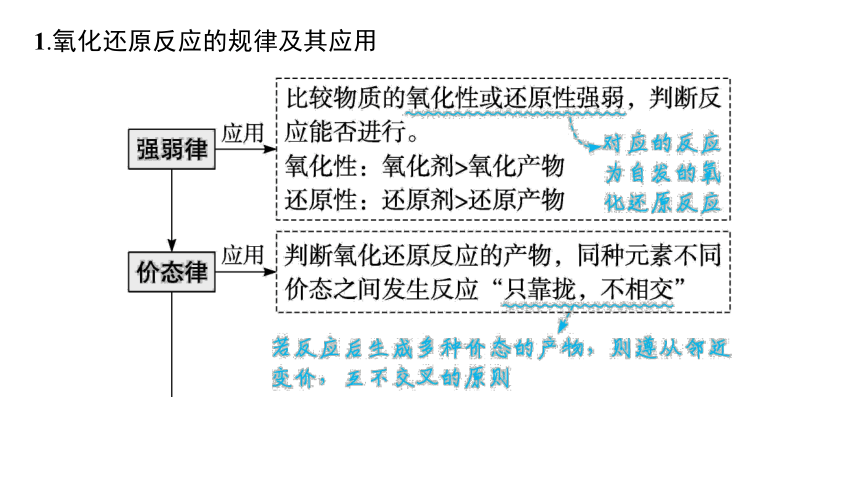
1.氧化还原反应的规律及其应用
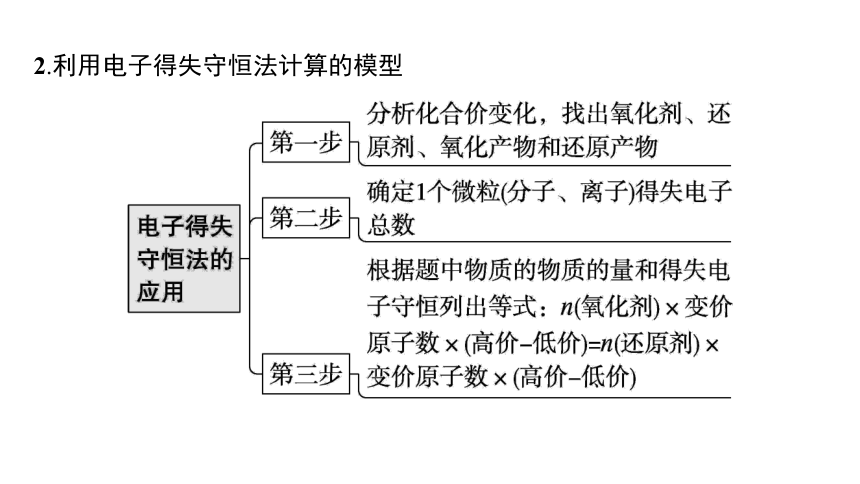
2.利用电子得失守恒法计算的模型
精研核心命题
命题点1氧化还原反应的概念及相互关系
典例1 (2023·浙江1月选考卷)关于反应2NH2OH+4Fe3+ ══ N2O↑+4Fe2++4H++H2O,下列说法正确的是( )
A.生成1 mol N2O,转移4 mol电子
B.NH2OH是还原产物
C.NH2OH既是氧化剂又是还原剂
D.若设计成原电池,Fe2+为负极产物
A
解析 NH2OH→N2O,N元素由-1价升高到+1价,故生成1 mol N2O转移4 mol电子,A正确;该反应中,N元素化合价升高,Fe元素化合价降低,故NH2OH是还原剂,Fe3+是氧化剂,B、C错误;原电池中负极发生氧化反应,正极发生还原反应,故设计成原电池时,Fe2+是正极还原产物,D错误。
变式演练(2023·山西大同一模)关于反应K2H3IO6+9HI ══ 2KI+4I2+6H2O,下列说法错误的是( )
A.K2H3IO6发生还原反应,具有氧化性
B.还原剂与氧化剂的物质的量之比为7∶1
C.KI是还原产物
D.生成12.7 g I2时,转移0.087 5 mol电子
C
解析 K2H3IO6中I为+7价,得电子被还原为0价,HI中的I从-1价升高为0价,发生归中反应,生成4 mol I2时转移7 mol e-。K2H3IO6发生还原反应,具有氧化性,A正确;9 mol HI参与反应,只有7 mol HI作还原剂,故还原剂与氧化剂的物质的量之比为7∶1,B正确;KI中K和I元素化合价均不变,故KI既不是氧化产物也不是还原产物,C错误;I2既是氧化产物又是还原产物,生成4 mol I2转移7 mol电子,12.7 g I2为0.05 mol,则转移电子为0.05 mol× =0.087 5 mol,D正确。
命题点2氧化还原反应的规律及其应用
典例2 (2022·湖南卷)科学家发现某些生物酶体系可以促进H+和e-的转移(如a、b和c),能将海洋中的 转化为N2进入大气层,反应过程如图所示。
D
思路剖析本题中含氮物质转化分析如下:
变式演练(2023·辽宁省协作校一模)已知反应:aFeSO4+bNa2O2 ══ cNa2FeO4+2Na2O+dNa2SO4+eO2↑,a=2。下列关于该反应的说法错误的是
( )
A.Na2FeO4可以对水体进行杀菌消毒、净化
B.Na2O2在该反应中既是氧化剂又是还原剂
C.3a=b
D.每生成1 mol Na2FeO4,转移4 mol电子
D
解析 Na2FeO4具有强氧化性,能对水体进行杀菌消毒,产生的Fe3+水解生成的Fe(OH)3胶体可以吸附水中的小颗粒,可以净水,A正确;Na2O2中O元素化合价既有升高,又有降低,故Na2O2既是氧化剂又是还原剂,B正确;a=2,根据Fe和S元素质量守恒可知,c=2、d=2,再根据Na元素守恒可知,b=6,则3a=b,C正确;该反应的化学方程式为2FeSO4+6Na2O2 ══ 2Na2FeO4+2Na2O+2Na2SO4+O2↑,则每生成1 mol Na2FeO4,转移5 mol电子,D错误。
命题点3复杂氧化还原反应的分析及计算
典例3 (2023·湖南卷)油画创作通常需要用到多种无机颜料,研究发现,在不同的空气湿度和光照条件下,颜料雌黄(As2S3)褪色的主要原因是发生了以下两种化学反应。
下列说法正确的是( )
B.反应Ⅰ和Ⅱ中,元素As和S都被氧化
C.反应Ⅰ和Ⅱ中,参加反应的 :Ⅰ<Ⅱ
D.反应Ⅰ和Ⅱ中,氧化1 mol As2S3转移的电子数之比为3∶7
D
变式演练(2023·山西临汾一模)实验室利用Bi(OH)3制取高锰酸钠的相关反应的离子方程式如下。
下列说法错误的是( )
A.反应Ⅰ中氧化产物和还原产物的物质的量比为5∶1
B
训练分层落实
练真题·明考向
1.(2023·全国乙卷)下列应用中涉及氧化还原反应的是( )
A.使用明矾对水进行净化
B.雪天道路上撒盐融雪
C.暖贴中的铁粉遇空气放热
D.荧光指示牌被照发光
C
解析 明矾净水是由于Al3+水解产生的Al(OH)3胶体具有吸附性,与氧化还原反应无关,A错误;雪天道路撒盐可降低雪的熔点,促进雪融化,与氧化还原反应无关,B错误;暖贴利用了原电池原理,涉及氧化还原反应,C正确;荧光指示牌利用了光的反射原理,与氧化还原反应无关,D错误。
2.(2023·辽宁卷)一定条件下,酸性KMnO4溶液与H2C2O4发生反应,Mn(Ⅱ)起催化作用,过程中不同价态含Mn粒子的浓度随时间变化如图所示。下列说法正确的是( )
A.Mn(Ⅲ)不能氧化H2C2O4
B.随着反应物浓度的减小,反应速率逐渐减小
C.该条件下,Mn(Ⅱ)和Mn(Ⅶ)不能大量共存
C
解析 Mn(Ⅲ)的浓度先增大后减小,而Mn(Ⅱ)在13 min左右开始逐渐增大,说明Mn(Ⅲ)能氧化H2C2O4,A错误;大约在13 min前,Mn(Ⅱ)变化不大,但Mn(Ⅶ)的浓度迅速下降,则说明该时间段反应速率有增大趋势,B错误;Mn(Ⅶ)的浓度在13 min左右时为0,之后Mn(Ⅱ)的浓度迅速增大,则Mn(Ⅶ)和Mn(Ⅱ)在该条件下不能大量共存,C正确;H2C2O4是弱酸,书写离子方程式时应写化学式:2 +5H2C2O4+6H+ ══ 2Mn2++10CO2↑+8H2O,D错误。
3.(2022·山东卷)实验室制备KMnO4过程为①高温下在熔融强碱性介质中用KClO3氧化MnO2制备K2MnO4;②水溶后冷却,调溶液pH至弱碱性, K2MnO4歧化生成KMnO4和MnO2;③减压过滤,将滤液蒸发浓缩、冷却结晶,再减压过滤得KMnO4。下列说法正确的是( )
A.①中用瓷坩埚作反应器
B.①中用NaOH作强碱性介质
C.②中K2MnO4只体现氧化性
D.MnO2转化为KMnO4的理论转化率约为66.7%
D
解析 ①中高温下在熔融强碱性介质中用KClO3氧化MnO2制备K2MnO4,由于瓷坩埚易被强碱腐蚀,故不能用瓷坩埚作反应器,A错误;制备KMnO4时为防止引入杂质离子,①中用KOH作强碱性介质,不能用NaOH,B错误;②中K2MnO4歧化生成KMnO4和MnO2,故其既体现氧化性又体现还原性,C错误;K2MnO4歧化生成KMnO4和MnO2的物质的量之比为2∶1,根据Mn元素守恒可知,MnO2中的Mn元素只有 转化为KMnO4,故MnO2转化为KMnO4的理论转化率约为66.7%,D正确。
练易错·避陷阱
4.(2023·浙江浙南名校联盟一模)关于反应FeS2+7Fe2(SO4)3+8H2O ══ 15FeSO4+8H2SO4,下列说法不正确的是( )
A.Fe2(SO4)3中Fe元素在反应中得到电子
B.H2O既不是氧化剂也不是还原剂
C.消耗0.2 mol FeS2,转移2.8 mol电子
D.氧化产物和还原产物物质的量之比为8∶15
D
解析 Fe2(SO4)3→FeSO4,Fe元素化合价降低,则Fe2(SO4)3得电子被还原,A正确;H2O中H和O元素化合价未发生变化,则H2O既不是氧化剂也不是还原剂,B正确;FeS2中S元素由-1价升高到+6价,消耗1 mol FeS2转移14 mol电子,故消耗0.2 mol FeS2时转移2.8 mol电子,C正确;FeS2→S发生氧化反应,1 mol FeS2反应得到2 mol氧化产物S,Fe2(SO4)3→FeSO4发生还原反应,7 mol Fe2(SO4)3反应得到14 mol还原产物FeSO4,故氧化产物和还原产物的物质的量之比为2 mol∶14 mol=1∶7,D错误。
5.(2023·河北邯郸模拟)工业上用发烟HClO4把潮湿的CrCl3氧化为棕色的烟[CrO2(ClO4)2]来除去Cr3+,化学方程式为19HClO4+8CrCl3+4H2O ══ 8CrO2(ClO4)2+27HCl。下列说法错误的是( )
A.CrO2(ClO4)2中Cr元素的化合价为+6价
B.CrCl3作还原剂,发生氧化反应
C.被还原的氧化剂与氧化产物的物质的量之比为19∶8
D.当有5.4 mol HCl生成时,转移电子的物质的量为4.8 mol
C
解析 CrO2(ClO4)2中Cl为+7价,O为-2价,则Cr元素的化合价为+6价,A正确; CrCl3中Cr的化合价由+3价升高到+6价,作还原剂,发生氧化反应,B正确;19 mol HClO4中有3 mol作氧化剂被还原,故被还原的氧化剂与氧化产物的物质的量之比为3∶8,C错误;当有27 mol HCl生成时,转移电子的物质的量为24 mol,故当有5.4 mol HCl生成时,转移电子的物质的量为4.8 mol,D正确。
6.(2023·浙江金华模拟)工业上除去电石渣浆(含CaO)上层清液中的S2-,并制取CaSO4·2H2O的流程如图:
C
练预测·押考向
7.连二亚硫酸钠(Na2S2O4)俗称保险粉,有强还原性,在空气中极易被氧化。用NaHSO3还原法制备保险粉的流程如下:
下列说法错误的是( )
A.反应1说明酸性:H2SO3>H2CO3
B.反应2中消耗的氧化剂和还原剂的物质的量之比为1∶2
C.反应2最好在无氧条件下进行
D.反应1结束后,可用盐酸酸化的BaCl2溶液检验NaHSO3是否被氧化
B
解析 由题给流程可知,碳酸钠溶液与二氧化硫反应生成亚硫酸氢钠和二氧化碳,亚硫酸氢钠溶液与锌粉反应生成连二亚硫酸钠和氢氧化锌,连二亚硫酸钠溶液再经结晶脱水得到连二亚硫酸钠固体。由分析可知,反应1为碳酸钠溶液与二氧化硫反应生成亚硫酸氢钠和二氧化碳,则亚硫酸的酸性强于碳酸,A正确;反应2为亚硫酸氢钠溶液与锌粉反应生成连二亚硫酸钠和氢氧化锌,反应中亚硫酸氢钠为反应的氧化剂,锌为还原剂,由得失电子数目守恒可知氧化剂与还原剂的物质的量之比为2∶1,B错误;由题意可知,连二亚硫酸钠有强还原性,在空气中极易被氧化,则制备连二亚硫酸钠时,反应2最好在无氧条件下进行,C正确;亚硫酸氢钠溶液不能与氯化钡溶液反应,若亚硫酸氢钠溶液被氧化,加入盐酸酸化的氯化钡溶液会与硫酸根离子反应生成白色硫酸钡沉淀,则反应1结束后,可用盐酸酸化的氯化钡溶液检验亚硫酸氢钠是否被氧化,D正确。
8.酸性环境中,纳米Fe/Ni去除 过程中的含氮微粒变化如图所示,溶液中铁以Fe2+形式存在。下列有关说法不正确的是( )
B.增大单位体积水体中纳米Fe/Ni的投入量,可提高 的去除效果
C.假设反应过程都能彻底进行,反应ⅰ、ⅱ消耗的单质铁的物质的量之比为3∶1
C
9.工业烟气中含有较高浓度的氮氧化物,需进行脱除处理才能排放到大气中。如图是一种利用NH3在催化剂条件下脱除NO的原理示意图:
下列说法错误的是( )
A.步骤①中NO发生氧化反应
B.步骤②中包含有σ键和π键的断裂
C.若参与反应的NO和NH3的物质的量相等,则该过程的总反应为4NH3+4NO+O2 4N2+6H2O
D.当消耗a mol NH3和b mol O2时,消耗NO的物质的量为
A
专题 氧化还原反应
2024
聚焦核心要点
要点1氧化还原反应的概念及相互关系
课标指引:1.认识有化合价变化的反应是氧化还原反应。 2.了解氧化还原反应的本质是电子的转移,知道常见的氧化剂和还原剂。
1.氧化还原反应的概念及关系
2.熟知常见的氧化剂和还原剂,并推测其反应产物
(1)常见氧化剂及还原产物的推测
氧化剂 KMnO4(H+)或MnO2 硝酸(H+、 ) KClO3、NaClO 浓硫酸
还原产物 Mn2+ NO2或NO Cl- SO2
氧化剂 H2O2 K2Cr2O7 Cl2 Fe3+
还原产物 H2O Cr3+ Cl- Fe2+
(2)常见还原剂及氧化产物的推测
还原剂 M(金属) S2- 、SO2 I- Br-
氧化产物 Mn+ S I2 Br2
还原剂 H2 CO、C NH3 H2O2 H2C2O4
氧化产物 H+ CO2 NO O2 CO2
要点2氧化还原反应的规律及其应用
课标指引:1.通过氧化还原反应实现含有不同价态同种元素的物质的相互转化。 2.能从物质类别、元素价态的角度,依据复分解反应和氧化还原反应原理,预测物质的化学性质和变化。
1.氧化还原反应的规律及其应用
2.利用电子得失守恒法计算的模型
精研核心命题
命题点1氧化还原反应的概念及相互关系
典例1 (2023·浙江1月选考卷)关于反应2NH2OH+4Fe3+ ══ N2O↑+4Fe2++4H++H2O,下列说法正确的是( )
A.生成1 mol N2O,转移4 mol电子
B.NH2OH是还原产物
C.NH2OH既是氧化剂又是还原剂
D.若设计成原电池,Fe2+为负极产物
A
解析 NH2OH→N2O,N元素由-1价升高到+1价,故生成1 mol N2O转移4 mol电子,A正确;该反应中,N元素化合价升高,Fe元素化合价降低,故NH2OH是还原剂,Fe3+是氧化剂,B、C错误;原电池中负极发生氧化反应,正极发生还原反应,故设计成原电池时,Fe2+是正极还原产物,D错误。
变式演练(2023·山西大同一模)关于反应K2H3IO6+9HI ══ 2KI+4I2+6H2O,下列说法错误的是( )
A.K2H3IO6发生还原反应,具有氧化性
B.还原剂与氧化剂的物质的量之比为7∶1
C.KI是还原产物
D.生成12.7 g I2时,转移0.087 5 mol电子
C
解析 K2H3IO6中I为+7价,得电子被还原为0价,HI中的I从-1价升高为0价,发生归中反应,生成4 mol I2时转移7 mol e-。K2H3IO6发生还原反应,具有氧化性,A正确;9 mol HI参与反应,只有7 mol HI作还原剂,故还原剂与氧化剂的物质的量之比为7∶1,B正确;KI中K和I元素化合价均不变,故KI既不是氧化产物也不是还原产物,C错误;I2既是氧化产物又是还原产物,生成4 mol I2转移7 mol电子,12.7 g I2为0.05 mol,则转移电子为0.05 mol× =0.087 5 mol,D正确。
命题点2氧化还原反应的规律及其应用
典例2 (2022·湖南卷)科学家发现某些生物酶体系可以促进H+和e-的转移(如a、b和c),能将海洋中的 转化为N2进入大气层,反应过程如图所示。
D
思路剖析本题中含氮物质转化分析如下:
变式演练(2023·辽宁省协作校一模)已知反应:aFeSO4+bNa2O2 ══ cNa2FeO4+2Na2O+dNa2SO4+eO2↑,a=2。下列关于该反应的说法错误的是
( )
A.Na2FeO4可以对水体进行杀菌消毒、净化
B.Na2O2在该反应中既是氧化剂又是还原剂
C.3a=b
D.每生成1 mol Na2FeO4,转移4 mol电子
D
解析 Na2FeO4具有强氧化性,能对水体进行杀菌消毒,产生的Fe3+水解生成的Fe(OH)3胶体可以吸附水中的小颗粒,可以净水,A正确;Na2O2中O元素化合价既有升高,又有降低,故Na2O2既是氧化剂又是还原剂,B正确;a=2,根据Fe和S元素质量守恒可知,c=2、d=2,再根据Na元素守恒可知,b=6,则3a=b,C正确;该反应的化学方程式为2FeSO4+6Na2O2 ══ 2Na2FeO4+2Na2O+2Na2SO4+O2↑,则每生成1 mol Na2FeO4,转移5 mol电子,D错误。
命题点3复杂氧化还原反应的分析及计算
典例3 (2023·湖南卷)油画创作通常需要用到多种无机颜料,研究发现,在不同的空气湿度和光照条件下,颜料雌黄(As2S3)褪色的主要原因是发生了以下两种化学反应。
下列说法正确的是( )
B.反应Ⅰ和Ⅱ中,元素As和S都被氧化
C.反应Ⅰ和Ⅱ中,参加反应的 :Ⅰ<Ⅱ
D.反应Ⅰ和Ⅱ中,氧化1 mol As2S3转移的电子数之比为3∶7
D
变式演练(2023·山西临汾一模)实验室利用Bi(OH)3制取高锰酸钠的相关反应的离子方程式如下。
下列说法错误的是( )
A.反应Ⅰ中氧化产物和还原产物的物质的量比为5∶1
B
训练分层落实
练真题·明考向
1.(2023·全国乙卷)下列应用中涉及氧化还原反应的是( )
A.使用明矾对水进行净化
B.雪天道路上撒盐融雪
C.暖贴中的铁粉遇空气放热
D.荧光指示牌被照发光
C
解析 明矾净水是由于Al3+水解产生的Al(OH)3胶体具有吸附性,与氧化还原反应无关,A错误;雪天道路撒盐可降低雪的熔点,促进雪融化,与氧化还原反应无关,B错误;暖贴利用了原电池原理,涉及氧化还原反应,C正确;荧光指示牌利用了光的反射原理,与氧化还原反应无关,D错误。
2.(2023·辽宁卷)一定条件下,酸性KMnO4溶液与H2C2O4发生反应,Mn(Ⅱ)起催化作用,过程中不同价态含Mn粒子的浓度随时间变化如图所示。下列说法正确的是( )
A.Mn(Ⅲ)不能氧化H2C2O4
B.随着反应物浓度的减小,反应速率逐渐减小
C.该条件下,Mn(Ⅱ)和Mn(Ⅶ)不能大量共存
C
解析 Mn(Ⅲ)的浓度先增大后减小,而Mn(Ⅱ)在13 min左右开始逐渐增大,说明Mn(Ⅲ)能氧化H2C2O4,A错误;大约在13 min前,Mn(Ⅱ)变化不大,但Mn(Ⅶ)的浓度迅速下降,则说明该时间段反应速率有增大趋势,B错误;Mn(Ⅶ)的浓度在13 min左右时为0,之后Mn(Ⅱ)的浓度迅速增大,则Mn(Ⅶ)和Mn(Ⅱ)在该条件下不能大量共存,C正确;H2C2O4是弱酸,书写离子方程式时应写化学式:2 +5H2C2O4+6H+ ══ 2Mn2++10CO2↑+8H2O,D错误。
3.(2022·山东卷)实验室制备KMnO4过程为①高温下在熔融强碱性介质中用KClO3氧化MnO2制备K2MnO4;②水溶后冷却,调溶液pH至弱碱性, K2MnO4歧化生成KMnO4和MnO2;③减压过滤,将滤液蒸发浓缩、冷却结晶,再减压过滤得KMnO4。下列说法正确的是( )
A.①中用瓷坩埚作反应器
B.①中用NaOH作强碱性介质
C.②中K2MnO4只体现氧化性
D.MnO2转化为KMnO4的理论转化率约为66.7%
D
解析 ①中高温下在熔融强碱性介质中用KClO3氧化MnO2制备K2MnO4,由于瓷坩埚易被强碱腐蚀,故不能用瓷坩埚作反应器,A错误;制备KMnO4时为防止引入杂质离子,①中用KOH作强碱性介质,不能用NaOH,B错误;②中K2MnO4歧化生成KMnO4和MnO2,故其既体现氧化性又体现还原性,C错误;K2MnO4歧化生成KMnO4和MnO2的物质的量之比为2∶1,根据Mn元素守恒可知,MnO2中的Mn元素只有 转化为KMnO4,故MnO2转化为KMnO4的理论转化率约为66.7%,D正确。
练易错·避陷阱
4.(2023·浙江浙南名校联盟一模)关于反应FeS2+7Fe2(SO4)3+8H2O ══ 15FeSO4+8H2SO4,下列说法不正确的是( )
A.Fe2(SO4)3中Fe元素在反应中得到电子
B.H2O既不是氧化剂也不是还原剂
C.消耗0.2 mol FeS2,转移2.8 mol电子
D.氧化产物和还原产物物质的量之比为8∶15
D
解析 Fe2(SO4)3→FeSO4,Fe元素化合价降低,则Fe2(SO4)3得电子被还原,A正确;H2O中H和O元素化合价未发生变化,则H2O既不是氧化剂也不是还原剂,B正确;FeS2中S元素由-1价升高到+6价,消耗1 mol FeS2转移14 mol电子,故消耗0.2 mol FeS2时转移2.8 mol电子,C正确;FeS2→S发生氧化反应,1 mol FeS2反应得到2 mol氧化产物S,Fe2(SO4)3→FeSO4发生还原反应,7 mol Fe2(SO4)3反应得到14 mol还原产物FeSO4,故氧化产物和还原产物的物质的量之比为2 mol∶14 mol=1∶7,D错误。
5.(2023·河北邯郸模拟)工业上用发烟HClO4把潮湿的CrCl3氧化为棕色的烟[CrO2(ClO4)2]来除去Cr3+,化学方程式为19HClO4+8CrCl3+4H2O ══ 8CrO2(ClO4)2+27HCl。下列说法错误的是( )
A.CrO2(ClO4)2中Cr元素的化合价为+6价
B.CrCl3作还原剂,发生氧化反应
C.被还原的氧化剂与氧化产物的物质的量之比为19∶8
D.当有5.4 mol HCl生成时,转移电子的物质的量为4.8 mol
C
解析 CrO2(ClO4)2中Cl为+7价,O为-2价,则Cr元素的化合价为+6价,A正确; CrCl3中Cr的化合价由+3价升高到+6价,作还原剂,发生氧化反应,B正确;19 mol HClO4中有3 mol作氧化剂被还原,故被还原的氧化剂与氧化产物的物质的量之比为3∶8,C错误;当有27 mol HCl生成时,转移电子的物质的量为24 mol,故当有5.4 mol HCl生成时,转移电子的物质的量为4.8 mol,D正确。
6.(2023·浙江金华模拟)工业上除去电石渣浆(含CaO)上层清液中的S2-,并制取CaSO4·2H2O的流程如图:
C
练预测·押考向
7.连二亚硫酸钠(Na2S2O4)俗称保险粉,有强还原性,在空气中极易被氧化。用NaHSO3还原法制备保险粉的流程如下:
下列说法错误的是( )
A.反应1说明酸性:H2SO3>H2CO3
B.反应2中消耗的氧化剂和还原剂的物质的量之比为1∶2
C.反应2最好在无氧条件下进行
D.反应1结束后,可用盐酸酸化的BaCl2溶液检验NaHSO3是否被氧化
B
解析 由题给流程可知,碳酸钠溶液与二氧化硫反应生成亚硫酸氢钠和二氧化碳,亚硫酸氢钠溶液与锌粉反应生成连二亚硫酸钠和氢氧化锌,连二亚硫酸钠溶液再经结晶脱水得到连二亚硫酸钠固体。由分析可知,反应1为碳酸钠溶液与二氧化硫反应生成亚硫酸氢钠和二氧化碳,则亚硫酸的酸性强于碳酸,A正确;反应2为亚硫酸氢钠溶液与锌粉反应生成连二亚硫酸钠和氢氧化锌,反应中亚硫酸氢钠为反应的氧化剂,锌为还原剂,由得失电子数目守恒可知氧化剂与还原剂的物质的量之比为2∶1,B错误;由题意可知,连二亚硫酸钠有强还原性,在空气中极易被氧化,则制备连二亚硫酸钠时,反应2最好在无氧条件下进行,C正确;亚硫酸氢钠溶液不能与氯化钡溶液反应,若亚硫酸氢钠溶液被氧化,加入盐酸酸化的氯化钡溶液会与硫酸根离子反应生成白色硫酸钡沉淀,则反应1结束后,可用盐酸酸化的氯化钡溶液检验亚硫酸氢钠是否被氧化,D正确。
8.酸性环境中,纳米Fe/Ni去除 过程中的含氮微粒变化如图所示,溶液中铁以Fe2+形式存在。下列有关说法不正确的是( )
B.增大单位体积水体中纳米Fe/Ni的投入量,可提高 的去除效果
C.假设反应过程都能彻底进行,反应ⅰ、ⅱ消耗的单质铁的物质的量之比为3∶1
C
9.工业烟气中含有较高浓度的氮氧化物,需进行脱除处理才能排放到大气中。如图是一种利用NH3在催化剂条件下脱除NO的原理示意图:
下列说法错误的是( )
A.步骤①中NO发生氧化反应
B.步骤②中包含有σ键和π键的断裂
C.若参与反应的NO和NH3的物质的量相等,则该过程的总反应为4NH3+4NO+O2 4N2+6H2O
D.当消耗a mol NH3和b mol O2时,消耗NO的物质的量为
A
同课章节目录
