专题3 信息型化学(离子)方程式的书写(共29张PPT)
文档属性
| 名称 | 专题3 信息型化学(离子)方程式的书写(共29张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 3.4MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-11-19 23:05:53 | ||
图片预览





文档简介
(共29张PPT)
专题 信息型化学(离子)方程式的书写
2024
突破点1 非氧化还原反应方程式的书写
核心归纳
高考指引:近几年,高考试题在无机化工流程题、化学实验综合题中考查了信息型非氧化还原反应方程式的书写,如SnO2与NaOH溶液反应等,侧重考查教材基础知识及迁移应用,突出对“宏观辨识与微观探析”等化学学科核心素养的考查。
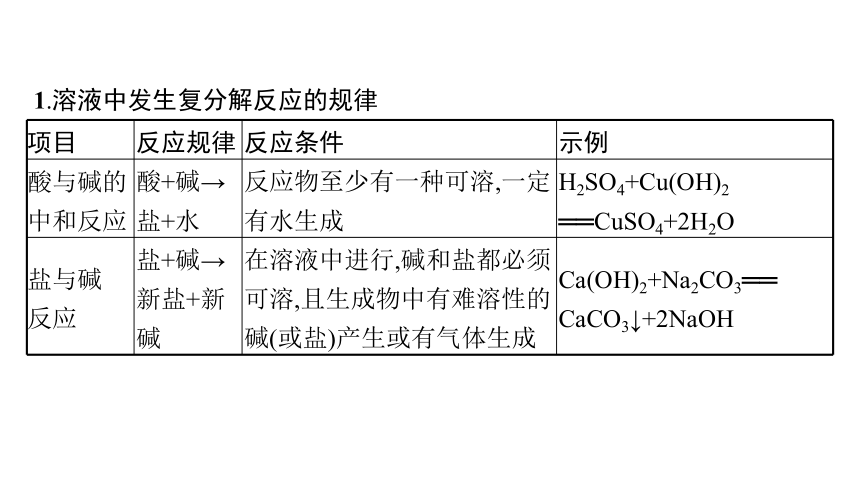
1.溶液中发生复分解反应的规律
项目 反应规律 反应条件 示例
酸与碱的 中和反应 酸+碱→盐+水 反应物至少有一种可溶,一定有水生成 H2SO4+Cu(OH)2
══CuSO4+2H2O
盐与碱 反应 盐+碱→新盐+新碱 在溶液中进行,碱和盐都必须可溶,且生成物中有难溶性的碱(或盐)产生或有气体生成 Ca(OH)2+Na2CO3══
CaCO3↓+2NaOH
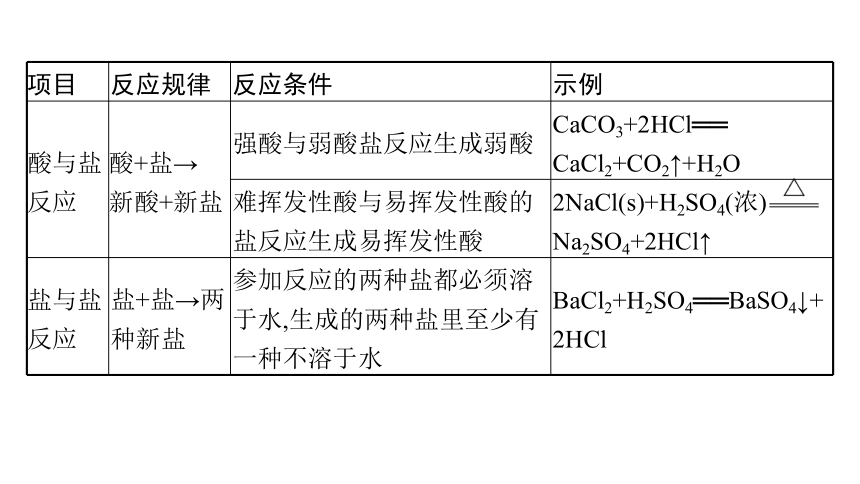
项目 反应规律 反应条件 示例
酸与盐 反应 酸+盐→ 新酸+新盐 强酸与弱酸盐反应生成弱酸 CaCO3+2HCl══
CaCl2+CO2↑+H2O
难挥发性酸与易挥发性酸的盐反应生成易挥发性酸 2NaCl(s)+H2SO4(浓) Na2SO4+2HCl↑
盐与盐 反应 盐+盐→两种新盐 参加反应的两种盐都必须溶于水,生成的两种盐里至少有一种不溶于水 BaCl2+H2SO4══BaSO4↓+2HCl
2.酸性氧化物与碱反应的规律
反应规律 应用示例
酸性氧化物+碱(足量)→正盐+水 SO2+2NaOH══Na2SO3+H2O
酸性氧化物+碱(少量)→酸式盐+水 SO2+NaOH══NaHSO3
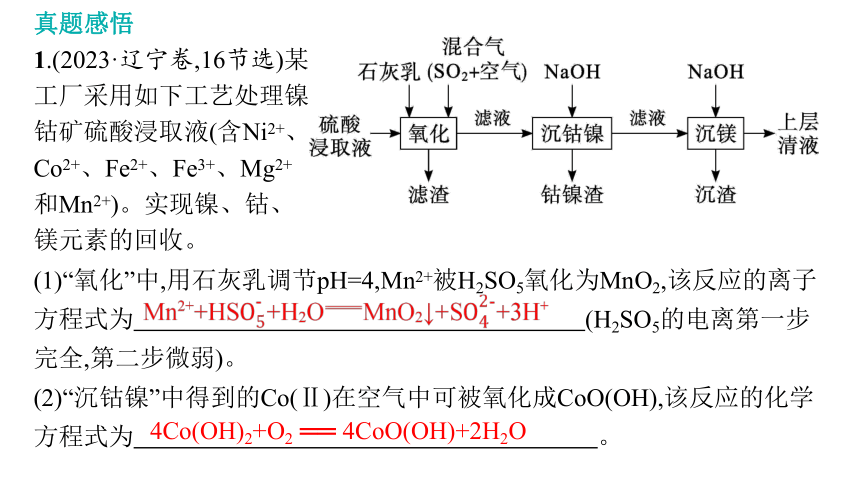
真题感悟
1.(2023·辽宁卷,16节选)某工厂采用如下工艺处理镍钴矿硫酸浸取液(含Ni2+、Co2+、Fe2+、Fe3+、Mg2+和Mn2+)。实现镍、钴、镁元素的回收。
(1)“氧化”中,用石灰乳调节pH=4,Mn2+被H2SO5氧化为MnO2,该反应的离子方程式为 (H2SO5的电离第一步完全,第二步微弱)。
(2)“沉钴镍”中得到的Co(Ⅱ)在空气中可被氧化成CoO(OH),该反应的化学方程式为 。
4Co(OH)2+O2 ══ 4CoO(OH)+2H2O
2.(高考题重组)(1)(2022·全国乙卷,27节选)向草酸(H2C2O4)溶液中加入适量K2CO3固体,制得KHC2O4和K2C2O4混合溶液。原料配比为n(H2C2O4)∶n(K2CO3)=1.5∶1,写出反应的化学方程式:
。
(3)(2021·辽宁卷,16节选)用FeCl3溶液制备Fe(OH)3胶体的化学方程式为 。
3H2C2O4+2K2CO3 ══ 2KHC2O4+K2C2O4+2H2O+2CO2↑
FeCl3·6H2O+6SOCl2 FeCl3+6SO2↑+12HCl↑
FeCl3+3H2O Fe(OH)3(胶体)+3HCl
3.(高考题重组)(1)(2022·重庆卷,15节选)沉淀1的主要成分是SnO2,焙烧时,与NaOH反应生成Na2SnO3的化学方程式为
。
(2)(2022·山东卷,17节选)酸解时有HF产生。氢氟酸与SiO2反应生成二元强酸H2SiF6,离子方程式为 。
SnO2+2NaOH Na2SnO3+H2O
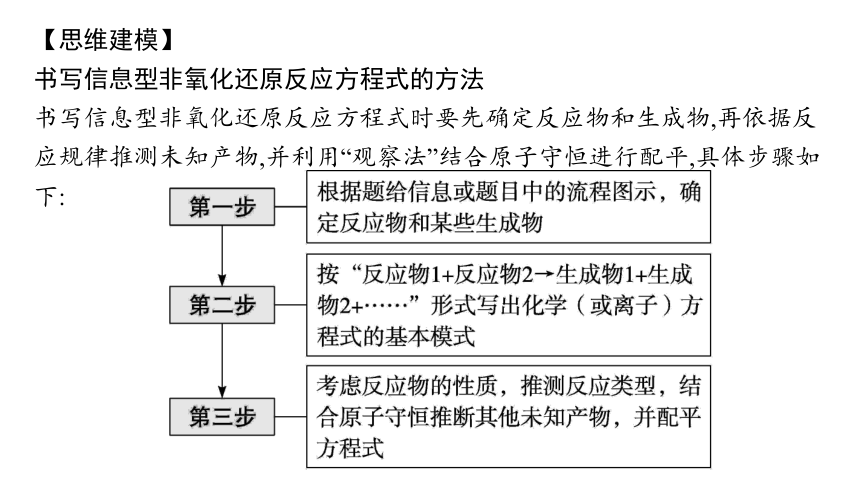
【思维建模】
书写信息型非氧化还原反应方程式的方法
书写信息型非氧化还原反应方程式时要先确定反应物和生成物,再依据反应规律推测未知产物,并利用“观察法”结合原子守恒进行配平,具体步骤如下:
考向预测
1.(2023·云南曲靖一模)工业上利用锌焙砂(主要成分为ZnO,还含有As2O3及铅、铜、镉的氧化物)生产高纯度氧化锌的工业流程如图所示:
已知:As2O3微溶于水而生成亚砷酸(H3AsO3),FeAsO4和ZnCO3难溶于水。
(1)“浸出”过程中(NH4)2SO4和NH3·H2O按1∶2参加反应,结合ZnO生成了[Zn(NH3)4]2+,发生反应的离子方程式为
。
(2)“除砷”过程中,先加入过量的(NH4)2S2O8,再加入FeSO4·H2O,该过程中(NH4)2S2O8过量的原因是
。
(3)“蒸氨”后锌元素以[Zn(NH3)2]SO4形式存在,写出CO2“沉锌”的化学方程式: 。
加入(NH4)2S2O8氧化 ,使其完全转化为 ,过量的(NH4)2S2O8再将Fe2+氧化为Fe3+,最后生成难溶的FeAsO4,达到除砷的目的
[Zn(NH3)2]SO4+CO2+H2O ══ ZnCO3↓+(NH4)2SO4
2.(2023·山西太原一模)人们将酸强度超过100%H2SO4的一类酸叫做超酸,某实验小组用SbCl5制备超酸HSbF6,并探究其性质。制备SbCl5的实验装置如图(夹持、加热及搅拌装置已略去):
(1)装置A中发生反应的化学方程式为 。
(2)实验小组在由SbCl5制备HSbF6时,没有选择玻璃仪器,其原因是
(写化学方程式)。
(3)1966年,美国某研究员无意中将蜡烛扔进HSbF6溶液中,发现蜡烛很快溶
解,并放出H2。已知稳定性: ,写出等物质
的量的异丁烷与HSbF6发生反应的化学方程式:
。
KClO3+6HCl(浓)==KCl+3Cl2↑+3H2O
SiO2+4HF===SiF4↑+2H2O
(CH3)3CH+HSbF6 ===(CH3)3CSbF6+H2↑
解析 (3)由已知信息知,异丁烷可以提供碳正离子与F-结合形成卤化物,同时(CH3)3C+稳定,在反应中易形成,故发生反应的化学方程式为(CH3)3CH+HSbF6 ══(CH3)3CSbF6+H2↑。
突破点2 氧化还原反应方程式的书写
核心归纳
高考指引:近几年,高考试题在化学综合实验题、化工流程题中重点考查了氧化还原反应方程式的书写,要求考生根据题中信息确定反应物和生成物,并写出相关的方程式,突出对“证据推理与模型认知”化学学科核心素养的考查。
1.配平氧化还原反应方程式的“三大原则”
2.配平氧化还原反应方程式的“五个步骤”
真题感悟
1.(2022·辽宁卷)某工厂采用辉铋矿(主要成分为Bi2S3,含有FeS2、SiO2杂质)与软锰矿(主要成分为MnO2)联合焙烧法制备BiOCl和MnSO4,工艺流程如下:
已知:①焙烧时过量的MnO2分解为Mn2O3,FeS2转变为Fe2O3;
②金属活动性:Fe>(H)>Bi>Cu;
③相关金属离子形成氢氧化物的pH范围如下:
离子 开始沉淀pH 完全沉淀pH
Fe2+ 6.5 8.3
Fe3+ 1.6 2.8
Mn2+ 8.1 10.1
回答下列问题:
(1)为提高焙烧效率,可采取的措施为 。
a.进一步粉碎矿石 b.鼓入适当过量的空气 c.降低焙烧温度
ab
(2)Bi2S3在空气中单独焙烧生成Bi2O3,反应的化学方程式为 。
(3)“酸浸”中过量浓盐酸的作用为①充分浸出Bi3+和Mn2+;② 。
(4)滤渣的主要成分为 (填化学式)。
(5)生成气体A的离子方程式为 。
(6)加入金属Bi的目的是 。
2Bi2S3+9O2 2Bi2O3+6SO2
抑制金属离子水解
SiO2
Mn2O3+6H++2Cl- ══2Mn2++Cl2↑+3H2O
将Fe3+转化为Fe2+
解析 (1)a项,联合焙烧时,进一步粉碎矿石,可以增大矿石与空气的接触面积,能够提高焙烧效率,选项a符合题意;b项,鼓入适当过量的空气有利于矿石充分反应,选项b符合题意;c项,降低焙烧温度,反应速率减慢,不利于提高焙烧效率,选项c不符合题意。
(6)由已知信息③知,调pH=2.6时,Fe3+会水解生成Fe(OH)3沉淀,但Fe2+还没开始沉淀,故要将Fe3+转化为Fe2+,在调pH后获得含FeCl2的滤液,为了不引入新的杂质,加入Bi作还原剂。
要点图解 本题中物质转化分析如下:
2.(1)(2022·海南卷,15节选)在H2O2存在下Cu溶于稀硫酸,反应的化学方程式为 。
(2)(2022·江苏卷,16节选)实验室以二氧化铈(CeO2)废渣为原料制备Cl-含量少的Ce2(CO3)3,其部分实验过程如下:
“酸浸”时CeO2与H2O2反应生成Ce3+并放出O2,该反应的离子方程式为 。
Cu+H2SO4+H2O2 ══ CuSO4+2H2O
2CeO2+H2O2+6H+ ══ 2Ce3++O2↑+4H2O
【思维建模】
书写与配平信息型氧化还原反应方程式的方法
根据题目提供信息确定“两剂”“两产物”,即氧化剂和还原剂、还原产物和氧化产物,部分氧化(或还原)产物要结合氧化还原反应价态转化规律推测,再依据电子得失守恒、原子守恒、电荷守恒进行配平,基本步骤如下:
考向预测
1.(2023·辽宁协作校一模)采用废铁屑还原软锰矿(软锰矿主要成分是MnO2,还含少量Fe、Mg、Ni、Si等元素的氧化物杂质)来制备Mn的工艺流程如图所示:
(1)在“浸出液”中加入“MnO2”时发生反应的离子方程式为 。
(2)硫酸酸化的MnSO4可与NaBiO3(难溶于水)反应生成Bi3+和 ,此反应的离子方程式为 。
MnO2+2Fe2++4H+ ══ Mn2++2Fe3++2H2O
2.(2023·湖南常德一模)利用MnO2悬浊液吸收SO2气体制取连二硫酸锰(MnS2O6)和硫酸锰(MnSO4)的装置(部分夹持、加热仪器已省略)如图所示。
已知:ⅰ.MnS2O6易溶于水,其在pH为2.8~3.5时最稳定,温度超过30 ℃会快速分解生成易溶于水的MnSO4;
ⅱ.连二硫酸的结构简式为 。
(1)MnS2O6中S的化合价为 。
(2)仪器a应装入的药品最好是 。
A.70%的硫酸溶液 B.稀盐酸 C.稀硝酸 D.浓硝酸
(3)装置B的作用为 ,装置C中反应的化学方程式为 ,表明反应完成的现象是
。装置D中水浴温度应控制在80 ℃左右,温度不能过高的原因是 。
(4)测定MnS2O6中锰元素的含量:准确称量产品质量,充分加热使之完全分解得到MnSO4,加适量水溶解,用KMnO4标准溶液进行滴定(锰元素均转化为MnO2),即可计算出MnS2O6中锰元素的含量。滴定过程中发生反应的离子方程式为 。
+5价
A
防倒吸
MnO2+2SO2 ══ MnS2O6
C中得到澄清溶液或黑色固体消失
温度过高,SO2的溶解度变小,反应速率减慢
解析 A装置中浓硫酸与亚硫酸钠反应制备二氧化碳,B装置防倒吸。在较低温度下C中二氧化锰吸收二氧化硫生成MnS2O6,在较高温度下D中二氧化锰吸收二氧化硫生成MnSO4,E中石灰乳吸收二氧化硫,防止污染。
(2)A用于制备二氧化硫气体,亚硫酸钠和浓硫酸反应生成二氧化硫气体;亚硫酸钠和盐酸反应能生成二氧化硫气体,由于盐酸易挥发,生成的二氧化硫中含有HCl杂质;硝酸具有强氧化性,亚硫酸钠被硝酸氧化为硫酸钠,不能放出二氧化硫,所以仪器a应装入的药品最好是70%的硫酸溶液,选A。
专题 信息型化学(离子)方程式的书写
2024
突破点1 非氧化还原反应方程式的书写
核心归纳
高考指引:近几年,高考试题在无机化工流程题、化学实验综合题中考查了信息型非氧化还原反应方程式的书写,如SnO2与NaOH溶液反应等,侧重考查教材基础知识及迁移应用,突出对“宏观辨识与微观探析”等化学学科核心素养的考查。
1.溶液中发生复分解反应的规律
项目 反应规律 反应条件 示例
酸与碱的 中和反应 酸+碱→盐+水 反应物至少有一种可溶,一定有水生成 H2SO4+Cu(OH)2
══CuSO4+2H2O
盐与碱 反应 盐+碱→新盐+新碱 在溶液中进行,碱和盐都必须可溶,且生成物中有难溶性的碱(或盐)产生或有气体生成 Ca(OH)2+Na2CO3══
CaCO3↓+2NaOH
项目 反应规律 反应条件 示例
酸与盐 反应 酸+盐→ 新酸+新盐 强酸与弱酸盐反应生成弱酸 CaCO3+2HCl══
CaCl2+CO2↑+H2O
难挥发性酸与易挥发性酸的盐反应生成易挥发性酸 2NaCl(s)+H2SO4(浓) Na2SO4+2HCl↑
盐与盐 反应 盐+盐→两种新盐 参加反应的两种盐都必须溶于水,生成的两种盐里至少有一种不溶于水 BaCl2+H2SO4══BaSO4↓+2HCl
2.酸性氧化物与碱反应的规律
反应规律 应用示例
酸性氧化物+碱(足量)→正盐+水 SO2+2NaOH══Na2SO3+H2O
酸性氧化物+碱(少量)→酸式盐+水 SO2+NaOH══NaHSO3
真题感悟
1.(2023·辽宁卷,16节选)某工厂采用如下工艺处理镍钴矿硫酸浸取液(含Ni2+、Co2+、Fe2+、Fe3+、Mg2+和Mn2+)。实现镍、钴、镁元素的回收。
(1)“氧化”中,用石灰乳调节pH=4,Mn2+被H2SO5氧化为MnO2,该反应的离子方程式为 (H2SO5的电离第一步完全,第二步微弱)。
(2)“沉钴镍”中得到的Co(Ⅱ)在空气中可被氧化成CoO(OH),该反应的化学方程式为 。
4Co(OH)2+O2 ══ 4CoO(OH)+2H2O
2.(高考题重组)(1)(2022·全国乙卷,27节选)向草酸(H2C2O4)溶液中加入适量K2CO3固体,制得KHC2O4和K2C2O4混合溶液。原料配比为n(H2C2O4)∶n(K2CO3)=1.5∶1,写出反应的化学方程式:
。
(3)(2021·辽宁卷,16节选)用FeCl3溶液制备Fe(OH)3胶体的化学方程式为 。
3H2C2O4+2K2CO3 ══ 2KHC2O4+K2C2O4+2H2O+2CO2↑
FeCl3·6H2O+6SOCl2 FeCl3+6SO2↑+12HCl↑
FeCl3+3H2O Fe(OH)3(胶体)+3HCl
3.(高考题重组)(1)(2022·重庆卷,15节选)沉淀1的主要成分是SnO2,焙烧时,与NaOH反应生成Na2SnO3的化学方程式为
。
(2)(2022·山东卷,17节选)酸解时有HF产生。氢氟酸与SiO2反应生成二元强酸H2SiF6,离子方程式为 。
SnO2+2NaOH Na2SnO3+H2O
【思维建模】
书写信息型非氧化还原反应方程式的方法
书写信息型非氧化还原反应方程式时要先确定反应物和生成物,再依据反应规律推测未知产物,并利用“观察法”结合原子守恒进行配平,具体步骤如下:
考向预测
1.(2023·云南曲靖一模)工业上利用锌焙砂(主要成分为ZnO,还含有As2O3及铅、铜、镉的氧化物)生产高纯度氧化锌的工业流程如图所示:
已知:As2O3微溶于水而生成亚砷酸(H3AsO3),FeAsO4和ZnCO3难溶于水。
(1)“浸出”过程中(NH4)2SO4和NH3·H2O按1∶2参加反应,结合ZnO生成了[Zn(NH3)4]2+,发生反应的离子方程式为
。
(2)“除砷”过程中,先加入过量的(NH4)2S2O8,再加入FeSO4·H2O,该过程中(NH4)2S2O8过量的原因是
。
(3)“蒸氨”后锌元素以[Zn(NH3)2]SO4形式存在,写出CO2“沉锌”的化学方程式: 。
加入(NH4)2S2O8氧化 ,使其完全转化为 ,过量的(NH4)2S2O8再将Fe2+氧化为Fe3+,最后生成难溶的FeAsO4,达到除砷的目的
[Zn(NH3)2]SO4+CO2+H2O ══ ZnCO3↓+(NH4)2SO4
2.(2023·山西太原一模)人们将酸强度超过100%H2SO4的一类酸叫做超酸,某实验小组用SbCl5制备超酸HSbF6,并探究其性质。制备SbCl5的实验装置如图(夹持、加热及搅拌装置已略去):
(1)装置A中发生反应的化学方程式为 。
(2)实验小组在由SbCl5制备HSbF6时,没有选择玻璃仪器,其原因是
(写化学方程式)。
(3)1966年,美国某研究员无意中将蜡烛扔进HSbF6溶液中,发现蜡烛很快溶
解,并放出H2。已知稳定性: ,写出等物质
的量的异丁烷与HSbF6发生反应的化学方程式:
。
KClO3+6HCl(浓)==KCl+3Cl2↑+3H2O
SiO2+4HF===SiF4↑+2H2O
(CH3)3CH+HSbF6 ===(CH3)3CSbF6+H2↑
解析 (3)由已知信息知,异丁烷可以提供碳正离子与F-结合形成卤化物,同时(CH3)3C+稳定,在反应中易形成,故发生反应的化学方程式为(CH3)3CH+HSbF6 ══(CH3)3CSbF6+H2↑。
突破点2 氧化还原反应方程式的书写
核心归纳
高考指引:近几年,高考试题在化学综合实验题、化工流程题中重点考查了氧化还原反应方程式的书写,要求考生根据题中信息确定反应物和生成物,并写出相关的方程式,突出对“证据推理与模型认知”化学学科核心素养的考查。
1.配平氧化还原反应方程式的“三大原则”
2.配平氧化还原反应方程式的“五个步骤”
真题感悟
1.(2022·辽宁卷)某工厂采用辉铋矿(主要成分为Bi2S3,含有FeS2、SiO2杂质)与软锰矿(主要成分为MnO2)联合焙烧法制备BiOCl和MnSO4,工艺流程如下:
已知:①焙烧时过量的MnO2分解为Mn2O3,FeS2转变为Fe2O3;
②金属活动性:Fe>(H)>Bi>Cu;
③相关金属离子形成氢氧化物的pH范围如下:
离子 开始沉淀pH 完全沉淀pH
Fe2+ 6.5 8.3
Fe3+ 1.6 2.8
Mn2+ 8.1 10.1
回答下列问题:
(1)为提高焙烧效率,可采取的措施为 。
a.进一步粉碎矿石 b.鼓入适当过量的空气 c.降低焙烧温度
ab
(2)Bi2S3在空气中单独焙烧生成Bi2O3,反应的化学方程式为 。
(3)“酸浸”中过量浓盐酸的作用为①充分浸出Bi3+和Mn2+;② 。
(4)滤渣的主要成分为 (填化学式)。
(5)生成气体A的离子方程式为 。
(6)加入金属Bi的目的是 。
2Bi2S3+9O2 2Bi2O3+6SO2
抑制金属离子水解
SiO2
Mn2O3+6H++2Cl- ══2Mn2++Cl2↑+3H2O
将Fe3+转化为Fe2+
解析 (1)a项,联合焙烧时,进一步粉碎矿石,可以增大矿石与空气的接触面积,能够提高焙烧效率,选项a符合题意;b项,鼓入适当过量的空气有利于矿石充分反应,选项b符合题意;c项,降低焙烧温度,反应速率减慢,不利于提高焙烧效率,选项c不符合题意。
(6)由已知信息③知,调pH=2.6时,Fe3+会水解生成Fe(OH)3沉淀,但Fe2+还没开始沉淀,故要将Fe3+转化为Fe2+,在调pH后获得含FeCl2的滤液,为了不引入新的杂质,加入Bi作还原剂。
要点图解 本题中物质转化分析如下:
2.(1)(2022·海南卷,15节选)在H2O2存在下Cu溶于稀硫酸,反应的化学方程式为 。
(2)(2022·江苏卷,16节选)实验室以二氧化铈(CeO2)废渣为原料制备Cl-含量少的Ce2(CO3)3,其部分实验过程如下:
“酸浸”时CeO2与H2O2反应生成Ce3+并放出O2,该反应的离子方程式为 。
Cu+H2SO4+H2O2 ══ CuSO4+2H2O
2CeO2+H2O2+6H+ ══ 2Ce3++O2↑+4H2O
【思维建模】
书写与配平信息型氧化还原反应方程式的方法
根据题目提供信息确定“两剂”“两产物”,即氧化剂和还原剂、还原产物和氧化产物,部分氧化(或还原)产物要结合氧化还原反应价态转化规律推测,再依据电子得失守恒、原子守恒、电荷守恒进行配平,基本步骤如下:
考向预测
1.(2023·辽宁协作校一模)采用废铁屑还原软锰矿(软锰矿主要成分是MnO2,还含少量Fe、Mg、Ni、Si等元素的氧化物杂质)来制备Mn的工艺流程如图所示:
(1)在“浸出液”中加入“MnO2”时发生反应的离子方程式为 。
(2)硫酸酸化的MnSO4可与NaBiO3(难溶于水)反应生成Bi3+和 ,此反应的离子方程式为 。
MnO2+2Fe2++4H+ ══ Mn2++2Fe3++2H2O
2.(2023·湖南常德一模)利用MnO2悬浊液吸收SO2气体制取连二硫酸锰(MnS2O6)和硫酸锰(MnSO4)的装置(部分夹持、加热仪器已省略)如图所示。
已知:ⅰ.MnS2O6易溶于水,其在pH为2.8~3.5时最稳定,温度超过30 ℃会快速分解生成易溶于水的MnSO4;
ⅱ.连二硫酸的结构简式为 。
(1)MnS2O6中S的化合价为 。
(2)仪器a应装入的药品最好是 。
A.70%的硫酸溶液 B.稀盐酸 C.稀硝酸 D.浓硝酸
(3)装置B的作用为 ,装置C中反应的化学方程式为 ,表明反应完成的现象是
。装置D中水浴温度应控制在80 ℃左右,温度不能过高的原因是 。
(4)测定MnS2O6中锰元素的含量:准确称量产品质量,充分加热使之完全分解得到MnSO4,加适量水溶解,用KMnO4标准溶液进行滴定(锰元素均转化为MnO2),即可计算出MnS2O6中锰元素的含量。滴定过程中发生反应的离子方程式为 。
+5价
A
防倒吸
MnO2+2SO2 ══ MnS2O6
C中得到澄清溶液或黑色固体消失
温度过高,SO2的溶解度变小,反应速率减慢
解析 A装置中浓硫酸与亚硫酸钠反应制备二氧化碳,B装置防倒吸。在较低温度下C中二氧化锰吸收二氧化硫生成MnS2O6,在较高温度下D中二氧化锰吸收二氧化硫生成MnSO4,E中石灰乳吸收二氧化硫,防止污染。
(2)A用于制备二氧化硫气体,亚硫酸钠和浓硫酸反应生成二氧化硫气体;亚硫酸钠和盐酸反应能生成二氧化硫气体,由于盐酸易挥发,生成的二氧化硫中含有HCl杂质;硝酸具有强氧化性,亚硫酸钠被硝酸氧化为硫酸钠,不能放出二氧化硫,所以仪器a应装入的药品最好是70%的硫酸溶液,选A。
同课章节目录
