专题 离子反应 氧化还原反应----基础巩固练(共26张PPT)
文档属性
| 名称 | 专题 离子反应 氧化还原反应----基础巩固练(共26张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 1.4MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-11-19 23:48:49 | ||
图片预览







文档简介
(共26张PPT)
专题 离子反应 氧化还原反应 ----基础巩固练
2024
基础巩固练
1.(2023·广东汕头一模)下列化学品在生活、生产中应用广泛。下列有关物质的应用与氧化还原反应无关的是( )
A.工业上用硫铁矿(FeS2)为原料生产发烟硫酸
B.用Na2O2作潜水器的供氧剂
C.用食醋可除去暖水瓶中的水垢
D.用优质糯米为原料酿制白酒
C
解析 食醋与水垢中的CaCO3发生复分解反应生成可溶性醋酸钙,不涉及氧化还原反应,C符合题意。
2.(2023·天津河西区一模)下列过程体现所用物质的氧化性的是( )
A.用FeCl3溶液腐蚀铜板
B.用SO2的水溶液吸收Br2
C.用锌块防止钢铁船体腐蚀
D.用铁粉防止FeSO4溶液变质
A
解析 用氯化铁溶液腐蚀铜板,发生的反应为2FeCl3+Cu ══ CuCl2+2FeCl2,FeCl3体现了氧化性,A符合题意。
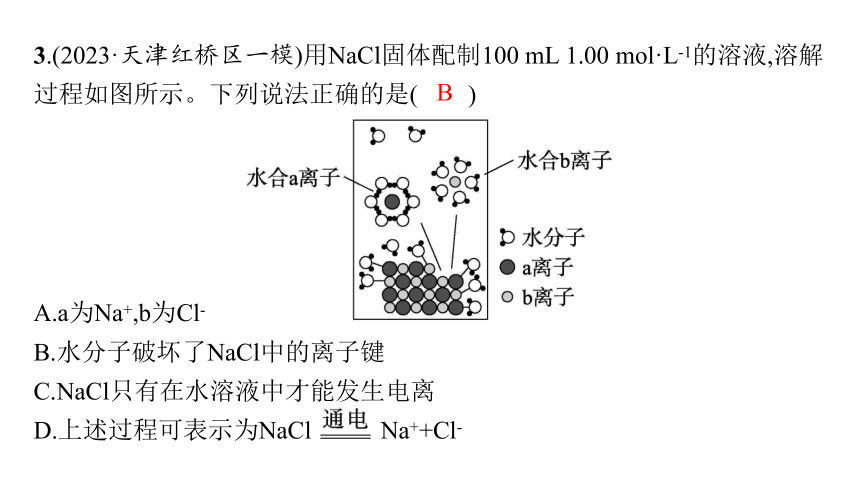
3.(2023·天津红桥区一模)用NaCl固体配制100 mL 1.00 mol·L-1的溶液,溶解过程如图所示。下列说法正确的是( )
A.a为Na+,b为Cl-
B.水分子破坏了NaCl中的离子键
C.NaCl只有在水溶液中才能发生电离
D.上述过程可表示为NaCl Na++Cl-
B
解析 水合a离子中H原子朝向中心离子,水合b离子中O原子朝向中心离子,根据正、负电荷相互吸引推测,a离子为Cl-,b离子为Na+,A错误;NaCl溶于水后,在水分子的作用下形成水合离子,水分子破坏了NaCl中的离子键,B正确;NaCl在熔融状态下也可发生电离,形成钠离子和氯离子,C错误;上述过程为氯化钠的电离,不需要通电,D错误。
4.(2023·广东佛山一模)离子鉴别能让我们感受微观世界的神奇。下列在透明溶液中能大量共存的离子组是( )
A
解析 酸性条件下, 与I-能发生氧化还原反应,不能大量共存,B错误;Al3+与S2-、 发生相互促进的水解反应,生成沉淀和气体,不能大量共存,C错误;Fe3+与SCN-反应生成Fe(SCN)3,不能大量共存,D错误。
5.(2023·天津红桥区一模)下列物质性质实验对应的离子方程式书写正确的是( )
D
解析 金属钠加入水中生成NaOH和氢气:2Na+2H2O ══ 2Na++2OH-+H2↑,A错误;AlCl3溶液中滴入过量NaOH溶液生成NaAlO2和H2O:Al3++4OH- ══ +2H2O,B错误;同浓度同体积的NH4HSO4溶液与NaOH溶液混合:H++OH- ══ H2O,C错误。
6.(2023·浙江丽水一模)关于反应2NaNO2+2KI+2H2SO4 ══ 2NO↑+I2+Na2SO4+K2SO4+2H2O,下列说法正确的是( )
A.KI发生还原反应
B.H2SO4既不是氧化剂,也不是还原剂
C.氧化产物与还原产物的物质的量之比为2∶1
D.消耗0.5 mol NaNO2时,转移1.0 mol电子
B
解析 该反应中,KI是还原剂,发生氧化反应,A错误;H2SO4中的元素化合价未变价,故H2SO4既不是氧化剂也不是还原剂,B正确;NaNO2中N元素化合价降低,NO为还原产物,KI中I元素化合价升高,I2为氧化产物,则氧化产物和还原产物的物质的量之比为1∶2,C错误;反应时NaNO2中N元素的化合价从+3价降低为+2价,则消耗0.5 mol NaNO2时转移0.5 mol电子,D错误。
7.(2023·湖北八市3月联考)下列各组离子在给定溶液中能大量共存的是
( )
A.0.1 mol·L-1 FeCl3溶液:Al3+、K+、Br-、I-
D
8.(2023·辽宁沈阳一模)明代《徐光启手迹》记载了制备王水的方法,其主要流程如图所示(水蒸气等部分产物已省略),下列说法中正确的是( )
A.X不能使酸性KMnO4溶液褪色
B.操作1利用了难挥发性酸制取挥发性酸
C.流程中涉及的均为非氧化还原反应
D.步骤ⅱ能在铁容器中进行
B
解析 FeSO4→Fe2O3,Fe元素化合价升高,根据氧化还原反应规律推知,部分硫元素化合价降低,则X为SO2,SO2能使酸性KMnO4溶液褪色,A错误;操作1后得到硝酸,该过程制取硝酸是利用了硝酸易挥发的性质,B正确;步骤ⅰ中煅烧绿矾生成SO2过程中,S、Fe的化合价发生变化,属于氧化还原反应,C错误;王水是浓硝酸和浓盐酸按体积比1∶3的混合物,会腐蚀铁容器,则步骤ⅱ不能在铁容器中进行,D错误。
9.(2023·山西太原一模)下列反应的离子方程式正确的是( )
A.向Na2S溶液中加入稀硝酸:S2-+2H+ ══ H2S↑
B.向H2O2溶液中滴入FeCl3溶液:H2O2+2Fe3+ ══ 2Fe2++O2↑+2H+
C.向AgCl沉淀中滴加浓氨水:2NH3·H2O+AgCl ══[Ag(NH3)2]++Cl-+2H2O
D.将NO、NO2混合气体通入NaOH溶液中:NO2+NO+2OH- ══
C
解析 向Na2S溶液中加入稀硝酸发生氧化还原反应,A错误;向H2O2溶液中滴入FeCl3溶液,Fe3+催化H2O2分解生成H2O和O2,FeCl3是催化剂,B错误;将体积比为1∶1的NO和NO2的混合气体通入NaOH溶液中生成NaNO2和H2O:NO2+NO+2OH- ══ 2 +H2O,D错误。
10.(2023·黑龙江哈尔滨一模)物质的用量可能影响反应的产物,下列离子方程式正确的是( )
B
11.(2023·湖南郴州一模)铅丹(Pb3O4)可作防锈用涂料,其中铅的化合价为+2价和+4价,它与浓盐酸反应的化学方程式为Pb3O4+8HCl(浓) ══ 3PbCl2+Cl2↑+4H2O。下列说法正确的是( )
A.Pb3O4与浓盐酸反应时,Pb3O4作为还原剂
B.物质的氧化性:Cl2>Pb3O4
C.Pb3O4中+2价的铅与+4价的铅的物质的量之比为2∶1
D.当上述反应中消耗1 mol Pb3O4时,生成的氯气为22.4 L
C
解析 该反应中,Pb元素的化合价由+4价降低到+2价,则Pb3O4是氧化剂,A错误;Pb3O4是氧化剂,氯气是氧化产物,则氧化性:Pb3O4>Cl2,B错误;铅丹中Pb元素的化合价只有+2价、+4价,根据化合价代数和为0,则Pb3O4中Pb2+与Pb4+的物质的量之比为2∶1,C正确;反应中消耗1 mol Pb3O4时,生成1 mol Cl2,题目未指明是否处于标准状况下,不能确定氯气的体积,D错误。
12.(2023·河北衡水中学一调)水合肼(N2H4·H2O)的性质类似氨水。利用水合肼处理铜氨{[Cu(NH3)4]2+}废液回收铜粉的实验流程如图所示。下列说法错误的是( )
A.上述三步反应均为氧化还原反应
B.反应1的目的是制备NaClO
C.合成水合肼的反应中每消耗1 mol CO(NH2)2转移1 mol 电子
D.反应2为2[Cu(NH3)4]2++N2H4·H2O+4OH- 2Cu↓+N2↑+8NH3↑+5H2O
C
解析 第一步反应中Cl元素化合价发生变化,第二步反应中Cl、N元素化合价发生变化,第三步反应中Cu、N元素化合价发生变化,三步反应均为氧化还原反应,A正确;合成水合肼时需要用到NaClO,则反应1的目的是用氢氧化钠溶液与氯气反应制备NaClO,B正确;NaClO与CO(NH2)2反应合成水合肼的过程中,N元素化合价由-3价升高至-2价,化合价升高1价,消耗1 mol CO(NH2)2时转移2 mol电子,C错误;反应2为2[Cu(NH3)4]2++N2H4·H2O+4OH-
2Cu↓+N2↑+8NH3↑+5H2O,D正确。
13.(2023·河南开封一模)白色粉末X可能由BaCl2、Na2SO4、K2CO3、KOH、AgNO3和无水硫酸铜中的一种或几种组成。为了探究它的组成,进行了如图所示实验。
下列判断错误的是( )
A.取少量滤液A,加入足量稀盐酸,有气泡产生
B.若向滤液A中通入过量气体C,最终无沉淀
C.滤渣B和沉淀D的成分相同
D.白色粉末X中一定含有BaCl2、K2CO3和KOH
A
解析 将白色粉末加入足量水中充分溶解,过滤得到滤渣B和滤液A,在滤渣B中加入足量稀盐酸,滤渣B全部溶解并得到气体C和无色滤液,滤渣B中一定含有BaCO3,一定不含有BaSO4、AgCl、Cu(OH)2,则气体C为二氧化碳。白色粉末中一定含有BaCl2、K2CO3,不含有Na2SO4、AgNO3、无水CuSO4,可能含有KOH;将气体C通入滤液A中产生沉淀D,说明滤液A中一定含有BaCl2和KOH,不含有K2CO3,沉淀D为BaCO3,则白色粉末中一定含有BaCl2、K2CO3、KOH,滤渣B和沉淀D都是BaCO3,滤液A中一定含有BaCl2和KOH,气体C为CO2。
14.(2023·北京顺义区一模)以硫酸厂矿渣(含Fe2O3、α-Al2O3、SiO2等)为原料制备铁黄(FeOOH)的一种工艺流程如图所示:
已知:α-Al2O3化学性质极不活泼,不溶于水也不溶于酸或碱。
试回答下列问题:
(1)“还原”过程中的离子方程式为 。
(2)“滤渣”中主要成分为 (填化学式)。
Fe+2Fe3+ ══ 3Fe2+
α-Al2O3、SiO2和Fe
(3)①“沉铁”过程中有CO2气体产生,反应的离子方程式为 。
②“沉铁”过程中往往有副产物Fe(OH)2生成,分析原因是 。
(4)氧化过程生成铁黄的化学方程式为
。
Fe2++2 ══ FeCO3↓+CO2↑+H2O
加入NH4HCO3, 促进Fe2+水解,产生Fe(OH)2
4FeCO3+O2+2H2O ══ 4FeOOH+4CO2
解析 矿渣中含有Fe2O3、α-Al2O3及SiO2,先加稀硫酸溶解,Fe2O3溶解生成Fe3+,α-Al2O3、SiO2不溶解,通过过滤可以除去,加入铁粉将Fe3+还原为Fe2+,再用NH4HCO3将Fe2+转化为FeCO3沉淀,通入空气将FeCO3氧化得到铁黄(FeOOH)。
专题 离子反应 氧化还原反应 ----基础巩固练
2024
基础巩固练
1.(2023·广东汕头一模)下列化学品在生活、生产中应用广泛。下列有关物质的应用与氧化还原反应无关的是( )
A.工业上用硫铁矿(FeS2)为原料生产发烟硫酸
B.用Na2O2作潜水器的供氧剂
C.用食醋可除去暖水瓶中的水垢
D.用优质糯米为原料酿制白酒
C
解析 食醋与水垢中的CaCO3发生复分解反应生成可溶性醋酸钙,不涉及氧化还原反应,C符合题意。
2.(2023·天津河西区一模)下列过程体现所用物质的氧化性的是( )
A.用FeCl3溶液腐蚀铜板
B.用SO2的水溶液吸收Br2
C.用锌块防止钢铁船体腐蚀
D.用铁粉防止FeSO4溶液变质
A
解析 用氯化铁溶液腐蚀铜板,发生的反应为2FeCl3+Cu ══ CuCl2+2FeCl2,FeCl3体现了氧化性,A符合题意。
3.(2023·天津红桥区一模)用NaCl固体配制100 mL 1.00 mol·L-1的溶液,溶解过程如图所示。下列说法正确的是( )
A.a为Na+,b为Cl-
B.水分子破坏了NaCl中的离子键
C.NaCl只有在水溶液中才能发生电离
D.上述过程可表示为NaCl Na++Cl-
B
解析 水合a离子中H原子朝向中心离子,水合b离子中O原子朝向中心离子,根据正、负电荷相互吸引推测,a离子为Cl-,b离子为Na+,A错误;NaCl溶于水后,在水分子的作用下形成水合离子,水分子破坏了NaCl中的离子键,B正确;NaCl在熔融状态下也可发生电离,形成钠离子和氯离子,C错误;上述过程为氯化钠的电离,不需要通电,D错误。
4.(2023·广东佛山一模)离子鉴别能让我们感受微观世界的神奇。下列在透明溶液中能大量共存的离子组是( )
A
解析 酸性条件下, 与I-能发生氧化还原反应,不能大量共存,B错误;Al3+与S2-、 发生相互促进的水解反应,生成沉淀和气体,不能大量共存,C错误;Fe3+与SCN-反应生成Fe(SCN)3,不能大量共存,D错误。
5.(2023·天津红桥区一模)下列物质性质实验对应的离子方程式书写正确的是( )
D
解析 金属钠加入水中生成NaOH和氢气:2Na+2H2O ══ 2Na++2OH-+H2↑,A错误;AlCl3溶液中滴入过量NaOH溶液生成NaAlO2和H2O:Al3++4OH- ══ +2H2O,B错误;同浓度同体积的NH4HSO4溶液与NaOH溶液混合:H++OH- ══ H2O,C错误。
6.(2023·浙江丽水一模)关于反应2NaNO2+2KI+2H2SO4 ══ 2NO↑+I2+Na2SO4+K2SO4+2H2O,下列说法正确的是( )
A.KI发生还原反应
B.H2SO4既不是氧化剂,也不是还原剂
C.氧化产物与还原产物的物质的量之比为2∶1
D.消耗0.5 mol NaNO2时,转移1.0 mol电子
B
解析 该反应中,KI是还原剂,发生氧化反应,A错误;H2SO4中的元素化合价未变价,故H2SO4既不是氧化剂也不是还原剂,B正确;NaNO2中N元素化合价降低,NO为还原产物,KI中I元素化合价升高,I2为氧化产物,则氧化产物和还原产物的物质的量之比为1∶2,C错误;反应时NaNO2中N元素的化合价从+3价降低为+2价,则消耗0.5 mol NaNO2时转移0.5 mol电子,D错误。
7.(2023·湖北八市3月联考)下列各组离子在给定溶液中能大量共存的是
( )
A.0.1 mol·L-1 FeCl3溶液:Al3+、K+、Br-、I-
D
8.(2023·辽宁沈阳一模)明代《徐光启手迹》记载了制备王水的方法,其主要流程如图所示(水蒸气等部分产物已省略),下列说法中正确的是( )
A.X不能使酸性KMnO4溶液褪色
B.操作1利用了难挥发性酸制取挥发性酸
C.流程中涉及的均为非氧化还原反应
D.步骤ⅱ能在铁容器中进行
B
解析 FeSO4→Fe2O3,Fe元素化合价升高,根据氧化还原反应规律推知,部分硫元素化合价降低,则X为SO2,SO2能使酸性KMnO4溶液褪色,A错误;操作1后得到硝酸,该过程制取硝酸是利用了硝酸易挥发的性质,B正确;步骤ⅰ中煅烧绿矾生成SO2过程中,S、Fe的化合价发生变化,属于氧化还原反应,C错误;王水是浓硝酸和浓盐酸按体积比1∶3的混合物,会腐蚀铁容器,则步骤ⅱ不能在铁容器中进行,D错误。
9.(2023·山西太原一模)下列反应的离子方程式正确的是( )
A.向Na2S溶液中加入稀硝酸:S2-+2H+ ══ H2S↑
B.向H2O2溶液中滴入FeCl3溶液:H2O2+2Fe3+ ══ 2Fe2++O2↑+2H+
C.向AgCl沉淀中滴加浓氨水:2NH3·H2O+AgCl ══[Ag(NH3)2]++Cl-+2H2O
D.将NO、NO2混合气体通入NaOH溶液中:NO2+NO+2OH- ══
C
解析 向Na2S溶液中加入稀硝酸发生氧化还原反应,A错误;向H2O2溶液中滴入FeCl3溶液,Fe3+催化H2O2分解生成H2O和O2,FeCl3是催化剂,B错误;将体积比为1∶1的NO和NO2的混合气体通入NaOH溶液中生成NaNO2和H2O:NO2+NO+2OH- ══ 2 +H2O,D错误。
10.(2023·黑龙江哈尔滨一模)物质的用量可能影响反应的产物,下列离子方程式正确的是( )
B
11.(2023·湖南郴州一模)铅丹(Pb3O4)可作防锈用涂料,其中铅的化合价为+2价和+4价,它与浓盐酸反应的化学方程式为Pb3O4+8HCl(浓) ══ 3PbCl2+Cl2↑+4H2O。下列说法正确的是( )
A.Pb3O4与浓盐酸反应时,Pb3O4作为还原剂
B.物质的氧化性:Cl2>Pb3O4
C.Pb3O4中+2价的铅与+4价的铅的物质的量之比为2∶1
D.当上述反应中消耗1 mol Pb3O4时,生成的氯气为22.4 L
C
解析 该反应中,Pb元素的化合价由+4价降低到+2价,则Pb3O4是氧化剂,A错误;Pb3O4是氧化剂,氯气是氧化产物,则氧化性:Pb3O4>Cl2,B错误;铅丹中Pb元素的化合价只有+2价、+4价,根据化合价代数和为0,则Pb3O4中Pb2+与Pb4+的物质的量之比为2∶1,C正确;反应中消耗1 mol Pb3O4时,生成1 mol Cl2,题目未指明是否处于标准状况下,不能确定氯气的体积,D错误。
12.(2023·河北衡水中学一调)水合肼(N2H4·H2O)的性质类似氨水。利用水合肼处理铜氨{[Cu(NH3)4]2+}废液回收铜粉的实验流程如图所示。下列说法错误的是( )
A.上述三步反应均为氧化还原反应
B.反应1的目的是制备NaClO
C.合成水合肼的反应中每消耗1 mol CO(NH2)2转移1 mol 电子
D.反应2为2[Cu(NH3)4]2++N2H4·H2O+4OH- 2Cu↓+N2↑+8NH3↑+5H2O
C
解析 第一步反应中Cl元素化合价发生变化,第二步反应中Cl、N元素化合价发生变化,第三步反应中Cu、N元素化合价发生变化,三步反应均为氧化还原反应,A正确;合成水合肼时需要用到NaClO,则反应1的目的是用氢氧化钠溶液与氯气反应制备NaClO,B正确;NaClO与CO(NH2)2反应合成水合肼的过程中,N元素化合价由-3价升高至-2价,化合价升高1价,消耗1 mol CO(NH2)2时转移2 mol电子,C错误;反应2为2[Cu(NH3)4]2++N2H4·H2O+4OH-
2Cu↓+N2↑+8NH3↑+5H2O,D正确。
13.(2023·河南开封一模)白色粉末X可能由BaCl2、Na2SO4、K2CO3、KOH、AgNO3和无水硫酸铜中的一种或几种组成。为了探究它的组成,进行了如图所示实验。
下列判断错误的是( )
A.取少量滤液A,加入足量稀盐酸,有气泡产生
B.若向滤液A中通入过量气体C,最终无沉淀
C.滤渣B和沉淀D的成分相同
D.白色粉末X中一定含有BaCl2、K2CO3和KOH
A
解析 将白色粉末加入足量水中充分溶解,过滤得到滤渣B和滤液A,在滤渣B中加入足量稀盐酸,滤渣B全部溶解并得到气体C和无色滤液,滤渣B中一定含有BaCO3,一定不含有BaSO4、AgCl、Cu(OH)2,则气体C为二氧化碳。白色粉末中一定含有BaCl2、K2CO3,不含有Na2SO4、AgNO3、无水CuSO4,可能含有KOH;将气体C通入滤液A中产生沉淀D,说明滤液A中一定含有BaCl2和KOH,不含有K2CO3,沉淀D为BaCO3,则白色粉末中一定含有BaCl2、K2CO3、KOH,滤渣B和沉淀D都是BaCO3,滤液A中一定含有BaCl2和KOH,气体C为CO2。
14.(2023·北京顺义区一模)以硫酸厂矿渣(含Fe2O3、α-Al2O3、SiO2等)为原料制备铁黄(FeOOH)的一种工艺流程如图所示:
已知:α-Al2O3化学性质极不活泼,不溶于水也不溶于酸或碱。
试回答下列问题:
(1)“还原”过程中的离子方程式为 。
(2)“滤渣”中主要成分为 (填化学式)。
Fe+2Fe3+ ══ 3Fe2+
α-Al2O3、SiO2和Fe
(3)①“沉铁”过程中有CO2气体产生,反应的离子方程式为 。
②“沉铁”过程中往往有副产物Fe(OH)2生成,分析原因是 。
(4)氧化过程生成铁黄的化学方程式为
。
Fe2++2 ══ FeCO3↓+CO2↑+H2O
加入NH4HCO3, 促进Fe2+水解,产生Fe(OH)2
4FeCO3+O2+2H2O ══ 4FeOOH+4CO2
解析 矿渣中含有Fe2O3、α-Al2O3及SiO2,先加稀硫酸溶解,Fe2O3溶解生成Fe3+,α-Al2O3、SiO2不溶解,通过过滤可以除去,加入铁粉将Fe3+还原为Fe2+,再用NH4HCO3将Fe2+转化为FeCO3沉淀,通入空气将FeCO3氧化得到铁黄(FeOOH)。
同课章节目录
