专题 离子反应 氧化还原反应----能力提升练(共30张PPT)
文档属性
| 名称 | 专题 离子反应 氧化还原反应----能力提升练(共30张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 1.9MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-11-19 23:49:54 | ||
图片预览











文档简介
(共30张PPT)
专题 离子反应 氧化还原反应----能力提升练
2024
能力提升练
1.(2023·北京东城区一模)依据下列实验现象推测,其反应原理不涉及氧化还原反应的是( )
A.K2CO3溶液和NH4Cl溶液混合,产生刺激性气味
B.将钠放入CuSO4溶液中,有蓝色沉淀生成
C.向酸性KMnO4溶液中加入H2O2,溶液紫色褪去
D.氯水在光照条件下放置一段时间后,溶液的pH降低
A
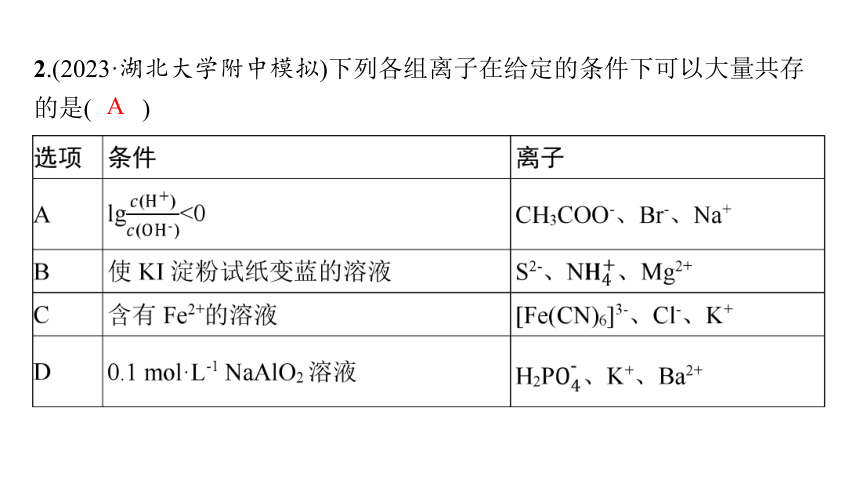
2.(2023·湖北大学附中模拟)下列各组离子在给定的条件下可以大量共存的是( )
A
3.(2023·山东青岛高三统考)高铜酸钾(KCuO2)是黑色固体,可通过如下反应制取:2CuO+2KO2 ══ O2↑+2KCuO2,下列说法错误的是( )
A.CuO中氧元素化合价不变
B.KCuO2可能具有强氧化性
C.该反应中每消耗0.2 mol CuO,转移0.2 mol电子
D.该反应中KO2既发生氧化反应又发生还原反应
C
解析 Cu由+2价变为+3价,2 mol CuO失去2 mol电子,2 mol KO2失去1 mol电子,故该反应中消耗0.2 mol CuO时转移0.3 mol电子,C错误。
4.(2023·天津新华中学模拟)下列离子方程式中正确的是( )
C
5.(2023·浙江浙南名校联盟联考)三氟化溴有强氧化性和强反应活性,是一种良好的非水溶剂,遇水立即发生如下反应:3BrF3+5H2O ══ HBrO3+Br2+9HF+O2↑,下列有关该反应的说法不正确的是( )
A.当0.5 mol H2O被氧化时,生成0.1 mol氧气
B.氧化剂与还原剂的物质的量之比为2∶3
C.当转移电子6 mol时,生成的还原产物为1 mol
D.当生成2.7 mol HF时,被BrF3还原的BrF3为0.2 mol
A
解析 该反应中5 mol H2O中有2 mol H2O发生氧化反应,生成1 mol O2,则0.5 mol H2O被氧化时生成0.25 mol O2,A错误;3 mol BrF3中作为氧化剂的BrF3有2 mol,作为还原剂的BrF3有1 mol,另有2 mol H2O也是还原剂,则氧化剂与还原剂的物质的量之比为2∶3,B正确;2 mol BrF3为氧化剂时,得到6 mol电子生成的还原产物为Br2,其物质的量为1 mol,C正确;生成9 mol HF时,有2 mol BrF3被还原,得到6 mol电子,有1 mol BrF3生成HBrO3失去2 mol电子,被1 mol BrF3还原的BrF3为 mol,则生成2.7 mol HF时,被BrF3还原的BrF3为0.2 mol,D正确。
6.(2023·安徽名校联盟联考)常温下,下列各组离子在指定溶液中一定能大量共存的是( )
C
7.(2023·广东东莞一模)已知有如下反应:①K2Cr2O7+14HCl(浓) ══ 2KCl+2CrCl3+3Cl2↑+7H2O;②Cr+2HCl(稀) ══ CrCl2+H2↑;③2KMnO4+16HCl(稀) ══ 2KCl+2MnCl2+5Cl2↑+8H2O。下列说法正确的是( )
A.氧化性:K2Cr2O7>KMnO4>Cl2
B.反应③中氧化剂与还原剂的物质的量之比为5∶1
C.向金属Cr中滴入浓硝酸无明显变化,说明两者不能发生反应
D.向Cr2(SO4)3溶液中滴入酸性KMnO4溶液,发生反应:
D
解析 根据①~③分别可得,氧化性:K2Cr2O7>Cl2、HCl>CrCl2、KMnO4>Cl2,①中使用浓盐酸,③中使用稀盐酸,则氧化性: KMnO4>K2Cr2O7,A错误。反应③中,氧化剂是KMnO4,还原剂是HCl,根据得失电子守恒可知,氧化剂和还原剂的物质的量之比为1∶5,B错误。②中Cr与稀盐酸反应生成H2,向金属Cr中滴入浓硝酸无明显变化,可能是发生了钝化,C错误。由于氧化性: KMnO4>K2Cr2O7,向Cr2(SO4)3溶液中滴入酸性KMnO4溶液,可发生氧化
8.(2023·山东济南一模)工业上可通过“酸性歧化法”和“电解法”制备KMnO4。“酸性歧化法”中,利用软锰矿(主要成分为MnO2)先生成K2MnO4,进而制备KMnO4,其流程如下所示。
实验室中模拟“酸性歧化法”制备KMnO4。下列说法正确的是( )
A.为加快“熔融”反应速率,可将矿石粉碎,并用玻璃棒不断翻炒固体
B.“酸化”时若改用盐酸,则反应为
C.“结晶”获取KMnO4晶体时采用蒸发结晶
D.该流程中涉及的氧化还原反应至少有2个
D
解析 制备KMnO4时,MnO2、KOH和O2在熔融状态下反应生成K2MnO4,反应后加水“溶浸”,使K2MnO4等可溶性物质溶解,并过滤,除去不溶性杂质,向滤液中通入过量CO2使溶液酸化,使K2MnO4发生歧化反应生成KMnO4和MnO2,过滤除去MnO2,将滤液进行结晶、过滤、洗涤、干燥等操作后可得到KMnO4晶体。玻璃中含有SiO2,高温下能与强碱KOH反应,故不能用玻璃棒翻炒固体,A错误;“酸化”时K2MnO4发生歧化反应生成KMnO4,KMnO4具有强氧化性,能与盐酸反应生成Cl2,故“酸化”时不能改用盐酸,B错误;酸化反应完成后过滤,高锰酸钾加热易分解,故应采用蒸发浓缩、冷却结晶的方法,C错误;“熔融”“酸化”过程均发生氧化还原反应,因此该流程中涉及的氧化还原反应至少有2个,D正确。
9.(2023·河南洛阳模拟)氮元素在自然界的某种转化示意图如图所示(a、b、c和d代表一定比例的H+和e-)。下列说法正确的是( )
A.过程①中 体现氧化性
B.过程②中发生反应的离子方程式
为 +H++e- ══ NO↑+H2O
C.过程③中c代表的是3H++3e-
D.过程④中1 mol N2H4参加反应
转移6 mol电子
A
10.(2023·湖南永州二模)乙二醇的生产工艺中,需使用热的K2CO3溶液(脱碳液)脱除CO2,脱碳液中含有的V2O5能减少溶液对管道的腐蚀。可使用“碘量法”测定脱碳液中V2O5的含量,操作中涉及两个反应如下:①V2O5+6HCl+2KI ══ 2VOCl2+2KCl+I2+3H2O;②I2+2Na2S2O3 ══ 2NaI+Na2S4O6。下列说法错误的是( )
A.反应①中氧化剂与还原剂物质的量之比为1∶2
B.反应①生成1 mol VOCl2时,反应转移1 mol电子
C.V的最高价为+5价,推测V2O5只有氧化性
D.溶液酸性过强时,反应②易发生其他反应
C
解析 KI中I元素的化合价由-1价升高到0价,则KI作还原剂,V2O5中V元素的化合价由+5价降低到+4价,则V2O5作氧化剂,故氧化剂与还原剂的物质的量之比为1∶2,A正确。生成2 mol VOCl2,转移2 mol电子,则生成1 mol VOCl2时转移1 mol电子,B正确;V2O5中V显+5价,处于最高价,O显-2价,处于最低价,即V2O5既具有氧化性又具有还原性,C错误;在酸性过强时, 与H+反应生成S、SO2和H2O,D正确。
11.(2023·安徽黄山一模)以含锌废液(主要成分为ZnSO4,含少量的Fe2+、Mn2+)为原料制备ZnCO3·2Zn(OH)2
的实验流程如下。下列说法不正确的是( )
A.1 mol过二硫酸钠(Na2S2O8)中含有σ键数为9NA(设NA为阿伏加德罗常数的值)
B.氧化除锰后的溶液中一定存在:Na+、Zn2+、Fe3+、
C.调节pH时试剂X可以选用Zn、ZnO、ZnCO3等物质
D.氧化除锰过程中生成MnO2的离子方程式:
C
解析 向含锌废液(主要成分为ZnSO4,含少量的Fe2+、Mn2+)中加入Na2S2O8溶液,生成MnO2沉淀且能将Fe2+氧化为Fe3+,过滤后向滤液中加入试剂X调节pH使Fe3+转化为Fe(OH)3沉淀,为了不引入新的杂质,试剂X可以为ZnO、ZnCO3、Zn(OH)2等,过滤后再加入NH4HCO3沉锌最后生成ZnCO3·2Zn(OH)2。 中含有1个过氧键(—O—O—),其结构式为
,单键均为σ键,双键中有1条σ键,1条π键,故1 mol过
二硫酸钠(Na2S2O8)中含有σ键数9NA,A正确;
12.(2023·安徽淮北一模)利用雾霾中的污染物NO、SO2获得产品NH4NO3的流程图如下,下列方程式错误的是( )
D
13.(2023·山东滨州综合测试)X溶液中含有下表所示离子中的5种,且其离子个数相等。向X溶液中加入足量稀盐酸有气体生成,反应前后阴离子种类不变。下列叙述错误的是(已知 对应还原产物为NO)( )
A.X溶液中含有3种阳离子、2种阴离子
B.原溶液中一定含有Mg2+
A
14.(2022·河北卷)以焙烧黄铁矿FeS2(杂质为石英等)产生的红渣为原料制备铵铁蓝
Fe(NH4)Fe(CN)6、
颜料。工艺流程如下:
回答下列问题:
(1)红渣的主要成分为 (填化学式);滤渣①的主要成分为
(填化学式)。
(2)黄铁矿研细的目的是 。
Fe2O3
SiO2
增大固液接触面积,加快反应速率,提高黄铁矿的利用率
(3)还原工序中,不生成S单质的反应的化学方程式为 。
(4)工序①的名称为 ,所得母液循环使用。
(5)沉铁工序产生的白色沉淀Fe(NH4)2Fe(CN)6中Fe的化合价为 ,氧化工序发生反应的离子方程式为
。
(6)若用还原工序得到的滤液制备Fe2O3·xH2O和(NH4)2SO4,所加试剂为
和 (填化学式,不引入杂质)。
7Fe2(SO4)3+FeS2+8H2O 15FeSO4+8H2SO4
蒸发浓缩、冷却结晶、过滤、洗涤
+2价
H2O2
NH3·H2O
专题 离子反应 氧化还原反应----能力提升练
2024
能力提升练
1.(2023·北京东城区一模)依据下列实验现象推测,其反应原理不涉及氧化还原反应的是( )
A.K2CO3溶液和NH4Cl溶液混合,产生刺激性气味
B.将钠放入CuSO4溶液中,有蓝色沉淀生成
C.向酸性KMnO4溶液中加入H2O2,溶液紫色褪去
D.氯水在光照条件下放置一段时间后,溶液的pH降低
A
2.(2023·湖北大学附中模拟)下列各组离子在给定的条件下可以大量共存的是( )
A
3.(2023·山东青岛高三统考)高铜酸钾(KCuO2)是黑色固体,可通过如下反应制取:2CuO+2KO2 ══ O2↑+2KCuO2,下列说法错误的是( )
A.CuO中氧元素化合价不变
B.KCuO2可能具有强氧化性
C.该反应中每消耗0.2 mol CuO,转移0.2 mol电子
D.该反应中KO2既发生氧化反应又发生还原反应
C
解析 Cu由+2价变为+3价,2 mol CuO失去2 mol电子,2 mol KO2失去1 mol电子,故该反应中消耗0.2 mol CuO时转移0.3 mol电子,C错误。
4.(2023·天津新华中学模拟)下列离子方程式中正确的是( )
C
5.(2023·浙江浙南名校联盟联考)三氟化溴有强氧化性和强反应活性,是一种良好的非水溶剂,遇水立即发生如下反应:3BrF3+5H2O ══ HBrO3+Br2+9HF+O2↑,下列有关该反应的说法不正确的是( )
A.当0.5 mol H2O被氧化时,生成0.1 mol氧气
B.氧化剂与还原剂的物质的量之比为2∶3
C.当转移电子6 mol时,生成的还原产物为1 mol
D.当生成2.7 mol HF时,被BrF3还原的BrF3为0.2 mol
A
解析 该反应中5 mol H2O中有2 mol H2O发生氧化反应,生成1 mol O2,则0.5 mol H2O被氧化时生成0.25 mol O2,A错误;3 mol BrF3中作为氧化剂的BrF3有2 mol,作为还原剂的BrF3有1 mol,另有2 mol H2O也是还原剂,则氧化剂与还原剂的物质的量之比为2∶3,B正确;2 mol BrF3为氧化剂时,得到6 mol电子生成的还原产物为Br2,其物质的量为1 mol,C正确;生成9 mol HF时,有2 mol BrF3被还原,得到6 mol电子,有1 mol BrF3生成HBrO3失去2 mol电子,被1 mol BrF3还原的BrF3为 mol,则生成2.7 mol HF时,被BrF3还原的BrF3为0.2 mol,D正确。
6.(2023·安徽名校联盟联考)常温下,下列各组离子在指定溶液中一定能大量共存的是( )
C
7.(2023·广东东莞一模)已知有如下反应:①K2Cr2O7+14HCl(浓) ══ 2KCl+2CrCl3+3Cl2↑+7H2O;②Cr+2HCl(稀) ══ CrCl2+H2↑;③2KMnO4+16HCl(稀) ══ 2KCl+2MnCl2+5Cl2↑+8H2O。下列说法正确的是( )
A.氧化性:K2Cr2O7>KMnO4>Cl2
B.反应③中氧化剂与还原剂的物质的量之比为5∶1
C.向金属Cr中滴入浓硝酸无明显变化,说明两者不能发生反应
D.向Cr2(SO4)3溶液中滴入酸性KMnO4溶液,发生反应:
D
解析 根据①~③分别可得,氧化性:K2Cr2O7>Cl2、HCl>CrCl2、KMnO4>Cl2,①中使用浓盐酸,③中使用稀盐酸,则氧化性: KMnO4>K2Cr2O7,A错误。反应③中,氧化剂是KMnO4,还原剂是HCl,根据得失电子守恒可知,氧化剂和还原剂的物质的量之比为1∶5,B错误。②中Cr与稀盐酸反应生成H2,向金属Cr中滴入浓硝酸无明显变化,可能是发生了钝化,C错误。由于氧化性: KMnO4>K2Cr2O7,向Cr2(SO4)3溶液中滴入酸性KMnO4溶液,可发生氧化
8.(2023·山东济南一模)工业上可通过“酸性歧化法”和“电解法”制备KMnO4。“酸性歧化法”中,利用软锰矿(主要成分为MnO2)先生成K2MnO4,进而制备KMnO4,其流程如下所示。
实验室中模拟“酸性歧化法”制备KMnO4。下列说法正确的是( )
A.为加快“熔融”反应速率,可将矿石粉碎,并用玻璃棒不断翻炒固体
B.“酸化”时若改用盐酸,则反应为
C.“结晶”获取KMnO4晶体时采用蒸发结晶
D.该流程中涉及的氧化还原反应至少有2个
D
解析 制备KMnO4时,MnO2、KOH和O2在熔融状态下反应生成K2MnO4,反应后加水“溶浸”,使K2MnO4等可溶性物质溶解,并过滤,除去不溶性杂质,向滤液中通入过量CO2使溶液酸化,使K2MnO4发生歧化反应生成KMnO4和MnO2,过滤除去MnO2,将滤液进行结晶、过滤、洗涤、干燥等操作后可得到KMnO4晶体。玻璃中含有SiO2,高温下能与强碱KOH反应,故不能用玻璃棒翻炒固体,A错误;“酸化”时K2MnO4发生歧化反应生成KMnO4,KMnO4具有强氧化性,能与盐酸反应生成Cl2,故“酸化”时不能改用盐酸,B错误;酸化反应完成后过滤,高锰酸钾加热易分解,故应采用蒸发浓缩、冷却结晶的方法,C错误;“熔融”“酸化”过程均发生氧化还原反应,因此该流程中涉及的氧化还原反应至少有2个,D正确。
9.(2023·河南洛阳模拟)氮元素在自然界的某种转化示意图如图所示(a、b、c和d代表一定比例的H+和e-)。下列说法正确的是( )
A.过程①中 体现氧化性
B.过程②中发生反应的离子方程式
为 +H++e- ══ NO↑+H2O
C.过程③中c代表的是3H++3e-
D.过程④中1 mol N2H4参加反应
转移6 mol电子
A
10.(2023·湖南永州二模)乙二醇的生产工艺中,需使用热的K2CO3溶液(脱碳液)脱除CO2,脱碳液中含有的V2O5能减少溶液对管道的腐蚀。可使用“碘量法”测定脱碳液中V2O5的含量,操作中涉及两个反应如下:①V2O5+6HCl+2KI ══ 2VOCl2+2KCl+I2+3H2O;②I2+2Na2S2O3 ══ 2NaI+Na2S4O6。下列说法错误的是( )
A.反应①中氧化剂与还原剂物质的量之比为1∶2
B.反应①生成1 mol VOCl2时,反应转移1 mol电子
C.V的最高价为+5价,推测V2O5只有氧化性
D.溶液酸性过强时,反应②易发生其他反应
C
解析 KI中I元素的化合价由-1价升高到0价,则KI作还原剂,V2O5中V元素的化合价由+5价降低到+4价,则V2O5作氧化剂,故氧化剂与还原剂的物质的量之比为1∶2,A正确。生成2 mol VOCl2,转移2 mol电子,则生成1 mol VOCl2时转移1 mol电子,B正确;V2O5中V显+5价,处于最高价,O显-2价,处于最低价,即V2O5既具有氧化性又具有还原性,C错误;在酸性过强时, 与H+反应生成S、SO2和H2O,D正确。
11.(2023·安徽黄山一模)以含锌废液(主要成分为ZnSO4,含少量的Fe2+、Mn2+)为原料制备ZnCO3·2Zn(OH)2
的实验流程如下。下列说法不正确的是( )
A.1 mol过二硫酸钠(Na2S2O8)中含有σ键数为9NA(设NA为阿伏加德罗常数的值)
B.氧化除锰后的溶液中一定存在:Na+、Zn2+、Fe3+、
C.调节pH时试剂X可以选用Zn、ZnO、ZnCO3等物质
D.氧化除锰过程中生成MnO2的离子方程式:
C
解析 向含锌废液(主要成分为ZnSO4,含少量的Fe2+、Mn2+)中加入Na2S2O8溶液,生成MnO2沉淀且能将Fe2+氧化为Fe3+,过滤后向滤液中加入试剂X调节pH使Fe3+转化为Fe(OH)3沉淀,为了不引入新的杂质,试剂X可以为ZnO、ZnCO3、Zn(OH)2等,过滤后再加入NH4HCO3沉锌最后生成ZnCO3·2Zn(OH)2。 中含有1个过氧键(—O—O—),其结构式为
,单键均为σ键,双键中有1条σ键,1条π键,故1 mol过
二硫酸钠(Na2S2O8)中含有σ键数9NA,A正确;
12.(2023·安徽淮北一模)利用雾霾中的污染物NO、SO2获得产品NH4NO3的流程图如下,下列方程式错误的是( )
D
13.(2023·山东滨州综合测试)X溶液中含有下表所示离子中的5种,且其离子个数相等。向X溶液中加入足量稀盐酸有气体生成,反应前后阴离子种类不变。下列叙述错误的是(已知 对应还原产物为NO)( )
A.X溶液中含有3种阳离子、2种阴离子
B.原溶液中一定含有Mg2+
A
14.(2022·河北卷)以焙烧黄铁矿FeS2(杂质为石英等)产生的红渣为原料制备铵铁蓝
Fe(NH4)Fe(CN)6、
颜料。工艺流程如下:
回答下列问题:
(1)红渣的主要成分为 (填化学式);滤渣①的主要成分为
(填化学式)。
(2)黄铁矿研细的目的是 。
Fe2O3
SiO2
增大固液接触面积,加快反应速率,提高黄铁矿的利用率
(3)还原工序中,不生成S单质的反应的化学方程式为 。
(4)工序①的名称为 ,所得母液循环使用。
(5)沉铁工序产生的白色沉淀Fe(NH4)2Fe(CN)6中Fe的化合价为 ,氧化工序发生反应的离子方程式为
。
(6)若用还原工序得到的滤液制备Fe2O3·xH2O和(NH4)2SO4,所加试剂为
和 (填化学式,不引入杂质)。
7Fe2(SO4)3+FeS2+8H2O 15FeSO4+8H2SO4
蒸发浓缩、冷却结晶、过滤、洗涤
+2价
H2O2
NH3·H2O
同课章节目录
