专题 元素及其化合物——专题突破练 能力提升练(共25张PPT)
文档属性
| 名称 | 专题 元素及其化合物——专题突破练 能力提升练(共25张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 2.3MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-11-19 23:59:03 | ||
图片预览







文档简介
(共25张PPT)
专题四 元素及其化合物
----能力提升练
2024
能力提升练
1.(2023·山东菏泽一模)下列有关物质的性质与应用之间具有对应关系的有( )
①浓硫酸具有脱水性,可用于干燥氯气
②二氧化氯具有强氧化性,可用作饮用水消毒
③Al(OH)3能与盐酸反应,可用作胃酸中和剂
④石英坩埚耐高温,可用来加热熔化烧碱、纯碱等固体
⑤锌的金属活泼性比铁强,可在轮船外壳上装若干锌块以减缓其腐蚀
A.2种 B.3种 C.4种 D.5种
B
解析 浓硫酸具有吸水性,可用于干燥氯气,①错误;二氧化氯具有强氧化性,可使细菌体内蛋白质变性,故可用作饮用水消毒,②正确;Al(OH)3的碱性较弱,能与盐酸反应,可用作胃酸中和剂,③正确;高温下,SiO2可与烧碱、纯碱等反应,故石英坩埚不能用来加热熔化烧碱、纯碱等固体,④错误;锌的金属活泼性比铁强,锌、铁构成的原电池中锌是负极,可在轮船外壳上装若干锌块以减缓其腐蚀,⑤正确。
2.(2023·安徽淮北一模)元素及其化合物在化工生产中有着重要的用途,下列说法正确的是( )
A.工业上以二氧化硅为原料制备高纯硅,还需要用到焦炭、氢气、氯化氢等原料
B.工业上制硫酸是用98.3%的硫酸吸收二氧化硫
C.工业上生产玻璃和水泥时均使用纯碱和石灰石作为原料
D.工业上制取钠单质普遍采用电解熔融的氢氧化钠
A
解析 工业上制硫酸是用98.3%的浓硫酸吸收三氧化硫,B错误;生产水泥的原料是黏土和石灰石,生产玻璃的原料是纯碱、石灰石和石英,工业上生产玻璃和水泥时均使用的原料是石灰石,C错误;工业上制取钠单质普遍采用电解熔融的氯化钠,氢氧化钠的成本较高,不适合工业上生产钠,D错误。
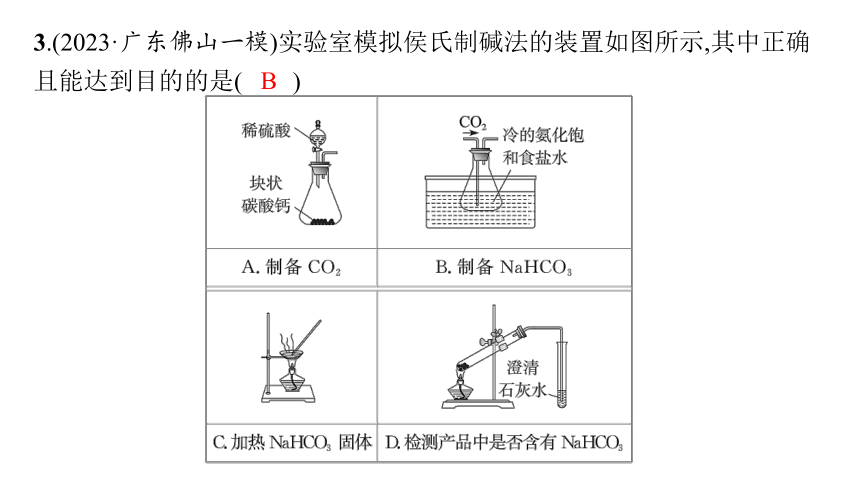
3.(2023·广东佛山一模)实验室模拟侯氏制碱法的装置如图所示,其中正确且能达到目的的是( )
B
解析 由于CaCO3与稀硫酸反应生成的CaSO4是微溶物,会覆盖在CaCO3表面阻止反应继续进行,故实验室制备CO2常用CaCO3与稀盐酸反应,不用稀硫酸,A错误;向冷的氨化饱和食盐水中通入CO2,发生反应NaCl+H2O+NH3+CO2 ══ NaHCO3↓+NH4Cl,故可获得NaHCO3固体,B正确;加热固体不能用蒸发皿,应该用坩埚,C错误;加热固体时试管口应向下倾斜,D错误。
4.(2023·河北邯郸一模)已知甲、乙为单质,丙为化合物。不能实现下述转化关系的是( )
A.若向丙的溶液中滴加NaOH溶液有蓝色沉淀生成,则甲可能为Cu
B.若丙的溶液遇Na2CO3放出气体CO2,则甲可能是H2
C.若向丙的溶液中滴加KSCN溶液显红色,则甲可能为Fe
D.若丙溶于水后得到强碱溶液,则甲可能是O2
C
解析 若向丙的溶液中滴加KSCN溶液显红色,则丙中含有Fe3+,电解铁盐溶液不能生成Fe单质,不符合转化关系,C错误。
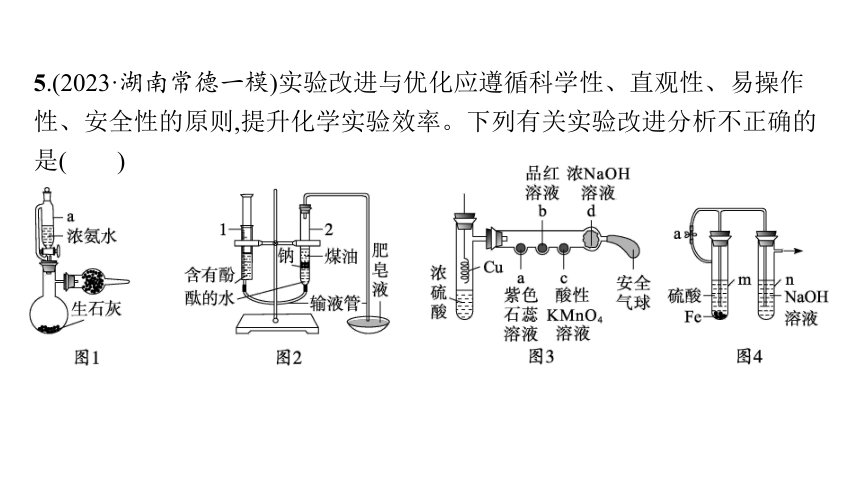
5.(2023·湖南常德一模)实验改进与优化应遵循科学性、直观性、易操作性、安全性的原则,提升化学实验效率。下列有关实验改进分析不正确的是( )
A.图1使用恒压滴液漏斗可防止浓氨水污染环境,并使漏斗内液体顺利
流下
B.图2用点燃的木条靠近肥皂泡,听到爆鸣声,可检验产物中有氢气
C.图3改进装置可用于SO2性质的探究实验
D.利用图4装置可较长时间看到白色絮状沉淀
答案 C
解析 铜和浓硫酸需要加热才能反应生成二氧化硫,C错误。
6.(2023·广东湛江一模)物质的类别和核心元素的化合价是研究物质性质的两个重要维度。下图为氮、硫的单质及其部分化合物的“价—类”二维图。下列说法不正确的是( )
A.坐标轴左侧区域代表的是氮的单质及其化合物
B.a→b→c→d→e的转化均能一步实现
C.c、d和i、j均属于酸性氧化物
D.f与l可以是同一种物质
C
解析 从图中元素化合价判断,左侧区域代表氮的单质及其化合物,右侧区域代表硫的单质及其化合物,A正确;b是S,c是SO2,S与O2反应生成SO2,SO2被氧化生成SO3,SO3与水反应生成H2SO4,均能一步转化,B正确;c是SO2,d是SO3,都是酸性氧化物,i是NO,j是NO2,NO和NO2都不是酸性氧化物,C错误;f是硫酸盐,l是铵盐,二者可以是同种物质,如(NH4)2SO4,D正确。
7.(2023·河南濮阳一模)利用如图所示装置进行下列实验(部分夹持和尾气处理装置省略),相应实验现象描述正确的是( )
选项 Ⅰ处试剂 Ⅱ处用品 实验现象
A NH4Cl 湿润的蓝色石蕊试纸 Ⅰ处产生白烟,Ⅱ处蓝色石蕊试纸变红
B Cu2(OH)2CO3 过氧化钠粉末 Ⅰ处由绿色变黑色,Ⅱ处由淡黄色变白色
C KClO3 湿润的淀粉试纸 Ⅰ处无明显现象,Ⅱ处淀粉试纸变蓝
D 氧化铁和碳粉的混合物 氧化铜粉末 Ⅰ处由黑色变银白色,Ⅱ处由黑色变红色
B
解析 氯化铵受热分解为NH3和HCl,在试管口遇冷又重新生成氯化铵,因此Ⅱ处蓝色石蕊试纸不会变红,A错误。Cu2(OH)2CO3受热分解为CuO、CO2、H2O,Cu2(OH)2CO3为绿色,CuO为黑色;Ⅰ处固体颜色由绿色变为黑色,二氧化碳、水能与Na2O2反应,Ⅱ处固体颜色由淡黄色变为白色,B正确。氯酸钾在二氧化锰作催化剂条件下加热得到KCl和氧气,题中没有给出MnO2,且Ⅱ处没有I2生成,则Ⅰ、Ⅱ处均无明显现象,C错误。氧化铁与碳粉在加热条件下发生反应2Fe2O3+3C 4Fe+3CO2↑或Fe2O3+3C 2Fe+3CO↑,氧化铁为红棕色,CO2不与CuO反应,CO与CuO加热条件下才反应,因此Ⅱ处无明显现象,D错误。
8.(2023·山东济宁一模)碱式碳酸铜[Cu2(OH)2CO3]是一种用途广泛的化工原料,实验室中以废铜屑为原料制取碱式碳酸铜的流程如下。下列说法错误的是( )
A.“加热”步骤可选用水浴加热
B.“酸浸”产生的气体可用NaOH溶液吸收
C.“滤液”中溶质的主要成分为NaNO3
D.可用盐酸和BaCl2溶液检验“滤液”中是否有
B
解析 “加热”的温度为70 ℃,可选用水浴加热,A正确;“酸浸”产生的气体为NO,NO与NaOH溶液不反应,不能用NaOH溶液吸收,B错误;“滤液”中溶质的主要成分为NaNO3等,C正确;检验 时,先加入氯化钡溶液,产生白色沉淀,再往白色沉淀中加入盐酸,沉淀完全溶解,且产生无色无味气体,说明有 ,否则没有,D正确。
9.(2023·天津东丽区一模)如图所示仪器可用于实验室制备少量无水FeCl3(已知:FeCl3遇水易水解),则下列说法正确的是( )
A.该实验中用于制Cl2的KMnO4也可以换成MnO2
B.仪器的接口顺序为a→e→d→h→i→c→b→g
C.可将制得的FeCl3先溶于较浓的盐酸中,再加水至指定体积,配成一定浓度的FeCl3溶液
D.用于干燥Cl2的浓硫酸可换成碱石灰
C
解析 常温下MnO2与浓盐酸不发生反应,不能换成MnO2,A错误;KMnO4与浓盐酸反应制取的Cl2中混有HCl、H2O(g),先通过饱和NaCl溶液除去HCl,再通过浓硫酸除去H2O(g),干燥的Cl2与铁粉在加热时反应生成FeCl3,用NaOH溶液吸收尾气Cl2,由于FeCl3遇水易水解,在连接盛有NaOH溶液洗气瓶前要接盛有浓硫酸的洗气瓶,防止NaOH溶液中H2O(g)进入,故仪器的接口顺序为a→e→d→c→b→h→i(或i→h)→c→b→g,B错误;FeCl3易发生水解反应,配制其溶液时,要先将FeCl3溶于较浓的盐酸中,再加水稀释,C正确;Cl2可与碱石灰反应,故用于干燥Cl2的浓硫酸不能换成碱石灰,D错误。
10.(2023·福建厦门外国语学校模拟)我国科学家研究在Pd/SVG催化剂上H2还原NO生成N2和NH3的路径,各基元反应及活化能Ea(kJ·mol-1)如图所示,下列说法错误的是( )
A.生成NH3的各基元反应中,N元素均
被还原
B.生成NH3的总反应方程式为
5H2+2NO 2H2O+2NH3
C.生成N2的总反应方程式为2H2+2NO N2+2H2O
D.在Pd/SVG催化剂上,NO更容易被H2还原为N2
D
11.(2023·湖北重点校联合调研)钾长石(K2O·Al2O3·6SiO2)是含钾量较高、分布较广、储量较大的非水溶性钾资源,以钾长石为原料制取钾肥K2CO3的一种工艺流程如图所示。已知:钾长石中的钾元素和铝元素在Na2CO3作用下转化为NaAlO2和KAlO2。下列说法正确的是( )
A.可用“水浸”操作直接提取钾长石中的主要成分
B.“浸渣Ⅰ”可以作为冶炼金属铝的主要原料
C.“碱化”时发生的主要反应为
D.流程中只有CO2可循环利用
答案 C
解析 钾长石是非水溶性钾资源,不能用“水浸”操作直接提取其中的主要成分,A错误;“煅烧”时铝元素转化为NaAlO2和KAlO2,“水浸”时二者均进入溶液,则“浸渣Ⅰ”不能冶炼金属铝,B错误;加入NaOH溶液碱化时,NaHCO3、KHCO3分别转化为Na2CO3、K2CO3: ,C正确;流程中除CO2可以循环利用外,Na2CO3也可循环利用,D错误。
12.(2023·四川巴中一模)硫代硫酸钠(Na2S2O3)在工业、医药等领域应用广泛。如图为实验室制取硫代硫酸钠的装置,反应过程中需通过pH传感器控制pH为7~8。
(1)盛Na2SO3的仪器名称为 。
(2)为了确保硫代硫酸钠的产量,实验中通入的SO2不能过量,原因是 。
蒸馏烧瓶
若SO2过量,溶液显酸性,产物发生反应导致产量减少
(3)若n(Na2CO3)∶n(Na2S)=1∶2,则装置C中反应的化学方程式为 。
(4)当数据采集处pH接近7时,应采取的操作为________________________
。
(5)装置B中的药品可以选择下列物质中的 (填字母)。
A.饱和NaHCO3溶液
B.饱和NaHSO3溶液
C.NaOH溶液
D.酸性KMnO4溶液
Na2CO3+2Na2S+4SO2 ══ 3Na2S2O3+CO2
控制分液漏斗的活塞,调节滴
加硫酸的速率,同时调节三通阀的方向使二氧化硫进入B装置
ACD
(6)现使用“碘量法”测定脱碳液中V2O5的含量:取m g脱碳液置于锥形瓶中,向锥形瓶中加入适量盐酸和足量KI溶液,发生反应为V2O5+6HCl+2KI ══ 2VOCl2+2KCl+I2+3H2O,此时溶液颜色为棕色,使用0.100 0 mol·L-1的Na2S2O3溶液滴定,消耗Na2S2O3溶液V mL,该过程的反应为I2+2Na2S2O3 ══ 2NaI+Na2S4O6。(已知有色离子仅有VO2+,其颜色为蓝色)
①滴定终点的现象为
。
②若滴定时,滴定管未用标准液润洗,则测得V2O5的含量 (填“偏大”“偏小”或“无影响”)。
③脱碳液中V2O5的质量分数为 %。
滴入最后半滴硫代硫酸钠时,溶液由棕色变为蓝色,且半分钟内不恢复
偏大
解析 (5)装置B的作用是吸收SO2尾气。饱和NaHCO3溶液能用于吸收SO2,A正确;饱和NaHSO3溶液不能吸收SO2,B错误;NaOH溶液能用于吸收SO2,C正确;SO2能被酸性KMnO4溶液氧化吸收,D正确。
(6)当溶液中I2被完全消耗时即为反应终点,溶液由棕色变为蓝色。若滴定管未润洗,Na2S2O3溶液被稀释而导致V增大,则测得V2O5含量偏大。由反应得到关系式为V2O5~I2~2Na2S2O3,n(Na2S2O3)=10-4V mol,则
专题四 元素及其化合物
----能力提升练
2024
能力提升练
1.(2023·山东菏泽一模)下列有关物质的性质与应用之间具有对应关系的有( )
①浓硫酸具有脱水性,可用于干燥氯气
②二氧化氯具有强氧化性,可用作饮用水消毒
③Al(OH)3能与盐酸反应,可用作胃酸中和剂
④石英坩埚耐高温,可用来加热熔化烧碱、纯碱等固体
⑤锌的金属活泼性比铁强,可在轮船外壳上装若干锌块以减缓其腐蚀
A.2种 B.3种 C.4种 D.5种
B
解析 浓硫酸具有吸水性,可用于干燥氯气,①错误;二氧化氯具有强氧化性,可使细菌体内蛋白质变性,故可用作饮用水消毒,②正确;Al(OH)3的碱性较弱,能与盐酸反应,可用作胃酸中和剂,③正确;高温下,SiO2可与烧碱、纯碱等反应,故石英坩埚不能用来加热熔化烧碱、纯碱等固体,④错误;锌的金属活泼性比铁强,锌、铁构成的原电池中锌是负极,可在轮船外壳上装若干锌块以减缓其腐蚀,⑤正确。
2.(2023·安徽淮北一模)元素及其化合物在化工生产中有着重要的用途,下列说法正确的是( )
A.工业上以二氧化硅为原料制备高纯硅,还需要用到焦炭、氢气、氯化氢等原料
B.工业上制硫酸是用98.3%的硫酸吸收二氧化硫
C.工业上生产玻璃和水泥时均使用纯碱和石灰石作为原料
D.工业上制取钠单质普遍采用电解熔融的氢氧化钠
A
解析 工业上制硫酸是用98.3%的浓硫酸吸收三氧化硫,B错误;生产水泥的原料是黏土和石灰石,生产玻璃的原料是纯碱、石灰石和石英,工业上生产玻璃和水泥时均使用的原料是石灰石,C错误;工业上制取钠单质普遍采用电解熔融的氯化钠,氢氧化钠的成本较高,不适合工业上生产钠,D错误。
3.(2023·广东佛山一模)实验室模拟侯氏制碱法的装置如图所示,其中正确且能达到目的的是( )
B
解析 由于CaCO3与稀硫酸反应生成的CaSO4是微溶物,会覆盖在CaCO3表面阻止反应继续进行,故实验室制备CO2常用CaCO3与稀盐酸反应,不用稀硫酸,A错误;向冷的氨化饱和食盐水中通入CO2,发生反应NaCl+H2O+NH3+CO2 ══ NaHCO3↓+NH4Cl,故可获得NaHCO3固体,B正确;加热固体不能用蒸发皿,应该用坩埚,C错误;加热固体时试管口应向下倾斜,D错误。
4.(2023·河北邯郸一模)已知甲、乙为单质,丙为化合物。不能实现下述转化关系的是( )
A.若向丙的溶液中滴加NaOH溶液有蓝色沉淀生成,则甲可能为Cu
B.若丙的溶液遇Na2CO3放出气体CO2,则甲可能是H2
C.若向丙的溶液中滴加KSCN溶液显红色,则甲可能为Fe
D.若丙溶于水后得到强碱溶液,则甲可能是O2
C
解析 若向丙的溶液中滴加KSCN溶液显红色,则丙中含有Fe3+,电解铁盐溶液不能生成Fe单质,不符合转化关系,C错误。
5.(2023·湖南常德一模)实验改进与优化应遵循科学性、直观性、易操作性、安全性的原则,提升化学实验效率。下列有关实验改进分析不正确的是( )
A.图1使用恒压滴液漏斗可防止浓氨水污染环境,并使漏斗内液体顺利
流下
B.图2用点燃的木条靠近肥皂泡,听到爆鸣声,可检验产物中有氢气
C.图3改进装置可用于SO2性质的探究实验
D.利用图4装置可较长时间看到白色絮状沉淀
答案 C
解析 铜和浓硫酸需要加热才能反应生成二氧化硫,C错误。
6.(2023·广东湛江一模)物质的类别和核心元素的化合价是研究物质性质的两个重要维度。下图为氮、硫的单质及其部分化合物的“价—类”二维图。下列说法不正确的是( )
A.坐标轴左侧区域代表的是氮的单质及其化合物
B.a→b→c→d→e的转化均能一步实现
C.c、d和i、j均属于酸性氧化物
D.f与l可以是同一种物质
C
解析 从图中元素化合价判断,左侧区域代表氮的单质及其化合物,右侧区域代表硫的单质及其化合物,A正确;b是S,c是SO2,S与O2反应生成SO2,SO2被氧化生成SO3,SO3与水反应生成H2SO4,均能一步转化,B正确;c是SO2,d是SO3,都是酸性氧化物,i是NO,j是NO2,NO和NO2都不是酸性氧化物,C错误;f是硫酸盐,l是铵盐,二者可以是同种物质,如(NH4)2SO4,D正确。
7.(2023·河南濮阳一模)利用如图所示装置进行下列实验(部分夹持和尾气处理装置省略),相应实验现象描述正确的是( )
选项 Ⅰ处试剂 Ⅱ处用品 实验现象
A NH4Cl 湿润的蓝色石蕊试纸 Ⅰ处产生白烟,Ⅱ处蓝色石蕊试纸变红
B Cu2(OH)2CO3 过氧化钠粉末 Ⅰ处由绿色变黑色,Ⅱ处由淡黄色变白色
C KClO3 湿润的淀粉试纸 Ⅰ处无明显现象,Ⅱ处淀粉试纸变蓝
D 氧化铁和碳粉的混合物 氧化铜粉末 Ⅰ处由黑色变银白色,Ⅱ处由黑色变红色
B
解析 氯化铵受热分解为NH3和HCl,在试管口遇冷又重新生成氯化铵,因此Ⅱ处蓝色石蕊试纸不会变红,A错误。Cu2(OH)2CO3受热分解为CuO、CO2、H2O,Cu2(OH)2CO3为绿色,CuO为黑色;Ⅰ处固体颜色由绿色变为黑色,二氧化碳、水能与Na2O2反应,Ⅱ处固体颜色由淡黄色变为白色,B正确。氯酸钾在二氧化锰作催化剂条件下加热得到KCl和氧气,题中没有给出MnO2,且Ⅱ处没有I2生成,则Ⅰ、Ⅱ处均无明显现象,C错误。氧化铁与碳粉在加热条件下发生反应2Fe2O3+3C 4Fe+3CO2↑或Fe2O3+3C 2Fe+3CO↑,氧化铁为红棕色,CO2不与CuO反应,CO与CuO加热条件下才反应,因此Ⅱ处无明显现象,D错误。
8.(2023·山东济宁一模)碱式碳酸铜[Cu2(OH)2CO3]是一种用途广泛的化工原料,实验室中以废铜屑为原料制取碱式碳酸铜的流程如下。下列说法错误的是( )
A.“加热”步骤可选用水浴加热
B.“酸浸”产生的气体可用NaOH溶液吸收
C.“滤液”中溶质的主要成分为NaNO3
D.可用盐酸和BaCl2溶液检验“滤液”中是否有
B
解析 “加热”的温度为70 ℃,可选用水浴加热,A正确;“酸浸”产生的气体为NO,NO与NaOH溶液不反应,不能用NaOH溶液吸收,B错误;“滤液”中溶质的主要成分为NaNO3等,C正确;检验 时,先加入氯化钡溶液,产生白色沉淀,再往白色沉淀中加入盐酸,沉淀完全溶解,且产生无色无味气体,说明有 ,否则没有,D正确。
9.(2023·天津东丽区一模)如图所示仪器可用于实验室制备少量无水FeCl3(已知:FeCl3遇水易水解),则下列说法正确的是( )
A.该实验中用于制Cl2的KMnO4也可以换成MnO2
B.仪器的接口顺序为a→e→d→h→i→c→b→g
C.可将制得的FeCl3先溶于较浓的盐酸中,再加水至指定体积,配成一定浓度的FeCl3溶液
D.用于干燥Cl2的浓硫酸可换成碱石灰
C
解析 常温下MnO2与浓盐酸不发生反应,不能换成MnO2,A错误;KMnO4与浓盐酸反应制取的Cl2中混有HCl、H2O(g),先通过饱和NaCl溶液除去HCl,再通过浓硫酸除去H2O(g),干燥的Cl2与铁粉在加热时反应生成FeCl3,用NaOH溶液吸收尾气Cl2,由于FeCl3遇水易水解,在连接盛有NaOH溶液洗气瓶前要接盛有浓硫酸的洗气瓶,防止NaOH溶液中H2O(g)进入,故仪器的接口顺序为a→e→d→c→b→h→i(或i→h)→c→b→g,B错误;FeCl3易发生水解反应,配制其溶液时,要先将FeCl3溶于较浓的盐酸中,再加水稀释,C正确;Cl2可与碱石灰反应,故用于干燥Cl2的浓硫酸不能换成碱石灰,D错误。
10.(2023·福建厦门外国语学校模拟)我国科学家研究在Pd/SVG催化剂上H2还原NO生成N2和NH3的路径,各基元反应及活化能Ea(kJ·mol-1)如图所示,下列说法错误的是( )
A.生成NH3的各基元反应中,N元素均
被还原
B.生成NH3的总反应方程式为
5H2+2NO 2H2O+2NH3
C.生成N2的总反应方程式为2H2+2NO N2+2H2O
D.在Pd/SVG催化剂上,NO更容易被H2还原为N2
D
11.(2023·湖北重点校联合调研)钾长石(K2O·Al2O3·6SiO2)是含钾量较高、分布较广、储量较大的非水溶性钾资源,以钾长石为原料制取钾肥K2CO3的一种工艺流程如图所示。已知:钾长石中的钾元素和铝元素在Na2CO3作用下转化为NaAlO2和KAlO2。下列说法正确的是( )
A.可用“水浸”操作直接提取钾长石中的主要成分
B.“浸渣Ⅰ”可以作为冶炼金属铝的主要原料
C.“碱化”时发生的主要反应为
D.流程中只有CO2可循环利用
答案 C
解析 钾长石是非水溶性钾资源,不能用“水浸”操作直接提取其中的主要成分,A错误;“煅烧”时铝元素转化为NaAlO2和KAlO2,“水浸”时二者均进入溶液,则“浸渣Ⅰ”不能冶炼金属铝,B错误;加入NaOH溶液碱化时,NaHCO3、KHCO3分别转化为Na2CO3、K2CO3: ,C正确;流程中除CO2可以循环利用外,Na2CO3也可循环利用,D错误。
12.(2023·四川巴中一模)硫代硫酸钠(Na2S2O3)在工业、医药等领域应用广泛。如图为实验室制取硫代硫酸钠的装置,反应过程中需通过pH传感器控制pH为7~8。
(1)盛Na2SO3的仪器名称为 。
(2)为了确保硫代硫酸钠的产量,实验中通入的SO2不能过量,原因是 。
蒸馏烧瓶
若SO2过量,溶液显酸性,产物发生反应导致产量减少
(3)若n(Na2CO3)∶n(Na2S)=1∶2,则装置C中反应的化学方程式为 。
(4)当数据采集处pH接近7时,应采取的操作为________________________
。
(5)装置B中的药品可以选择下列物质中的 (填字母)。
A.饱和NaHCO3溶液
B.饱和NaHSO3溶液
C.NaOH溶液
D.酸性KMnO4溶液
Na2CO3+2Na2S+4SO2 ══ 3Na2S2O3+CO2
控制分液漏斗的活塞,调节滴
加硫酸的速率,同时调节三通阀的方向使二氧化硫进入B装置
ACD
(6)现使用“碘量法”测定脱碳液中V2O5的含量:取m g脱碳液置于锥形瓶中,向锥形瓶中加入适量盐酸和足量KI溶液,发生反应为V2O5+6HCl+2KI ══ 2VOCl2+2KCl+I2+3H2O,此时溶液颜色为棕色,使用0.100 0 mol·L-1的Na2S2O3溶液滴定,消耗Na2S2O3溶液V mL,该过程的反应为I2+2Na2S2O3 ══ 2NaI+Na2S4O6。(已知有色离子仅有VO2+,其颜色为蓝色)
①滴定终点的现象为
。
②若滴定时,滴定管未用标准液润洗,则测得V2O5的含量 (填“偏大”“偏小”或“无影响”)。
③脱碳液中V2O5的质量分数为 %。
滴入最后半滴硫代硫酸钠时,溶液由棕色变为蓝色,且半分钟内不恢复
偏大
解析 (5)装置B的作用是吸收SO2尾气。饱和NaHCO3溶液能用于吸收SO2,A正确;饱和NaHSO3溶液不能吸收SO2,B错误;NaOH溶液能用于吸收SO2,C正确;SO2能被酸性KMnO4溶液氧化吸收,D正确。
(6)当溶液中I2被完全消耗时即为反应终点,溶液由棕色变为蓝色。若滴定管未润洗,Na2S2O3溶液被稀释而导致V增大,则测得V2O5含量偏大。由反应得到关系式为V2O5~I2~2Na2S2O3,n(Na2S2O3)=10-4V mol,则
同课章节目录
