专题 化学工艺流程及分析(共47张PPT)
文档属性
| 名称 | 专题 化学工艺流程及分析(共47张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 3.9MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-11-19 23:59:34 | ||
图片预览









文档简介
(共47张PPT)
专题 化学工艺流程及分析
2024
无机化工流程及分析:
山东卷(2022、2021、2020),湖南卷(2023、2022、2021),海南卷(2022、2021、2020),湖北卷(2023、2022、2021),江苏卷(2022、2021),重庆卷(2022、2021)
高考指引:近几年,全国卷及各省市高考化学试卷大多考查了化学工艺流程题,侧重考查新信息的吸收和处理能力,及灵活应用所学知识解决生产实际问题的能力,突出对“证据推理与模型认知”等化学学科核心素养的考查。
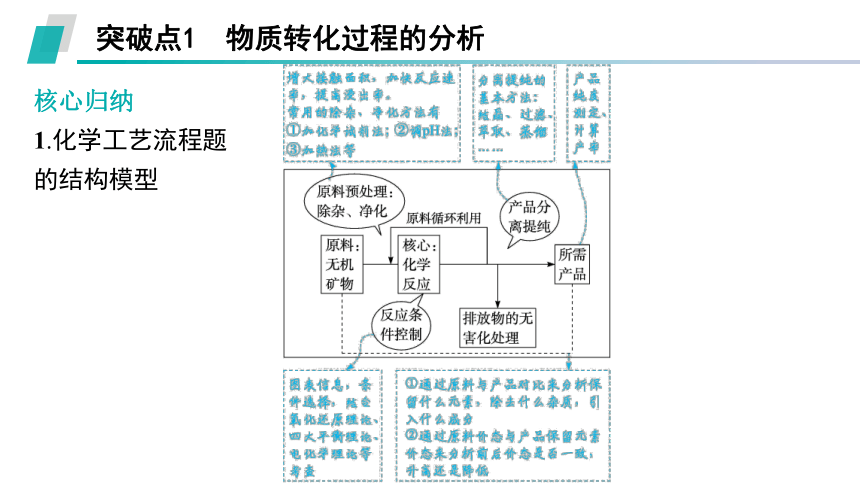
突破点1 物质转化过程的分析
核心归纳
1.化学工艺流程题
的结构模型
2.分析化学工艺流程图示的常用方法
(1)主线法
①流程图大多分为三部分:原料预处理阶段、转化与分离阶段、获取最终产物阶段。
②分析每个流程中前后物质的变化。
(2)双线法
①反应线:物质的性质及转化关系。
②操作线:物质转化过程中涉及的实验操作,如分离提纯等。
(3)四线法
试剂线 为达到最终目的各步操作中加入的物质,发生氧化还原反应、复分解反应等
转化线 元素守恒——焙烧、煅烧、溶浸(酸浸、碱浸)、沉淀、结晶、电解等
除杂线 通过复分解反应沉淀、置换沉淀、氧化还原沉淀,或加热产生气体等
分离线 过滤(趁热过滤)、蒸发、结晶、萃取(反萃取)、洗涤、干燥等
真题感悟
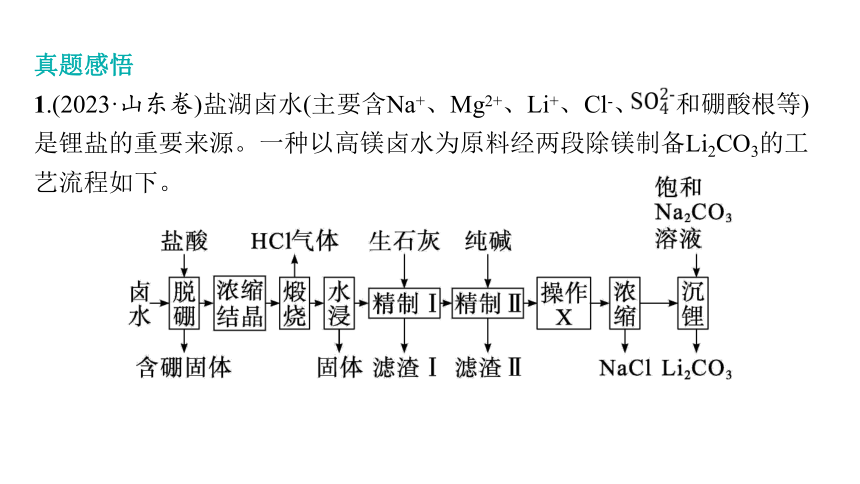
1.(2023·山东卷)盐湖卤水(主要含Na+、Mg2+、Li+、Cl-、 和硼酸根等)是锂盐的重要来源。一种以高镁卤水为原料经两段除镁制备Li2CO3的工艺流程如下。
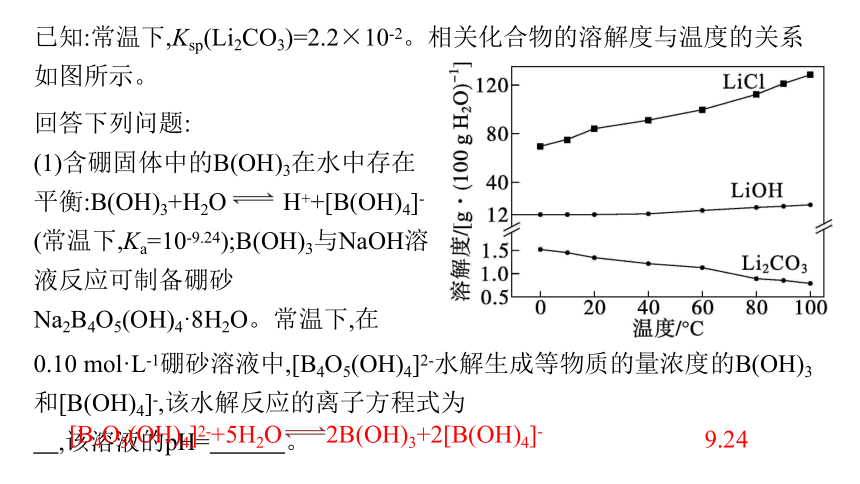
已知:常温下,Ksp(Li2CO3)=2.2×10-2。相关化合物的溶解度与温度的关系如图所示。
回答下列问题:
(1)含硼固体中的B(OH)3在水中存在平衡:B(OH)3+H2O H++[B(OH)4]-(常温下,Ka=10-9.24);B(OH)3与NaOH溶液反应可制备硼砂Na2B4O5(OH)4·8H2O。常温下,在
0.10 mol·L-1硼砂溶液中,[B4O5(OH)4]2-水解生成等物质的量浓度的B(OH)3和[B(OH)4]-,该水解反应的离子方程式为 ,该溶液的pH= 。
[B4O5(OH)4]2-+5H2O 2B(OH)3+2[B(OH)4]-
9.24
(2)滤渣Ⅰ的主要成分是 (填化学式);精制Ⅰ后溶液中Li+的浓度为2.0 mol·L-1,则常温下精制Ⅱ过程中 浓度应控制在
mol·L-1以下。若脱硼后直接进行精制Ⅰ,除无法回收HCl外,还将增加 的用量(填化学式)。
(3)精制Ⅱ的目的是 ;进行操作X时应选择的试剂是 ,若不进行该操作而直接浓缩,将导致 。
Mg(OH)2、CaSO4
5.5×10-3
Na2CO3、CaO
进一步除去溶液中的Ca2+
盐酸
一部分Li+以LiOH和Li2CO3的形式沉淀析出,从而使沉锂产率降低
【思维建模】
解答物质转化过程中流程及分析的方法
(1)准确识别化学工艺流程图示呈现形式
(2)高度关注核心元素的转化,特别是元素的化合价变化。
(3)真心站在化工生产实际的角度来剖析问题。
突破点2 化工流程中的操作及原因的分析
核心归纳
化工流程中“原因类”描述性问题的答题模板
目的或原因 答题模板
沉淀水洗的目的 除去××(可溶于水)杂质
沉淀用乙醇洗涤的目的 a.减小固体的溶解度;b.除去固体表面吸附的杂质;c.乙醇挥发带走水分,使固体快速干燥
冷凝回流的作用及目的 防止××蒸气逸出脱离反应体系,提高××物质的转化率
控制溶液pH的目的 防止××离子水解;防止××离子沉淀;确保××离子沉淀完全;防止××溶解等
目的或原因 答题模板
加过量A试剂的原因 使B物质反应完全(或提高B物质的转化率)等
温度不高于××℃的原因 温度过高,××物质分解(如H2O2、浓硝酸、NH4HCO3等)或××物质挥发(如浓硝酸、浓盐酸)或××物质被氧化(如Na2SO3等)或促进××物质水解(如AlCl3等)
温度控制在××~××℃ 温度过高或温度过低会影响催化剂的活性或有副反应发生,同时也会影响反应速率
减压蒸馏(减压蒸发)的原因 减小压强,使液体沸点降低,防止××物质受热分解(如H2O2、浓硝酸、NH4HCO3等)
真题感悟
2.(2023·全国新课标卷)铬和钒具有广泛用途。铬钒渣中铬和钒以低价态含氧酸盐形式存在,主要杂质为铁、铝、硅、磷等的化合物。从铬钒渣中分离提取铬和钒的一种流程如下图所示。
回答下列问题:
(1)煅烧过程中,钒和铬被氧化为相应的最高价含氧酸盐,其中含铬化合物主要为 (填化学式)。
(2)水浸渣中主要有SiO2和 。
(3)“沉淀”步骤调pH到弱碱性,主要除去的杂质是 。
(4)“除硅磷”步骤中,使硅、磷分别以MgSiO3和MgNH4PO4的形式沉淀。该步需要控制溶液的pH≈9以达到最好的除杂效果。若pH<9时,会导致 ;pH>9时,
会导致 。
Na2CrO4
Fe2O3
铝
磷不能除净(磷酸盐会转化为可溶性酸式盐)
硅不能除净(生成氢氧化镁,镁离子被消耗)
A.酸性 B.碱性 C.两性
(6)“还原”步骤中加入焦亚硫酸钠(Na2S2O5)溶液,反应的离子方程式为 。
C
解析 (1)碱性条件下,铬被氧化生成Na2CrO4。
(2)Fe2O3不与Na2CO3、NaOH反应,也不溶于水。
(4)pH<9,磷容易形成易溶的磷酸二氢盐,导致磷不能除净。pH>9,易形成Mg(OH)2沉淀,导致硅不能除净。
突破点3 化工流程中的图像分析
核心归纳
1.溶解度曲线
及分析
2.浸取率曲线及分析
(1)“浸取率”升高的原因一般是温度升高,浸取速率加快,但当“浸取率”达到
最大值后,温度升高“浸取率”反而下降,其原因一般是反应试剂的分解或挥发。
(2)根据图中曲线变化,选择达到一定较高“浸取率”的条件。
3.物质存在形态与pH的关系
真题感悟
3.(2022·山东卷)工业上以氟磷灰石[Ca5F(PO4)3,含SiO2等杂质]为原料生产磷酸和石膏,工艺流程如下:
回答下列问题:
(1)酸解时有HF产生。氢氟酸与SiO2反应生成二元强酸H2SiF6,离子方程式为 。
(2)部分盐的溶度积常数见下表。精制Ⅰ中,按物质的量之比n(Na2CO3)∶n( )=1∶1加入Na2CO3脱氟,充分反应后,
c(Na+)= mol·L-1;再分批加入一定量的BaCO3,首先转化为沉淀的离子是 。
项目 BaSiF6 Na2SiF6 CaSO4 BaSO4
Ksp 1.0×10-6 4.0×10-6 9.0×10-4 1.0×10-10
2.0×10-2
(3) 浓度(以SO3%计)在一定范围时,石膏存在形式与温度、H3PO4浓度(以P2O5%计)的关系如图甲所示。酸解后,在所得100 ℃、P2O5%为45的混合体系中,石膏存在形式为 (填化学式);洗涤时使用一定浓度的硫酸溶液而不使用水,原因是 ,回收利用洗涤液X的操作单元是 ;一定温度下,石膏存在形式与溶液中P2O5%和SO3%的关系如图乙所示,下列条件能实现酸解所得石膏结晶转化的是 (填字母)。
A.65 ℃、P2O5%=15、SO3%=15
B.80 ℃、P2O5%=10、SO3%=20
C.65 ℃、P2O5%=10、SO3%=30
D.80 ℃、P2O5%=10、SO3%=10
图甲
图乙
CaSO4·0.5H2O
减少CaSO4的溶解损失,提高石膏的产率
酸解
AD
由图乙信息可知,在每条线上方的以CaSO4·0.5H2O形式存在,在每条线下方的以CaSO4·2H2O形式存在。A项,P2O5%=15、SO3%=15,该点坐标位于
65 ℃线的下方,能实现晶体的完全转化;B项,P2O5%=10、SO3%=20,该点坐标位于80 ℃线的上方,不能实现晶体的完全转化;C项,P2O5%=10、SO3%=30,该点坐标位于65 ℃线上方,不能实现晶体的完全转化;D项,P2O5%=10、SO3%=10,该点坐标位于80 ℃线下方,晶体全部以CaSO4·2H2O形式存在,能实现晶体的完全转化。
【思维建模】
分析化工流程题中图像的方法
(1)识图——三看
一看轴——横、纵坐标所表示的化学含义(x轴和y轴表示的意义)(特别是双纵坐标),寻找x、y轴之间的关系,因为这是理解题意和进行正确思维的前提;
二看点——曲线中的特殊点(顶点、始点、终点、拐点、交叉点);
三看线——曲线的走势(变化趋势是上升、下降、波动等变化)。
(2)析图
分析图中为什么会出现这些特殊点,曲线为什么有这样的变化趋势和走向,分析曲线变化的因果关系;通过联想,把课本内的有关化学概念、原理、规律等与图中的曲线和相关点建立联系。
(3)用图
将相关的化学知识与图中曲线紧密结合,在头脑中构建新的曲线——知识体系,然后运用新的曲线——知识体系揭示问题的实质,解决实际问题。
突破点4 化工流程中的定量分析及计算
核心归纳
1.化工流程中定量计算的常见类型及方法
类型 解题方法
物质含量的计算 根据关系式法、得失电子守恒法、滴定法等,求出混合物中某一成分的量,再除以样品的总量,即可得出其含量
确定物质化学式的计算 ①根据题给信息,计算出有关物质的物质的量;
②根据电荷守恒,确定出未知离子的物质的量;
③根据质量守恒,确定出结晶水的物质的量;
④各粒子的物质的量之比的最简整数比即为粒子的下标比
类型 解题方法
热重曲线计算 ①设晶体为1 mol;
②失重一般是先失水,再失气态非金属氧化物;
③计算每步的m余, =固体残留率;
④晶体中金属质量不减少,仍在m余中;
⑤失重最后一般为金属氧化物,由质量守恒得mO,由n金属∶nO即可求出失重后物质的化学式
类型 解题方法
多步滴定计算 复杂的滴定可分为两类:
①连续滴定法:第一步滴定反应生成的产物,还可以继续参加第二步的滴定,根据第二步滴定的消耗量,可计算出第一步滴定的反应物的量;
②返滴定法:第一步用的滴定剂是过量的,然后第二步再用另一物质返滴定过量的物质,根据第一步加入的量减去第二步中过量的量,即可得出第一步所求物质的物质的量
2.化工流程中定量计算的常用公式
真题感悟
4.(2022·辽宁卷,16节选)某工厂采用辉铋矿(主要成分为Bi2S3,含有FeS2、SiO2杂质)与软锰矿(主要成分为MnO2)联合焙烧法制备BiOCl和MnSO4,工艺流程如下:
已知:①焙烧时过量的MnO2分解为Mn2O3,FeS2转变为Fe2O3;
②金属活动性:Fe>(H)>Bi>Cu;
③相关金属离子形成氢氧化物的pH范围见表:
金属离子 开始沉淀pH 完全沉淀pH
Fe2+ 6.5 8.3
Fe3+ 1.6 2.8
Mn2+ 8.1 10.1
将100 kg辉铋矿进行联合焙烧,转化时消耗1.1 kg金属Bi,假设其余各步损失不计,干燥后称量BiOCl产品质量为32 kg,滴定测得产品中Bi的质量分数为78.5%。辉铋矿中Bi元素的质量分数为 。
24.02%
解析 对辉铋矿进行联合焙烧,转化时消耗1.1 kg金属Bi,即外加入1.1 kg金属Bi。32 kg BiOCl产品中Bi元素的质量分数为78.5%,则辉铋矿中含有Bi元素的质量为32 kg×78.5%-1.1 kg=24.02 kg,故辉铋矿中Bi元素的质量分数为 ×100%=24.02%。
1.(2023·辽宁辽阳一模节选)采用废铁屑还原软锰矿(软锰矿主要成分是MnO2,还含少量Fe、Mg、Ni、Si等元素的氧化物杂质)来制备Mn的工艺流程如图所示:
考向预测演练
离子 Fe2+ Fe3+ Mg2+ Ni2+ Mn2+
开始沉淀的pH 7.5 2.7 8.1 7.7 8.3
完全沉淀的pH 9.7 3.7 9.4 8.4 9.8
回答下列问题:
(1)pH=5.5(室温)时,溶液中残余的Fe3+的浓度为 mol·L-1,加入MnS“除杂”后的滤渣为 。
已知:①Ksp(MnS)=2.8×10-10,Ksp(NiS)=2.0×10-21;②溶液中某离子浓度≤1.0×10-6 mol·L-1时,认为该离子沉淀完全;③室温时生成氢氧化物的pH见下表。
1×10-11.4
NiS
(2)“沉锰”过程中温度和pH对Mn2+和Mg2+沉淀率的影响如图所示。由图可知,“沉锰”的合适条件是 ,“沉锰”除去的杂质金属离子是 。
45 ℃,pH为7.5
Mg2+
(3)若沉锰过程在pH为7.0条件下充分进行,反应温度对锰沉淀率的影响关系如图所示。当温度超过30 ℃,沉锰反应的锰沉淀率随温度升高而下降的原因是 。
温度超过30 ℃,NH4HCO3水解程度增大,释放出NH3和CO2,不利于“沉锰”
(2)“沉锰”过程中锰离子沉淀率越高、镁离子沉淀率越低对应的温度和pH就是“沉锰”的合适条件,由图可知,“沉锰”的合适条件是温度为45 ℃、pH为7.5;“沉锰”除去的杂质金属离子是Mg2+。
2.(2023·湖南常德一模)钒钛系SCR催化剂主要包含TiO2、V2O5、WO3。从废SCR催化剂中回收TiO2、V2O5、WO3的某种工艺部分流程如下:
(1)“碱浸”选择高温的目的是 。
(2)钛酸钠 (填“难”或“易”)溶于水。在酸洗过程中Na2Ti3O7转化为H2TiO3的化学方程式为 。
加快反应速率或加快“碱浸”速率
难
Na2Ti3O7+H2SO4+2H2O ══ 3H2TiO3+Na2SO4
(4)为测定废催化剂中V2O5的含量,现进行如下实验:准确称取5.000 g废催化剂样品置于烧杯中,加入足量质量分数为50%的硫酸,加热,冷却后将溶液移入250 mL容量瓶中,加水定容。准确量取25.00 mL溶液置于锥形瓶中,滴加2~3滴指示剂,用浓度为0.100 0 mol·L-1的(NH4)2Fe(SO4)2标准溶液进行滴定,恰好完全反应时消耗标准溶液的体积为20.00 mL。实验过程中,V元素最终转化为V3+,计算废催化剂中V2O5的含量为 (以百分数表示,废催化剂中其他成分对测定无影响)。
18.2%
专题 化学工艺流程及分析
2024
无机化工流程及分析:
山东卷(2022、2021、2020),湖南卷(2023、2022、2021),海南卷(2022、2021、2020),湖北卷(2023、2022、2021),江苏卷(2022、2021),重庆卷(2022、2021)
高考指引:近几年,全国卷及各省市高考化学试卷大多考查了化学工艺流程题,侧重考查新信息的吸收和处理能力,及灵活应用所学知识解决生产实际问题的能力,突出对“证据推理与模型认知”等化学学科核心素养的考查。
突破点1 物质转化过程的分析
核心归纳
1.化学工艺流程题
的结构模型
2.分析化学工艺流程图示的常用方法
(1)主线法
①流程图大多分为三部分:原料预处理阶段、转化与分离阶段、获取最终产物阶段。
②分析每个流程中前后物质的变化。
(2)双线法
①反应线:物质的性质及转化关系。
②操作线:物质转化过程中涉及的实验操作,如分离提纯等。
(3)四线法
试剂线 为达到最终目的各步操作中加入的物质,发生氧化还原反应、复分解反应等
转化线 元素守恒——焙烧、煅烧、溶浸(酸浸、碱浸)、沉淀、结晶、电解等
除杂线 通过复分解反应沉淀、置换沉淀、氧化还原沉淀,或加热产生气体等
分离线 过滤(趁热过滤)、蒸发、结晶、萃取(反萃取)、洗涤、干燥等
真题感悟
1.(2023·山东卷)盐湖卤水(主要含Na+、Mg2+、Li+、Cl-、 和硼酸根等)是锂盐的重要来源。一种以高镁卤水为原料经两段除镁制备Li2CO3的工艺流程如下。
已知:常温下,Ksp(Li2CO3)=2.2×10-2。相关化合物的溶解度与温度的关系如图所示。
回答下列问题:
(1)含硼固体中的B(OH)3在水中存在平衡:B(OH)3+H2O H++[B(OH)4]-(常温下,Ka=10-9.24);B(OH)3与NaOH溶液反应可制备硼砂Na2B4O5(OH)4·8H2O。常温下,在
0.10 mol·L-1硼砂溶液中,[B4O5(OH)4]2-水解生成等物质的量浓度的B(OH)3和[B(OH)4]-,该水解反应的离子方程式为 ,该溶液的pH= 。
[B4O5(OH)4]2-+5H2O 2B(OH)3+2[B(OH)4]-
9.24
(2)滤渣Ⅰ的主要成分是 (填化学式);精制Ⅰ后溶液中Li+的浓度为2.0 mol·L-1,则常温下精制Ⅱ过程中 浓度应控制在
mol·L-1以下。若脱硼后直接进行精制Ⅰ,除无法回收HCl外,还将增加 的用量(填化学式)。
(3)精制Ⅱ的目的是 ;进行操作X时应选择的试剂是 ,若不进行该操作而直接浓缩,将导致 。
Mg(OH)2、CaSO4
5.5×10-3
Na2CO3、CaO
进一步除去溶液中的Ca2+
盐酸
一部分Li+以LiOH和Li2CO3的形式沉淀析出,从而使沉锂产率降低
【思维建模】
解答物质转化过程中流程及分析的方法
(1)准确识别化学工艺流程图示呈现形式
(2)高度关注核心元素的转化,特别是元素的化合价变化。
(3)真心站在化工生产实际的角度来剖析问题。
突破点2 化工流程中的操作及原因的分析
核心归纳
化工流程中“原因类”描述性问题的答题模板
目的或原因 答题模板
沉淀水洗的目的 除去××(可溶于水)杂质
沉淀用乙醇洗涤的目的 a.减小固体的溶解度;b.除去固体表面吸附的杂质;c.乙醇挥发带走水分,使固体快速干燥
冷凝回流的作用及目的 防止××蒸气逸出脱离反应体系,提高××物质的转化率
控制溶液pH的目的 防止××离子水解;防止××离子沉淀;确保××离子沉淀完全;防止××溶解等
目的或原因 答题模板
加过量A试剂的原因 使B物质反应完全(或提高B物质的转化率)等
温度不高于××℃的原因 温度过高,××物质分解(如H2O2、浓硝酸、NH4HCO3等)或××物质挥发(如浓硝酸、浓盐酸)或××物质被氧化(如Na2SO3等)或促进××物质水解(如AlCl3等)
温度控制在××~××℃ 温度过高或温度过低会影响催化剂的活性或有副反应发生,同时也会影响反应速率
减压蒸馏(减压蒸发)的原因 减小压强,使液体沸点降低,防止××物质受热分解(如H2O2、浓硝酸、NH4HCO3等)
真题感悟
2.(2023·全国新课标卷)铬和钒具有广泛用途。铬钒渣中铬和钒以低价态含氧酸盐形式存在,主要杂质为铁、铝、硅、磷等的化合物。从铬钒渣中分离提取铬和钒的一种流程如下图所示。
回答下列问题:
(1)煅烧过程中,钒和铬被氧化为相应的最高价含氧酸盐,其中含铬化合物主要为 (填化学式)。
(2)水浸渣中主要有SiO2和 。
(3)“沉淀”步骤调pH到弱碱性,主要除去的杂质是 。
(4)“除硅磷”步骤中,使硅、磷分别以MgSiO3和MgNH4PO4的形式沉淀。该步需要控制溶液的pH≈9以达到最好的除杂效果。若pH<9时,会导致 ;pH>9时,
会导致 。
Na2CrO4
Fe2O3
铝
磷不能除净(磷酸盐会转化为可溶性酸式盐)
硅不能除净(生成氢氧化镁,镁离子被消耗)
A.酸性 B.碱性 C.两性
(6)“还原”步骤中加入焦亚硫酸钠(Na2S2O5)溶液,反应的离子方程式为 。
C
解析 (1)碱性条件下,铬被氧化生成Na2CrO4。
(2)Fe2O3不与Na2CO3、NaOH反应,也不溶于水。
(4)pH<9,磷容易形成易溶的磷酸二氢盐,导致磷不能除净。pH>9,易形成Mg(OH)2沉淀,导致硅不能除净。
突破点3 化工流程中的图像分析
核心归纳
1.溶解度曲线
及分析
2.浸取率曲线及分析
(1)“浸取率”升高的原因一般是温度升高,浸取速率加快,但当“浸取率”达到
最大值后,温度升高“浸取率”反而下降,其原因一般是反应试剂的分解或挥发。
(2)根据图中曲线变化,选择达到一定较高“浸取率”的条件。
3.物质存在形态与pH的关系
真题感悟
3.(2022·山东卷)工业上以氟磷灰石[Ca5F(PO4)3,含SiO2等杂质]为原料生产磷酸和石膏,工艺流程如下:
回答下列问题:
(1)酸解时有HF产生。氢氟酸与SiO2反应生成二元强酸H2SiF6,离子方程式为 。
(2)部分盐的溶度积常数见下表。精制Ⅰ中,按物质的量之比n(Na2CO3)∶n( )=1∶1加入Na2CO3脱氟,充分反应后,
c(Na+)= mol·L-1;再分批加入一定量的BaCO3,首先转化为沉淀的离子是 。
项目 BaSiF6 Na2SiF6 CaSO4 BaSO4
Ksp 1.0×10-6 4.0×10-6 9.0×10-4 1.0×10-10
2.0×10-2
(3) 浓度(以SO3%计)在一定范围时,石膏存在形式与温度、H3PO4浓度(以P2O5%计)的关系如图甲所示。酸解后,在所得100 ℃、P2O5%为45的混合体系中,石膏存在形式为 (填化学式);洗涤时使用一定浓度的硫酸溶液而不使用水,原因是 ,回收利用洗涤液X的操作单元是 ;一定温度下,石膏存在形式与溶液中P2O5%和SO3%的关系如图乙所示,下列条件能实现酸解所得石膏结晶转化的是 (填字母)。
A.65 ℃、P2O5%=15、SO3%=15
B.80 ℃、P2O5%=10、SO3%=20
C.65 ℃、P2O5%=10、SO3%=30
D.80 ℃、P2O5%=10、SO3%=10
图甲
图乙
CaSO4·0.5H2O
减少CaSO4的溶解损失,提高石膏的产率
酸解
AD
由图乙信息可知,在每条线上方的以CaSO4·0.5H2O形式存在,在每条线下方的以CaSO4·2H2O形式存在。A项,P2O5%=15、SO3%=15,该点坐标位于
65 ℃线的下方,能实现晶体的完全转化;B项,P2O5%=10、SO3%=20,该点坐标位于80 ℃线的上方,不能实现晶体的完全转化;C项,P2O5%=10、SO3%=30,该点坐标位于65 ℃线上方,不能实现晶体的完全转化;D项,P2O5%=10、SO3%=10,该点坐标位于80 ℃线下方,晶体全部以CaSO4·2H2O形式存在,能实现晶体的完全转化。
【思维建模】
分析化工流程题中图像的方法
(1)识图——三看
一看轴——横、纵坐标所表示的化学含义(x轴和y轴表示的意义)(特别是双纵坐标),寻找x、y轴之间的关系,因为这是理解题意和进行正确思维的前提;
二看点——曲线中的特殊点(顶点、始点、终点、拐点、交叉点);
三看线——曲线的走势(变化趋势是上升、下降、波动等变化)。
(2)析图
分析图中为什么会出现这些特殊点,曲线为什么有这样的变化趋势和走向,分析曲线变化的因果关系;通过联想,把课本内的有关化学概念、原理、规律等与图中的曲线和相关点建立联系。
(3)用图
将相关的化学知识与图中曲线紧密结合,在头脑中构建新的曲线——知识体系,然后运用新的曲线——知识体系揭示问题的实质,解决实际问题。
突破点4 化工流程中的定量分析及计算
核心归纳
1.化工流程中定量计算的常见类型及方法
类型 解题方法
物质含量的计算 根据关系式法、得失电子守恒法、滴定法等,求出混合物中某一成分的量,再除以样品的总量,即可得出其含量
确定物质化学式的计算 ①根据题给信息,计算出有关物质的物质的量;
②根据电荷守恒,确定出未知离子的物质的量;
③根据质量守恒,确定出结晶水的物质的量;
④各粒子的物质的量之比的最简整数比即为粒子的下标比
类型 解题方法
热重曲线计算 ①设晶体为1 mol;
②失重一般是先失水,再失气态非金属氧化物;
③计算每步的m余, =固体残留率;
④晶体中金属质量不减少,仍在m余中;
⑤失重最后一般为金属氧化物,由质量守恒得mO,由n金属∶nO即可求出失重后物质的化学式
类型 解题方法
多步滴定计算 复杂的滴定可分为两类:
①连续滴定法:第一步滴定反应生成的产物,还可以继续参加第二步的滴定,根据第二步滴定的消耗量,可计算出第一步滴定的反应物的量;
②返滴定法:第一步用的滴定剂是过量的,然后第二步再用另一物质返滴定过量的物质,根据第一步加入的量减去第二步中过量的量,即可得出第一步所求物质的物质的量
2.化工流程中定量计算的常用公式
真题感悟
4.(2022·辽宁卷,16节选)某工厂采用辉铋矿(主要成分为Bi2S3,含有FeS2、SiO2杂质)与软锰矿(主要成分为MnO2)联合焙烧法制备BiOCl和MnSO4,工艺流程如下:
已知:①焙烧时过量的MnO2分解为Mn2O3,FeS2转变为Fe2O3;
②金属活动性:Fe>(H)>Bi>Cu;
③相关金属离子形成氢氧化物的pH范围见表:
金属离子 开始沉淀pH 完全沉淀pH
Fe2+ 6.5 8.3
Fe3+ 1.6 2.8
Mn2+ 8.1 10.1
将100 kg辉铋矿进行联合焙烧,转化时消耗1.1 kg金属Bi,假设其余各步损失不计,干燥后称量BiOCl产品质量为32 kg,滴定测得产品中Bi的质量分数为78.5%。辉铋矿中Bi元素的质量分数为 。
24.02%
解析 对辉铋矿进行联合焙烧,转化时消耗1.1 kg金属Bi,即外加入1.1 kg金属Bi。32 kg BiOCl产品中Bi元素的质量分数为78.5%,则辉铋矿中含有Bi元素的质量为32 kg×78.5%-1.1 kg=24.02 kg,故辉铋矿中Bi元素的质量分数为 ×100%=24.02%。
1.(2023·辽宁辽阳一模节选)采用废铁屑还原软锰矿(软锰矿主要成分是MnO2,还含少量Fe、Mg、Ni、Si等元素的氧化物杂质)来制备Mn的工艺流程如图所示:
考向预测演练
离子 Fe2+ Fe3+ Mg2+ Ni2+ Mn2+
开始沉淀的pH 7.5 2.7 8.1 7.7 8.3
完全沉淀的pH 9.7 3.7 9.4 8.4 9.8
回答下列问题:
(1)pH=5.5(室温)时,溶液中残余的Fe3+的浓度为 mol·L-1,加入MnS“除杂”后的滤渣为 。
已知:①Ksp(MnS)=2.8×10-10,Ksp(NiS)=2.0×10-21;②溶液中某离子浓度≤1.0×10-6 mol·L-1时,认为该离子沉淀完全;③室温时生成氢氧化物的pH见下表。
1×10-11.4
NiS
(2)“沉锰”过程中温度和pH对Mn2+和Mg2+沉淀率的影响如图所示。由图可知,“沉锰”的合适条件是 ,“沉锰”除去的杂质金属离子是 。
45 ℃,pH为7.5
Mg2+
(3)若沉锰过程在pH为7.0条件下充分进行,反应温度对锰沉淀率的影响关系如图所示。当温度超过30 ℃,沉锰反应的锰沉淀率随温度升高而下降的原因是 。
温度超过30 ℃,NH4HCO3水解程度增大,释放出NH3和CO2,不利于“沉锰”
(2)“沉锰”过程中锰离子沉淀率越高、镁离子沉淀率越低对应的温度和pH就是“沉锰”的合适条件,由图可知,“沉锰”的合适条件是温度为45 ℃、pH为7.5;“沉锰”除去的杂质金属离子是Mg2+。
2.(2023·湖南常德一模)钒钛系SCR催化剂主要包含TiO2、V2O5、WO3。从废SCR催化剂中回收TiO2、V2O5、WO3的某种工艺部分流程如下:
(1)“碱浸”选择高温的目的是 。
(2)钛酸钠 (填“难”或“易”)溶于水。在酸洗过程中Na2Ti3O7转化为H2TiO3的化学方程式为 。
加快反应速率或加快“碱浸”速率
难
Na2Ti3O7+H2SO4+2H2O ══ 3H2TiO3+Na2SO4
(4)为测定废催化剂中V2O5的含量,现进行如下实验:准确称取5.000 g废催化剂样品置于烧杯中,加入足量质量分数为50%的硫酸,加热,冷却后将溶液移入250 mL容量瓶中,加水定容。准确量取25.00 mL溶液置于锥形瓶中,滴加2~3滴指示剂,用浓度为0.100 0 mol·L-1的(NH4)2Fe(SO4)2标准溶液进行滴定,恰好完全反应时消耗标准溶液的体积为20.00 mL。实验过程中,V元素最终转化为V3+,计算废催化剂中V2O5的含量为 (以百分数表示,废催化剂中其他成分对测定无影响)。
18.2%
同课章节目录
