专题 元素及其化合物之间的转化(共43张PPT)
文档属性
| 名称 | 专题 元素及其化合物之间的转化(共43张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 4.7MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-11-20 00:01:05 | ||
图片预览




文档简介
(共43张PPT)
专题 元素及其化合物之间的转化
2024
考题统计
(1)金属及其化合物的性质与转化:
山东卷(2022、2021、2020),湖南卷(2022、2021),湖北卷(2022、2021),浙江卷(2023、2022、2021),江苏卷(2022、2021、2020),重庆卷(2021)
(2)非金属及其化合物的性质与转化:
山东卷(2023),湖北卷(2023),湖南卷(2022),广东卷(2023、2022、2021),江苏卷(2022、2021),辽宁卷(2023、2021),河北卷(2021),海南卷(2021),北京卷(2023、2021、2020),重庆卷(2021)
聚焦核心要点
要点1基于“价—类”二维图认识元素及其化合物之间的转化关系
课标指引:1.能够列举、描述、辨识典型物质重要的物理和化学性质及实验现象。 2.能从物质类别、元素价态的角度,依据复分解反应和氧化还原反应原理,预测物质的化学性质和变化。
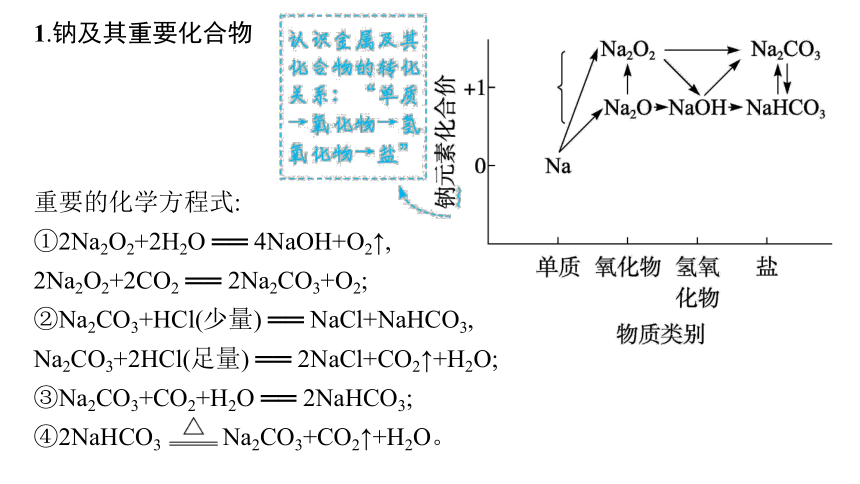
1.钠及其重要化合物
重要的化学方程式:
①2Na2O2+2H2O ══ 4NaOH+O2↑,
2Na2O2+2CO2 ══ 2Na2CO3+O2;
②Na2CO3+HCl(少量) ══ NaCl+NaHCO3,
Na2CO3+2HCl(足量) ══ 2NaCl+CO2↑+H2O;
③Na2CO3+CO2+H2O ══ 2NaHCO3;
④2NaHCO3 Na2CO3+CO2↑+H2O。
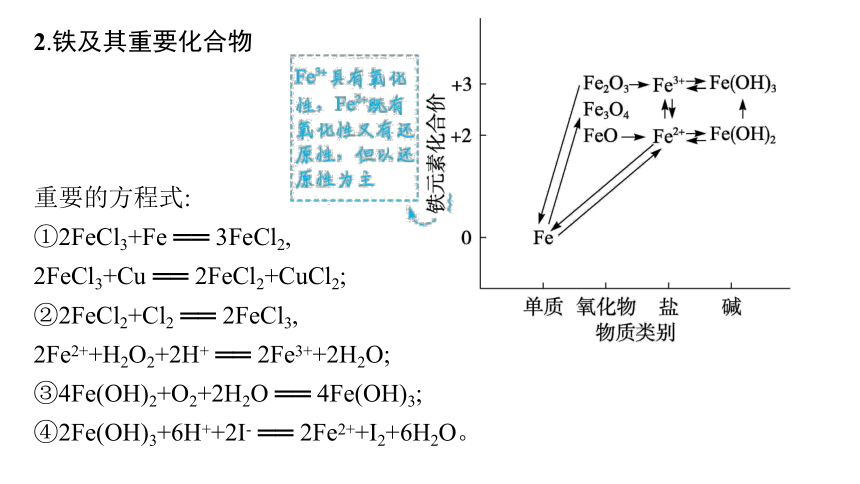
2.铁及其重要化合物
重要的方程式:
①2FeCl3+Fe ══ 3FeCl2,
2FeCl3+Cu ══ 2FeCl2+CuCl2;
②2FeCl2+Cl2 ══ 2FeCl3,
2Fe2++H2O2+2H+ ══ 2Fe3++2H2O;
③4Fe(OH)2+O2+2H2O ══ 4Fe(OH)3;
④2Fe(OH)3+6H++2I- ══ 2Fe2++I2+6H2O。
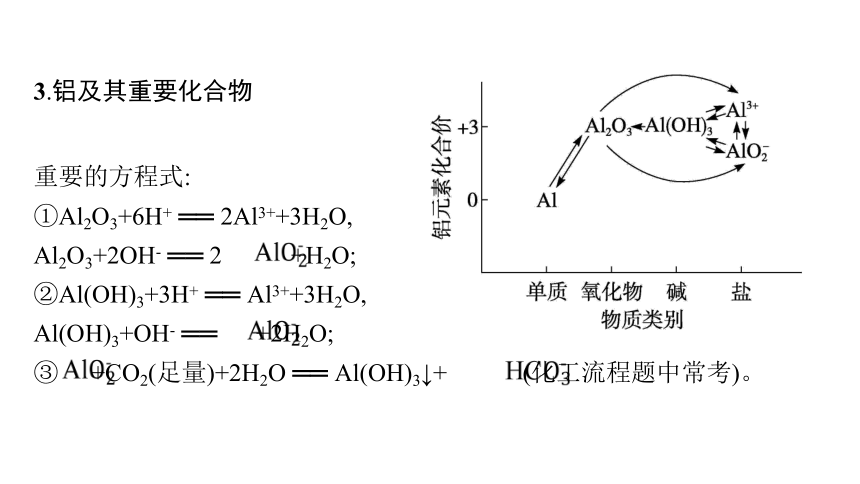
3.铝及其重要化合物
重要的方程式:
①Al2O3+6H+ ══ 2Al3++3H2O,
Al2O3+2OH- ══ 2 +H2O;
②Al(OH)3+3H+ ══ Al3++3H2O,
Al(OH)3+OH- ══ +2H2O;
③ +CO2(足量)+2H2O ══ Al(OH)3↓+ (化工流程题中常考)。
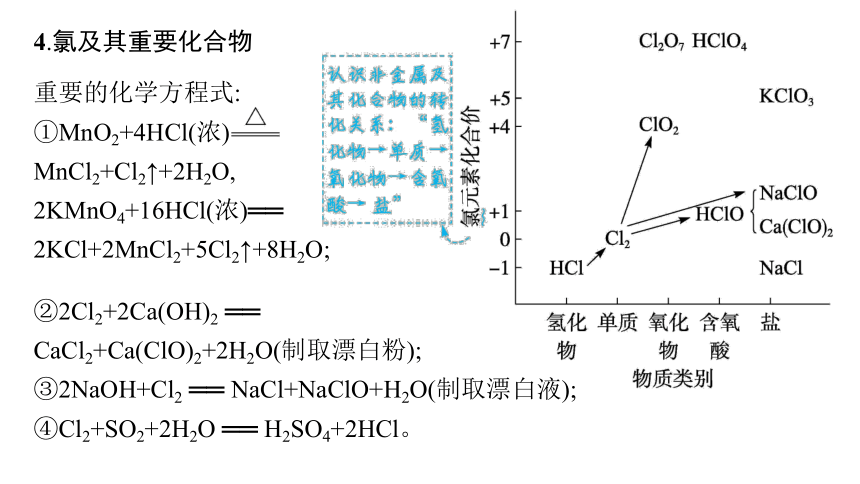
4.氯及其重要化合物
重要的化学方程式:
①MnO2+4HCl(浓) MnCl2+Cl2↑+2H2O,
2KMnO4+16HCl(浓)══ 2KCl+2MnCl2+5Cl2↑+8H2O;
②2Cl2+2Ca(OH)2 ══
CaCl2+Ca(ClO)2+2H2O(制取漂白粉);
③2NaOH+Cl2 ══ NaCl+NaClO+H2O(制取漂白液);
④Cl2+SO2+2H2O ══ H2SO4+2HCl。
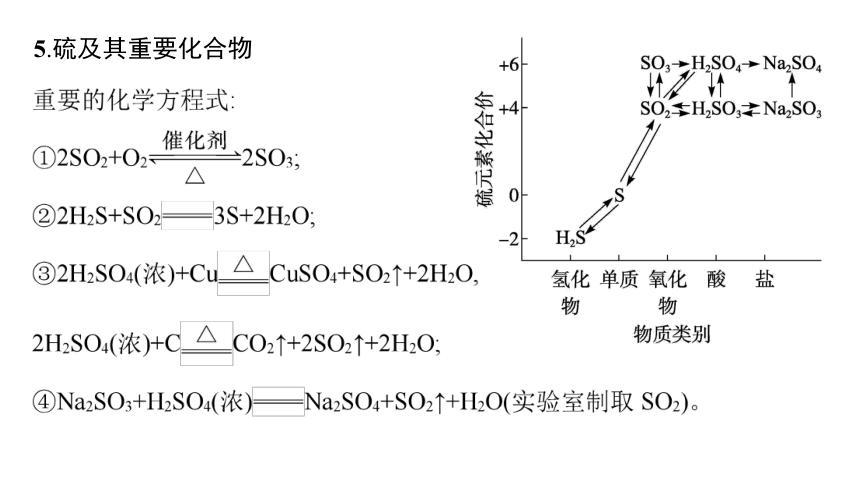
5.硫及其重要化合物
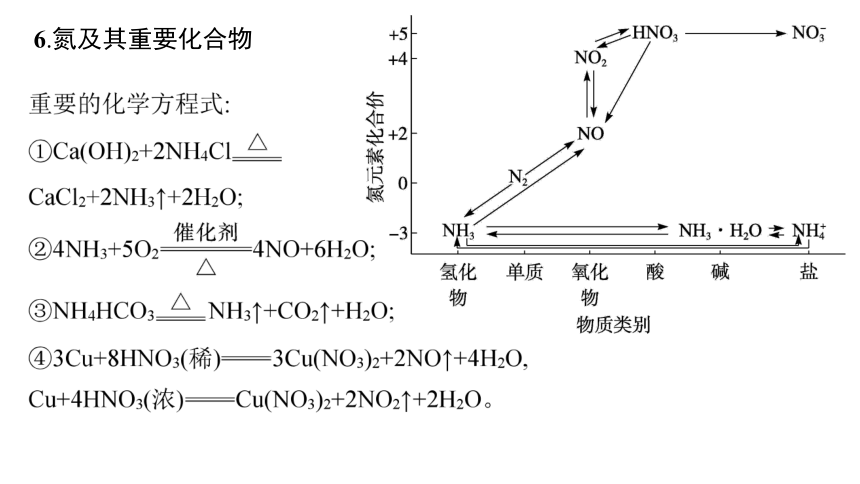
6.氮及其重要化合物
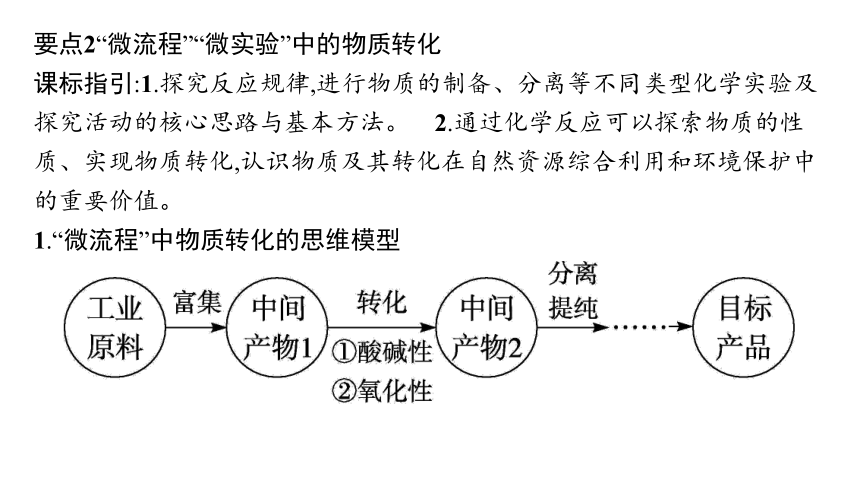
要点2“微流程”“微实验”中的物质转化
课标指引:1.探究反应规律,进行物质的制备、分离等不同类型化学实验及探究活动的核心思路与基本方法。 2.通过化学反应可以探索物质的性质、实现物质转化,认识物质及其转化在自然资源综合利用和环境保护中的重要价值。
1.“微流程”中物质转化的思维模型
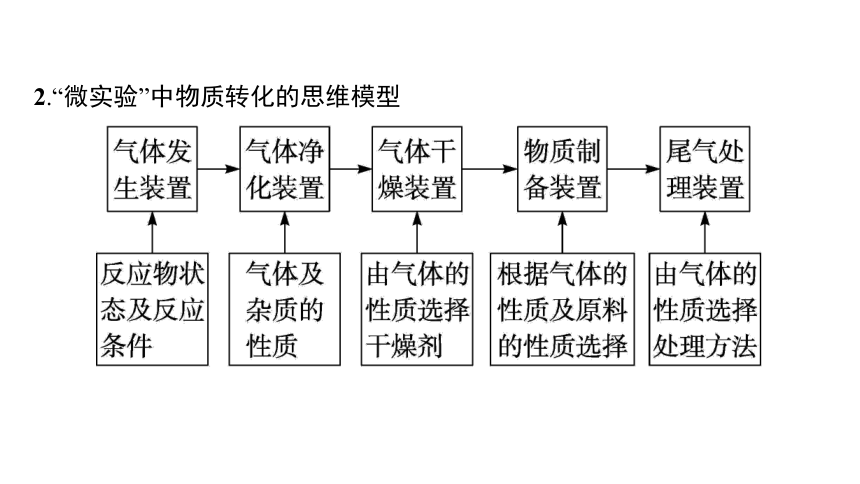
2.“微实验”中物质转化的思维模型
易错辨析
试判断物质间的转化能否通过一步反应实现(填“能”或“不能”):
不能
氨气催化氧化生成NO。
不能
SiO2与水不反应。
能
不能
Na2O与H2O反应生成NaOH,不能生成O2。
精研核心命题
命题点1基于“价—类”二维图的物质转化关系
典例1 (2023·广东卷)部分含Na或含Cu物质的分类与相应化合价关系如图所示。下列推断不合理的是( )
A.可存在c→d→e的转化
B.能与H2O反应生成c的物质只有b
C.新制的d可用于检验葡萄糖中的醛基
D.若b能与H2O反应生成O2,则b中含共价键
B
解析 若为含Cu物质,c为CuOH,d为Cu(OH)2,e为CuO,CuOH被氧化生成Cu(OH)2,Cu(OH)2受热分解生成CuO,存在c→d→e的转化,A正确。若为含钠物质,a为Na,b为Na2O2(或Na2O),c为NaOH,Na、Na2O2(或Na2O)都能与水反应生成NaOH,B错误。若d为Cu(OH)2,新制Cu(OH)2可用于检验葡萄糖中的醛基,C正确。若b能与H2O反应生成O2,则b为Na2O2,由Na+和构成,则b中含离子键和共价键,D正确。
变式演练(2023·河南郑州一模)“价—类”二维图是基于核心元素的化合价和物质类别研究物质性质的一种模型。下图是硫元素的“价—类”二维图。下列说法正确的是( )
A.硫化亚铁与稀硝酸反应可用来制取a
B.从价态角度分析,a、b、c、g都具有还原性
C.c通入溴水中,溴水褪色,证明c有漂白性
D.b在足量的纯氧中燃烧,可一步转化为d
B
解析 根据硫元素的“价—类”二维图可知,a为H2S,b为S,c为SO2,d为SO3,e为H2SO4,f为含+4价硫元素的盐,g为含S2-或HS-的盐。硝酸可以氧化硫化亚铁中的硫元素而生成硫或硫酸盐,不会生成硫化氢,A错误;a、b、c、g中S元素都不是最高价,故可以被氧化,具有还原性,B正确;SO2使溴水褪色体现了SO2的还原性,不能证明二氧化硫的漂白性,C错误;硫单质在氧气中燃烧只能生成二氧化硫,不能一步转化为三氧化硫,D错误。
命题点2“微流程”中的物质转化
典例2 (2022·山东卷)高压氢还原法可直接从溶液中提取金属粉。以硫化铜精矿(含Zn、Fe元素的杂质)为主要原料制备Cu粉的工艺流程如下,可能用到的数据见下表。
物质 Fe(OH)3 Cu(OH)2 Zn(OH)2
开始沉淀pH 1.9 4.2 6.2
沉淀完全pH 3.2 6.7 8.2
下列说法错误的是( )
A.固体X主要成分是Fe(OH)3和S;金属M为Zn
B.浸取时,增大O2压强可促进金属离子浸出
C.中和调pH的范围为3.2~4.2
D.还原时,增大溶液酸度有利于Cu的生成
D
解析 根据工艺流程可知,固体X的主要成分是S、Fe(OH)3,金属M为Zn,A正确;CuS难溶于硫酸,在溶液中存在沉淀溶解平衡CuS(s) Cu2+(aq)+
S2-(aq),增大O2的浓度,可以反应消耗S2-,使之转化为S,从而使沉淀溶解平衡正向移动,从而可促进金属离子的浸取,B正确;用NH3调节溶液pH时,要使Fe3+转化为沉淀,而Cu2+、Zn2+仍以离子形式存在于溶液中,结合离子沉淀的pH范围可知,中和时应该调节溶液pH范围为3.2~4.2,C正确;用H2还原Cu2+变为Cu单质时,H2失去电子被氧化为H+,与溶液中OH-结合形成H2O,若还原时增大溶液的酸度,即c(H+)增大,不利于H2失去电子还原Cu2+,故不利于Cu的生成,D错误。
要点图解 本题中物质转化分析如下:
变式演练(2023·辽宁卷)某工厂采用如下工艺制备Cr(OH)3,已知焙烧后Cr元素以+6价形式存在,下列说法错误的是( )
A.“焙烧”中产生CO2
B.滤渣的主要成分为Fe(OH)2
C.滤液①中Cr元素的主要存在形式为
D.淀粉水解液中的葡萄糖起还原作用
B
【思维建模】
抓住“六关键”,突破“微流程”中物质转化类题目
命题点3“微实验”中的物质转化
典例3 (2023·湖北卷)利用如图所示的装置(夹持及加热装置略)制备高纯白磷的流程如下:
下列操作错误的是( )
A.红磷使用前洗涤以除去表面杂质
B.将红磷转入装置,抽真空后加热外管以去除水和氧气
C.从a口通入冷凝水,升温使红磷转化
D.冷凝管外壁出现白磷,冷却后在氮气氛围下收集
C
解析 洗去红磷表面杂质,有利于得到高纯度的白磷,A正确;为防止红磷在加热条件下与O2反应,可加热除去红磷表面的水,以及装置内的氧气,B正确;冷凝水从b口通入,才能使冷凝管中充满水,提高冷凝效果,C错误;白磷着火点低,为防止白磷自燃,可在N2气氛中收集,D正确。
变式演练(2023·湖北七市州3月联考)碘化钾为白色固体,可用作分析试剂、感光材料、制药和食品添加剂等,可通过碘酸钾与硫化氢反应制备。实验装置如图所示(夹持及加热装置已省略),下列说法错误的是( )
A.仪器a、b名称是恒压滴液漏斗,实验中应先关闭K,打开仪器b,制备碘酸钾
B.滴入30%氢氧化钾溶液后,乙装置中紫黑色固体溶解,棕黄色溶液逐渐变为无色
C.乙装置中稀硫酸的主要作用是减小硫化氢的溶解度,以利于其逸出在丙装置中被吸收
D.如果乙装置中最终生成4.8 g黄色沉淀,则理论上可制得碘化钾的质量为8.3 g
答案 D
解析 仪器a、b为恒压滴液漏斗,利用碘酸钾与硫化氢气体制备碘化钾,由于碘酸钾在溶液中,硫化氢为气体,需先关闭K制备碘酸钾,然后制备硫化氢并将其通入碘酸钾溶液中制备碘化钾,A正确;碘单质溶解后溶液呈棕黄色,随着碘单质与氢氧化钾反应生成无色的碘化钾和碘酸钾,溶液逐渐变为无色,B正确;硫化氢为弱电解质,加入稀硫酸能抑制硫化氢的电离,降低其溶解度,使其逸出被吸收,C正确;黄色沉淀为S,4.8 g S为0.15 mol,硫元素由硫化氢中的-2价升高为0价,生成0.15 mol S转移0.3 mol电子,根据反应3I2+6KOH ══ KIO3+5KI+3H2O,3H2S+KIO3 ══ 3S↓+KI+3H2O,故理论上可生成0.3 mol碘化钾,其质量为49.8 g,D错误。
【思维建模】
抓住“四步骤”,突破“微实验”中物质转化类题目
训练分层落实
练真题·明考向
1.(2023·湖北卷)工业制备高纯硅的主要过程如下:
下列说法错误的是( )
A.制备粗硅的反应方程式为SiO2+2C Si+2CO↑
B.1 mol Si含Si—Si键的数目约为4×6.02×1023
C.原料气HCl和H2应充分去除水和氧气
D.生成SiHCl3的反应为熵减过程
B
2.(2023·辽宁卷)下列有关物质的工业制备反应错误的是( )
D
解析 MgO熔点高,冶炼镁采取电解熔融氯化镁:MgCl2 Mg+Cl2↑,D错误。
3.(2023·湖南卷)处理某铜冶金污水(含Cu2+、Fe3+、Zn2+、Al3+)的部分流程如下。
已知:①溶液中金属离子开始沉淀和完全沉淀的pH如下表所示。
物质 Fe(OH)3 Cu(OH)2 Zn(OH)2 Al(OH)3
开始沉淀pH 1.9 4.2 6.2 3.5
完全沉淀pH 3.2 6.7 8.2 4.6
②Ksp(CuS)=6.4×10-36,Ksp(ZnS)=1.6×10-24。
下列说法错误的是( )
A.“沉渣Ⅰ”中含有Fe(OH)3和Al(OH)3
D.“出水”经阴离子交换树脂软化处理后,可用作工业冷却循环用水
D
练易错·避陷阱
4.(2023·陕西咸阳一模)如图是某元素常见物质的“价—类”二维图,f为钠盐。下列说法不正确的是( )
A.物质a既可被氧化,也可被还原
B.可存在a→b→d→e→f的转化关系
C.可通过灼热的氧化铜除去d中混有的少量c
D.向足量f溶液中加入少量稀盐酸,一定没有CO2产生
D
解析 结合图示可知,a为CH4、b为C、c为CO、d为CO2、e为H2CO3、f为Na2CO3或NaHCO3。a为CH4,碳元素化合价可升高,氢元素化合价可降低,则物质a既可被氧化,也可被还原,A正确;可存在a→b→d→e→f的转化关系:甲烷高温分解生成碳,碳燃烧生成二氧化碳,二氧化碳溶于水生成碳酸,碳酸与适量的碱反应生成盐,B正确;CO能被灼热的氧化铜氧化生成二氧化碳,可通过灼热的氧化铜除去d中混有的少量c,C正确;f可能为正盐或酸式盐,向足量f溶液中加入少量稀盐酸,正盐转化成酸式盐,可能没有CO2产生,酸式盐和盐酸反应一定有CO2产生,D错误。
5.(2023·湖南岳阳一模)纯磷酸(熔点为42 ℃,易吸潮)可通过市售85%磷酸溶液减压蒸馏除水、结晶除杂得到,纯化过程需要严格控制温度和水分,温度低于21 ℃易形成2H3PO4·H2O(熔点为30 ℃),高于100 ℃则发生分子间脱水生成焦磷酸等。某兴趣小组为制备磷酸晶体设计的实验装置如图(夹持装置略):
下列说法错误的是( )
A.仪器A的名称是蒸馏烧瓶,仪器B的进水口为b
B.空气流入毛细管的主要作用是防止液体暴沸,还具有搅拌和加速水逸出的作用
C.过滤磷酸晶体时,需要干燥的环境,同时还需要控制温度为30~42 ℃之间
D.磷酸中少量的水极难除去的原因是分子中含羟基,可与水分子间形成氢键
A
解析 仪器A是圆底烧瓶,冷凝管中冷凝水下进上出冷凝效果好,A错误;五氧化二磷可作为干燥剂,空气经干燥后进入仪器A中,可以防止液体暴沸,还具有搅拌和加速水逸出的作用,B正确;纯磷酸(熔点为42 ℃,易吸潮)纯化过程温度低于21 ℃易形成2H3PO4·H2O(熔点为30 ℃),为防止纯磷酸熔化,过滤时需要干燥的环境,同时还需要控制温度为30~42 ℃之间,C正确;磷酸的
结构为 ,分子中含羟基,可与水分子间形成氢键,磷酸中少量
的水极难除去,D正确。
练预测·押考向
6.H2和O2在钯的配合物离子[PdCl4]2-的作用下合成H2O2,反应历程如图。已知Pd为第五周期第Ⅷ族元素,基态Pd原子的价层电子排布式为4d10, [PdCl4]2-的空间结构为平面正方形。下列说法正确的是( )
A.在[PdCl4]2-中Pd原子为sp3杂化
B.在[PdCl2O2]2-和[PdCl4]2-中Pd提供孤电子对形成配位键
C.第③步发生的反应为[PdCl2O2]2-+2HCl ══ H2O2+[PdCl4]2-
D.等物质的量的H2和O2发生反应时,反应①和反应②转移的电子数之比为1∶2
C
解析 [PdCl4]2-的空间结构为平面正方形,说明中心原子Pd不是sp3杂化,A错误;在[PdCl2O2]2-和[PdCl4]2-中Pd提供空轨道形成配位键,B错误;根据反应历程图可知,第③步发生的反应为[PdCl2O2]2-+2HCl ══ H2O2+[PdCl4]2-,C正确;等物质的量的H2和O2发生反应时,反应①中H的化合价由0→+1价,反应②中O的化合价由0→-1价,故转移的电子数之比为1∶1,D错误。
7.炼油、石化等工业会产生含硫(-2价)废水,可通过催化氧化法进行处理,碱性条件下,催化氧化废水的机理如图所示。其中MnO2为催化剂,附着在催化剂载体聚苯胺的表面。下列说法错误的是( )
A.催化氧化过程中既有共价键的断裂又有离子键的断裂
B.转化Ⅰ中化合价发生变化的元素仅有S和O
C.催化氧化过程的总反应为O2+2H2O+2S2- 4OH-+2S↓
D.催化剂使用一段时间后催化效率会下降,原因是生成的S覆盖在催化剂表面或进入催化剂内空位处
B
解析 由图可知,转化Ⅰ中二氧化锰中氧脱离生成空位,有离子键的断裂,水生成OH-,有共价键的断裂,A正确;转化Ⅰ中锰原子形成的化学键数目发生改变,故化合价发生变化的元素有S、O和Mn,B错误;催化氧化过程的总反应为氧气、水、硫离子在催化作用下生成氢氧根离子和硫单质: O2+2H2O+2S2- 4OH-+2S↓,C正确;反应中生成硫单质,生成的S覆盖在催化剂表面或进入催化剂内空位处,阻碍了反应的进行,导致催化剂使用一段时间后催化效率会下降,D正确。
专题 元素及其化合物之间的转化
2024
考题统计
(1)金属及其化合物的性质与转化:
山东卷(2022、2021、2020),湖南卷(2022、2021),湖北卷(2022、2021),浙江卷(2023、2022、2021),江苏卷(2022、2021、2020),重庆卷(2021)
(2)非金属及其化合物的性质与转化:
山东卷(2023),湖北卷(2023),湖南卷(2022),广东卷(2023、2022、2021),江苏卷(2022、2021),辽宁卷(2023、2021),河北卷(2021),海南卷(2021),北京卷(2023、2021、2020),重庆卷(2021)
聚焦核心要点
要点1基于“价—类”二维图认识元素及其化合物之间的转化关系
课标指引:1.能够列举、描述、辨识典型物质重要的物理和化学性质及实验现象。 2.能从物质类别、元素价态的角度,依据复分解反应和氧化还原反应原理,预测物质的化学性质和变化。
1.钠及其重要化合物
重要的化学方程式:
①2Na2O2+2H2O ══ 4NaOH+O2↑,
2Na2O2+2CO2 ══ 2Na2CO3+O2;
②Na2CO3+HCl(少量) ══ NaCl+NaHCO3,
Na2CO3+2HCl(足量) ══ 2NaCl+CO2↑+H2O;
③Na2CO3+CO2+H2O ══ 2NaHCO3;
④2NaHCO3 Na2CO3+CO2↑+H2O。
2.铁及其重要化合物
重要的方程式:
①2FeCl3+Fe ══ 3FeCl2,
2FeCl3+Cu ══ 2FeCl2+CuCl2;
②2FeCl2+Cl2 ══ 2FeCl3,
2Fe2++H2O2+2H+ ══ 2Fe3++2H2O;
③4Fe(OH)2+O2+2H2O ══ 4Fe(OH)3;
④2Fe(OH)3+6H++2I- ══ 2Fe2++I2+6H2O。
3.铝及其重要化合物
重要的方程式:
①Al2O3+6H+ ══ 2Al3++3H2O,
Al2O3+2OH- ══ 2 +H2O;
②Al(OH)3+3H+ ══ Al3++3H2O,
Al(OH)3+OH- ══ +2H2O;
③ +CO2(足量)+2H2O ══ Al(OH)3↓+ (化工流程题中常考)。
4.氯及其重要化合物
重要的化学方程式:
①MnO2+4HCl(浓) MnCl2+Cl2↑+2H2O,
2KMnO4+16HCl(浓)══ 2KCl+2MnCl2+5Cl2↑+8H2O;
②2Cl2+2Ca(OH)2 ══
CaCl2+Ca(ClO)2+2H2O(制取漂白粉);
③2NaOH+Cl2 ══ NaCl+NaClO+H2O(制取漂白液);
④Cl2+SO2+2H2O ══ H2SO4+2HCl。
5.硫及其重要化合物
6.氮及其重要化合物
要点2“微流程”“微实验”中的物质转化
课标指引:1.探究反应规律,进行物质的制备、分离等不同类型化学实验及探究活动的核心思路与基本方法。 2.通过化学反应可以探索物质的性质、实现物质转化,认识物质及其转化在自然资源综合利用和环境保护中的重要价值。
1.“微流程”中物质转化的思维模型
2.“微实验”中物质转化的思维模型
易错辨析
试判断物质间的转化能否通过一步反应实现(填“能”或“不能”):
不能
氨气催化氧化生成NO。
不能
SiO2与水不反应。
能
不能
Na2O与H2O反应生成NaOH,不能生成O2。
精研核心命题
命题点1基于“价—类”二维图的物质转化关系
典例1 (2023·广东卷)部分含Na或含Cu物质的分类与相应化合价关系如图所示。下列推断不合理的是( )
A.可存在c→d→e的转化
B.能与H2O反应生成c的物质只有b
C.新制的d可用于检验葡萄糖中的醛基
D.若b能与H2O反应生成O2,则b中含共价键
B
解析 若为含Cu物质,c为CuOH,d为Cu(OH)2,e为CuO,CuOH被氧化生成Cu(OH)2,Cu(OH)2受热分解生成CuO,存在c→d→e的转化,A正确。若为含钠物质,a为Na,b为Na2O2(或Na2O),c为NaOH,Na、Na2O2(或Na2O)都能与水反应生成NaOH,B错误。若d为Cu(OH)2,新制Cu(OH)2可用于检验葡萄糖中的醛基,C正确。若b能与H2O反应生成O2,则b为Na2O2,由Na+和构成,则b中含离子键和共价键,D正确。
变式演练(2023·河南郑州一模)“价—类”二维图是基于核心元素的化合价和物质类别研究物质性质的一种模型。下图是硫元素的“价—类”二维图。下列说法正确的是( )
A.硫化亚铁与稀硝酸反应可用来制取a
B.从价态角度分析,a、b、c、g都具有还原性
C.c通入溴水中,溴水褪色,证明c有漂白性
D.b在足量的纯氧中燃烧,可一步转化为d
B
解析 根据硫元素的“价—类”二维图可知,a为H2S,b为S,c为SO2,d为SO3,e为H2SO4,f为含+4价硫元素的盐,g为含S2-或HS-的盐。硝酸可以氧化硫化亚铁中的硫元素而生成硫或硫酸盐,不会生成硫化氢,A错误;a、b、c、g中S元素都不是最高价,故可以被氧化,具有还原性,B正确;SO2使溴水褪色体现了SO2的还原性,不能证明二氧化硫的漂白性,C错误;硫单质在氧气中燃烧只能生成二氧化硫,不能一步转化为三氧化硫,D错误。
命题点2“微流程”中的物质转化
典例2 (2022·山东卷)高压氢还原法可直接从溶液中提取金属粉。以硫化铜精矿(含Zn、Fe元素的杂质)为主要原料制备Cu粉的工艺流程如下,可能用到的数据见下表。
物质 Fe(OH)3 Cu(OH)2 Zn(OH)2
开始沉淀pH 1.9 4.2 6.2
沉淀完全pH 3.2 6.7 8.2
下列说法错误的是( )
A.固体X主要成分是Fe(OH)3和S;金属M为Zn
B.浸取时,增大O2压强可促进金属离子浸出
C.中和调pH的范围为3.2~4.2
D.还原时,增大溶液酸度有利于Cu的生成
D
解析 根据工艺流程可知,固体X的主要成分是S、Fe(OH)3,金属M为Zn,A正确;CuS难溶于硫酸,在溶液中存在沉淀溶解平衡CuS(s) Cu2+(aq)+
S2-(aq),增大O2的浓度,可以反应消耗S2-,使之转化为S,从而使沉淀溶解平衡正向移动,从而可促进金属离子的浸取,B正确;用NH3调节溶液pH时,要使Fe3+转化为沉淀,而Cu2+、Zn2+仍以离子形式存在于溶液中,结合离子沉淀的pH范围可知,中和时应该调节溶液pH范围为3.2~4.2,C正确;用H2还原Cu2+变为Cu单质时,H2失去电子被氧化为H+,与溶液中OH-结合形成H2O,若还原时增大溶液的酸度,即c(H+)增大,不利于H2失去电子还原Cu2+,故不利于Cu的生成,D错误。
要点图解 本题中物质转化分析如下:
变式演练(2023·辽宁卷)某工厂采用如下工艺制备Cr(OH)3,已知焙烧后Cr元素以+6价形式存在,下列说法错误的是( )
A.“焙烧”中产生CO2
B.滤渣的主要成分为Fe(OH)2
C.滤液①中Cr元素的主要存在形式为
D.淀粉水解液中的葡萄糖起还原作用
B
【思维建模】
抓住“六关键”,突破“微流程”中物质转化类题目
命题点3“微实验”中的物质转化
典例3 (2023·湖北卷)利用如图所示的装置(夹持及加热装置略)制备高纯白磷的流程如下:
下列操作错误的是( )
A.红磷使用前洗涤以除去表面杂质
B.将红磷转入装置,抽真空后加热外管以去除水和氧气
C.从a口通入冷凝水,升温使红磷转化
D.冷凝管外壁出现白磷,冷却后在氮气氛围下收集
C
解析 洗去红磷表面杂质,有利于得到高纯度的白磷,A正确;为防止红磷在加热条件下与O2反应,可加热除去红磷表面的水,以及装置内的氧气,B正确;冷凝水从b口通入,才能使冷凝管中充满水,提高冷凝效果,C错误;白磷着火点低,为防止白磷自燃,可在N2气氛中收集,D正确。
变式演练(2023·湖北七市州3月联考)碘化钾为白色固体,可用作分析试剂、感光材料、制药和食品添加剂等,可通过碘酸钾与硫化氢反应制备。实验装置如图所示(夹持及加热装置已省略),下列说法错误的是( )
A.仪器a、b名称是恒压滴液漏斗,实验中应先关闭K,打开仪器b,制备碘酸钾
B.滴入30%氢氧化钾溶液后,乙装置中紫黑色固体溶解,棕黄色溶液逐渐变为无色
C.乙装置中稀硫酸的主要作用是减小硫化氢的溶解度,以利于其逸出在丙装置中被吸收
D.如果乙装置中最终生成4.8 g黄色沉淀,则理论上可制得碘化钾的质量为8.3 g
答案 D
解析 仪器a、b为恒压滴液漏斗,利用碘酸钾与硫化氢气体制备碘化钾,由于碘酸钾在溶液中,硫化氢为气体,需先关闭K制备碘酸钾,然后制备硫化氢并将其通入碘酸钾溶液中制备碘化钾,A正确;碘单质溶解后溶液呈棕黄色,随着碘单质与氢氧化钾反应生成无色的碘化钾和碘酸钾,溶液逐渐变为无色,B正确;硫化氢为弱电解质,加入稀硫酸能抑制硫化氢的电离,降低其溶解度,使其逸出被吸收,C正确;黄色沉淀为S,4.8 g S为0.15 mol,硫元素由硫化氢中的-2价升高为0价,生成0.15 mol S转移0.3 mol电子,根据反应3I2+6KOH ══ KIO3+5KI+3H2O,3H2S+KIO3 ══ 3S↓+KI+3H2O,故理论上可生成0.3 mol碘化钾,其质量为49.8 g,D错误。
【思维建模】
抓住“四步骤”,突破“微实验”中物质转化类题目
训练分层落实
练真题·明考向
1.(2023·湖北卷)工业制备高纯硅的主要过程如下:
下列说法错误的是( )
A.制备粗硅的反应方程式为SiO2+2C Si+2CO↑
B.1 mol Si含Si—Si键的数目约为4×6.02×1023
C.原料气HCl和H2应充分去除水和氧气
D.生成SiHCl3的反应为熵减过程
B
2.(2023·辽宁卷)下列有关物质的工业制备反应错误的是( )
D
解析 MgO熔点高,冶炼镁采取电解熔融氯化镁:MgCl2 Mg+Cl2↑,D错误。
3.(2023·湖南卷)处理某铜冶金污水(含Cu2+、Fe3+、Zn2+、Al3+)的部分流程如下。
已知:①溶液中金属离子开始沉淀和完全沉淀的pH如下表所示。
物质 Fe(OH)3 Cu(OH)2 Zn(OH)2 Al(OH)3
开始沉淀pH 1.9 4.2 6.2 3.5
完全沉淀pH 3.2 6.7 8.2 4.6
②Ksp(CuS)=6.4×10-36,Ksp(ZnS)=1.6×10-24。
下列说法错误的是( )
A.“沉渣Ⅰ”中含有Fe(OH)3和Al(OH)3
D.“出水”经阴离子交换树脂软化处理后,可用作工业冷却循环用水
D
练易错·避陷阱
4.(2023·陕西咸阳一模)如图是某元素常见物质的“价—类”二维图,f为钠盐。下列说法不正确的是( )
A.物质a既可被氧化,也可被还原
B.可存在a→b→d→e→f的转化关系
C.可通过灼热的氧化铜除去d中混有的少量c
D.向足量f溶液中加入少量稀盐酸,一定没有CO2产生
D
解析 结合图示可知,a为CH4、b为C、c为CO、d为CO2、e为H2CO3、f为Na2CO3或NaHCO3。a为CH4,碳元素化合价可升高,氢元素化合价可降低,则物质a既可被氧化,也可被还原,A正确;可存在a→b→d→e→f的转化关系:甲烷高温分解生成碳,碳燃烧生成二氧化碳,二氧化碳溶于水生成碳酸,碳酸与适量的碱反应生成盐,B正确;CO能被灼热的氧化铜氧化生成二氧化碳,可通过灼热的氧化铜除去d中混有的少量c,C正确;f可能为正盐或酸式盐,向足量f溶液中加入少量稀盐酸,正盐转化成酸式盐,可能没有CO2产生,酸式盐和盐酸反应一定有CO2产生,D错误。
5.(2023·湖南岳阳一模)纯磷酸(熔点为42 ℃,易吸潮)可通过市售85%磷酸溶液减压蒸馏除水、结晶除杂得到,纯化过程需要严格控制温度和水分,温度低于21 ℃易形成2H3PO4·H2O(熔点为30 ℃),高于100 ℃则发生分子间脱水生成焦磷酸等。某兴趣小组为制备磷酸晶体设计的实验装置如图(夹持装置略):
下列说法错误的是( )
A.仪器A的名称是蒸馏烧瓶,仪器B的进水口为b
B.空气流入毛细管的主要作用是防止液体暴沸,还具有搅拌和加速水逸出的作用
C.过滤磷酸晶体时,需要干燥的环境,同时还需要控制温度为30~42 ℃之间
D.磷酸中少量的水极难除去的原因是分子中含羟基,可与水分子间形成氢键
A
解析 仪器A是圆底烧瓶,冷凝管中冷凝水下进上出冷凝效果好,A错误;五氧化二磷可作为干燥剂,空气经干燥后进入仪器A中,可以防止液体暴沸,还具有搅拌和加速水逸出的作用,B正确;纯磷酸(熔点为42 ℃,易吸潮)纯化过程温度低于21 ℃易形成2H3PO4·H2O(熔点为30 ℃),为防止纯磷酸熔化,过滤时需要干燥的环境,同时还需要控制温度为30~42 ℃之间,C正确;磷酸的
结构为 ,分子中含羟基,可与水分子间形成氢键,磷酸中少量
的水极难除去,D正确。
练预测·押考向
6.H2和O2在钯的配合物离子[PdCl4]2-的作用下合成H2O2,反应历程如图。已知Pd为第五周期第Ⅷ族元素,基态Pd原子的价层电子排布式为4d10, [PdCl4]2-的空间结构为平面正方形。下列说法正确的是( )
A.在[PdCl4]2-中Pd原子为sp3杂化
B.在[PdCl2O2]2-和[PdCl4]2-中Pd提供孤电子对形成配位键
C.第③步发生的反应为[PdCl2O2]2-+2HCl ══ H2O2+[PdCl4]2-
D.等物质的量的H2和O2发生反应时,反应①和反应②转移的电子数之比为1∶2
C
解析 [PdCl4]2-的空间结构为平面正方形,说明中心原子Pd不是sp3杂化,A错误;在[PdCl2O2]2-和[PdCl4]2-中Pd提供空轨道形成配位键,B错误;根据反应历程图可知,第③步发生的反应为[PdCl2O2]2-+2HCl ══ H2O2+[PdCl4]2-,C正确;等物质的量的H2和O2发生反应时,反应①中H的化合价由0→+1价,反应②中O的化合价由0→-1价,故转移的电子数之比为1∶1,D错误。
7.炼油、石化等工业会产生含硫(-2价)废水,可通过催化氧化法进行处理,碱性条件下,催化氧化废水的机理如图所示。其中MnO2为催化剂,附着在催化剂载体聚苯胺的表面。下列说法错误的是( )
A.催化氧化过程中既有共价键的断裂又有离子键的断裂
B.转化Ⅰ中化合价发生变化的元素仅有S和O
C.催化氧化过程的总反应为O2+2H2O+2S2- 4OH-+2S↓
D.催化剂使用一段时间后催化效率会下降,原因是生成的S覆盖在催化剂表面或进入催化剂内空位处
B
解析 由图可知,转化Ⅰ中二氧化锰中氧脱离生成空位,有离子键的断裂,水生成OH-,有共价键的断裂,A正确;转化Ⅰ中锰原子形成的化学键数目发生改变,故化合价发生变化的元素有S、O和Mn,B错误;催化氧化过程的总反应为氧气、水、硫离子在催化作用下生成氢氧根离子和硫单质: O2+2H2O+2S2- 4OH-+2S↓,C正确;反应中生成硫单质,生成的S覆盖在催化剂表面或进入催化剂内空位处,阻碍了反应的进行,导致催化剂使用一段时间后催化效率会下降,D正确。
同课章节目录
