专题 元素及其化合物——专题突破练----基础巩固练(共28张PPT)
文档属性
| 名称 | 专题 元素及其化合物——专题突破练----基础巩固练(共28张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 1.9MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-11-20 00:01:36 | ||
图片预览






文档简介
(共28张PPT)
专题 元素及其化合物----基础巩固练
2024
基础巩固练
1.(2023·湖南岳阳一模)下列物质应用错误的是( )
A.石膏可用于调节水泥的硬化速率
B.掺杂了I2的聚乙炔具有导电性
C.硫酸铜用作无水酒精的检水剂
D.氧化钙用作食品抗氧化剂
D
解析 氧化钙和水反应生成氢氧化钙,可用作食品干燥剂,不能用作抗氧化剂,D错误。
2.(2023·山东济南一模)下列实验中硫酸的作用与其他三项不同的是( )
A.蔗糖中加入浓硫酸产生黑“面包”
B.亚硫酸钠与硫酸制取SO2
C.配制Fe2(SO4)3溶液时加入稀硫酸
D.海带提碘时加入硫酸与H2O2溶液
A
解析 A项蔗糖中加入浓硫酸产生黑“面包”,体现浓硫酸的脱水性和强氧化性;其余三项体现硫酸的酸性。
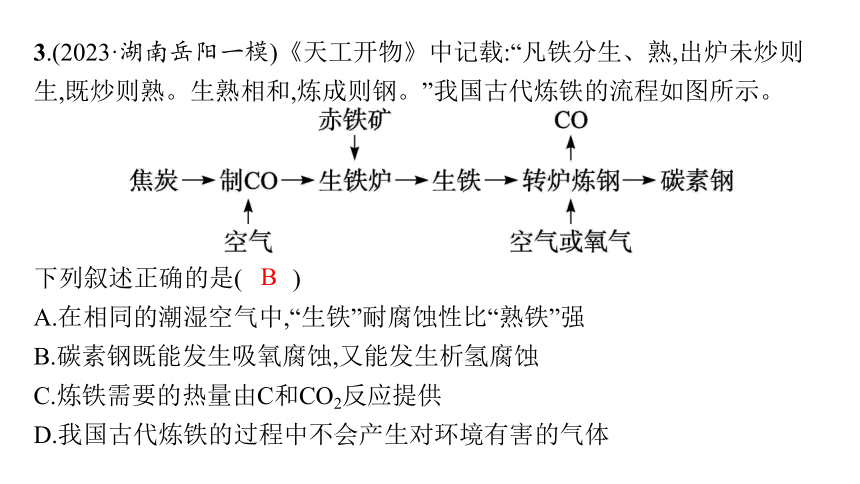
3.(2023·湖南岳阳一模)《天工开物》中记载:“凡铁分生、熟,出炉未炒则生,既炒则熟。生熟相和,炼成则钢。”我国古代炼铁的流程如图所示。
下列叙述正确的是( )
A.在相同的潮湿空气中,“生铁”耐腐蚀性比“熟铁”强
B.碳素钢既能发生吸氧腐蚀,又能发生析氢腐蚀
C.炼铁需要的热量由C和CO2反应提供
D.我国古代炼铁的过程中不会产生对环境有害的气体
B
解析 题目中的“生铁”“熟铁”即平常所说的生铁和钢,在相同的潮湿空气中,钢耐腐蚀性比生铁强,A错误;碳素钢在酸性环境中发生析氢腐蚀,在中性或偏碱性的环境中发生吸氧腐蚀,B正确;炼铁需要的热量由C和O2反应提供,C错误;炼铁过程中会有CO、SO2等气体生成,D错误。
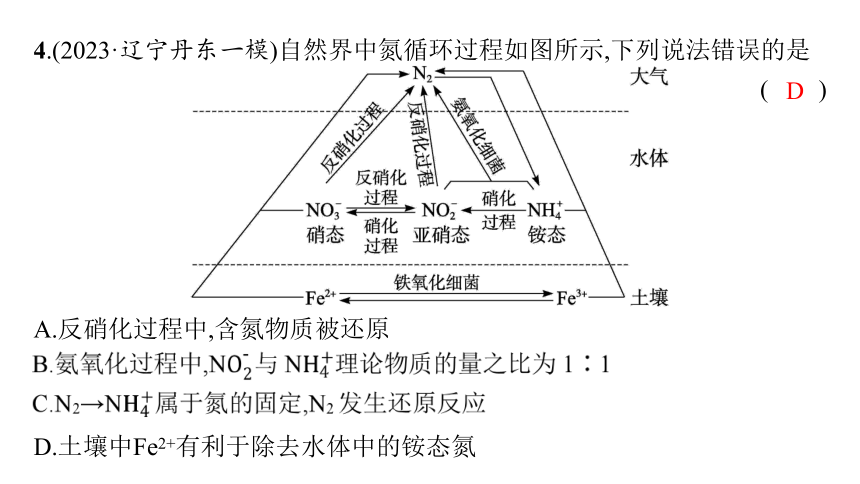
4.(2023·辽宁丹东一模)自然界中氮循环过程如图所示,下列说法错误的是
( )
A.反硝化过程中,含氮物质被还原
D.土壤中Fe2+有利于除去水体中的铵态氮
D
解析 由转化图可知,Fe2+与水体中的 反应,可以除去水体中的硝态氮,D错误。
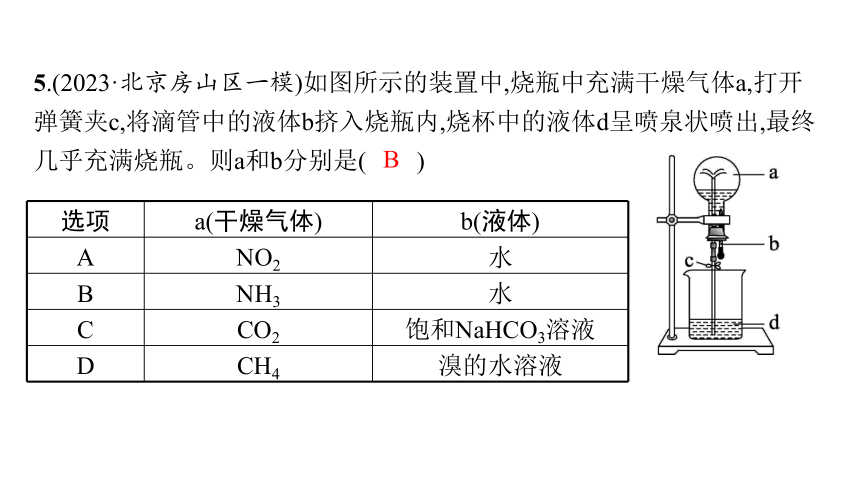
5.(2023·北京房山区一模)如图所示的装置中,烧瓶中充满干燥气体a,打开弹簧夹c,将滴管中的液体b挤入烧瓶内,烧杯中的液体d呈喷泉状喷出,最终几乎充满烧瓶。则a和b分别是( )
选项 a(干燥气体) b(液体)
A NO2 水
B NH3 水
C CO2 饱和NaHCO3溶液
D CH4 溴的水溶液
B
解析 NO2与水反应的化学方程式为3NO2+H2O ══ 2HNO3+NO,NO难溶于水,液体不可能充满烧瓶,A错误;NH3极易溶于水,造成烧瓶中压强变小,形成喷泉,且最终液体几乎充满烧瓶,B正确;CO2难溶于饱和NaHCO3溶液,烧瓶内不可能形成喷泉,C错误;CH4难溶于水,且不与溴单质反应,烧瓶内不可能形成喷泉,D错误。
6.(2023·天津红桥区一模)部分含氮物质的分类与相应化合价关系如图所示。下列说法正确的是( )
A.a的氧化或还原均可实现氮的固定
B.b是红棕色气体,b常温下可转化为c
C.常温下d的稀溶液可保存在铝制容器中
D.e的溶液一定呈中性
A
解析 氮的固定是将游离态的氮转化为化合态的氮,氮单质中元素化合价可升高也可降低,A正确;b为NO,是无色气体,B错误;浓硝酸能使铝钝化,可以盛放在铝制容器中,C错误;e为硝酸盐,其溶液不一定呈中性,如硝酸铵溶液由于铵根离子水解,溶液显酸性,D错误。
7.(2023·广东茂名一模)某兴趣小组利用如图装置探究SO2的性质,观察到①中溶液不褪色,②③中溶液均褪色。下列判断正确的是( )
A.②③均体现SO2的漂白性
B.SO2与品红分子直接反应使其褪色
C
解析 ②中的品红褪色体现了SO2的漂白性,③中的酸性KMnO4溶液褪色体现了SO2的还原性,A错误;SO2与水反应生成的H2SO3能与品红分子结合,使品红溶液褪色,无水存在时,SO2分子不能使其褪色,B错误;SO2与水反应
8.(2023·河北衡水中学一调)甲、乙、丙、丁为中学化学常见的物质,其相互转化关系如图(水作为溶剂的未在图上标出),下列组合不符合题意的是( )
选项 甲 乙 丙
A CO2 NaHCO3 Na2CO3
B Fe FeCl2 FeCl3
C H2S S SO2
D AlCl3 Al(OH)3 NaAlO2
B
解析 足量CO2和氢氧化钠反应生成NaHCO3,NaHCO3和氢氧化钠反应生成Na2CO3,Na2CO3溶液和CO2反应生成NaHCO3,A正确。若丁是氯气,Fe和氯气反应生成FeCl3;若丁是盐酸,Fe和盐酸反应生成FeCl2,FeCl2和盐酸不反应,B错误。H2S在氧气不足的条件下燃烧生成S和水,S和氧气点燃生成SO2,SO2和H2S反应生成S和水,C正确。AlCl3和少量氢氧化钠反应生成Al(OH)3,Al(OH)3和氢氧化钠反应生成NaAlO2,NaAlO2溶液和AlCl3溶液混合生成Al(OH)3,D正确。
9.(2023·广东深圳一模)利用如图所示装置进行Cl2的制备及性质探究实验时,下列说法不正确的是( )
A.甲中反应的氧化剂与还原剂的物质的量之比为1∶4
B.乙的作用为除去Cl2中的HCl
C.丙中紫色石蕊溶液先变红后褪色
D.为吸收多余的Cl2,丁中可盛放NaOH溶液
A
解析 装置甲中二氧化锰和浓盐酸在加热的条件下发生反应: MnO2+4HCl(浓) MnCl2+2H2O+Cl2↑,氧化剂是MnO2,还原剂是HCl,其物质的量之比为1∶2,A错误;装置甲中制备的氯气中混有HCl气体,乙中饱和NaCl溶液的作用是除去Cl2中的HCl,B正确;Cl2与水反应生成HCl、HClO,溶液显酸性,且HClO具有漂白性,则Cl2通入紫色石蕊溶液先变红后褪色,C正确;Cl2与NaOH溶液反应生成NaCl和NaClO,可用NaOH溶液吸收多余的Cl2,丁中可盛放NaOH溶液,D正确。
10.(2023·河北唐山一模)用绿矾(FeSO4·7H2O)制备电池电极材料LiFePO4的流程如下:
下列说法正确的是( )
A.溶解过程中H3PO4可抑制Fe2+的水解
B.可用酸性KMnO4溶液检验反应1中Fe2+是否完全反应
C.洗涤沉淀时可用玻璃棒搅拌
D.反应2中氧化剂与还原剂的物质的量之比为1∶2
A
解析 Fe2+能发生水解:Fe2++2H2O Fe(OH)2+2H+,加入磷酸溶解过程中可以抑制Fe2+水解,A正确;反应1中NaClO作氧化剂,将Fe2+氧化成Fe3+,本身被还原成NaCl,酸性高锰酸钾溶液能氧化Cl-而褪色,故不能用酸性高锰酸钾溶液检验反应1中Fe2+是否完全反应,B错误;洗涤沉淀时,不能用玻璃棒搅拌,防止弄破滤纸,C错误;草酸为还原剂,FePO4为氧化剂,根据得失电子守恒可得,FePO4与草酸的物质的量之比为2∶1,D错误。
11.(2023·辽宁鞍山一模)室温下,下列实验探究方案及现象能达到探究目的的是( )
选项 探究方案及现象 探究目的
A 用pH计测量醋酸、盐酸的pH,比较溶液pH大小 醋酸是弱电解质
B 向久置的Na2SO3溶液中加入足量BaCl2溶液,出现白色沉淀;再加入足量稀盐酸,部分沉淀溶解 Na2SO3不能被空气氧化
C 向NaBr溶液中滴加过量氯水,溶液变橙色,再加入淀粉KI溶液,溶液变蓝色 氧化性: Cl2>Br2>I2
D 向盛有FeSO4溶液的试管中滴加几滴KSCN溶液,无明显现象,振荡,再滴加几滴新制氯水,溶液变红 Fe2+具有还原性
D
解析 未指明醋酸和盐酸的浓度,只比较pH大小,无法判断醋酸是强电解质还是弱电解质,A错误;加入足量盐酸后部分沉淀溶解,则说明沉淀中有BaSO4,同时也说明Na2SO3能被空气中的O2氧化为Na2SO4,B错误;氯水过量,溶液变为蓝色,有可能是过量氯水将KI氧化成了碘单质,无法比较出溴单质和碘单质的氧化性强弱,C错误;KSCN溶液可用于检验Fe3+,滴加氯水后,溶液变红,则说明Fe2+被氧化成Fe3+,可以证明Fe2+具有还原性,D正确。
12.(2023·山东淄博一模)利用下图装置制备ClO2,并以ClO2为原料制备NaClO2。已知:高于60 ℃时,NaClO2分解生成NaClO3和NaCl。下列说法错误的是( )
A.Na2SO3和H2O2均作还原剂
B.装置②④的作用分别是防倒吸、吸收未反应的污染气体
C.从装置③反应后的溶液中获得晶体,可采用常压蒸发结晶
D.反应结束时,通氮气的目的是将仪器中残留的气体排入④中
C
解析 ①中发生反应2NaClO3+Na2SO3+H2SO4 2ClO2↑+2Na2SO4+H2O,S的化合价升高,Na2SO3为还原剂;2ClO2+2NaOH+H2O2 ══ 2NaClO2+2H2O+O2中O元素化合价也升高,H2O2为还原剂,A正确。装置②④的作用分别是防倒吸、吸收生成的ClO2,B正确。由于温度高于60 ℃时,NaClO2会发生分解,所以可采取冷却结晶的方法获得晶体,C错误。反应结束时,通氮气的目的是将仪器中残留的气体排入④中,排除污染气体,保证实验结束安全,D正确。
13.(2023·安徽宿州一模)纳米氧化锌是一种多功能的新型无机材料,化工上可以利用废弃的锌镍电池废料(主要含Zn、Ni和少量的Fe、Al)制备纳米氧化锌,其生产流程如图所示:
已知:Ksp[Zn(OH)2]=1.6×10-16;Ksp[Ni(OH)2]=2.8×10-15;Ksp[Fe(OH)3]=2.7×10-39;
Ksp[Al(OH)3]=4.6×10-33。回答下列问题:
(1)为检验“氧化”操作后的溶液中是否含有Fe2+,某同学取适量待检溶液,滴加酸性高锰酸钾溶液,该方法是否合理: (填“是”或“否”),理由是 (用离子方程式表示)。
(2)“沉铁铝”操作中加热不仅能够加快反应速率,另外一个主要目的是 。
取“沉铁铝”操作所得的沉淀物置于1.0 L水中室温下充分溶解,其中沉淀物中若含有5.6 g Fe(OH)3,则最终所得溶液中c(Fe3+)= mol·L-1。
否
防止生成胶体,便于沉淀分离
1×10-10
(3)假定萃取达到平衡时,样品在水和萃取剂中的总浓度比为1∶80,若在50 mL的水溶液样品中用10 mL萃取剂萃取,则萃取后溶液中残留的样品浓度与原溶液中样品浓度的比值为 。
(4)化工生产中,分离Zn2+用萃取法而不通过调节溶液pH形成沉淀的方法,原因是 。
(5)“沉锌”过程中若NH4HCO3用量过大,易生成碱式碳酸锌[2Zn(OH)2·ZnCO3·2H2O]沉淀,该反应的离子方程式为
。
1∶17
Zn(OH)2与Ni(OH)2的Ksp接近,难以通过调节pH分离Ni2+、Zn2+
3Zn2++6 +H2O ══ 2Zn(OH)2·ZnCO3·2H2O↓+5CO2↑
解析 (2)“沉铁铝”操作中加热不仅能够加快反应速率,另外一个主要目的是防止生成胶体,便于沉淀分离;取“沉铁铝”操作所得的沉淀物置于1.0 L水中在室温下充分溶解,其中沉淀物中若含有5.6 g Fe(OH)3,最终所得溶液是Fe(OH)3的饱和溶液,c(Fe3+)·c3(OH-)=Ksp[Fe(OH)3]=2.7×10-39,
(3)假定萃取达到平衡时,样品在水和萃取剂中的总浓度比为1∶80,设50 mL的水溶液中样品的浓度为c,用10 mL萃取剂萃取,萃取后水溶液中残留
专题 元素及其化合物----基础巩固练
2024
基础巩固练
1.(2023·湖南岳阳一模)下列物质应用错误的是( )
A.石膏可用于调节水泥的硬化速率
B.掺杂了I2的聚乙炔具有导电性
C.硫酸铜用作无水酒精的检水剂
D.氧化钙用作食品抗氧化剂
D
解析 氧化钙和水反应生成氢氧化钙,可用作食品干燥剂,不能用作抗氧化剂,D错误。
2.(2023·山东济南一模)下列实验中硫酸的作用与其他三项不同的是( )
A.蔗糖中加入浓硫酸产生黑“面包”
B.亚硫酸钠与硫酸制取SO2
C.配制Fe2(SO4)3溶液时加入稀硫酸
D.海带提碘时加入硫酸与H2O2溶液
A
解析 A项蔗糖中加入浓硫酸产生黑“面包”,体现浓硫酸的脱水性和强氧化性;其余三项体现硫酸的酸性。
3.(2023·湖南岳阳一模)《天工开物》中记载:“凡铁分生、熟,出炉未炒则生,既炒则熟。生熟相和,炼成则钢。”我国古代炼铁的流程如图所示。
下列叙述正确的是( )
A.在相同的潮湿空气中,“生铁”耐腐蚀性比“熟铁”强
B.碳素钢既能发生吸氧腐蚀,又能发生析氢腐蚀
C.炼铁需要的热量由C和CO2反应提供
D.我国古代炼铁的过程中不会产生对环境有害的气体
B
解析 题目中的“生铁”“熟铁”即平常所说的生铁和钢,在相同的潮湿空气中,钢耐腐蚀性比生铁强,A错误;碳素钢在酸性环境中发生析氢腐蚀,在中性或偏碱性的环境中发生吸氧腐蚀,B正确;炼铁需要的热量由C和O2反应提供,C错误;炼铁过程中会有CO、SO2等气体生成,D错误。
4.(2023·辽宁丹东一模)自然界中氮循环过程如图所示,下列说法错误的是
( )
A.反硝化过程中,含氮物质被还原
D.土壤中Fe2+有利于除去水体中的铵态氮
D
解析 由转化图可知,Fe2+与水体中的 反应,可以除去水体中的硝态氮,D错误。
5.(2023·北京房山区一模)如图所示的装置中,烧瓶中充满干燥气体a,打开弹簧夹c,将滴管中的液体b挤入烧瓶内,烧杯中的液体d呈喷泉状喷出,最终几乎充满烧瓶。则a和b分别是( )
选项 a(干燥气体) b(液体)
A NO2 水
B NH3 水
C CO2 饱和NaHCO3溶液
D CH4 溴的水溶液
B
解析 NO2与水反应的化学方程式为3NO2+H2O ══ 2HNO3+NO,NO难溶于水,液体不可能充满烧瓶,A错误;NH3极易溶于水,造成烧瓶中压强变小,形成喷泉,且最终液体几乎充满烧瓶,B正确;CO2难溶于饱和NaHCO3溶液,烧瓶内不可能形成喷泉,C错误;CH4难溶于水,且不与溴单质反应,烧瓶内不可能形成喷泉,D错误。
6.(2023·天津红桥区一模)部分含氮物质的分类与相应化合价关系如图所示。下列说法正确的是( )
A.a的氧化或还原均可实现氮的固定
B.b是红棕色气体,b常温下可转化为c
C.常温下d的稀溶液可保存在铝制容器中
D.e的溶液一定呈中性
A
解析 氮的固定是将游离态的氮转化为化合态的氮,氮单质中元素化合价可升高也可降低,A正确;b为NO,是无色气体,B错误;浓硝酸能使铝钝化,可以盛放在铝制容器中,C错误;e为硝酸盐,其溶液不一定呈中性,如硝酸铵溶液由于铵根离子水解,溶液显酸性,D错误。
7.(2023·广东茂名一模)某兴趣小组利用如图装置探究SO2的性质,观察到①中溶液不褪色,②③中溶液均褪色。下列判断正确的是( )
A.②③均体现SO2的漂白性
B.SO2与品红分子直接反应使其褪色
C
解析 ②中的品红褪色体现了SO2的漂白性,③中的酸性KMnO4溶液褪色体现了SO2的还原性,A错误;SO2与水反应生成的H2SO3能与品红分子结合,使品红溶液褪色,无水存在时,SO2分子不能使其褪色,B错误;SO2与水反应
8.(2023·河北衡水中学一调)甲、乙、丙、丁为中学化学常见的物质,其相互转化关系如图(水作为溶剂的未在图上标出),下列组合不符合题意的是( )
选项 甲 乙 丙
A CO2 NaHCO3 Na2CO3
B Fe FeCl2 FeCl3
C H2S S SO2
D AlCl3 Al(OH)3 NaAlO2
B
解析 足量CO2和氢氧化钠反应生成NaHCO3,NaHCO3和氢氧化钠反应生成Na2CO3,Na2CO3溶液和CO2反应生成NaHCO3,A正确。若丁是氯气,Fe和氯气反应生成FeCl3;若丁是盐酸,Fe和盐酸反应生成FeCl2,FeCl2和盐酸不反应,B错误。H2S在氧气不足的条件下燃烧生成S和水,S和氧气点燃生成SO2,SO2和H2S反应生成S和水,C正确。AlCl3和少量氢氧化钠反应生成Al(OH)3,Al(OH)3和氢氧化钠反应生成NaAlO2,NaAlO2溶液和AlCl3溶液混合生成Al(OH)3,D正确。
9.(2023·广东深圳一模)利用如图所示装置进行Cl2的制备及性质探究实验时,下列说法不正确的是( )
A.甲中反应的氧化剂与还原剂的物质的量之比为1∶4
B.乙的作用为除去Cl2中的HCl
C.丙中紫色石蕊溶液先变红后褪色
D.为吸收多余的Cl2,丁中可盛放NaOH溶液
A
解析 装置甲中二氧化锰和浓盐酸在加热的条件下发生反应: MnO2+4HCl(浓) MnCl2+2H2O+Cl2↑,氧化剂是MnO2,还原剂是HCl,其物质的量之比为1∶2,A错误;装置甲中制备的氯气中混有HCl气体,乙中饱和NaCl溶液的作用是除去Cl2中的HCl,B正确;Cl2与水反应生成HCl、HClO,溶液显酸性,且HClO具有漂白性,则Cl2通入紫色石蕊溶液先变红后褪色,C正确;Cl2与NaOH溶液反应生成NaCl和NaClO,可用NaOH溶液吸收多余的Cl2,丁中可盛放NaOH溶液,D正确。
10.(2023·河北唐山一模)用绿矾(FeSO4·7H2O)制备电池电极材料LiFePO4的流程如下:
下列说法正确的是( )
A.溶解过程中H3PO4可抑制Fe2+的水解
B.可用酸性KMnO4溶液检验反应1中Fe2+是否完全反应
C.洗涤沉淀时可用玻璃棒搅拌
D.反应2中氧化剂与还原剂的物质的量之比为1∶2
A
解析 Fe2+能发生水解:Fe2++2H2O Fe(OH)2+2H+,加入磷酸溶解过程中可以抑制Fe2+水解,A正确;反应1中NaClO作氧化剂,将Fe2+氧化成Fe3+,本身被还原成NaCl,酸性高锰酸钾溶液能氧化Cl-而褪色,故不能用酸性高锰酸钾溶液检验反应1中Fe2+是否完全反应,B错误;洗涤沉淀时,不能用玻璃棒搅拌,防止弄破滤纸,C错误;草酸为还原剂,FePO4为氧化剂,根据得失电子守恒可得,FePO4与草酸的物质的量之比为2∶1,D错误。
11.(2023·辽宁鞍山一模)室温下,下列实验探究方案及现象能达到探究目的的是( )
选项 探究方案及现象 探究目的
A 用pH计测量醋酸、盐酸的pH,比较溶液pH大小 醋酸是弱电解质
B 向久置的Na2SO3溶液中加入足量BaCl2溶液,出现白色沉淀;再加入足量稀盐酸,部分沉淀溶解 Na2SO3不能被空气氧化
C 向NaBr溶液中滴加过量氯水,溶液变橙色,再加入淀粉KI溶液,溶液变蓝色 氧化性: Cl2>Br2>I2
D 向盛有FeSO4溶液的试管中滴加几滴KSCN溶液,无明显现象,振荡,再滴加几滴新制氯水,溶液变红 Fe2+具有还原性
D
解析 未指明醋酸和盐酸的浓度,只比较pH大小,无法判断醋酸是强电解质还是弱电解质,A错误;加入足量盐酸后部分沉淀溶解,则说明沉淀中有BaSO4,同时也说明Na2SO3能被空气中的O2氧化为Na2SO4,B错误;氯水过量,溶液变为蓝色,有可能是过量氯水将KI氧化成了碘单质,无法比较出溴单质和碘单质的氧化性强弱,C错误;KSCN溶液可用于检验Fe3+,滴加氯水后,溶液变红,则说明Fe2+被氧化成Fe3+,可以证明Fe2+具有还原性,D正确。
12.(2023·山东淄博一模)利用下图装置制备ClO2,并以ClO2为原料制备NaClO2。已知:高于60 ℃时,NaClO2分解生成NaClO3和NaCl。下列说法错误的是( )
A.Na2SO3和H2O2均作还原剂
B.装置②④的作用分别是防倒吸、吸收未反应的污染气体
C.从装置③反应后的溶液中获得晶体,可采用常压蒸发结晶
D.反应结束时,通氮气的目的是将仪器中残留的气体排入④中
C
解析 ①中发生反应2NaClO3+Na2SO3+H2SO4 2ClO2↑+2Na2SO4+H2O,S的化合价升高,Na2SO3为还原剂;2ClO2+2NaOH+H2O2 ══ 2NaClO2+2H2O+O2中O元素化合价也升高,H2O2为还原剂,A正确。装置②④的作用分别是防倒吸、吸收生成的ClO2,B正确。由于温度高于60 ℃时,NaClO2会发生分解,所以可采取冷却结晶的方法获得晶体,C错误。反应结束时,通氮气的目的是将仪器中残留的气体排入④中,排除污染气体,保证实验结束安全,D正确。
13.(2023·安徽宿州一模)纳米氧化锌是一种多功能的新型无机材料,化工上可以利用废弃的锌镍电池废料(主要含Zn、Ni和少量的Fe、Al)制备纳米氧化锌,其生产流程如图所示:
已知:Ksp[Zn(OH)2]=1.6×10-16;Ksp[Ni(OH)2]=2.8×10-15;Ksp[Fe(OH)3]=2.7×10-39;
Ksp[Al(OH)3]=4.6×10-33。回答下列问题:
(1)为检验“氧化”操作后的溶液中是否含有Fe2+,某同学取适量待检溶液,滴加酸性高锰酸钾溶液,该方法是否合理: (填“是”或“否”),理由是 (用离子方程式表示)。
(2)“沉铁铝”操作中加热不仅能够加快反应速率,另外一个主要目的是 。
取“沉铁铝”操作所得的沉淀物置于1.0 L水中室温下充分溶解,其中沉淀物中若含有5.6 g Fe(OH)3,则最终所得溶液中c(Fe3+)= mol·L-1。
否
防止生成胶体,便于沉淀分离
1×10-10
(3)假定萃取达到平衡时,样品在水和萃取剂中的总浓度比为1∶80,若在50 mL的水溶液样品中用10 mL萃取剂萃取,则萃取后溶液中残留的样品浓度与原溶液中样品浓度的比值为 。
(4)化工生产中,分离Zn2+用萃取法而不通过调节溶液pH形成沉淀的方法,原因是 。
(5)“沉锌”过程中若NH4HCO3用量过大,易生成碱式碳酸锌[2Zn(OH)2·ZnCO3·2H2O]沉淀,该反应的离子方程式为
。
1∶17
Zn(OH)2与Ni(OH)2的Ksp接近,难以通过调节pH分离Ni2+、Zn2+
3Zn2++6 +H2O ══ 2Zn(OH)2·ZnCO3·2H2O↓+5CO2↑
解析 (2)“沉铁铝”操作中加热不仅能够加快反应速率,另外一个主要目的是防止生成胶体,便于沉淀分离;取“沉铁铝”操作所得的沉淀物置于1.0 L水中在室温下充分溶解,其中沉淀物中若含有5.6 g Fe(OH)3,最终所得溶液是Fe(OH)3的饱和溶液,c(Fe3+)·c3(OH-)=Ksp[Fe(OH)3]=2.7×10-39,
(3)假定萃取达到平衡时,样品在水和萃取剂中的总浓度比为1∶80,设50 mL的水溶液中样品的浓度为c,用10 mL萃取剂萃取,萃取后水溶液中残留
同课章节目录
