课题3 二氧化碳和一氧化碳(第二课时)(36张ppt)
文档属性
| 名称 | 课题3 二氧化碳和一氧化碳(第二课时)(36张ppt) |  | |
| 格式 | zip | ||
| 文件大小 | 1.2MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2015-04-07 19:38:04 | ||
图片预览









文档简介
课件36张PPT。人教版《化学》九年级上册
第六单元
课题3 二氧化碳和一氧化碳
第二课时创作者:张国良
欢迎一切抄袭!
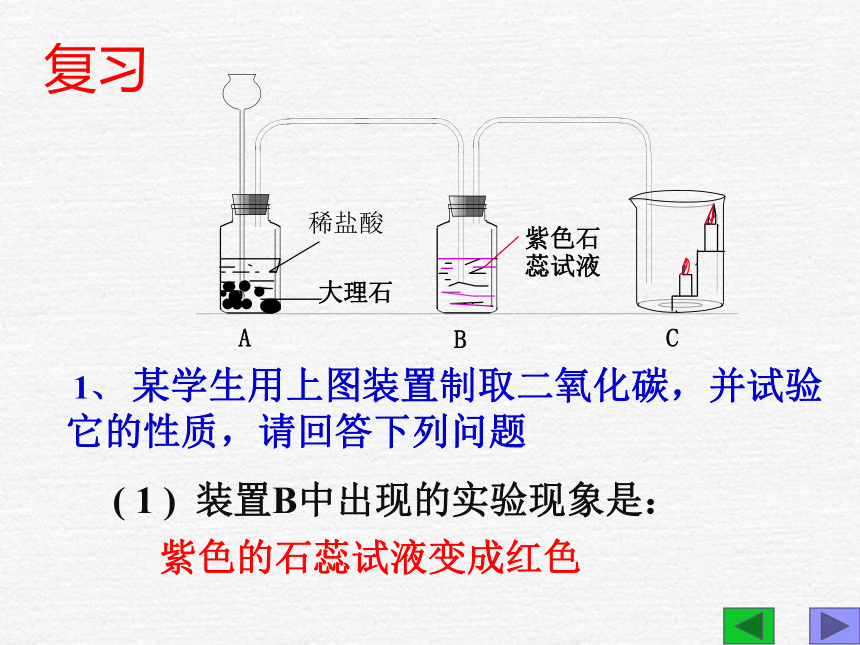
感谢CCTV、MTV等一切TV!1、复习CO2的性质2、学习CO的性质物理性质化学性质用途本节课学习目标: 1、 某学生用上图装置制取二氧化碳,并试验它的性质,请回答下列问题 ( 1 ) 装置B中出现的实验现象是:紫色的石蕊试液变成红色复习(2) 烧杯C中放有高低不同的燃着的蜡烛,
实验中观察到的现象是_____的蜡烛先熄灭,
说明二氧化碳具有________________和
__________________________的性质。
低处比空气的密度大不燃烧也不支持燃烧的性质跳过1、地球大气中CO2的含量不断增加的后果主要是( )
A、 破坏臭氧层 B、 温室效应加剧
C、 产生酸雨 D、 毒害农作物
2、检验久未开启的菜窖内CO2浓度是否太大的正确方法
是( )
A、带入一个盛满澄清石灰水的试管
B、带入一杯水
C、带入一个接通电源的手电筒
D、带入一个点燃的油灯或木柴
BD跳过 3、由于大气中CO2含量的增大,“使温室效应加剧”,使地球变热,海平面升高,为了减少CO2含量的增加,下列措施可行的是( )
A、用石灰水吸收空气中的CO2
B、开展植树造林,增加地球表面绿化面积
C、发展太阳能、核能、水能等以代替矿物燃料
D、限制汽车工业发展,减少汽车数量。B、C 跳过 4、 农业科技人员向农民建议:在利用温室生产时,可向温室中通入适量的二氧化碳。这是因为( )
A、CO2可使害虫窒息死亡,从而防止病虫害
B、CO2可产生温室效应,从而提高室温
C、CO2能灭火,施用后可防止火灾
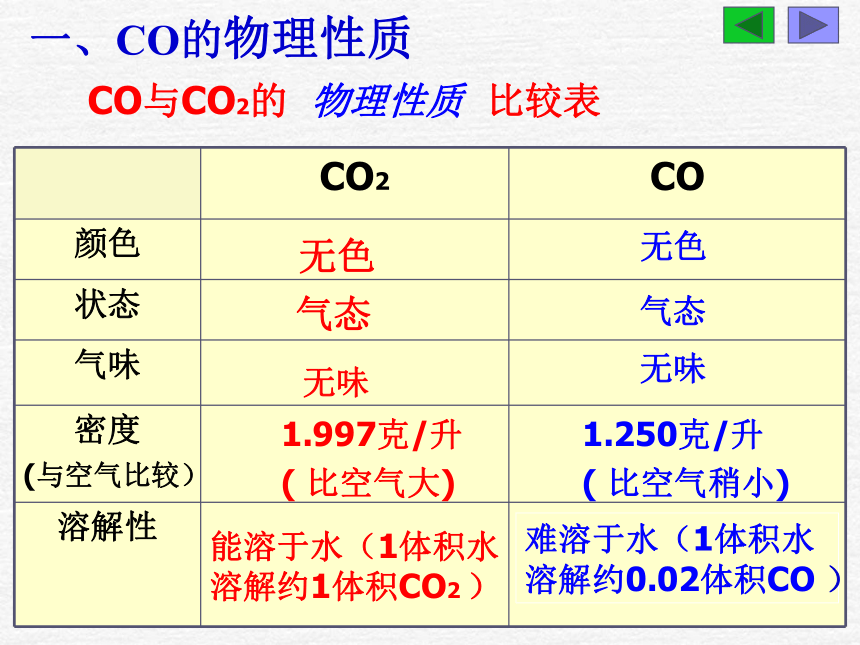
D、施用CO2,可促进植物的光合作用D跳过 一氧化碳物理性质化学性质课堂练习一、CO的物理性质无色无色气态气态无味无味1.997克/升
( 比空气大)能溶于水(1体积水溶解约1体积CO2 )1.250克/升
( 比空气稍小)难溶于水(1体积水 溶解约0.02体积CO )CO与CO2的 物理性质 比较表1、现有下列四种气体:氧气、氢气、二氧化碳、
一氧化碳。试回答:
(1)只能用排水法收集的是________
(2)只能用向上排空气法收集的是_______
(3)既可用向上排空气法又可用排水法收
集的是_______
(4)即可用向下排空气法又可用排水法收
集的是_______一氧化碳二氧化碳氧气氢气返回课堂练习一二、CO的化学性质二、一氧化碳的化学性质(可燃性、毒性、还原性) 1、一氧化碳的可燃性CO可燃性试验二、一氧化碳的化学性质(可燃性、毒性、还原性)一氧化碳在空气里燃烧,发出蓝色的火焰,并生成能使澄清的石灰水变浑浊的气体。一氧化碳在空气里能够燃烧生成二氧化碳。 1、一氧化碳的可燃性注意:一氧化碳点燃前必须验纯,因为CO是可燃性气体,混有O2时,点燃可能发生爆炸。二、一氧化碳的化学性质(可燃性、毒性、还原性) 1、一氧化碳的可燃性煤炉中的化学变化二、一氧化碳的化学性质(可燃性、毒性、还原性)燃烧的煤炉中:下:氧气不足:水洒在煤炉上:2、一氧化碳的毒性向试管中的血液通入CO气体,不久血液的颜色发生改变。CO毒性试验想一想
CO为什么会使人中毒呢?
中毒的生理过程如何?二、一氧化碳的化学性质(可燃性、毒性、还原性)机理:CO极易与血液中的血红蛋白结合,从而使血红蛋白不能很好地与氧气结合,造成生物体内缺氧,严重时会危及生命。一氧化碳中毒处理处理方法:轻微中毒者,应立即撤离中毒环境,呼吸大量新鲜空气或吸氧;病情严重者,进行人工呼吸或医院急救。在家用煤气(含有CO)中掺入微量具有难闻气味的气体,可方便煤气泄漏时能够及时发觉。2、一氧化碳的毒性思考:1、有人用炉火取暖,为防止煤气中毒,在火炉上放一盆水,这样做行吗?
答:不行,因为一氧化碳难溶于水。2、有人说他身强力壮,不会煤气中毒,等到一闻到煤气味就把火炉搬出去,这样做行吗?答:不行。因为一氧化碳没有气味。分析讨论:当发现煤气泄漏时,应怎样做?如果发生煤气泄露,首先应立即关闭煤气总阀门;迅速打开门窗;同时到室外空气新鲜的地方打电话给煤气公司。如果情况严重,要及时报警。注意:发生煤气泄露时,绝对禁止一切能引起火花的行为:不能开灯,不能打开抽油烟机和排风扇,不能点火,不能在室内拨打电话等。 一氧化碳是煤气的主要成分,俗称煤气。一氧化碳有毒。讨论1、CO有剧毒,那么冬天房间里用煤或木炭取暖时应该怎样做,才能防止发生煤气中毒事件?通风排气现象:黑色的粉末变成红色,澄清的石灰水变浑浊。 CO + CuO == Cu + CO2实验步骤:
1、通:加热前,先通CO排出玻璃管内的空气
2、点:点燃酒精灯加热
3、撤:反应结束,撤走加热CuO的酒精灯
4、通:继续通CO至试管冷却CO有剧毒,为防止污染空气,应先点燃处理未反应的尾气。该酒精灯应最先点且最慢熄。3、CO具有还原性 未反应完的尾气中的CO,最简单的处理方法是用酒精灯点燃处理,避免散逸到大气中,而污染环境。也可循环利用作燃料,也可以系一个气球,把CO收集起来。 优点:①节约能源②保护环境 实验结束时,先熄灭酒精灯,后停止通入CO气体?为什么? 这是因为 : 如果先停止通入氢气,灼热的铜就会和进入玻璃管中的氧气反应,重新生成黑色的氧化铜。思考一氧化碳也能还原氧化铁3CO + Fe2O3 === 2Fe + 3CO2高温(这是高炉炼铁的主要原理)以上两反应中,一氧化碳都是还原剂,具有还原性。实验步骤中的“先”与“后”及注意:(炼铁原理)⑶结束时,先停止加热后停止通入CO。⑴通CO前先验纯;后通入。⑵反应时的先后顺序是先通入CO后用酒精灯加热。 ⑷ 尾气的处理方法点燃或使用气球收集,以防尾气中的CO污染空气。实验现象:黑色固体变成红色,石灰水变浑浊,尾部有蓝色火焰。若将装置中的氧化铜换成氧化铁,
反应方程式是:实验现象:红色固体变成黑色,石灰水变浑浊,尾部有蓝色火焰。CO还原性总结三、一氧化碳的用途:① 作燃料
一氧化碳燃烧时会放出大量的热,它是许多气体燃料的主要成分。
② 冶炼金属
一氧化碳具有还原性质,可用于还原CuO、ZnO、Fe2O3、 Fe3O4等金属氧化物。四、一氧化碳的污染:空气中CO一半以上来自汽车排放的废气,其余主要来自煤等燃料的燃烧和石油炼制等。1、用于干冰人工降雨和食品保藏等2、灭火“温室效应”1、作气体燃料(煤气主要成分)2、作还原剂(冶炼金属) CO2和CO在生活中的作用的比较泄漏后造成空气污染、煤气中毒。物质都有两面性,学习化学,认识物质,可以让我们合理使用各种物质,趋利避害!3、作气体肥料4、作化工原料CO2和CO化学性质的比较不能燃烧 不具氧化性没有毒不具还原性有毒CO2+H2O=H2CO3不与水反应CO2+Ca(OH)2=CaCO3↓+H2O不与石灰水反应(1)怎样除去CO中的CO2(2)怎样除去CO2 中的CO三、思考题(孩儿们这里非常重要)利用CO2和CO化学性质的不同:
⑴除CO2中CO的方法是?
⑵除CO中的CO2的方法是?
⑶区别CO2和CO的方法有哪些?1、分别通入澄清的石灰水观察石灰水是否变浑浊。 2、分别通入紫色石蕊试液观察溶液是否变红。 3、分别通入灼热的氧化铜观察是否有红色的铜生成。 1、复习了CO2的性质2、学习了CO的性质(1)物理性质(2)化学性质3、CO的用途:1、CO具有 可燃性 2、CO具有 毒性 3、CO具有 还原性无色、无味、气态、密度比空气小、难溶于水1、可以用于冶金工业2、可作燃料返回本节课的学习收获:课堂练习二2、氢气和一氧化碳有相似的物理性质,它们都是
______颜色,_____气味的气体,_____溶于水。相
似的化学性质是都有_______性和_______性。工业
上常用它们冶炼金属,主要是利用它们的______性,
还常用作气体燃料,是利用它们的______性。 没有没有难可燃还原可燃还原1、在使用燃气热水器时,若通风不畅,易使人中
毒,造成中毒的气体是( )
A、氧气 B、氮气 C、二氧化碳 D、一氧化碳D跳过4、宣传科学知识,揭露伪科学是化学工作者的义务。下列各项中,属于为科学的是( )
A、用液态氢作燃料发射火箭
B、用干冰进行人工降雨
C、用催化剂把水变成汽油
D、CO气体可用来冶炼金属3、将一束红亮的铜丝放在酒精灯上燃烧一会儿,然后趁热迅速插入充满CO气体的集气瓶内,整个过程中看到铜丝的颜色变化情况是:红色 _____色 _____色。黑红A D跳过5、将两支用于医学研究的小白鼠分别放入A、B两个瓶中,A瓶内装有CO和O2的混合气体,B瓶装有CO2气体,拧紧瓶盖,结果两支小白鼠很快都死了,造成小白鼠死亡的主要原因是:
A瓶------------------------------
B瓶--------------------------------CO 的毒性使小白鼠死亡CO2不能供给呼吸导致小白鼠窒息死亡6、区别CO和CO2的方法很多,下列方法不能用来区别CO和CO2的是 ( )
A、分别通入紫色的石蕊试液中
B、分别通过灼热的氧化铜
C、分别通入澄清的石灰水中
D、用鼻子闻气体的味道D7、如图,⑴将一支盛有CO2的试管倒立在一个装满水的烧杯中看到 ;
原因是 。
⑵如果将水换成石蕊试液,可以看到 ;
原因是 。
⑶如果将水换成澄清的石灰水可以看到 ;
原因是 。 试管内液面升高二氧化碳溶于水后,试管内气压降低。试管内液面升高,且进入试管内的液体变红。CO2溶于水后,试管内气压降低,CO2与水反应生成的碳酸使石蕊变红。试管内液面升高,且进入试管内的液体变浑浊。试管内气压降低,CO2与石灰水反应生成了白色沉淀CaCO3。
第六单元
课题3 二氧化碳和一氧化碳
第二课时创作者:张国良
欢迎一切抄袭!
感谢CCTV、MTV等一切TV!1、复习CO2的性质2、学习CO的性质物理性质化学性质用途本节课学习目标: 1、 某学生用上图装置制取二氧化碳,并试验它的性质,请回答下列问题 ( 1 ) 装置B中出现的实验现象是:紫色的石蕊试液变成红色复习(2) 烧杯C中放有高低不同的燃着的蜡烛,
实验中观察到的现象是_____的蜡烛先熄灭,
说明二氧化碳具有________________和
__________________________的性质。
低处比空气的密度大不燃烧也不支持燃烧的性质跳过1、地球大气中CO2的含量不断增加的后果主要是( )
A、 破坏臭氧层 B、 温室效应加剧
C、 产生酸雨 D、 毒害农作物
2、检验久未开启的菜窖内CO2浓度是否太大的正确方法
是( )
A、带入一个盛满澄清石灰水的试管
B、带入一杯水
C、带入一个接通电源的手电筒
D、带入一个点燃的油灯或木柴
BD跳过 3、由于大气中CO2含量的增大,“使温室效应加剧”,使地球变热,海平面升高,为了减少CO2含量的增加,下列措施可行的是( )
A、用石灰水吸收空气中的CO2
B、开展植树造林,增加地球表面绿化面积
C、发展太阳能、核能、水能等以代替矿物燃料
D、限制汽车工业发展,减少汽车数量。B、C 跳过 4、 农业科技人员向农民建议:在利用温室生产时,可向温室中通入适量的二氧化碳。这是因为( )
A、CO2可使害虫窒息死亡,从而防止病虫害
B、CO2可产生温室效应,从而提高室温
C、CO2能灭火,施用后可防止火灾
D、施用CO2,可促进植物的光合作用D跳过 一氧化碳物理性质化学性质课堂练习一、CO的物理性质无色无色气态气态无味无味1.997克/升
( 比空气大)能溶于水(1体积水溶解约1体积CO2 )1.250克/升
( 比空气稍小)难溶于水(1体积水 溶解约0.02体积CO )CO与CO2的 物理性质 比较表1、现有下列四种气体:氧气、氢气、二氧化碳、
一氧化碳。试回答:
(1)只能用排水法收集的是________
(2)只能用向上排空气法收集的是_______
(3)既可用向上排空气法又可用排水法收
集的是_______
(4)即可用向下排空气法又可用排水法收
集的是_______一氧化碳二氧化碳氧气氢气返回课堂练习一二、CO的化学性质二、一氧化碳的化学性质(可燃性、毒性、还原性) 1、一氧化碳的可燃性CO可燃性试验二、一氧化碳的化学性质(可燃性、毒性、还原性)一氧化碳在空气里燃烧,发出蓝色的火焰,并生成能使澄清的石灰水变浑浊的气体。一氧化碳在空气里能够燃烧生成二氧化碳。 1、一氧化碳的可燃性注意:一氧化碳点燃前必须验纯,因为CO是可燃性气体,混有O2时,点燃可能发生爆炸。二、一氧化碳的化学性质(可燃性、毒性、还原性) 1、一氧化碳的可燃性煤炉中的化学变化二、一氧化碳的化学性质(可燃性、毒性、还原性)燃烧的煤炉中:下:氧气不足:水洒在煤炉上:2、一氧化碳的毒性向试管中的血液通入CO气体,不久血液的颜色发生改变。CO毒性试验想一想
CO为什么会使人中毒呢?
中毒的生理过程如何?二、一氧化碳的化学性质(可燃性、毒性、还原性)机理:CO极易与血液中的血红蛋白结合,从而使血红蛋白不能很好地与氧气结合,造成生物体内缺氧,严重时会危及生命。一氧化碳中毒处理处理方法:轻微中毒者,应立即撤离中毒环境,呼吸大量新鲜空气或吸氧;病情严重者,进行人工呼吸或医院急救。在家用煤气(含有CO)中掺入微量具有难闻气味的气体,可方便煤气泄漏时能够及时发觉。2、一氧化碳的毒性思考:1、有人用炉火取暖,为防止煤气中毒,在火炉上放一盆水,这样做行吗?
答:不行,因为一氧化碳难溶于水。2、有人说他身强力壮,不会煤气中毒,等到一闻到煤气味就把火炉搬出去,这样做行吗?答:不行。因为一氧化碳没有气味。分析讨论:当发现煤气泄漏时,应怎样做?如果发生煤气泄露,首先应立即关闭煤气总阀门;迅速打开门窗;同时到室外空气新鲜的地方打电话给煤气公司。如果情况严重,要及时报警。注意:发生煤气泄露时,绝对禁止一切能引起火花的行为:不能开灯,不能打开抽油烟机和排风扇,不能点火,不能在室内拨打电话等。 一氧化碳是煤气的主要成分,俗称煤气。一氧化碳有毒。讨论1、CO有剧毒,那么冬天房间里用煤或木炭取暖时应该怎样做,才能防止发生煤气中毒事件?通风排气现象:黑色的粉末变成红色,澄清的石灰水变浑浊。 CO + CuO == Cu + CO2实验步骤:
1、通:加热前,先通CO排出玻璃管内的空气
2、点:点燃酒精灯加热
3、撤:反应结束,撤走加热CuO的酒精灯
4、通:继续通CO至试管冷却CO有剧毒,为防止污染空气,应先点燃处理未反应的尾气。该酒精灯应最先点且最慢熄。3、CO具有还原性 未反应完的尾气中的CO,最简单的处理方法是用酒精灯点燃处理,避免散逸到大气中,而污染环境。也可循环利用作燃料,也可以系一个气球,把CO收集起来。 优点:①节约能源②保护环境 实验结束时,先熄灭酒精灯,后停止通入CO气体?为什么? 这是因为 : 如果先停止通入氢气,灼热的铜就会和进入玻璃管中的氧气反应,重新生成黑色的氧化铜。思考一氧化碳也能还原氧化铁3CO + Fe2O3 === 2Fe + 3CO2高温(这是高炉炼铁的主要原理)以上两反应中,一氧化碳都是还原剂,具有还原性。实验步骤中的“先”与“后”及注意:(炼铁原理)⑶结束时,先停止加热后停止通入CO。⑴通CO前先验纯;后通入。⑵反应时的先后顺序是先通入CO后用酒精灯加热。 ⑷ 尾气的处理方法点燃或使用气球收集,以防尾气中的CO污染空气。实验现象:黑色固体变成红色,石灰水变浑浊,尾部有蓝色火焰。若将装置中的氧化铜换成氧化铁,
反应方程式是:实验现象:红色固体变成黑色,石灰水变浑浊,尾部有蓝色火焰。CO还原性总结三、一氧化碳的用途:① 作燃料
一氧化碳燃烧时会放出大量的热,它是许多气体燃料的主要成分。
② 冶炼金属
一氧化碳具有还原性质,可用于还原CuO、ZnO、Fe2O3、 Fe3O4等金属氧化物。四、一氧化碳的污染:空气中CO一半以上来自汽车排放的废气,其余主要来自煤等燃料的燃烧和石油炼制等。1、用于干冰人工降雨和食品保藏等2、灭火“温室效应”1、作气体燃料(煤气主要成分)2、作还原剂(冶炼金属) CO2和CO在生活中的作用的比较泄漏后造成空气污染、煤气中毒。物质都有两面性,学习化学,认识物质,可以让我们合理使用各种物质,趋利避害!3、作气体肥料4、作化工原料CO2和CO化学性质的比较不能燃烧 不具氧化性没有毒不具还原性有毒CO2+H2O=H2CO3不与水反应CO2+Ca(OH)2=CaCO3↓+H2O不与石灰水反应(1)怎样除去CO中的CO2(2)怎样除去CO2 中的CO三、思考题(孩儿们这里非常重要)利用CO2和CO化学性质的不同:
⑴除CO2中CO的方法是?
⑵除CO中的CO2的方法是?
⑶区别CO2和CO的方法有哪些?1、分别通入澄清的石灰水观察石灰水是否变浑浊。 2、分别通入紫色石蕊试液观察溶液是否变红。 3、分别通入灼热的氧化铜观察是否有红色的铜生成。 1、复习了CO2的性质2、学习了CO的性质(1)物理性质(2)化学性质3、CO的用途:1、CO具有 可燃性 2、CO具有 毒性 3、CO具有 还原性无色、无味、气态、密度比空气小、难溶于水1、可以用于冶金工业2、可作燃料返回本节课的学习收获:课堂练习二2、氢气和一氧化碳有相似的物理性质,它们都是
______颜色,_____气味的气体,_____溶于水。相
似的化学性质是都有_______性和_______性。工业
上常用它们冶炼金属,主要是利用它们的______性,
还常用作气体燃料,是利用它们的______性。 没有没有难可燃还原可燃还原1、在使用燃气热水器时,若通风不畅,易使人中
毒,造成中毒的气体是( )
A、氧气 B、氮气 C、二氧化碳 D、一氧化碳D跳过4、宣传科学知识,揭露伪科学是化学工作者的义务。下列各项中,属于为科学的是( )
A、用液态氢作燃料发射火箭
B、用干冰进行人工降雨
C、用催化剂把水变成汽油
D、CO气体可用来冶炼金属3、将一束红亮的铜丝放在酒精灯上燃烧一会儿,然后趁热迅速插入充满CO气体的集气瓶内,整个过程中看到铜丝的颜色变化情况是:红色 _____色 _____色。黑红A D跳过5、将两支用于医学研究的小白鼠分别放入A、B两个瓶中,A瓶内装有CO和O2的混合气体,B瓶装有CO2气体,拧紧瓶盖,结果两支小白鼠很快都死了,造成小白鼠死亡的主要原因是:
A瓶------------------------------
B瓶--------------------------------CO 的毒性使小白鼠死亡CO2不能供给呼吸导致小白鼠窒息死亡6、区别CO和CO2的方法很多,下列方法不能用来区别CO和CO2的是 ( )
A、分别通入紫色的石蕊试液中
B、分别通过灼热的氧化铜
C、分别通入澄清的石灰水中
D、用鼻子闻气体的味道D7、如图,⑴将一支盛有CO2的试管倒立在一个装满水的烧杯中看到 ;
原因是 。
⑵如果将水换成石蕊试液,可以看到 ;
原因是 。
⑶如果将水换成澄清的石灰水可以看到 ;
原因是 。 试管内液面升高二氧化碳溶于水后,试管内气压降低。试管内液面升高,且进入试管内的液体变红。CO2溶于水后,试管内气压降低,CO2与水反应生成的碳酸使石蕊变红。试管内液面升高,且进入试管内的液体变浑浊。试管内气压降低,CO2与石灰水反应生成了白色沉淀CaCO3。
同课章节目录
- 绪言 化学使世界变得更加绚丽多彩
- 第一单元 走进化学世界
- 课题1 物质的变化和性质
- 课题2 化学是一门以实验为基础的科学
- 课题3 走进化学实验室
- 第二单元 我们周围的空气
- 课题1 空气
- 课题2 氧气
- 课题3 制取氧气
- 实验活动1 氧气的实验室制取与性质
- 第三单元 物质构成的奥秘
- 课题1 分子和原子
- 课题2 原子的结构
- 课题3 元素
- 第四单元 自然界的水
- 课题1 爱护水资源
- 课题2 水的净化
- 课题3 水的组成
- 课题4 化学式与化合价
- 第五单元 化学方程式
- 课题 1 质量守恒定律
- 课题 2 如何正确书写化学方程式
- 课题 3 利用化学方程式的简单计算
- 第六单元 碳和碳的氧化物
- 课题1 金刚石、石墨和C60
- 课题2 二氧化碳制取的研究
- 课题3 二氧化碳和一氧化碳
- 实验活动2 二氧化碳的实验室制取与性质
- 第七单元 燃料及其利用
- 课题 1 燃烧和灭火
- 课题2 燃料的合理利用与开发
- 实验活动 3 燃烧的条件
