2.4 化学反应条件的优化——工业合成氨 课件(共31张PPT)2023-2024学年高二化学鲁科版选择性必修1
文档属性
| 名称 | 2.4 化学反应条件的优化——工业合成氨 课件(共31张PPT)2023-2024学年高二化学鲁科版选择性必修1 |

|
|
| 格式 | pptx | ||
| 文件大小 | 2.4MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-11-20 10:23:02 | ||
图片预览











文档简介
(共31张PPT)
第2章 化学反应的方向、限度与速率
第4节 化学反应条件的优化——工业合成氨
素 养 目 标
1.能从反应限度和反应速率角度讨论化学反应和化工生产条件的选择和优化,运用温度、浓度、压强、催化剂对化学反应速率和平衡的影响规律解释实际问题,随之形成科学态度与社会责任的学科核心素养。
2.使学生形成多角度综合调控化学反应的思路,发展学生绿色化学的观念,体验科学态度与社会责任的学科核心素养。
基础落实 必备知识全过关
重难探究 能力素养全提升
目录索引
基础落实 必备知识全过关
必备知识
一、合成氨反应的限度
1.合成氨反应的特点
合成氨反应是一个可逆反应,化学方程式为N2(g)+3H2(g) 2NH3(g)。在298 K时ΔH=-92.2 kJ·mol-1,ΔS=-198.2 J·K-1·mol-1,该反应是一个放热反应,同时又是一个熵减小的反应。
2.合成氨的自发性
在298 K时,合成氨是自发进行的反应。
3.合成氨反应的限度
降低温度、增大压强将有利于合成氨反应的化学平衡向生成氨气的方向移动,在一定温度和压强下,从化学平衡的角度分析,反应物氮气与氢气的体积比为1∶3时平衡混合物中氨的含量最高。
【微思考】已知298 K时,N2(g)+3H2(g) 2NH3(g)
ΔH=-92.2 kJ·mol-1,ΔS=-198.2 J·K-1·mol-1,请通过计算说明298 K时合成氨反应能否自发进行
提示 ΔH-TΔS=-92.2×103 J·mol-1-298 K×(-198.2 J·K-1·mol-1)=-92.2×103 J·mol-1+59 063.6 J·mol-1=-33 136.4 J·mol-1<0,即298 K时合成氨反应能自发进行。
二、合成氨反应的速率
1.浓度对合成氨反应速率的影响
由v=kc(N2)c1.5(H2)c-1(NH3)知,合成氨反应的速率与氮气浓度的1次方成正比,与氢气浓度的1.5次方成正比,与氨气浓度的1次方成反比。在反应过程中,随着氨气浓度的增加反应速率会逐渐降低,因此为了保证足够高的反应速率,应该适时将氨从混合物中分离出来。
2.催化剂对反应速率的影响
加入适宜的催化剂可以改变反应的历程,降低反应的活化能,从而增大反应速率。在其他条件相同的情况下,使用催化剂可使合成氨反应的速率提高上万亿倍。
3.温度
温度越高,合成氨反应进行得越快。
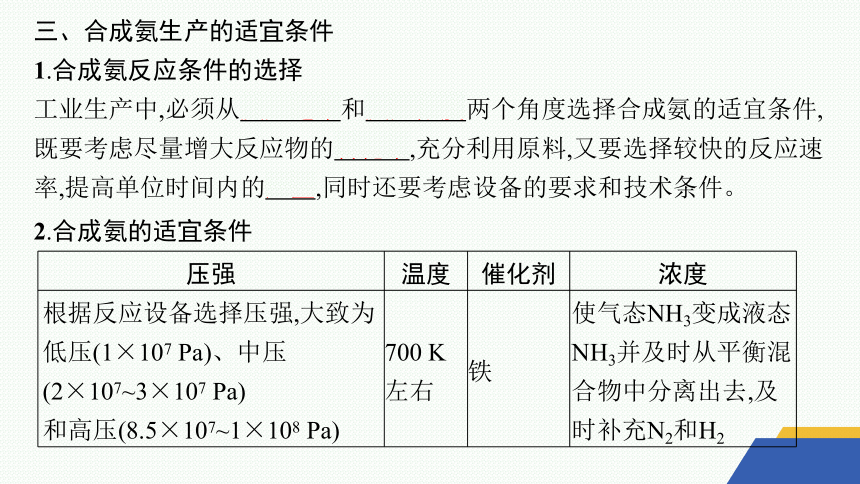
三、合成氨生产的适宜条件
1.合成氨反应条件的选择
工业生产中,必须从反应速率和反应限度两个角度选择合成氨的适宜条件,既要考虑尽量增大反应物的转化率,充分利用原料,又要选择较快的反应速率,提高单位时间内的产量,同时还要考虑设备的要求和技术条件。
2.合成氨的适宜条件
压强 温度 催化剂 浓度
根据反应设备选择压强,大致为低压(1×107 Pa)、中压(2×107~3×107 Pa) 和高压(8.5×107~1×108 Pa) 700 K 左右 铁 使气态NH3变成液态NH3并及时从平衡混合物中分离出去,及时补充N2和H2
自我检测
判断下列说法是否正确,正确的打“√”,错误的打“×”。
(1)使用铁做催化剂,可提高合成氨反应的速率和平衡转化率。( )
(2)高压比常压条件更有利于合成氨的反应。( )
(3)500 ℃左右比室温更有利于合成氨的反应,提高H2的平衡转化率。( )
(4)合成氨时采用循环操作,可提高原料的利用率。( )
(5)合成氨采用2×107~5×107 Pa,因为该压强下铁触媒的活性最高。( )
(6)合成氨工业采用高压,不仅能提高转化率,还能缩短到达平衡的时间。
( )
√
×
×
√
×
√
重难探究 能力素养全提升
探究 工业生产中选择适宜生产条件的思路
问题探究
利用氮气与氢气直接合成氨的工业生产曾是一个较难的课题。1909年,德国物理化学家哈伯用锇催化剂将氮气与氢气在17.5 MPa~20 MPa和500~600 ℃下直接合成氨,反应器出口仅仅得到6%的氨。假如你是合成氨工厂的厂长,你最关心什么呢
提示 最关心的问题应是如何提高单位时间内的产量以及原料的利用率。
归纳拓展
1.合成氨最佳条件的分析与选择
(1)温度。
升高温度有利于提高反应速率,但不利于提高平衡混合物中氨的含量。且催化剂都有一个适宜的使用温度。合成氨工业上一般采用700 K左右的温度。此温度催化剂活性最强。
(2)压强。
增大压强,有利于提高反应速率,也有利于提高平衡混合物中氨的含量。但压强越大,对设备材料、技术的要求就越高,生产成本也越高,综合考虑,工业上采用的压强一般为1×107~1×108 Pa。
(3)浓度。
理论上n(N2)∶n(H2)=1∶3时,平衡转化率最高,但实验表明当n(N2)∶n(H2)=1∶2.8时更有利于氨的合成。工业上通常采用1∶2.8的比例投料,并且及时地分离出NH3,促使平衡正向移动。
(4)催化剂。
催化剂不影响化学平衡,但能极大地加快反应速率,工业上一般采用铁触媒做合成氨的催化剂。
2.工业生产中选择适宜生产条件的思路
(1)从可逆性、反应前后气态物质系数的变化、焓变三个角度分析化学反应的特点。
(2)根据反应特点具体分析外界条件对反应速率和化学平衡的影响;从反应速率和化学平衡的角度进行综合分析,再充分考虑实际情况,选出适宜的外界条件。
应用体验
视角1 合成氨的反应原理
1.合成氨工业的主要反应为N2+3H2 2NH3 ΔH<0,在密闭容器中进行该反应。下列说法正确的是( )
A.其他条件不变,及时分离出NH3,会降低NH3的产率
B.使用催化剂可使N2的转化率达到100%
C.其他条件不变,增大压强不仅能提高转化率,还能缩短到达平衡的时间
D.其他条件不变,温度越高,氨气的产率越高
C
解析 其他条件不变,及时分离出NH3,平衡正向移动,生成NH3的物质的量增大,可提高NH3的产率,A错误;催化剂不能改变平衡转化率,则N2的转化率一定小于100%,B错误;增大压强,反应速率加快,达到平衡所用的时间缩短,由于合成氨反应为气体体积减小的可逆反应,增大压强平衡正向移动,从而提高反应的转化率,C正确;合成氨反应的正反应为放热反应,升高温度,平衡逆向移动,氨气的产率降低,D错误。
2.合成氨技术的发明使工业化人工固氮成为现实。
(1)下列有关合成氨工业的叙述,不能用平衡移动原理来解释的是
(填字母)。
A.使用铁作为催化剂有利于合成氨的反应
B.高压比常压更有利于合成氨的反应
C.700 K左右比室温更有利于合成氨的反应
D.使反应混合物中的氨液化有利于合成氨的反应
AC
(2)已知工业合成氨的热化学方程式为N2(g)+3H2(g) 2NH3(g)
ΔH=-92.2 kJ·mol-1。
①一定温度下,在容积恒定的密闭容器中,一定量的N2和H2反应达到平衡后,改变某一外界条件,反应速率与时间的关系如图所示,其中t2、t4、t7时刻所对应的实验条件改变分别是t2__________________,t4_______________,
t7___________。
②温度为T ℃时,将2a mol H2和a mol N2放入0.5 L 密闭容器中,充分反应达平衡后测得N2的转化率为50%,此时放出热量46.1 kJ,则该温度下反应的平衡常数为______________。
增大N2或H2的浓度
加入催化剂
降温
4.0 mol-2·L2
解析 (1)使用铁作为催化剂,能同等程度地加快正、逆反应的速率,即正、逆反应速率仍相等,因而平衡不发生移动,只是可以缩短达到平衡所需的时间,不能用平衡移动原理来解释。由于合成氨反应的正反应是一个气态物质系数减小的反应,所以增大压强可以使平衡向着生成氨的方向移动,可以用平衡移动原理解释。合成氨反应是放热反应,低温虽然可以提高氨气的产量,但是反应速率太慢,而温度太高虽能加快反应速率,但却使平衡混合物中氨气的含量降低,因此工业生产一般采用适宜的温度,既能加快反应速率又能适当维持平衡混合物中氨气的含量。700 K左右催化剂的活性最高,因此不能用平衡移动原理来解释。将反应产物氨气液化分离,降低了反应产物的浓度,将使平衡向生成氨的方向移动,有利于氨的生成,可以用平衡移动原理来解释。
(2)①t2时刻正反应速率瞬间加快,逆反应速率未变化,平衡正向移动,应是增大了反应物的浓度;t4时刻反应速率加快,但平衡未发生移动,应是加入了催化剂;t7时刻正、逆反应速率都瞬间减慢后平衡正向移动,应是降低了温度。
②根据“三段式”计算:
N2(g) + 3H2(g) 2NH3(g)
起始物质的量浓度/(mol·L-1) 2a 4a 0
转化物质的量浓度/(mol·L-1) a 3a 2a
平衡物质的量浓度/(mol·L-1) a a 2a
平衡时放出热量为46.1 kJ,则平衡时N2转化了0.5 mol,0.5a mol=0.5 mol,则a=1.0。
规律方法 合成氨条件的优化
视角2 合成氨条件的控制
3.下列关于合成氨工业说法不正确的是( )
A.将原料气进行净化处理,是为了防止其中混有的杂质使催化剂“中毒”
B.合成氨厂一般采用10 MPa~30 MPa的压强,综合考虑了反应速率、转化率和成本等因素
C.将混合气体中的氨液化有利于合成氨反应
D.根据勒·夏特列原理,500 ℃左右比室温更有利于合成氨的反应
D
解析 将原料气进行净化处理,是为了防止其中混有的杂质使催化剂“中毒”, A选项正确;合成氨厂一般采用10 MPa~30 MPa的压强,综合考虑了反应速率、转化率和成本等因素,因为压强大,反应速率快,反应物的转化率升高,有利于合成氨,但是压强太高时对仪器设备要求也高,压强过低时反应速率慢,反应物的转化率降低,不利于合成氨,B选项正确;将混合气体中的氨液化,即减小了生成物的浓度,合成氨反应的化学平衡正向移动,有利于合成氨,C选项正确;合成氨是放热反应,升高温度,合成氨反应的化学平衡逆向移动,因此室温比500 ℃左右更有利于合成氨的反应,D选项错误。
4.对于可逆反应3H2(g)+N2(g) 2NH3(g) ΔH<0,当反应达到平衡后,为了使H2的转化率增大,下列选项中采用的三种方法都正确的是( )
A.升高温度,降低压强,增加氮气
B.降低温度,增大压强,加入催化剂
C.升高温度,增大压强,增加氮气
D.降低温度,增大压强,分离出部分氨
D
解析 合成氨反应是放热反应,从理论上分析应采用尽可能低的温度,合成氨反应前后都是气体物质,反应前气体体积比反应后气体体积更大,所以增大压强会使平衡向着气体体积减小的方向进行,即向正反应方向移动,增加反应物浓度或减小反应产物的浓度,会使平衡向着正反应方向移动,在合成氨反应中分离出部分氨气,会使平衡向着正反应方向移动,加入催化剂可加速反应的进行,但对平衡移动无影响。综合分析可得,D是正确的。
5.合成氨时采用700 K左右的温度进行,主要是因为在该温度时( )
A.合成氨的化学反应速率最大
B.N2的转化率最高
C.催化剂的活性最大
D.NH3在平衡混合气体中的体积分数最大
C
解析 当压强一定、温度升高时,虽然能增大合成氨的反应速率,但由于合成氨反应是放热反应,升高温度会降低平衡混合物中NH3的含量。因此,从反应的理想条件来看,氨的合成反应在较低温度下进行有利,但是温度过低,反应速率很小,需要很长的时间才能达到平衡状态,这在工业生产上是很不经济的。催化剂铁在700 K左右时的活性最大,这是合成氨反应一般选择在700 K左右进行的重要原因之一。
6.有关合成氨工业的下列说法正确的是( )
A.从合成塔出来的混合气体中NH3的含量较小,所以生产氨的工厂的效率都很低
B.由于氨可液化分离出来,N2、H2在实际生产中循环使用,所以总体来说氨的产率较高
C.合成氨工业的反应温度一般控制在700 K左右,目的是使化学平衡向正反应方向移动
D.合成氨厂采用的压强是2×107~3×107 Pa,因在该压强下铁催化剂的活性最大
B
解析 合成氨工业中从合成塔出来的混合气体中NH3的含量较小,但由于分离出NH3后,N2和H2可循环使用,所以总体来说氨的产率是较高的,则A项错误,B项正确;合成氨工业的反应温度控制在700 K左右而不选择常温,是为了加快反应速率,且催化剂在700 K时催化活性最高,C项错误;合成氨的反应为气态物质系数减小的反应,增大压强主要是为了使平衡向正反应方向移动,与催化剂活性无关,D项错误。
视角3 合成氨过程的图像分析
7.工业合成氨的正反应是放热反应,下列关于反应N2(g)+3H2(g) 2NH3(g)的图像中,错误的是( )
C
解析 合成氨反应是放热反应,升高温度,正、逆反应速率都增大,但逆反应速率增大的程度大,A正确;在T1时w(NH3)最大,达到平衡,再升高温度,平衡逆向移动,w(NH3)减小,B正确;低温时达到平衡,w(NH3)大,C错误;增大压强,平衡向右移动,w(NH3)增大,D正确。
8.工业合成氨[N2(g)+3H2(g) 2NH3(g)]反应过程中的能量变化如图所示,根据图示回答下列问题:
(1)该反应通常用活性铁做催化剂,加活性铁会使图中B点 (填“升高”或“降低”),理由是 。
(2)450 ℃时该反应的平衡常数 (填“<”“>”或“=”)500 ℃时的平衡常数。
(3)一定条件下的密闭容器中,该反应达到平衡,要提高H2的转化率,可以采取的合理措施有 (填字母)。
a.高温高压 b.加入催化剂 c.增加N2的浓度
d.增加H2的浓度 e.分离出NH3
降低
催化剂能降低反应的活化能
>
ce
解析(1)催化剂能降低反应的活化能。
(2)该反应正向为放热反应,低温有利于平衡正向移动,450 ℃时反应正向进行的程度大,即450 ℃对应的平衡常数比500 ℃时大。
(3)高温使化学平衡逆向移动,H2转化率降低,a不合理;催化剂对平衡无影响,b不合理;增加N2的浓度可以提高H2的转化率,c合理;增加H2的浓度会降低H2的转化率,d不合理;分离出NH3,有利于平衡右移,提高H2的转化率,e合理。
本 课 结 束
第2章 化学反应的方向、限度与速率
第4节 化学反应条件的优化——工业合成氨
素 养 目 标
1.能从反应限度和反应速率角度讨论化学反应和化工生产条件的选择和优化,运用温度、浓度、压强、催化剂对化学反应速率和平衡的影响规律解释实际问题,随之形成科学态度与社会责任的学科核心素养。
2.使学生形成多角度综合调控化学反应的思路,发展学生绿色化学的观念,体验科学态度与社会责任的学科核心素养。
基础落实 必备知识全过关
重难探究 能力素养全提升
目录索引
基础落实 必备知识全过关
必备知识
一、合成氨反应的限度
1.合成氨反应的特点
合成氨反应是一个可逆反应,化学方程式为N2(g)+3H2(g) 2NH3(g)。在298 K时ΔH=-92.2 kJ·mol-1,ΔS=-198.2 J·K-1·mol-1,该反应是一个放热反应,同时又是一个熵减小的反应。
2.合成氨的自发性
在298 K时,合成氨是自发进行的反应。
3.合成氨反应的限度
降低温度、增大压强将有利于合成氨反应的化学平衡向生成氨气的方向移动,在一定温度和压强下,从化学平衡的角度分析,反应物氮气与氢气的体积比为1∶3时平衡混合物中氨的含量最高。
【微思考】已知298 K时,N2(g)+3H2(g) 2NH3(g)
ΔH=-92.2 kJ·mol-1,ΔS=-198.2 J·K-1·mol-1,请通过计算说明298 K时合成氨反应能否自发进行
提示 ΔH-TΔS=-92.2×103 J·mol-1-298 K×(-198.2 J·K-1·mol-1)=-92.2×103 J·mol-1+59 063.6 J·mol-1=-33 136.4 J·mol-1<0,即298 K时合成氨反应能自发进行。
二、合成氨反应的速率
1.浓度对合成氨反应速率的影响
由v=kc(N2)c1.5(H2)c-1(NH3)知,合成氨反应的速率与氮气浓度的1次方成正比,与氢气浓度的1.5次方成正比,与氨气浓度的1次方成反比。在反应过程中,随着氨气浓度的增加反应速率会逐渐降低,因此为了保证足够高的反应速率,应该适时将氨从混合物中分离出来。
2.催化剂对反应速率的影响
加入适宜的催化剂可以改变反应的历程,降低反应的活化能,从而增大反应速率。在其他条件相同的情况下,使用催化剂可使合成氨反应的速率提高上万亿倍。
3.温度
温度越高,合成氨反应进行得越快。
三、合成氨生产的适宜条件
1.合成氨反应条件的选择
工业生产中,必须从反应速率和反应限度两个角度选择合成氨的适宜条件,既要考虑尽量增大反应物的转化率,充分利用原料,又要选择较快的反应速率,提高单位时间内的产量,同时还要考虑设备的要求和技术条件。
2.合成氨的适宜条件
压强 温度 催化剂 浓度
根据反应设备选择压强,大致为低压(1×107 Pa)、中压(2×107~3×107 Pa) 和高压(8.5×107~1×108 Pa) 700 K 左右 铁 使气态NH3变成液态NH3并及时从平衡混合物中分离出去,及时补充N2和H2
自我检测
判断下列说法是否正确,正确的打“√”,错误的打“×”。
(1)使用铁做催化剂,可提高合成氨反应的速率和平衡转化率。( )
(2)高压比常压条件更有利于合成氨的反应。( )
(3)500 ℃左右比室温更有利于合成氨的反应,提高H2的平衡转化率。( )
(4)合成氨时采用循环操作,可提高原料的利用率。( )
(5)合成氨采用2×107~5×107 Pa,因为该压强下铁触媒的活性最高。( )
(6)合成氨工业采用高压,不仅能提高转化率,还能缩短到达平衡的时间。
( )
√
×
×
√
×
√
重难探究 能力素养全提升
探究 工业生产中选择适宜生产条件的思路
问题探究
利用氮气与氢气直接合成氨的工业生产曾是一个较难的课题。1909年,德国物理化学家哈伯用锇催化剂将氮气与氢气在17.5 MPa~20 MPa和500~600 ℃下直接合成氨,反应器出口仅仅得到6%的氨。假如你是合成氨工厂的厂长,你最关心什么呢
提示 最关心的问题应是如何提高单位时间内的产量以及原料的利用率。
归纳拓展
1.合成氨最佳条件的分析与选择
(1)温度。
升高温度有利于提高反应速率,但不利于提高平衡混合物中氨的含量。且催化剂都有一个适宜的使用温度。合成氨工业上一般采用700 K左右的温度。此温度催化剂活性最强。
(2)压强。
增大压强,有利于提高反应速率,也有利于提高平衡混合物中氨的含量。但压强越大,对设备材料、技术的要求就越高,生产成本也越高,综合考虑,工业上采用的压强一般为1×107~1×108 Pa。
(3)浓度。
理论上n(N2)∶n(H2)=1∶3时,平衡转化率最高,但实验表明当n(N2)∶n(H2)=1∶2.8时更有利于氨的合成。工业上通常采用1∶2.8的比例投料,并且及时地分离出NH3,促使平衡正向移动。
(4)催化剂。
催化剂不影响化学平衡,但能极大地加快反应速率,工业上一般采用铁触媒做合成氨的催化剂。
2.工业生产中选择适宜生产条件的思路
(1)从可逆性、反应前后气态物质系数的变化、焓变三个角度分析化学反应的特点。
(2)根据反应特点具体分析外界条件对反应速率和化学平衡的影响;从反应速率和化学平衡的角度进行综合分析,再充分考虑实际情况,选出适宜的外界条件。
应用体验
视角1 合成氨的反应原理
1.合成氨工业的主要反应为N2+3H2 2NH3 ΔH<0,在密闭容器中进行该反应。下列说法正确的是( )
A.其他条件不变,及时分离出NH3,会降低NH3的产率
B.使用催化剂可使N2的转化率达到100%
C.其他条件不变,增大压强不仅能提高转化率,还能缩短到达平衡的时间
D.其他条件不变,温度越高,氨气的产率越高
C
解析 其他条件不变,及时分离出NH3,平衡正向移动,生成NH3的物质的量增大,可提高NH3的产率,A错误;催化剂不能改变平衡转化率,则N2的转化率一定小于100%,B错误;增大压强,反应速率加快,达到平衡所用的时间缩短,由于合成氨反应为气体体积减小的可逆反应,增大压强平衡正向移动,从而提高反应的转化率,C正确;合成氨反应的正反应为放热反应,升高温度,平衡逆向移动,氨气的产率降低,D错误。
2.合成氨技术的发明使工业化人工固氮成为现实。
(1)下列有关合成氨工业的叙述,不能用平衡移动原理来解释的是
(填字母)。
A.使用铁作为催化剂有利于合成氨的反应
B.高压比常压更有利于合成氨的反应
C.700 K左右比室温更有利于合成氨的反应
D.使反应混合物中的氨液化有利于合成氨的反应
AC
(2)已知工业合成氨的热化学方程式为N2(g)+3H2(g) 2NH3(g)
ΔH=-92.2 kJ·mol-1。
①一定温度下,在容积恒定的密闭容器中,一定量的N2和H2反应达到平衡后,改变某一外界条件,反应速率与时间的关系如图所示,其中t2、t4、t7时刻所对应的实验条件改变分别是t2__________________,t4_______________,
t7___________。
②温度为T ℃时,将2a mol H2和a mol N2放入0.5 L 密闭容器中,充分反应达平衡后测得N2的转化率为50%,此时放出热量46.1 kJ,则该温度下反应的平衡常数为______________。
增大N2或H2的浓度
加入催化剂
降温
4.0 mol-2·L2
解析 (1)使用铁作为催化剂,能同等程度地加快正、逆反应的速率,即正、逆反应速率仍相等,因而平衡不发生移动,只是可以缩短达到平衡所需的时间,不能用平衡移动原理来解释。由于合成氨反应的正反应是一个气态物质系数减小的反应,所以增大压强可以使平衡向着生成氨的方向移动,可以用平衡移动原理解释。合成氨反应是放热反应,低温虽然可以提高氨气的产量,但是反应速率太慢,而温度太高虽能加快反应速率,但却使平衡混合物中氨气的含量降低,因此工业生产一般采用适宜的温度,既能加快反应速率又能适当维持平衡混合物中氨气的含量。700 K左右催化剂的活性最高,因此不能用平衡移动原理来解释。将反应产物氨气液化分离,降低了反应产物的浓度,将使平衡向生成氨的方向移动,有利于氨的生成,可以用平衡移动原理来解释。
(2)①t2时刻正反应速率瞬间加快,逆反应速率未变化,平衡正向移动,应是增大了反应物的浓度;t4时刻反应速率加快,但平衡未发生移动,应是加入了催化剂;t7时刻正、逆反应速率都瞬间减慢后平衡正向移动,应是降低了温度。
②根据“三段式”计算:
N2(g) + 3H2(g) 2NH3(g)
起始物质的量浓度/(mol·L-1) 2a 4a 0
转化物质的量浓度/(mol·L-1) a 3a 2a
平衡物质的量浓度/(mol·L-1) a a 2a
平衡时放出热量为46.1 kJ,则平衡时N2转化了0.5 mol,0.5a mol=0.5 mol,则a=1.0。
规律方法 合成氨条件的优化
视角2 合成氨条件的控制
3.下列关于合成氨工业说法不正确的是( )
A.将原料气进行净化处理,是为了防止其中混有的杂质使催化剂“中毒”
B.合成氨厂一般采用10 MPa~30 MPa的压强,综合考虑了反应速率、转化率和成本等因素
C.将混合气体中的氨液化有利于合成氨反应
D.根据勒·夏特列原理,500 ℃左右比室温更有利于合成氨的反应
D
解析 将原料气进行净化处理,是为了防止其中混有的杂质使催化剂“中毒”, A选项正确;合成氨厂一般采用10 MPa~30 MPa的压强,综合考虑了反应速率、转化率和成本等因素,因为压强大,反应速率快,反应物的转化率升高,有利于合成氨,但是压强太高时对仪器设备要求也高,压强过低时反应速率慢,反应物的转化率降低,不利于合成氨,B选项正确;将混合气体中的氨液化,即减小了生成物的浓度,合成氨反应的化学平衡正向移动,有利于合成氨,C选项正确;合成氨是放热反应,升高温度,合成氨反应的化学平衡逆向移动,因此室温比500 ℃左右更有利于合成氨的反应,D选项错误。
4.对于可逆反应3H2(g)+N2(g) 2NH3(g) ΔH<0,当反应达到平衡后,为了使H2的转化率增大,下列选项中采用的三种方法都正确的是( )
A.升高温度,降低压强,增加氮气
B.降低温度,增大压强,加入催化剂
C.升高温度,增大压强,增加氮气
D.降低温度,增大压强,分离出部分氨
D
解析 合成氨反应是放热反应,从理论上分析应采用尽可能低的温度,合成氨反应前后都是气体物质,反应前气体体积比反应后气体体积更大,所以增大压强会使平衡向着气体体积减小的方向进行,即向正反应方向移动,增加反应物浓度或减小反应产物的浓度,会使平衡向着正反应方向移动,在合成氨反应中分离出部分氨气,会使平衡向着正反应方向移动,加入催化剂可加速反应的进行,但对平衡移动无影响。综合分析可得,D是正确的。
5.合成氨时采用700 K左右的温度进行,主要是因为在该温度时( )
A.合成氨的化学反应速率最大
B.N2的转化率最高
C.催化剂的活性最大
D.NH3在平衡混合气体中的体积分数最大
C
解析 当压强一定、温度升高时,虽然能增大合成氨的反应速率,但由于合成氨反应是放热反应,升高温度会降低平衡混合物中NH3的含量。因此,从反应的理想条件来看,氨的合成反应在较低温度下进行有利,但是温度过低,反应速率很小,需要很长的时间才能达到平衡状态,这在工业生产上是很不经济的。催化剂铁在700 K左右时的活性最大,这是合成氨反应一般选择在700 K左右进行的重要原因之一。
6.有关合成氨工业的下列说法正确的是( )
A.从合成塔出来的混合气体中NH3的含量较小,所以生产氨的工厂的效率都很低
B.由于氨可液化分离出来,N2、H2在实际生产中循环使用,所以总体来说氨的产率较高
C.合成氨工业的反应温度一般控制在700 K左右,目的是使化学平衡向正反应方向移动
D.合成氨厂采用的压强是2×107~3×107 Pa,因在该压强下铁催化剂的活性最大
B
解析 合成氨工业中从合成塔出来的混合气体中NH3的含量较小,但由于分离出NH3后,N2和H2可循环使用,所以总体来说氨的产率是较高的,则A项错误,B项正确;合成氨工业的反应温度控制在700 K左右而不选择常温,是为了加快反应速率,且催化剂在700 K时催化活性最高,C项错误;合成氨的反应为气态物质系数减小的反应,增大压强主要是为了使平衡向正反应方向移动,与催化剂活性无关,D项错误。
视角3 合成氨过程的图像分析
7.工业合成氨的正反应是放热反应,下列关于反应N2(g)+3H2(g) 2NH3(g)的图像中,错误的是( )
C
解析 合成氨反应是放热反应,升高温度,正、逆反应速率都增大,但逆反应速率增大的程度大,A正确;在T1时w(NH3)最大,达到平衡,再升高温度,平衡逆向移动,w(NH3)减小,B正确;低温时达到平衡,w(NH3)大,C错误;增大压强,平衡向右移动,w(NH3)增大,D正确。
8.工业合成氨[N2(g)+3H2(g) 2NH3(g)]反应过程中的能量变化如图所示,根据图示回答下列问题:
(1)该反应通常用活性铁做催化剂,加活性铁会使图中B点 (填“升高”或“降低”),理由是 。
(2)450 ℃时该反应的平衡常数 (填“<”“>”或“=”)500 ℃时的平衡常数。
(3)一定条件下的密闭容器中,该反应达到平衡,要提高H2的转化率,可以采取的合理措施有 (填字母)。
a.高温高压 b.加入催化剂 c.增加N2的浓度
d.增加H2的浓度 e.分离出NH3
降低
催化剂能降低反应的活化能
>
ce
解析(1)催化剂能降低反应的活化能。
(2)该反应正向为放热反应,低温有利于平衡正向移动,450 ℃时反应正向进行的程度大,即450 ℃对应的平衡常数比500 ℃时大。
(3)高温使化学平衡逆向移动,H2转化率降低,a不合理;催化剂对平衡无影响,b不合理;增加N2的浓度可以提高H2的转化率,c合理;增加H2的浓度会降低H2的转化率,d不合理;分离出NH3,有利于平衡右移,提高H2的转化率,e合理。
本 课 结 束
同课章节目录
- 第1章 化学反应与能量转化
- 第1节 化学反应的热效应
- 第2节 化学能转化为电能——电池
- 第3节 电能转化为化学能——电解
- 第4节 金属的腐蚀与防护
- 微项目 设计载人航天器用化学电池与氧气再生方案——化学反应中能量及物质的转化利用
- 第2章 化学反应的方向、 限度与速率
- 第1节 化学反应的方向
- 第2节 化学反应的限度
- 第3节 化学反应的速率
- 第4节 化学反应条件的优化——工业合成氨
- 微项目 探讨如何利用工业废气中的二氧化碳合成甲醇——化学反应选择与反应条件优化
- 第3章 物质在水溶液中的行为
- 第1节 水与水溶液
- 第2节 弱电解质的电离 盐类的水解
- 第3节 沉淀溶解平衡
- 第4节 离子反应
- 微项目 揭秘索尔维制碱法和侯氏制碱法——化学平衡思想的创造性应用
