3.2.2 盐类的水解 课件(共31张PPT)2023-2024学年高二化学鲁科版选择性必修1
文档属性
| 名称 | 3.2.2 盐类的水解 课件(共31张PPT)2023-2024学年高二化学鲁科版选择性必修1 |

|
|
| 格式 | pptx | ||
| 文件大小 | 3.9MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-11-20 10:24:10 | ||
图片预览










文档简介
(共42张PPT)
高中同步学案优化设计
GAO ZHONG TONG BU XUE AN YOU HUA SHE JI
第3章 物质在水溶液中的行为
第2节 第2课时 盐类的水解
素 养 目 标
1.通过实验归纳盐溶液的酸碱性与其类型之间的关系,并进一步探究盐溶液呈现不同酸碱性的原因,总结其规律,培养证据推理与模型认知的化学核心素养。
2.了解影响盐类水解平衡的因素,能多角度、动态地分析外界条件对盐类水解平衡的影响,形成变化观念与平衡思想的化学核心素养。
3.熟练掌握盐类水解的表示方法——水解离子方程式的书写,培养宏观辨识与微观探析的化学核心素养。
基础落实 必备知识全过关
重难探究 能力素养全提升
目录索引
基础落实 必备知识全过关
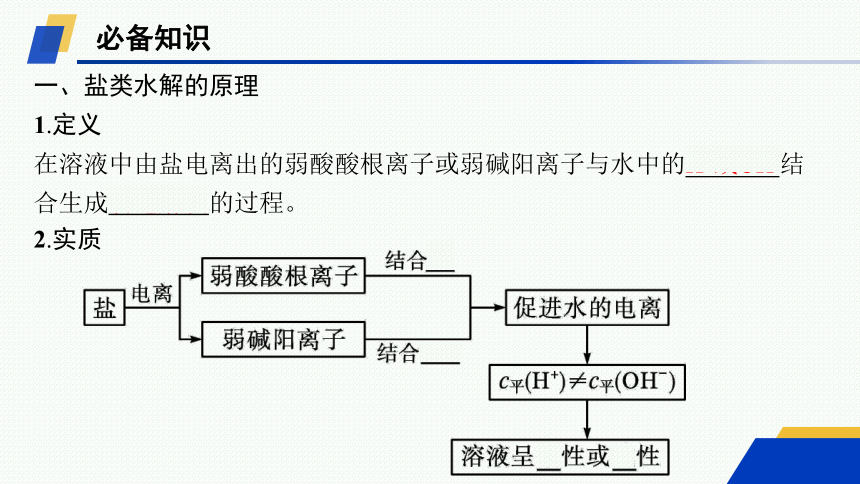
必备知识
一、盐类水解的原理
1.定义
在溶液中由盐电离出的弱酸酸根离子或弱碱阳离子与水中的H+或OH-结合生成弱电解质的过程。
2.实质
3.特点
可逆→水解反应是可逆反应
|
吸热→水解反应是中和反应的逆反应,是吸热反应
|
微弱→一般情况下,水解的程度很微弱
4.盐类的水解规律及溶液的酸碱性
(1)在可溶性盐溶液中:有弱才水解,无弱不水解,越弱越水解,都弱都水解,谁强显谁性。
(2)常见的“弱”离子。
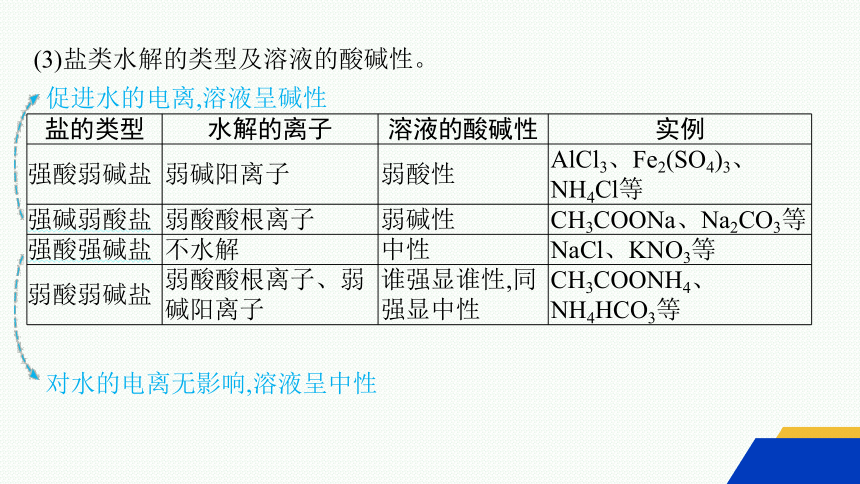
(3)盐类水解的类型及溶液的酸碱性。
盐的类型 水解的离子 溶液的酸碱性 实例
强酸弱碱盐 弱碱阳离子 弱酸性 AlCl3、Fe2(SO4)3、NH4Cl等
强碱弱酸盐 弱酸酸根离子 弱碱性 CH3COONa、Na2CO3等
强酸强碱盐 不水解 中性 NaCl、KNO3等
弱酸弱碱盐 弱酸酸根离子、弱碱阳离子 谁强显谁性,同强显中性 CH3COONH4、NH4HCO3等
促进水的电离,溶液呈碱性
对水的电离无影响,溶液呈中性
【微思考1】已知酸性:HF>CH3COOH,则0.1 mol·L-1NaF溶液与0.1 mol·L-1
CH3COONa溶液的pH大小关系如何
提示 根据越弱越水解的规律可知,相同浓度时,CH3COO-的水解程度大于F-的水解程度,则NaF溶液与CH3COONa溶液的pH大小关系为NaF溶液5.影响盐类水解的因素
(1)内因:相同条件下,弱酸的酸性越弱,其形成的盐越易水解,对应盐溶液的碱性越强;弱碱的碱性越弱,其形成的盐越易水解,对应盐溶液的酸性越强。
(2)外因。
①温度:盐的水解反应是吸热反应,升高温度水解平衡向右移动,水解程度增大。
②浓度:加水稀释盐的溶液,水解平衡向右移动,水解程度增大。
③外加酸、碱:加酸可抑制弱碱阳离子的水解,加碱可抑制弱酸酸根离子的水解。
④两种水解离子的相互影响:弱碱阳离子和弱酸酸根离子在同一溶液中,两种水解相互促进,使两种水解程度都增大,甚至反应完全。
【微思考2】实验室配制FeCl2溶液时,通常将FeCl2固体先溶解在盐酸中,再加水稀释至所需浓度,同时还加入少量铁屑,为什么
提示溶解在盐酸中的目的是抑制Fe2+的水解,而加入铁屑的作用是防止Fe2+被空气中的氧气氧化。
二、盐类水解离子方程式的书写
1.书写要求
(1)大多数盐的水解反应进行的程度很小,水解产物很少,无明显沉淀或气体生成。书写水解的离子方程式时,一般用“ ”连接,产物不标“↑”或“↓”。如:
(2)多元弱酸酸根离子的水解分步进行,水解以第一步为主。如Na2CO3的水解:
HClO+OH-
NH3·H2O
(3)多元弱碱阳离子水解反应过程复杂,通常以总反应表示。如AlCl3的水解:
Al(OH)3
2.盐的水解常数
在溶液中由盐电离产生的弱酸酸根离子或弱碱阳离子与水中的H+或OH-结合生成弱电解质的过程,叫作盐类的水解。水解反应的平衡常数叫作水解平衡常数或水解常数,用Kh表示。Kh表示水解反应趋势大小:Kh数值越大,水解趋势越大。
MOH
自我检测
判断下列说法是否正确,正确的打“√”,错误的打“×”。
(1)酸式盐溶液可能呈酸性,也可能呈碱性。( )
(3)常温下,pH=10的CH3COONa溶液与pH=4的NH4Cl溶液,水的电离程度相同。( )
√
×
√
×
(5)常温下,pH=11的CH3COONa溶液与pH=3的CH3COOH溶液,水的电离程度相同。( )
×
(6)NaHCO3、NaHSO4都能促进水的电离。( )
×
×
重难探究 能力素养全提升
探究一 盐类水解的规律及其影响因素
问题探究
盐类水解的规律及其影响因素
相同条件下,上面三支试管内分别盛有0.1 mol·L-1的Na2CO3溶液、0.1 mol·L-1的NaHCO3溶液、0.1 mol·L-1的CH3COONa溶液,向其中各滴入几滴酚酞溶液。
1.甲试管颜色最深、乙试管次之,丙试管颜色最浅。为什么
提示相同条件下,酸越弱, 对应的盐水解程度越大,溶液碱性越强,滴加酚酞溶液以后颜色越深。相同条件下,正盐水解程度大于相应的酸式盐。
2.小明同学对甲试管进行加热,发现微热后红色加深,这一现象说明了什么
提示加热能促进 的水解,溶液的碱性增强。
归纳拓展
1.盐类水解的规律
“有弱才水解,无弱不水解,越弱越水解,谁强显谁性。”
(1)强酸和弱碱生成的盐水解,溶液呈酸性。
(2)强碱和弱酸生成的正盐水解,溶液呈碱性。
(3)强酸强碱盐(正盐)不水解,溶液呈中性。
(4)弱酸酸式盐水解,溶液的酸碱性取决于酸式酸根离子的电离程度和水解程度的相对大小。
①若电离程度大于水解程度,溶液显酸性,如NaHSO3溶液、NaH2PO4溶液等。
②若电离程度小于水解程度,溶液显碱性,如NaHCO3溶液、Na2HPO4溶液等。
2.水解平衡的移动
盐类的水解平衡遵循勒·夏特列原理,受温度、浓度及外加酸碱等因素的影响。
例如:不同条件对FeCl3水解平衡Fe3++3H2O Fe(OH)3+3H+的影响
改变条件 平衡移动方向 n(H+) pH 水解程度 现象
升温 向右 增大 降低 增大 颜色变深
加FeCl3(s) 向右 增大 降低 减小 颜色变深
加水 向右 增大 升高 增大 颜色变浅
通HCl 向左 增大 降低 减小 颜色变浅
加铁粉 向左 减小 升高 减小 颜色变浅
加NaHCO3 粉末 向右 减小 升高 增大 生成红褐色沉淀和无色气体
盐类的水解是吸热反应
【微点拨】溶液中盐的浓度越小,水解程度越大,但是溶液的酸(碱)性越弱;盐浓度越大,水解程度越小,但是溶液的酸(碱)性越强。
应用体验
视角1 盐类水解的规律
1.已知常温下,Ka(HCN)=6.2×10-10 mol·L-1,Ka(HF)=6.8×10-4 mol·L-1, Ka(CH3COOH)=1.7×10-5 mol·L-1,Ka(HNO2)=7.1×10-4 mol·L-1。物质的量浓度均为0.1 mol·L-1的下列溶液,pH由大到小的顺序正确的是( )
A.NaCN>NaNO2>CH3COONa>NaF
B.NaF>NaNO2>CH3COONa>NaCN
C.NaCN>CH3COONa>NaNO2>NaF
D.NaCN>CH3COONa>NaF>NaNO2
D
解析 由Ka(HNO2)>Ka(HF)>Ka(CH3COOH)>Ka(HCN)可知,酸性:HNO2>HF> CH3COOH>HCN,则水解能力:CN->CH3COO->F-> ,弱酸酸根离子的水解能力越强,相同条件下对应盐溶液的碱性越强,pH越大。
【变式设问】
(1)向NaF和NaCN混合溶液中加入适量CH3COOH,可发生怎样的反应 试写出反应的离子方程式。
(2)已知Ka1(H2CO3)>Ka(HCN)>Ka2(H2CO3),则在NaCN溶液中通入少量CO2,会发生怎样的反应 试写出反应的离子方程式。
提示 NaF与CH3COOH不能反应,NaCN可与CH3COOH反应,离子方程式为CH3COOH+CN-═CH3COO-+HCN。
提示 H2O+CO2+CN-═HCN+ 。
归纳总结 比较等浓度盐溶液酸碱性强弱的步骤
(1)首先根据盐的种类,对盐溶液按照酸性、中性、碱性进行分组。
(2)呈酸性的强酸弱碱盐溶液,需比较相应的弱碱碱性强弱,根据越弱越水解,则成盐的弱碱越弱,水解后酸性越强;呈碱性的强碱弱酸盐溶液,需比较相应的弱酸酸性强弱,根据越弱越水解,则成盐的弱酸越弱,水解后碱性越强。
2.物质的量浓度相同的三种盐NaX、NaY和NaZ的溶液,其pH分别为8、9、10,则HX、HY、HZ的酸性由强到弱的顺序是( )
A.HX、HZ、HY B.HX、HY、HZ
C.HZ、HY、HX D.HY、HZ、HX
B
解析 利用盐类水解规律“越弱越水解,谁强显谁性”,结合同浓度三种酸的钠盐溶液的pH可推知,碱性越强则对应的酸越弱,因此酸性由强到弱的顺序为HX>HY>HZ,答案选B。
3.下列关于盐溶液呈酸碱性的说法错误的是( )
A.盐溶液呈酸碱性的原因是破坏了水的电离平衡
B.NH4Cl溶液呈酸性是由于溶液中c平(H+)>c平(OH-)
C.在稀CH3COONa溶液中,由水电离的c水(OH-)≠c水(H+)
D.水电离出的H+或OH-与盐中的弱离子结合,可能造成盐溶液呈酸性或碱性
C
解析 在水溶液中,盐电离出的离子和水电离出的H+或OH-结合生成弱电解质,溶液中H+和OH-浓度不相等,导致溶液呈酸性或碱性,即破坏了水的电离平衡,故A、D项正确;氯化铵是强酸弱碱盐,铵根离子水解导致溶液中c平(H+)>c平(OH-),则溶液呈酸性,故B项正确;任何稀的电解质溶液中由水电离的c水(OH-)=c水(H+),与电解质溶液的酸碱性无关,故C项错误。
视角2 盐类水解的影响因素
4.一定条件下,CH3COONa溶液中存在水解平衡:CH3COO-+H2O CH3COOH+OH-。下列说法正确的是( )
A.加入少量NaOH固体,c平(CH3COO-)减小
B.升高温度,溶液的pH增大
C.稀释溶液,溶液的pH增大
D.通入少量HCl气体,水解平衡常数减小
B
解析 加入的NaOH会抑制CH3COO-的水解,使c平(CH3COO-)增大,A错误;升温能促进盐类的水解,即c平(OH-)增大,溶液的pH增大,B正确;虽然稀释能促进水解,但仍以增大溶液体积为主,即c平(OH-)减小,溶液的pH也减小,C错误;通入HCl能促进CH3COO-的水解,但温度不变,水解平衡常数不变,D错误。
5.某溶液中FeCl3的水解反应已达平衡,若要使FeCl3的水解程度增大,应采取的方法是( )
A.加入CH3COONa B.加入浓盐酸
C.加FeCl3固体 D.降温
A
解析 CH3COONa溶液显碱性,能促进FeCl3的水解,A正确;加入浓盐酸平衡逆向移动,水解程度减小,B错误;加FeCl3固体,FeCl3浓度增大,FeCl3水解程度减小,C错误;降温使水解平衡逆向移动,FeCl3水解程度减小,D错误。
探究二 盐类水解方程式的书写
问题探究
1.NaHCO3在水溶液中既能发生电离又能发生水解反应,请分别写出相关的电离方程式和水解的离子方程式。
2.已知NaHSO3、NaH2PO4的水溶液呈酸性,试分析在NaHSO3、NaH2PO4的水溶液中,电离与水解程度的大小关系。
提示两种盐溶液中酸式酸根离子的电离程度大于水解程度。
归纳拓展
盐类水解方程式的书写
因相互促进水解不能大量共存
(5)多元弱酸的酸式酸根离子既有水解倾向,又有电离倾向。溶液的酸碱性由电离和水解的相对强弱来决定,即当电离程度大于水解程度时,溶液呈酸性,应该用电离方程式来表示酸性的产生(如NaH2PO4、NaHSO3等),当电离程度小于水解程度时,溶液呈碱性,应该用相应的水解方程式来表示碱性的产生(如Na2HPO4、NaHCO3、NaHS等)。
应用体验
视角1 水解方程式的判断
1.下列属于水解方程式且书写正确的打“√”,错误的打“×”:
解析 S2-应分步水解,错误。
(1)Na2S溶液中:S2-+2H2O H2S+2OH-。( )
(2)NaHS溶液中:HS-+H2O H2S+OH-。( )
(3)AlCl3溶液中:Al3++3H2O Al(OH)3↓+3H+。( )
解析 为HS-水解的离子方程式,正确。
解析 Al3+水解程度小,不能生成Al(OH)3沉淀,错误。
解析 为电离方程式,错误。
解析 为化学反应的离子方程式,不是水解方程式。
×
√
×
×
×
易错警示 盐类水解离子方程式与电离方程式的主要区别是:生成离子的种类不同。盐类水解的离子方程式在形式上一定符合“阴生阴、阳生阳”,即阴离子水解一定生成OH-,阳离子水解一定生成H+(或H3O+)。例如:
NaHS电离:HS-+H2O S2-+H3O+
NaHS水解:HS-+H2O H2S+OH-
2.下列各反应的方程式中,属于水解反应的是( )
D
3.下列物质在常温下发生水解反应时,对应的离子方程式正确的是( )
B
易错点拨 单一离子水解要用“ ”连接,无气体、沉淀;多元弱酸根离子水解分步进行,弱碱阳离子水解一步写出;要注意区分弱酸酸式酸根离子的水解和电离过程。
4.下列水解反应方程式正确的是( )
A.NH4Cl+H2O==NH3·H2O+HCl
B.CH3COONa+H2O==CH3COOH+NaOH
C.Na2CO3+2H2O CO2↑+H2O+2NaOH
D.FeCl3+3H2O Fe(OH)3+3HCl
解析A项,应为NH4Cl+H2O NH3·H2O+HCl;B项,应为CH3COONa+H2O
CH3COOH+NaOH;C项,应为Na2CO3+H2O NaHCO3+NaOH。
D
视角2 盐溶液酸碱性的判断及水解方程式的书写
5.盐是一类常见的电解质,实验表明盐溶液不一定呈中性。
(1)CH3COONa、NH4Cl、KNO3的水溶液分别呈 性、
性、 性。
碱
酸
中
解析 CH3COONa是强碱弱酸盐,水解使溶液显碱性;NH4Cl是强酸弱碱盐,水解使溶液显酸性;KNO3是强酸强碱盐,溶液显中性。
(2)盐中阴、阳离子的水解使溶液呈现的酸碱性不同,它们水解的离子方程式也不相同,CH3COONa和NH4Cl水解的离子方程式分别为
、 。
(3)氯化铝溶液呈 性,原因是 (用离子方程式表示)。
酸
本 课 结 束
高中同步学案优化设计
GAO ZHONG TONG BU XUE AN YOU HUA SHE JI
第3章 物质在水溶液中的行为
第2节 第2课时 盐类的水解
素 养 目 标
1.通过实验归纳盐溶液的酸碱性与其类型之间的关系,并进一步探究盐溶液呈现不同酸碱性的原因,总结其规律,培养证据推理与模型认知的化学核心素养。
2.了解影响盐类水解平衡的因素,能多角度、动态地分析外界条件对盐类水解平衡的影响,形成变化观念与平衡思想的化学核心素养。
3.熟练掌握盐类水解的表示方法——水解离子方程式的书写,培养宏观辨识与微观探析的化学核心素养。
基础落实 必备知识全过关
重难探究 能力素养全提升
目录索引
基础落实 必备知识全过关
必备知识
一、盐类水解的原理
1.定义
在溶液中由盐电离出的弱酸酸根离子或弱碱阳离子与水中的H+或OH-结合生成弱电解质的过程。
2.实质
3.特点
可逆→水解反应是可逆反应
|
吸热→水解反应是中和反应的逆反应,是吸热反应
|
微弱→一般情况下,水解的程度很微弱
4.盐类的水解规律及溶液的酸碱性
(1)在可溶性盐溶液中:有弱才水解,无弱不水解,越弱越水解,都弱都水解,谁强显谁性。
(2)常见的“弱”离子。
(3)盐类水解的类型及溶液的酸碱性。
盐的类型 水解的离子 溶液的酸碱性 实例
强酸弱碱盐 弱碱阳离子 弱酸性 AlCl3、Fe2(SO4)3、NH4Cl等
强碱弱酸盐 弱酸酸根离子 弱碱性 CH3COONa、Na2CO3等
强酸强碱盐 不水解 中性 NaCl、KNO3等
弱酸弱碱盐 弱酸酸根离子、弱碱阳离子 谁强显谁性,同强显中性 CH3COONH4、NH4HCO3等
促进水的电离,溶液呈碱性
对水的电离无影响,溶液呈中性
【微思考1】已知酸性:HF>CH3COOH,则0.1 mol·L-1NaF溶液与0.1 mol·L-1
CH3COONa溶液的pH大小关系如何
提示 根据越弱越水解的规律可知,相同浓度时,CH3COO-的水解程度大于F-的水解程度,则NaF溶液与CH3COONa溶液的pH大小关系为NaF溶液
(1)内因:相同条件下,弱酸的酸性越弱,其形成的盐越易水解,对应盐溶液的碱性越强;弱碱的碱性越弱,其形成的盐越易水解,对应盐溶液的酸性越强。
(2)外因。
①温度:盐的水解反应是吸热反应,升高温度水解平衡向右移动,水解程度增大。
②浓度:加水稀释盐的溶液,水解平衡向右移动,水解程度增大。
③外加酸、碱:加酸可抑制弱碱阳离子的水解,加碱可抑制弱酸酸根离子的水解。
④两种水解离子的相互影响:弱碱阳离子和弱酸酸根离子在同一溶液中,两种水解相互促进,使两种水解程度都增大,甚至反应完全。
【微思考2】实验室配制FeCl2溶液时,通常将FeCl2固体先溶解在盐酸中,再加水稀释至所需浓度,同时还加入少量铁屑,为什么
提示溶解在盐酸中的目的是抑制Fe2+的水解,而加入铁屑的作用是防止Fe2+被空气中的氧气氧化。
二、盐类水解离子方程式的书写
1.书写要求
(1)大多数盐的水解反应进行的程度很小,水解产物很少,无明显沉淀或气体生成。书写水解的离子方程式时,一般用“ ”连接,产物不标“↑”或“↓”。如:
(2)多元弱酸酸根离子的水解分步进行,水解以第一步为主。如Na2CO3的水解:
HClO+OH-
NH3·H2O
(3)多元弱碱阳离子水解反应过程复杂,通常以总反应表示。如AlCl3的水解:
Al(OH)3
2.盐的水解常数
在溶液中由盐电离产生的弱酸酸根离子或弱碱阳离子与水中的H+或OH-结合生成弱电解质的过程,叫作盐类的水解。水解反应的平衡常数叫作水解平衡常数或水解常数,用Kh表示。Kh表示水解反应趋势大小:Kh数值越大,水解趋势越大。
MOH
自我检测
判断下列说法是否正确,正确的打“√”,错误的打“×”。
(1)酸式盐溶液可能呈酸性,也可能呈碱性。( )
(3)常温下,pH=10的CH3COONa溶液与pH=4的NH4Cl溶液,水的电离程度相同。( )
√
×
√
×
(5)常温下,pH=11的CH3COONa溶液与pH=3的CH3COOH溶液,水的电离程度相同。( )
×
(6)NaHCO3、NaHSO4都能促进水的电离。( )
×
×
重难探究 能力素养全提升
探究一 盐类水解的规律及其影响因素
问题探究
盐类水解的规律及其影响因素
相同条件下,上面三支试管内分别盛有0.1 mol·L-1的Na2CO3溶液、0.1 mol·L-1的NaHCO3溶液、0.1 mol·L-1的CH3COONa溶液,向其中各滴入几滴酚酞溶液。
1.甲试管颜色最深、乙试管次之,丙试管颜色最浅。为什么
提示相同条件下,酸越弱, 对应的盐水解程度越大,溶液碱性越强,滴加酚酞溶液以后颜色越深。相同条件下,正盐水解程度大于相应的酸式盐。
2.小明同学对甲试管进行加热,发现微热后红色加深,这一现象说明了什么
提示加热能促进 的水解,溶液的碱性增强。
归纳拓展
1.盐类水解的规律
“有弱才水解,无弱不水解,越弱越水解,谁强显谁性。”
(1)强酸和弱碱生成的盐水解,溶液呈酸性。
(2)强碱和弱酸生成的正盐水解,溶液呈碱性。
(3)强酸强碱盐(正盐)不水解,溶液呈中性。
(4)弱酸酸式盐水解,溶液的酸碱性取决于酸式酸根离子的电离程度和水解程度的相对大小。
①若电离程度大于水解程度,溶液显酸性,如NaHSO3溶液、NaH2PO4溶液等。
②若电离程度小于水解程度,溶液显碱性,如NaHCO3溶液、Na2HPO4溶液等。
2.水解平衡的移动
盐类的水解平衡遵循勒·夏特列原理,受温度、浓度及外加酸碱等因素的影响。
例如:不同条件对FeCl3水解平衡Fe3++3H2O Fe(OH)3+3H+的影响
改变条件 平衡移动方向 n(H+) pH 水解程度 现象
升温 向右 增大 降低 增大 颜色变深
加FeCl3(s) 向右 增大 降低 减小 颜色变深
加水 向右 增大 升高 增大 颜色变浅
通HCl 向左 增大 降低 减小 颜色变浅
加铁粉 向左 减小 升高 减小 颜色变浅
加NaHCO3 粉末 向右 减小 升高 增大 生成红褐色沉淀和无色气体
盐类的水解是吸热反应
【微点拨】溶液中盐的浓度越小,水解程度越大,但是溶液的酸(碱)性越弱;盐浓度越大,水解程度越小,但是溶液的酸(碱)性越强。
应用体验
视角1 盐类水解的规律
1.已知常温下,Ka(HCN)=6.2×10-10 mol·L-1,Ka(HF)=6.8×10-4 mol·L-1, Ka(CH3COOH)=1.7×10-5 mol·L-1,Ka(HNO2)=7.1×10-4 mol·L-1。物质的量浓度均为0.1 mol·L-1的下列溶液,pH由大到小的顺序正确的是( )
A.NaCN>NaNO2>CH3COONa>NaF
B.NaF>NaNO2>CH3COONa>NaCN
C.NaCN>CH3COONa>NaNO2>NaF
D.NaCN>CH3COONa>NaF>NaNO2
D
解析 由Ka(HNO2)>Ka(HF)>Ka(CH3COOH)>Ka(HCN)可知,酸性:HNO2>HF> CH3COOH>HCN,则水解能力:CN->CH3COO->F-> ,弱酸酸根离子的水解能力越强,相同条件下对应盐溶液的碱性越强,pH越大。
【变式设问】
(1)向NaF和NaCN混合溶液中加入适量CH3COOH,可发生怎样的反应 试写出反应的离子方程式。
(2)已知Ka1(H2CO3)>Ka(HCN)>Ka2(H2CO3),则在NaCN溶液中通入少量CO2,会发生怎样的反应 试写出反应的离子方程式。
提示 NaF与CH3COOH不能反应,NaCN可与CH3COOH反应,离子方程式为CH3COOH+CN-═CH3COO-+HCN。
提示 H2O+CO2+CN-═HCN+ 。
归纳总结 比较等浓度盐溶液酸碱性强弱的步骤
(1)首先根据盐的种类,对盐溶液按照酸性、中性、碱性进行分组。
(2)呈酸性的强酸弱碱盐溶液,需比较相应的弱碱碱性强弱,根据越弱越水解,则成盐的弱碱越弱,水解后酸性越强;呈碱性的强碱弱酸盐溶液,需比较相应的弱酸酸性强弱,根据越弱越水解,则成盐的弱酸越弱,水解后碱性越强。
2.物质的量浓度相同的三种盐NaX、NaY和NaZ的溶液,其pH分别为8、9、10,则HX、HY、HZ的酸性由强到弱的顺序是( )
A.HX、HZ、HY B.HX、HY、HZ
C.HZ、HY、HX D.HY、HZ、HX
B
解析 利用盐类水解规律“越弱越水解,谁强显谁性”,结合同浓度三种酸的钠盐溶液的pH可推知,碱性越强则对应的酸越弱,因此酸性由强到弱的顺序为HX>HY>HZ,答案选B。
3.下列关于盐溶液呈酸碱性的说法错误的是( )
A.盐溶液呈酸碱性的原因是破坏了水的电离平衡
B.NH4Cl溶液呈酸性是由于溶液中c平(H+)>c平(OH-)
C.在稀CH3COONa溶液中,由水电离的c水(OH-)≠c水(H+)
D.水电离出的H+或OH-与盐中的弱离子结合,可能造成盐溶液呈酸性或碱性
C
解析 在水溶液中,盐电离出的离子和水电离出的H+或OH-结合生成弱电解质,溶液中H+和OH-浓度不相等,导致溶液呈酸性或碱性,即破坏了水的电离平衡,故A、D项正确;氯化铵是强酸弱碱盐,铵根离子水解导致溶液中c平(H+)>c平(OH-),则溶液呈酸性,故B项正确;任何稀的电解质溶液中由水电离的c水(OH-)=c水(H+),与电解质溶液的酸碱性无关,故C项错误。
视角2 盐类水解的影响因素
4.一定条件下,CH3COONa溶液中存在水解平衡:CH3COO-+H2O CH3COOH+OH-。下列说法正确的是( )
A.加入少量NaOH固体,c平(CH3COO-)减小
B.升高温度,溶液的pH增大
C.稀释溶液,溶液的pH增大
D.通入少量HCl气体,水解平衡常数减小
B
解析 加入的NaOH会抑制CH3COO-的水解,使c平(CH3COO-)增大,A错误;升温能促进盐类的水解,即c平(OH-)增大,溶液的pH增大,B正确;虽然稀释能促进水解,但仍以增大溶液体积为主,即c平(OH-)减小,溶液的pH也减小,C错误;通入HCl能促进CH3COO-的水解,但温度不变,水解平衡常数不变,D错误。
5.某溶液中FeCl3的水解反应已达平衡,若要使FeCl3的水解程度增大,应采取的方法是( )
A.加入CH3COONa B.加入浓盐酸
C.加FeCl3固体 D.降温
A
解析 CH3COONa溶液显碱性,能促进FeCl3的水解,A正确;加入浓盐酸平衡逆向移动,水解程度减小,B错误;加FeCl3固体,FeCl3浓度增大,FeCl3水解程度减小,C错误;降温使水解平衡逆向移动,FeCl3水解程度减小,D错误。
探究二 盐类水解方程式的书写
问题探究
1.NaHCO3在水溶液中既能发生电离又能发生水解反应,请分别写出相关的电离方程式和水解的离子方程式。
2.已知NaHSO3、NaH2PO4的水溶液呈酸性,试分析在NaHSO3、NaH2PO4的水溶液中,电离与水解程度的大小关系。
提示两种盐溶液中酸式酸根离子的电离程度大于水解程度。
归纳拓展
盐类水解方程式的书写
因相互促进水解不能大量共存
(5)多元弱酸的酸式酸根离子既有水解倾向,又有电离倾向。溶液的酸碱性由电离和水解的相对强弱来决定,即当电离程度大于水解程度时,溶液呈酸性,应该用电离方程式来表示酸性的产生(如NaH2PO4、NaHSO3等),当电离程度小于水解程度时,溶液呈碱性,应该用相应的水解方程式来表示碱性的产生(如Na2HPO4、NaHCO3、NaHS等)。
应用体验
视角1 水解方程式的判断
1.下列属于水解方程式且书写正确的打“√”,错误的打“×”:
解析 S2-应分步水解,错误。
(1)Na2S溶液中:S2-+2H2O H2S+2OH-。( )
(2)NaHS溶液中:HS-+H2O H2S+OH-。( )
(3)AlCl3溶液中:Al3++3H2O Al(OH)3↓+3H+。( )
解析 为HS-水解的离子方程式,正确。
解析 Al3+水解程度小,不能生成Al(OH)3沉淀,错误。
解析 为电离方程式,错误。
解析 为化学反应的离子方程式,不是水解方程式。
×
√
×
×
×
易错警示 盐类水解离子方程式与电离方程式的主要区别是:生成离子的种类不同。盐类水解的离子方程式在形式上一定符合“阴生阴、阳生阳”,即阴离子水解一定生成OH-,阳离子水解一定生成H+(或H3O+)。例如:
NaHS电离:HS-+H2O S2-+H3O+
NaHS水解:HS-+H2O H2S+OH-
2.下列各反应的方程式中,属于水解反应的是( )
D
3.下列物质在常温下发生水解反应时,对应的离子方程式正确的是( )
B
易错点拨 单一离子水解要用“ ”连接,无气体、沉淀;多元弱酸根离子水解分步进行,弱碱阳离子水解一步写出;要注意区分弱酸酸式酸根离子的水解和电离过程。
4.下列水解反应方程式正确的是( )
A.NH4Cl+H2O==NH3·H2O+HCl
B.CH3COONa+H2O==CH3COOH+NaOH
C.Na2CO3+2H2O CO2↑+H2O+2NaOH
D.FeCl3+3H2O Fe(OH)3+3HCl
解析A项,应为NH4Cl+H2O NH3·H2O+HCl;B项,应为CH3COONa+H2O
CH3COOH+NaOH;C项,应为Na2CO3+H2O NaHCO3+NaOH。
D
视角2 盐溶液酸碱性的判断及水解方程式的书写
5.盐是一类常见的电解质,实验表明盐溶液不一定呈中性。
(1)CH3COONa、NH4Cl、KNO3的水溶液分别呈 性、
性、 性。
碱
酸
中
解析 CH3COONa是强碱弱酸盐,水解使溶液显碱性;NH4Cl是强酸弱碱盐,水解使溶液显酸性;KNO3是强酸强碱盐,溶液显中性。
(2)盐中阴、阳离子的水解使溶液呈现的酸碱性不同,它们水解的离子方程式也不相同,CH3COONa和NH4Cl水解的离子方程式分别为
、 。
(3)氯化铝溶液呈 性,原因是 (用离子方程式表示)。
酸
本 课 结 束
同课章节目录
- 第1章 化学反应与能量转化
- 第1节 化学反应的热效应
- 第2节 化学能转化为电能——电池
- 第3节 电能转化为化学能——电解
- 第4节 金属的腐蚀与防护
- 微项目 设计载人航天器用化学电池与氧气再生方案——化学反应中能量及物质的转化利用
- 第2章 化学反应的方向、 限度与速率
- 第1节 化学反应的方向
- 第2节 化学反应的限度
- 第3节 化学反应的速率
- 第4节 化学反应条件的优化——工业合成氨
- 微项目 探讨如何利用工业废气中的二氧化碳合成甲醇——化学反应选择与反应条件优化
- 第3章 物质在水溶液中的行为
- 第1节 水与水溶液
- 第2节 弱电解质的电离 盐类的水解
- 第3节 沉淀溶解平衡
- 第4节 离子反应
- 微项目 揭秘索尔维制碱法和侯氏制碱法——化学平衡思想的创造性应用
