第2章末整合 课件(共51张PPT)2023-2024学年高二化学鲁科版选择性必修1
文档属性
| 名称 | 第2章末整合 课件(共51张PPT)2023-2024学年高二化学鲁科版选择性必修1 |  | |
| 格式 | pptx | ||
| 文件大小 | 4.3MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-11-20 10:26:20 | ||
图片预览










文档简介
(共51张PPT)
第2章 化学反应的方向、限度与速率
章 末 整 合
突破1 化学平衡移动与转化率
利用勒·夏特列原理解释平衡移动方向和转化率高低是高考的重点内容。
典例1 (2022全国甲卷,28)金属钛(Ti)在航空航天、医疗器械等工业领域有着重要用途。目前生产钛的方法之一是将金红石(TiO2)转化为TiCl4,再进一步还原得到钛。回答下列问题:
(1)TiO2转化为TiCl4有直接氯化法和碳氯化法。在1 000 ℃时反应的热化学方程式及其平衡常数如下:
(ⅰ)直接氯化:
TiO2(s)+2Cl2(g)═TiCl4(g)+O2(g) ΔH1=172 kJ·mol-1,Kp1=1.0×10-2
(ⅱ)碳氯化:
TiO2(s)+2Cl2(g)+2C(s)═TiCl4(g)+2CO(g) ΔH2=-51 kJ·mol-1, Kp2=1.2×1012 Pa
①反应2C(s)+O2(g)═2CO(g)的ΔH为 kJ·mol-1,Kp= Pa。
②碳氯化的反应趋势远大于直接氯化,其原因是 。
③对于碳氯化反应:增大压强,平衡 (填“向左”“向右”或“不”)移动;温度升高,平衡转化率 (填“变大”“变小”或“不变”)。
-223
1.2×1014
C与O2反应生成CO的平衡常数很大,可推动TiO2直接氯化反应平衡向生成TiCl4方向移动
向左
变小
解析 本题考查盖斯定律的应用、平衡常数的计算、外界条件对平衡和转化率的影响等。
①由盖斯定律可知,反应(ⅱ)-反应(ⅰ)可得2C(s)+O2(g)═2CO(g)
ΔH=-51 kJ·mol-1-172 kJ·mol-1=-223 kJ·mol-1。
②C与O2反应生成CO的平衡常数很大,可推动TiO2直接氯化反应平衡向生成TiCl4方向移动,故碳氯化的反应趋势大于直接氯化。
③碳氯化反应中,正向反应为气体分子数增大的放热反应,依据勒·夏特列原理,增大压强,平衡向左移动;升高温度,平衡向左移动,平衡转化率减小。
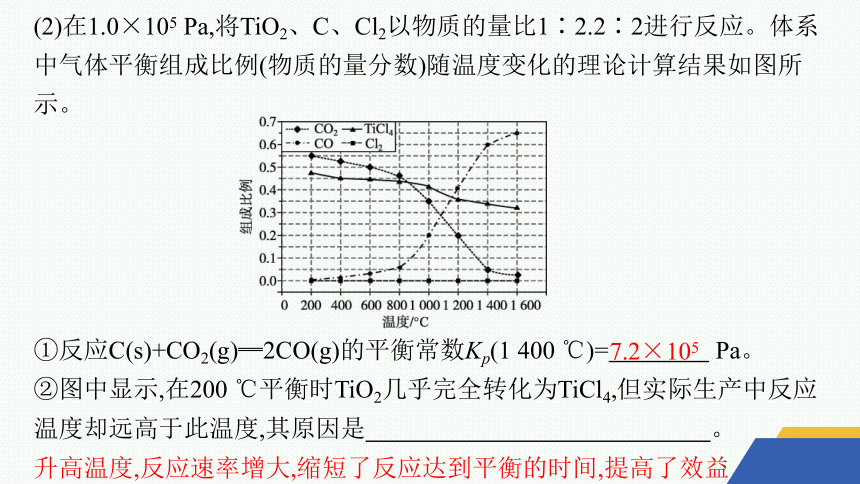
(2)在1.0×105 Pa,将TiO2、C、Cl2以物质的量比1∶2.2∶2进行反应。体系中气体平衡组成比例(物质的量分数)随温度变化的理论计算结果如图所示。
①反应C(s)+CO2(g)═2CO(g)的平衡常数Kp(1 400 ℃)= Pa。
②图中显示,在200 ℃平衡时TiO2几乎完全转化为TiCl4,但实际生产中反应温度却远高于此温度,其原因是 。
7.2×105
升高温度,反应速率增大,缩短了反应达到平衡的时间,提高了效益
解析 ①根据图像可知,1 400 ℃时CO2、CO的组成比例分别为0.05、0.6,
②实际生产中反应温度高于200 ℃,原因是升高温度,反应速率增大,缩短了反应达到平衡的时间,可以达到最佳效益。
(3)TiO2碳氯化是一个“气—固—固”反应,有利于TiO2-C“固—固”接触的措施是 。
将固体TiO2和C粉碎并充分混合
解析 将固体TiO2和C粉碎并充分混合,可增大反应物间的接触面积。
规律方法 1.化学平衡移动的判断方法
(1)依据勒·夏特列原理判断。
通过比较改变条件瞬时的正、逆反应速率的相对大小来判断平衡移动的方向。
①若外界条件改变,引起v(正)>v(逆),则化学平衡向正反应方向(或向右)移动;
②若外界条件改变,引起v(正)③若外界条件改变,虽能引起v(正)和v(逆)变化,但变化后新的v'(正)和v'(逆)仍保持相等,则化学平衡不发生移动。
(2)依据浓度商(Q)规则判断。
Qv(逆)
Q=K 反应处于化学平衡状态,v(正)=v(逆)
Q>K 反应向逆反应方向进行,v(正)2.转化率大小变化分析
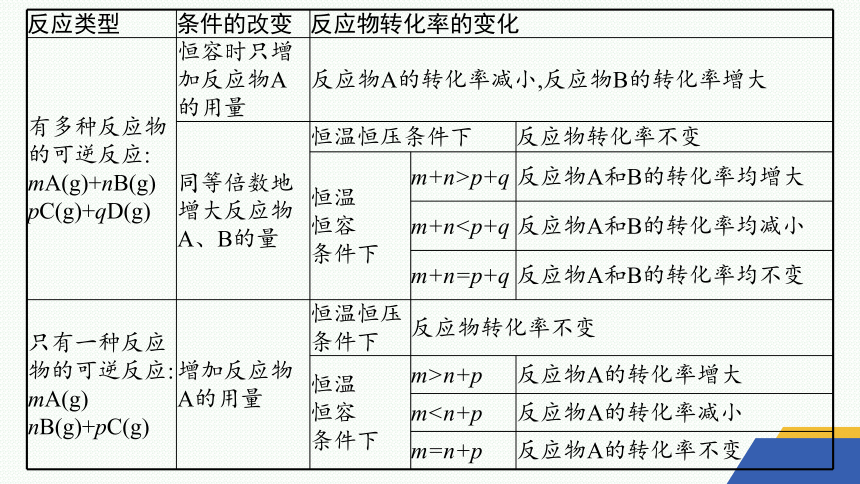
判断反应物转化率的变化时,不要把平衡正向移动与反应物转化率提高等同起来,要视具体情况具体分析。常见有以下几种情形:
反应类型 条件的改变 反应物转化率的变化
有多种反应物的可逆反应: mA(g)+nB(g) pC(g)+qD(g) 恒容时只增加反应物A的用量 反应物A的转化率减小,反应物B的转化率增大
同等倍数地增大反应物A、B的量 恒温恒压条件下 反应物转化率不变
恒温 恒容 条件下 m+n>p+q 反应物A和B的转化率均增大
m+nm+n=p+q 反应物A和B的转化率均不变
只有一种反应物的可逆反应: mA(g) nB(g)+pC(g) 增加反应物A的用量 恒温恒压条件下 反应物转化率不变
恒温 恒容 条件下 m>n+p 反应物A的转化率增大
mm=n+p 反应物A的转化率不变
【变式训练1-1】
CH4-CO2催化重整反应为CH4(g)+CO2(g) 2CO(g)+2H2(g) ΔH=+247 kJ·mol-1。有利于提高CH4平衡转化率的条件是( )
A.高温低压 B.低温高压
C.高温高压 D.低温低压
A
解析由于题给反应正向为吸热且气体体积增大的反应,要提高CH4的平衡转化率,需在高温低压下进行。
【变式训练1-2】
(2021广东化学,14)反应X==2Z经历两步:①X→Y;②Y→2Z。反应体系中X、Y、Z的浓度c随时间t的变化曲线如图所示。下列说法不正确的是( )
A.a为c(X)随t的变化曲线
B.t1时,c(X)=c(Y)=c(Z)
C.t2时,Y的消耗速率大于生成速率
D.t3后,c(Z)=2c0-c(Y)
D
解析 本题考查化学反应速率与化学平衡。从①②步反应中X、Y、Z的量的关系可知,a表示X的浓度变化,A项正确;t1时,X、Y、Z浓度交于同一点,B项正确;t2时反应未达到平衡,Y的浓度处于下降趋势,C项正确;t3时X已完全反应,则c(Y)+ =c0,则c(Z)=2[c0-c(Y)],D项错误。
突破2 化学平衡常数(K)及转化率(α)的计算
化学平衡常数(K)及转化率(α)的计算是高考的重点、热点和难点,主要涉及温度一定时浓度平衡常数和压强平衡常数的计算。
典例2 (2022全国乙卷,28节选)油气开采、石油化工、煤化工等行业废气普遍含有的硫化氢,需要回收处理并加以利用。回答下列问题:
(1)在1 470 K、100 kPa反应条件下,将n(H2S)∶n(Ar)=1∶4的混合气进行H2S热分解反应:2H2S(g)═S2(g)+2H2(g)的ΔH=+170 kJ·mol-1。平衡时混合气中H2S与H2的分压相等,H2S平衡转化率为______,平衡常数Kp=_____kPa。
50%
4.76
解析 设起始时H2S的物质的量为1 mol,平衡时消耗H2S的物质的量为x mol,则
(2)在1 373 K、100 kPa反应条件下,对于n(H2S)∶n(Ar)分别为4∶1、1∶1、1∶4、1∶9、1∶19的H2S-Ar混合气,热分解反应过程中H2S转化率随时间的变化如下图所示。
①n(H2S)∶n(Ar)越小,H2S平衡转化率 ,理由是 。
②n(H2S)∶n(Ar)=1∶9对应图中曲线 ,计算其在0~0.1 s之间,H2S分压的平均变化率为 kPa·s-1。
越高
等温等压下加入惰性气体,平衡向气体分子数增加的方向移动
d
24.9
(2)①H2S分解的反应是气体分子数增大的反应,因此等温等压下加入惰性气体,平衡向气体分子数增加的方向移动,即H2S的平衡转化率越大。
②由图像和转化率大小关系可知,曲线a、b、c、d、e分别表示n(H2S)∶n(Ar)为4∶1、1∶1、1∶4、1∶9和1∶19时的H2S转化率与时间的关系,因此n(H2S)∶n(Ar)=1∶9对应的是曲线d。
设起始时H2S的物质的量为1 mol,则Ar的物质的量为9 mol,由题图可知,当0.1 s时H2S的转化率为24%,则
2H2S(g) S2(g)+2H2(g)
起始/mol 1 0 0
转化/mol 0.24 0.12 0.24
0.1 s/mol 0.76 0.12 0.24
则0.1 s时气体的总物质的量为
0.76 mol+0.12 mol+0.24 mol+9 mol=10.12 mol。
起始时,H2S的分压为100 kPa×0.1=10 kPa,0.1 s时H2S的分压为100 kPa×
≈7.51 kPa,即变化值约为2.49 kPa,则变化率为24.9 kPa·s-1。
3.压强平衡常数计算的一般步骤
【变式训练2-1】
在300 mL的密闭容器中,放入镍粉并充入一定量的CO气体,一定条件下发生反应:Ni(s)+4CO(g) Ni(CO)4(g),已知该反应平衡常数与温度的关系如下表。
温度/℃ 25 80 230
5×104 2 1.9×10-5
下列说法正确的是( )
A.上述生成Ni(CO)4(g)的反应为吸热反应
B.25 ℃时反应Ni(CO)4(g) Ni(s)+4CO(g)的平衡常数为0.5 mol3·L-3
C.在某条件下达到平衡,测得Ni(CO)4、CO的浓度均为0.5 mol·L-1,则此时温度高于80 ℃
D.80 ℃时,在相同容器中充入0.3 mol CO和0.3 mol Ni(CO)4,同时加入足量Ni,此时v(正)>v(逆)
D
【变式训练2-2】
(1)活性炭还原NO2的反应为2NO2(g)+2C(s) N2(g)+2CO2(g),在恒温条件下,1 mol NO2和足量活性炭发生该反应,测得平衡时NO2和CO2的物质的量浓度与平衡总压的关系如图1所示,C点时该反应的平衡常数Kp=_____MPa (Kp为以分压表示的平衡常数,分压=总压×物质的量分数)。
图1
4
(2)以CO作为还原剂与磷石膏(主要成分为CaSO4·2H2O)反应,不同反应温度下可得到不同的产物。向盛有CaSO4的真空恒容密闭容器中充入CO,反应体系起始总压强为0.1a MPa,不同温度下反应后所得固态物质的物质的量如图2所示。在低于800 ℃时主要反应的化学方程式为
;1 150 ℃下,反应CaSO4+CO CaO+CO2+SO2达到平衡时,c平(SO2)=8.0×10-5 mol·L-1, CO的转化率为80%,则c始(CO)= mol·L-1,该反应的压强平衡常数Kp= Mpa(用含a的代数式表示;用平衡分压代替平衡浓度计算,分压=总压×物质的量分数;忽略副反应)。
图2
CaSO4+4CO CaS+4CO2
1.0×10-4
0.32a
解析(1)Kp的表达式为Kp= ,先计算平衡时,混合气体中各组分的物质的量分数,设平衡时NO2的变化量为x mol,则
2NO2(g)+2C(s) N2(g)+2CO2(g)
起始/mol 1 0 0
变化/mol x 0.5x x
平衡/mol 1-x 0.5x x
平衡时物质的量分数
由于C点时c(NO2)=c(CO2),即1-x=x,解得x=0.5。把x=0.5代入上述物质的量分数算式中,得到NO2、N2、CO2的物质的量分数分别为0.4、0.2、0.4,由于NO2与CO2的物质的量分数相等,故p(CO2)=p(NO2),
突破3 常见的化学反应速率、化学平衡图像分析
1.速率—时间图像
反应mA(g)+nB(g) pC(g)+qD(g),m+n>p+q,且ΔH>0
(1)t1时增大反应物的浓度,正反应速率瞬间增大,然后逐渐减小,而逆反应速率逐渐增大;
(2)t2时升高温度,正反应和逆反应速率均增大,吸热反应的反应速率增大得快;
(3)t3时减小压强,容器容积增大,浓度变小,正反应速率和逆反应速率均减小,正反应的反应速率减小得多;
(4)t4时使用催化剂,正反应速率和逆反应速率均瞬间增大但仍相等。
2.转化率(或含量)—时间图像
反应mA(g)+nB(g) pC(g)+qD(g),m+n>p+q,且ΔH>0
(1)图甲表示压强对反应物转化率的影响,对于气体反应物系数之和大于气体反应产物系数之和的反应,压强越大,反应物的转化率越大;
(2)图乙表示温度对反应物转化率的影响,对于吸热反应,温度越高,反应物的转化率越大;
(3)图丙表示催化剂对反应物转化率的影响,催化剂只能改变化学反应速率,不能改变反应物的转化率。
3.恒压(温)线
反应mA(g)+nB(g) pC(g)+qD(g),m+n>p+q,且ΔH>0
分析时可沿横轴作一条平行于纵轴的虚线,即为等压线或等温线,然后分析另一条件变化对该反应的影响。
4.特殊类型图像
(1)对于化学反应mA(g)+nB(g) pC(g)+qD(g),如下图所示,M点前,表示从反应物开始,v(正)>v(逆);M点为刚达到平衡点;M点后为平衡受温度的影响情况,即升温,A的百分含量增加或C的百分含量减少,平衡左移,故正反应ΔH<0。
(2)对于化学反应mA(g)+nB(g) pC(g)+qD(g),如下图所示,L线上所有的点都是平衡点。L线的左上方(E点),A的百分含量大于此压强时平衡体系的A的百分含量,所以E点v(正)>v(逆);则L线的右下方(F点),v(正)典例3 (2022湖南卷,14改编)向容积均为1 L的两恒容容器中分别充入2 mol X和1 mol Y发生反应:2X(g)+Y(g) Z(g) ΔH,其中甲为绝热过程,乙为恒温过程,两反应体系的压强随时间的变化曲线如图所示。下列说法正确的是( )
A.ΔH>0
B.气体的总物质的量:naC.a点平衡常数:K<12 mol-2·L2
D.反应速率:va正B
解析 该反应正向是气体分子数减小的反应,绝热容器中气体压强先增大后减小,说明该反应是放热反应,ΔH<0,A项错误;甲容器的温度较高,a、c点气压相等,则c点气体的物质的量较大,B项正确;依据c点进行分析,利用“三段式”计算,设生成Z的物质的量为 mol。
规律方法 解答化学平衡图像题的四步骤
【变式训练3-1】
(2021湖南卷,16节选)某兴趣小组对该反应进行了实验探究。在一定温度和催化剂的条件下,将0.1 mol NH3通入3 L 的密闭容器中进行反应(此时容器内总压为200 kPa),各物质的分压随时间的变化曲线如图所示。
(1)若保持容器容积不变,t1时反应达到平衡,用H2的浓度变化表示0~t1时间内的反应速率v(H2)= mol·L-1·min-1(用含t1的代数式表示);
解析 根据题图可知,从反应达平衡时(即t1时),氨气和氢气的分压都为1.2×100 kPa,氮气的分压为0.4×100 kPa,列三段式为:
2NH3 N2+3H2 总压
起始/mol 0.1 0 0 200 kPa
转化/mol 2n n 3n
平衡/mol 0.1-2n n 3n (1.2+1.2+0.4)×100 kPa
(2)t2时将容器容积迅速缩小至原来的一半并保持不变,图中能正确表示压缩后N2分压变化趋势的曲线是 (用图中a、b、c、d表示),理由是 ;
B
t2时刻,将容器的容积迅速缩小为原来的一半,则所有气体的分压突然增大为原平衡时的2倍,则N2的分压突变为0.8×100 kPa,之后平衡逆向移动,氮气的分压减小
解析 t2时刻,将容器的容积迅速缩小为原来的一半,则所有气体的分压突然增大为原平衡时的2倍,则N2的分压突变为0.8×100 kPa,之后平衡逆向移动,氮气的分压减小,所以符合条件的曲线为b。
(3)在该温度下,反应的标准平衡常数Kθ= 。
0.48
【变式训练3-2】
探究CH3OH合成反应中化学平衡的影响因素,有利于提高CH3OH的产率。以CO2、H2为原料合成CH3OH涉及的主要反应如下:
Ⅰ.CO2(g)+3H2(g) CH3OH(g)+H2O(g) ΔH1=-49.5 kJ·mol-1
Ⅱ.CO(g)+2H2(g) CH3OH(g) ΔH2=-90.4 kJ·mol-1
Ⅲ.CO2(g)+H2(g) CO(g)+H2O(g) ΔH3=+40.9 kJ·mol-1
回答下列问题:
(1)不同压强下,按照n(CO2)∶n(H2)=1∶3投料,实验测定CO2的平衡转化率和CH3OH的平衡产率随温度的变化关系如下图所示。
其中纵坐标表示CO2平衡转化率的是图 (填“甲”或“乙”);压强p1、p2、p3由大到小的顺序为 ;图乙中T1温度时,三条曲线几乎交于一点的原因是 。
乙
p1>p2>p3
T1时以反应Ⅲ为主,反应Ⅲ前后气体分子数相等,压强改变对平衡没有影响
解析 从图乙中看到在T1时,p不同时三条曲线交于一点,说明压强的改变对平衡无影响。而反应Ⅲ前后分子数不变,反应以Ⅲ为主,所以升高温度平衡向正方向移动,CO2的转化率升高。图乙纵坐标表示CO2的平衡转化率,图甲纵坐标表示CH3OH的平衡产率,反应Ⅰ、Ⅱ都是体积减小的反应,增大压强平衡向正反应方向移动,故p1>p2>p3。
(2)为同时提高CO2的平衡转化率和CH3OH的平衡产率,应选择的反应条件为 (填字母)。
A.低温、高压
B.高温、低压
C.低温、低压
D.高温、高压
A
解析 由反应的方程式可知,低温、高压可提高CO2的平衡转化率和CH3OH的平衡产率。
【变式训练3-3】
298 K时,将20 mL 3x mol·L-1 Na3AsO3溶液、20 mL 3x mol·L-1I2溶液和20 mL NaOH溶液混合,发生反应:
(1)下列可判断反应达到平衡的是 (填字母)。
ac
(2)tm时,v(正) (填“大于”“小于”或“等于”)v(逆)。
大于
(3)tm时v(逆) (填“大于”“小于”或“等于”)tn时v(逆),理由是
。
小于
tm时反应产物浓度较低,逆反应速率较小
解析 tm时反应未达到平衡状态,所以v(正)大于v(逆)。
解析 从tm到tn,反应逐渐趋于平衡状态,反应物浓度逐渐减小而反应产物浓度逐渐增大,所以正反应速率逐渐减小,逆反应速率逐渐增大,故tm时v(逆)小于tn时v(逆)。
本 课 结 束
第2章 化学反应的方向、限度与速率
章 末 整 合
突破1 化学平衡移动与转化率
利用勒·夏特列原理解释平衡移动方向和转化率高低是高考的重点内容。
典例1 (2022全国甲卷,28)金属钛(Ti)在航空航天、医疗器械等工业领域有着重要用途。目前生产钛的方法之一是将金红石(TiO2)转化为TiCl4,再进一步还原得到钛。回答下列问题:
(1)TiO2转化为TiCl4有直接氯化法和碳氯化法。在1 000 ℃时反应的热化学方程式及其平衡常数如下:
(ⅰ)直接氯化:
TiO2(s)+2Cl2(g)═TiCl4(g)+O2(g) ΔH1=172 kJ·mol-1,Kp1=1.0×10-2
(ⅱ)碳氯化:
TiO2(s)+2Cl2(g)+2C(s)═TiCl4(g)+2CO(g) ΔH2=-51 kJ·mol-1, Kp2=1.2×1012 Pa
①反应2C(s)+O2(g)═2CO(g)的ΔH为 kJ·mol-1,Kp= Pa。
②碳氯化的反应趋势远大于直接氯化,其原因是 。
③对于碳氯化反应:增大压强,平衡 (填“向左”“向右”或“不”)移动;温度升高,平衡转化率 (填“变大”“变小”或“不变”)。
-223
1.2×1014
C与O2反应生成CO的平衡常数很大,可推动TiO2直接氯化反应平衡向生成TiCl4方向移动
向左
变小
解析 本题考查盖斯定律的应用、平衡常数的计算、外界条件对平衡和转化率的影响等。
①由盖斯定律可知,反应(ⅱ)-反应(ⅰ)可得2C(s)+O2(g)═2CO(g)
ΔH=-51 kJ·mol-1-172 kJ·mol-1=-223 kJ·mol-1。
②C与O2反应生成CO的平衡常数很大,可推动TiO2直接氯化反应平衡向生成TiCl4方向移动,故碳氯化的反应趋势大于直接氯化。
③碳氯化反应中,正向反应为气体分子数增大的放热反应,依据勒·夏特列原理,增大压强,平衡向左移动;升高温度,平衡向左移动,平衡转化率减小。
(2)在1.0×105 Pa,将TiO2、C、Cl2以物质的量比1∶2.2∶2进行反应。体系中气体平衡组成比例(物质的量分数)随温度变化的理论计算结果如图所示。
①反应C(s)+CO2(g)═2CO(g)的平衡常数Kp(1 400 ℃)= Pa。
②图中显示,在200 ℃平衡时TiO2几乎完全转化为TiCl4,但实际生产中反应温度却远高于此温度,其原因是 。
7.2×105
升高温度,反应速率增大,缩短了反应达到平衡的时间,提高了效益
解析 ①根据图像可知,1 400 ℃时CO2、CO的组成比例分别为0.05、0.6,
②实际生产中反应温度高于200 ℃,原因是升高温度,反应速率增大,缩短了反应达到平衡的时间,可以达到最佳效益。
(3)TiO2碳氯化是一个“气—固—固”反应,有利于TiO2-C“固—固”接触的措施是 。
将固体TiO2和C粉碎并充分混合
解析 将固体TiO2和C粉碎并充分混合,可增大反应物间的接触面积。
规律方法 1.化学平衡移动的判断方法
(1)依据勒·夏特列原理判断。
通过比较改变条件瞬时的正、逆反应速率的相对大小来判断平衡移动的方向。
①若外界条件改变,引起v(正)>v(逆),则化学平衡向正反应方向(或向右)移动;
②若外界条件改变,引起v(正)
(2)依据浓度商(Q)规则判断。
Q
Q=K 反应处于化学平衡状态,v(正)=v(逆)
Q>K 反应向逆反应方向进行,v(正)
判断反应物转化率的变化时,不要把平衡正向移动与反应物转化率提高等同起来,要视具体情况具体分析。常见有以下几种情形:
反应类型 条件的改变 反应物转化率的变化
有多种反应物的可逆反应: mA(g)+nB(g) pC(g)+qD(g) 恒容时只增加反应物A的用量 反应物A的转化率减小,反应物B的转化率增大
同等倍数地增大反应物A、B的量 恒温恒压条件下 反应物转化率不变
恒温 恒容 条件下 m+n>p+q 反应物A和B的转化率均增大
m+n
只有一种反应物的可逆反应: mA(g) nB(g)+pC(g) 增加反应物A的用量 恒温恒压条件下 反应物转化率不变
恒温 恒容 条件下 m>n+p 反应物A的转化率增大
m
【变式训练1-1】
CH4-CO2催化重整反应为CH4(g)+CO2(g) 2CO(g)+2H2(g) ΔH=+247 kJ·mol-1。有利于提高CH4平衡转化率的条件是( )
A.高温低压 B.低温高压
C.高温高压 D.低温低压
A
解析由于题给反应正向为吸热且气体体积增大的反应,要提高CH4的平衡转化率,需在高温低压下进行。
【变式训练1-2】
(2021广东化学,14)反应X==2Z经历两步:①X→Y;②Y→2Z。反应体系中X、Y、Z的浓度c随时间t的变化曲线如图所示。下列说法不正确的是( )
A.a为c(X)随t的变化曲线
B.t1时,c(X)=c(Y)=c(Z)
C.t2时,Y的消耗速率大于生成速率
D.t3后,c(Z)=2c0-c(Y)
D
解析 本题考查化学反应速率与化学平衡。从①②步反应中X、Y、Z的量的关系可知,a表示X的浓度变化,A项正确;t1时,X、Y、Z浓度交于同一点,B项正确;t2时反应未达到平衡,Y的浓度处于下降趋势,C项正确;t3时X已完全反应,则c(Y)+ =c0,则c(Z)=2[c0-c(Y)],D项错误。
突破2 化学平衡常数(K)及转化率(α)的计算
化学平衡常数(K)及转化率(α)的计算是高考的重点、热点和难点,主要涉及温度一定时浓度平衡常数和压强平衡常数的计算。
典例2 (2022全国乙卷,28节选)油气开采、石油化工、煤化工等行业废气普遍含有的硫化氢,需要回收处理并加以利用。回答下列问题:
(1)在1 470 K、100 kPa反应条件下,将n(H2S)∶n(Ar)=1∶4的混合气进行H2S热分解反应:2H2S(g)═S2(g)+2H2(g)的ΔH=+170 kJ·mol-1。平衡时混合气中H2S与H2的分压相等,H2S平衡转化率为______,平衡常数Kp=_____kPa。
50%
4.76
解析 设起始时H2S的物质的量为1 mol,平衡时消耗H2S的物质的量为x mol,则
(2)在1 373 K、100 kPa反应条件下,对于n(H2S)∶n(Ar)分别为4∶1、1∶1、1∶4、1∶9、1∶19的H2S-Ar混合气,热分解反应过程中H2S转化率随时间的变化如下图所示。
①n(H2S)∶n(Ar)越小,H2S平衡转化率 ,理由是 。
②n(H2S)∶n(Ar)=1∶9对应图中曲线 ,计算其在0~0.1 s之间,H2S分压的平均变化率为 kPa·s-1。
越高
等温等压下加入惰性气体,平衡向气体分子数增加的方向移动
d
24.9
(2)①H2S分解的反应是气体分子数增大的反应,因此等温等压下加入惰性气体,平衡向气体分子数增加的方向移动,即H2S的平衡转化率越大。
②由图像和转化率大小关系可知,曲线a、b、c、d、e分别表示n(H2S)∶n(Ar)为4∶1、1∶1、1∶4、1∶9和1∶19时的H2S转化率与时间的关系,因此n(H2S)∶n(Ar)=1∶9对应的是曲线d。
设起始时H2S的物质的量为1 mol,则Ar的物质的量为9 mol,由题图可知,当0.1 s时H2S的转化率为24%,则
2H2S(g) S2(g)+2H2(g)
起始/mol 1 0 0
转化/mol 0.24 0.12 0.24
0.1 s/mol 0.76 0.12 0.24
则0.1 s时气体的总物质的量为
0.76 mol+0.12 mol+0.24 mol+9 mol=10.12 mol。
起始时,H2S的分压为100 kPa×0.1=10 kPa,0.1 s时H2S的分压为100 kPa×
≈7.51 kPa,即变化值约为2.49 kPa,则变化率为24.9 kPa·s-1。
3.压强平衡常数计算的一般步骤
【变式训练2-1】
在300 mL的密闭容器中,放入镍粉并充入一定量的CO气体,一定条件下发生反应:Ni(s)+4CO(g) Ni(CO)4(g),已知该反应平衡常数与温度的关系如下表。
温度/℃ 25 80 230
5×104 2 1.9×10-5
下列说法正确的是( )
A.上述生成Ni(CO)4(g)的反应为吸热反应
B.25 ℃时反应Ni(CO)4(g) Ni(s)+4CO(g)的平衡常数为0.5 mol3·L-3
C.在某条件下达到平衡,测得Ni(CO)4、CO的浓度均为0.5 mol·L-1,则此时温度高于80 ℃
D.80 ℃时,在相同容器中充入0.3 mol CO和0.3 mol Ni(CO)4,同时加入足量Ni,此时v(正)>v(逆)
D
【变式训练2-2】
(1)活性炭还原NO2的反应为2NO2(g)+2C(s) N2(g)+2CO2(g),在恒温条件下,1 mol NO2和足量活性炭发生该反应,测得平衡时NO2和CO2的物质的量浓度与平衡总压的关系如图1所示,C点时该反应的平衡常数Kp=_____MPa (Kp为以分压表示的平衡常数,分压=总压×物质的量分数)。
图1
4
(2)以CO作为还原剂与磷石膏(主要成分为CaSO4·2H2O)反应,不同反应温度下可得到不同的产物。向盛有CaSO4的真空恒容密闭容器中充入CO,反应体系起始总压强为0.1a MPa,不同温度下反应后所得固态物质的物质的量如图2所示。在低于800 ℃时主要反应的化学方程式为
;1 150 ℃下,反应CaSO4+CO CaO+CO2+SO2达到平衡时,c平(SO2)=8.0×10-5 mol·L-1, CO的转化率为80%,则c始(CO)= mol·L-1,该反应的压强平衡常数Kp= Mpa(用含a的代数式表示;用平衡分压代替平衡浓度计算,分压=总压×物质的量分数;忽略副反应)。
图2
CaSO4+4CO CaS+4CO2
1.0×10-4
0.32a
解析(1)Kp的表达式为Kp= ,先计算平衡时,混合气体中各组分的物质的量分数,设平衡时NO2的变化量为x mol,则
2NO2(g)+2C(s) N2(g)+2CO2(g)
起始/mol 1 0 0
变化/mol x 0.5x x
平衡/mol 1-x 0.5x x
平衡时物质的量分数
由于C点时c(NO2)=c(CO2),即1-x=x,解得x=0.5。把x=0.5代入上述物质的量分数算式中,得到NO2、N2、CO2的物质的量分数分别为0.4、0.2、0.4,由于NO2与CO2的物质的量分数相等,故p(CO2)=p(NO2),
突破3 常见的化学反应速率、化学平衡图像分析
1.速率—时间图像
反应mA(g)+nB(g) pC(g)+qD(g),m+n>p+q,且ΔH>0
(1)t1时增大反应物的浓度,正反应速率瞬间增大,然后逐渐减小,而逆反应速率逐渐增大;
(2)t2时升高温度,正反应和逆反应速率均增大,吸热反应的反应速率增大得快;
(3)t3时减小压强,容器容积增大,浓度变小,正反应速率和逆反应速率均减小,正反应的反应速率减小得多;
(4)t4时使用催化剂,正反应速率和逆反应速率均瞬间增大但仍相等。
2.转化率(或含量)—时间图像
反应mA(g)+nB(g) pC(g)+qD(g),m+n>p+q,且ΔH>0
(1)图甲表示压强对反应物转化率的影响,对于气体反应物系数之和大于气体反应产物系数之和的反应,压强越大,反应物的转化率越大;
(2)图乙表示温度对反应物转化率的影响,对于吸热反应,温度越高,反应物的转化率越大;
(3)图丙表示催化剂对反应物转化率的影响,催化剂只能改变化学反应速率,不能改变反应物的转化率。
3.恒压(温)线
反应mA(g)+nB(g) pC(g)+qD(g),m+n>p+q,且ΔH>0
分析时可沿横轴作一条平行于纵轴的虚线,即为等压线或等温线,然后分析另一条件变化对该反应的影响。
4.特殊类型图像
(1)对于化学反应mA(g)+nB(g) pC(g)+qD(g),如下图所示,M点前,表示从反应物开始,v(正)>v(逆);M点为刚达到平衡点;M点后为平衡受温度的影响情况,即升温,A的百分含量增加或C的百分含量减少,平衡左移,故正反应ΔH<0。
(2)对于化学反应mA(g)+nB(g) pC(g)+qD(g),如下图所示,L线上所有的点都是平衡点。L线的左上方(E点),A的百分含量大于此压强时平衡体系的A的百分含量,所以E点v(正)>v(逆);则L线的右下方(F点),v(正)
A.ΔH>0
B.气体的总物质的量:na
D.反应速率:va正
解析 该反应正向是气体分子数减小的反应,绝热容器中气体压强先增大后减小,说明该反应是放热反应,ΔH<0,A项错误;甲容器的温度较高,a、c点气压相等,则c点气体的物质的量较大,B项正确;依据c点进行分析,利用“三段式”计算,设生成Z的物质的量为 mol。
规律方法 解答化学平衡图像题的四步骤
【变式训练3-1】
(2021湖南卷,16节选)某兴趣小组对该反应进行了实验探究。在一定温度和催化剂的条件下,将0.1 mol NH3通入3 L 的密闭容器中进行反应(此时容器内总压为200 kPa),各物质的分压随时间的变化曲线如图所示。
(1)若保持容器容积不变,t1时反应达到平衡,用H2的浓度变化表示0~t1时间内的反应速率v(H2)= mol·L-1·min-1(用含t1的代数式表示);
解析 根据题图可知,从反应达平衡时(即t1时),氨气和氢气的分压都为1.2×100 kPa,氮气的分压为0.4×100 kPa,列三段式为:
2NH3 N2+3H2 总压
起始/mol 0.1 0 0 200 kPa
转化/mol 2n n 3n
平衡/mol 0.1-2n n 3n (1.2+1.2+0.4)×100 kPa
(2)t2时将容器容积迅速缩小至原来的一半并保持不变,图中能正确表示压缩后N2分压变化趋势的曲线是 (用图中a、b、c、d表示),理由是 ;
B
t2时刻,将容器的容积迅速缩小为原来的一半,则所有气体的分压突然增大为原平衡时的2倍,则N2的分压突变为0.8×100 kPa,之后平衡逆向移动,氮气的分压减小
解析 t2时刻,将容器的容积迅速缩小为原来的一半,则所有气体的分压突然增大为原平衡时的2倍,则N2的分压突变为0.8×100 kPa,之后平衡逆向移动,氮气的分压减小,所以符合条件的曲线为b。
(3)在该温度下,反应的标准平衡常数Kθ= 。
0.48
【变式训练3-2】
探究CH3OH合成反应中化学平衡的影响因素,有利于提高CH3OH的产率。以CO2、H2为原料合成CH3OH涉及的主要反应如下:
Ⅰ.CO2(g)+3H2(g) CH3OH(g)+H2O(g) ΔH1=-49.5 kJ·mol-1
Ⅱ.CO(g)+2H2(g) CH3OH(g) ΔH2=-90.4 kJ·mol-1
Ⅲ.CO2(g)+H2(g) CO(g)+H2O(g) ΔH3=+40.9 kJ·mol-1
回答下列问题:
(1)不同压强下,按照n(CO2)∶n(H2)=1∶3投料,实验测定CO2的平衡转化率和CH3OH的平衡产率随温度的变化关系如下图所示。
其中纵坐标表示CO2平衡转化率的是图 (填“甲”或“乙”);压强p1、p2、p3由大到小的顺序为 ;图乙中T1温度时,三条曲线几乎交于一点的原因是 。
乙
p1>p2>p3
T1时以反应Ⅲ为主,反应Ⅲ前后气体分子数相等,压强改变对平衡没有影响
解析 从图乙中看到在T1时,p不同时三条曲线交于一点,说明压强的改变对平衡无影响。而反应Ⅲ前后分子数不变,反应以Ⅲ为主,所以升高温度平衡向正方向移动,CO2的转化率升高。图乙纵坐标表示CO2的平衡转化率,图甲纵坐标表示CH3OH的平衡产率,反应Ⅰ、Ⅱ都是体积减小的反应,增大压强平衡向正反应方向移动,故p1>p2>p3。
(2)为同时提高CO2的平衡转化率和CH3OH的平衡产率,应选择的反应条件为 (填字母)。
A.低温、高压
B.高温、低压
C.低温、低压
D.高温、高压
A
解析 由反应的方程式可知,低温、高压可提高CO2的平衡转化率和CH3OH的平衡产率。
【变式训练3-3】
298 K时,将20 mL 3x mol·L-1 Na3AsO3溶液、20 mL 3x mol·L-1I2溶液和20 mL NaOH溶液混合,发生反应:
(1)下列可判断反应达到平衡的是 (填字母)。
ac
(2)tm时,v(正) (填“大于”“小于”或“等于”)v(逆)。
大于
(3)tm时v(逆) (填“大于”“小于”或“等于”)tn时v(逆),理由是
。
小于
tm时反应产物浓度较低,逆反应速率较小
解析 tm时反应未达到平衡状态,所以v(正)大于v(逆)。
解析 从tm到tn,反应逐渐趋于平衡状态,反应物浓度逐渐减小而反应产物浓度逐渐增大,所以正反应速率逐渐减小,逆反应速率逐渐增大,故tm时v(逆)小于tn时v(逆)。
本 课 结 束
同课章节目录
- 第1章 化学反应与能量转化
- 第1节 化学反应的热效应
- 第2节 化学能转化为电能——电池
- 第3节 电能转化为化学能——电解
- 第4节 金属的腐蚀与防护
- 微项目 设计载人航天器用化学电池与氧气再生方案——化学反应中能量及物质的转化利用
- 第2章 化学反应的方向、 限度与速率
- 第1节 化学反应的方向
- 第2节 化学反应的限度
- 第3节 化学反应的速率
- 第4节 化学反应条件的优化——工业合成氨
- 微项目 探讨如何利用工业废气中的二氧化碳合成甲醇——化学反应选择与反应条件优化
- 第3章 物质在水溶液中的行为
- 第1节 水与水溶液
- 第2节 弱电解质的电离 盐类的水解
- 第3节 沉淀溶解平衡
- 第4节 离子反应
- 微项目 揭秘索尔维制碱法和侯氏制碱法——化学平衡思想的创造性应用
