【备考2024】浙江省中考科学一轮复习专项练习12:水与溶液(含解析)
文档属性
| 名称 | 【备考2024】浙江省中考科学一轮复习专项练习12:水与溶液(含解析) |  | |
| 格式 | doc | ||
| 文件大小 | 985.5KB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 浙教版 | ||
| 科目 | 科学 | ||
| 更新时间 | 2023-11-20 13:42:59 | ||
图片预览



文档简介
中小学教育资源及组卷应用平台
【备考2024】浙江省中考科学一轮复习专项练习12:水与溶液
一、单选题
1.从一杯蔗糖溶液的上部取一些溶液,测得它的密度为a克/厘米3,再从下部取一些溶液,测得它的密度为( )
A.大于a克/厘米3 B.小于a克/厘米3
C.等于a克/厘米3 D.无法判断
2. “恒大冰泉”是来自长白山的天然矿泉水,判断“恒大冰泉”属于溶液的依据是( )
①无色 ②混合物 ③化合物 ④均一性 ⑤稳定性.
A.①②④ B.②④⑤ C.①③⑤ D.③④⑤
3.从10 g质量分数为10%的硝酸钾溶液中取出5 g,那么剩下的5 g硝酸钾溶液的质量分数为( )
A.1% B.90% C.10% D.11.1%
4.下列关于水资源的叙述,正确的是( )
A.通常所说的水资源是指陆地上的所有水体
B.冰川分布于两极和高山地区,是目前可供人类利用的最重要的水资源之一
C.目前你用的淡水资源,主要是指河流水、湖泊淡水河浅层地下水
D.水资源开发利用后,都能很快恢复
5.如图表示一杯刚配制的饱和蔗糖溶液,要增加该溶液的溶质质量分数,下列操作正确的是( )
A.升温 B.降温 C.加糖 D.搅拌
6.如图是对20℃一定质量的甲的溶液进行恒温蒸发的结晶实验过程,下列判断正确的是( )
A.a溶液可能是饱和溶液
B.d溶液的溶质质量分数大于a、b、c溶液
C.“n”的值是6
D.20℃甲在水中的溶解度为50克
7.如图所示,要使其灯泡发光,需在广口瓶中加入以下哪种物质( )
A.氯化钠固体 B.氢氧化钠溶液
C.蔗糖溶液 D.酒精
8.海水晒盐是利用下列哪种方法结出晶体的( )
A.冷却热饱和溶液 B.升温使其溶解度下降
C.蒸发溶剂 D.降温使其溶解度下降
9.对湖泊出现的“水华”现象,下列叙述不正确的是( )
A.生活污水不经处理排入湖泊,容易引发藻类过度繁殖
B.湖水温度升高是引起藻类大量繁殖的主要因素
C.藻类植物过度繁殖,会破坏湖泊原有生态系统
D.藻类植物过度繁殖可导致鱼虾死亡
10.某同学需要配制50g质量分数为15%的氯化钠溶液,步骤如图所示,下列分析正确的是( )
A.配制过程中出现了两处操作错误
B.实验操作步骤为:计算、称量、量取、蒸发
C.若所有操作都正确,完全溶解后有液滴溅出,会导致溶质的质量分数偏小
D.配制时应称量氯化钠固体的质量为7.0g
11. 将60℃的硝酸钾溶液降温至20℃,有晶体析出.有关该过程的说法错误的是( )
A.60℃时的溶液一定是硝酸钾饱和溶液
B.20 摄氏度时的溶液一定是硝酸钾的饱和溶液
C.硝酸钾的溶解度随温度降低而减小
D.硝酸钾的晶体可采用降温结晶的方法得到
12.如图所示为蒸发食盐溶液的实验过程,其中①→②→③为恒温蒸发过程,③→④为升温蒸发过程,分析实验过程,可以作出如下判断,其中错误的是( ) 21·cn·jy·com
A.在①→③变化过程中,食盐的溶解度保持不变
B.在②→③变化过程中,溶剂的质量不断减少
C.③与④溶液中,溶质与溶剂的比值不可能相同
D.在①→④变化过程中,食盐的质量分数一直不断增大
13.如图为某固体饱和溶液浓度随温度变化的曲线。该固体从溶液中析出时不会带结晶水。M、N两点分别表示该固体形成的两份溶液在不同温度时的对应的浓度值。当条件改变时,M、N两点的位置可能也随之变化,其中判断错误的是( ) 21om
A.都升温10℃后,M、N点均水平向右移
B.都降温10℃后,M点沿曲线向左下移,N点向左平移
C.恒温下加水稀释,M、N点均不动
D.恒温下蒸发溶剂,M点不动,N点先向上移至曲线再不动
14.已知甲、乙两种物质的溶解度(S甲、S乙)均随着温度的升高而增大.10℃时,20克水中最多能溶解5克甲;30℃时,乙物质的饱和溶液中溶质的质量分数为20%,那么,在20℃时进行比较,正确的是( )
A.S甲=S乙 B.S甲>S乙 C.S甲<S乙 D.无法确定
15.t℃时,将一定量的某物质的溶液分成三等份,分别加热,再降温到t℃。已知从三份溶液中蒸发掉的溶剂分别为10克、20克、30克,析出的晶体分别为a克、b克、c克,则“a、b、c三者关系为 ( )
A.c=a+b B.c=a+2b C.c=2a+b D.c=2b-a
二、填空题
16.水是重要的自然资源,水资源不足,将严重影响人类的生存,请结合下表回答问题。
水资源紧缺程度 轻度缺水 中度缺水 重度缺水 极度缺水
人均水量(米/年) 1700~3000 1000~1700 500 ~ 1000 <500
(1)我国北方人均水量约为720米/年,水资源紧缺程度为 。
(2)研究表明 :1节含汞、镉、铅等金属的干电池所造成的污染,可使60吨水无法饮用。若成年人每人每天饮水约2千克,则60吨水可供1个人饮用约 年。
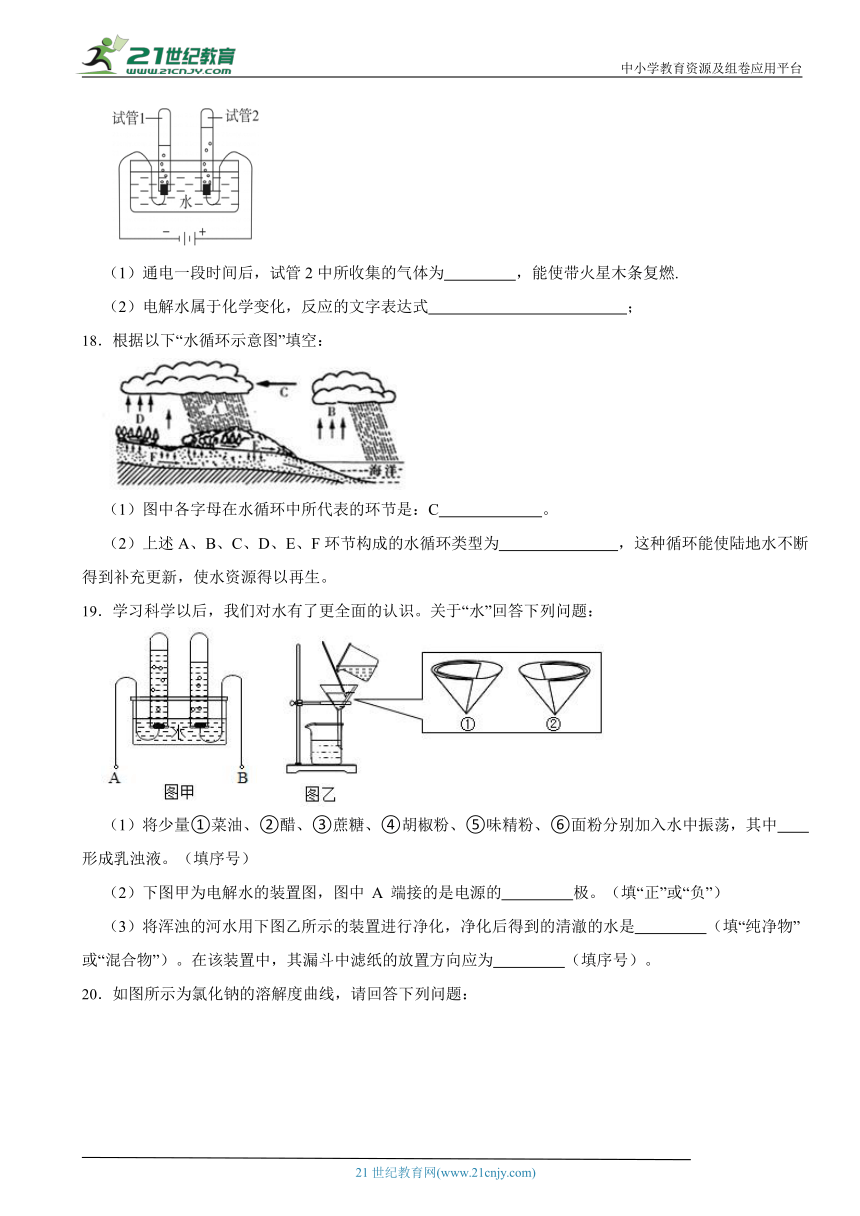
17.小刚利用下图所示的装置探究水的组成。
(1)通电一段时间后,试管2中所收集的气体为 ,能使带火星木条复燃.
(2)电解水属于化学变化,反应的文字表达式 ;
18.根据以下“水循环示意图”填空:
(1)图中各字母在水循环中所代表的环节是:C 。
(2)上述A、B、C、D、E、F环节构成的水循环类型为 ,这种循环能使陆地水不断得到补充更新,使水资源得以再生。
19.学习科学以后,我们对水有了更全面的认识。关于“水”回答下列问题:
(1)将少量①菜油、②醋、③蔗糖、④胡椒粉、⑤味精粉、⑥面粉分别加入水中振荡,其中 形成乳浊液。(填序号)
(2)下图甲为电解水的装置图,图中 A 端接的是电源的 极。(填“正”或“负”)
(3)将浑浊的河水用下图乙所示的装置进行净化,净化后得到的清澈的水是 (填“纯净物”或“混合物”)。在该装置中,其漏斗中滤纸的放置方向应为 (填序号)。
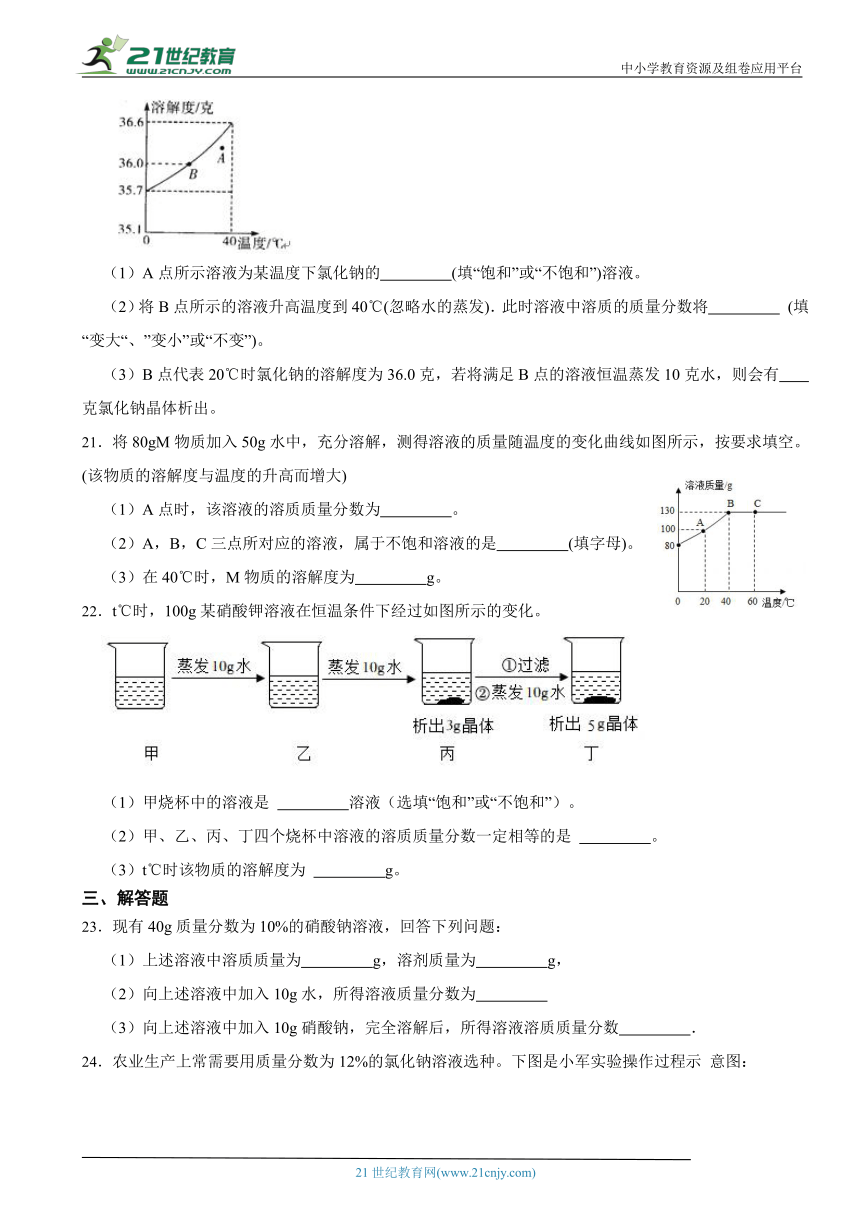
20.如图所示为氯化钠的溶解度曲线,请回答下列问题:
(1)A点所示溶液为某温度下氯化钠的 (填“饱和”或“不饱和”)溶液。
(2)将B点所示的溶液升高温度到40℃(忽略水的蒸发).此时溶液中溶质的质量分数将 (填“变大“、”变小”或“不变”)。
(3)B点代表20℃时氯化钠的溶解度为36.0克,若将满足B点的溶液恒温蒸发10克水,则会有 克氯化钠晶体析出。
21.将80gM物质加入50g水中,充分溶解,测得溶液的质量随温度的变化曲线如图所示,按要求填空。(该物质的溶解度与温度的升高而增大)
(1)A点时,该溶液的溶质质量分数为 。
(2)A,B,C三点所对应的溶液,属于不饱和溶液的是 (填字母)。
(3)在40℃时,M物质的溶解度为 g。
22.t℃时,100g某硝酸钾溶液在恒温条件下经过如图所示的变化。
(1)甲烧杯中的溶液是 溶液(选填“饱和”或“不饱和”)。
(2)甲、乙、丙、丁四个烧杯中溶液的溶质质量分数一定相等的是 。
(3)t℃时该物质的溶解度为 g。
三、解答题
23.现有40g质量分数为10%的硝酸钠溶液,回答下列问题:
(1)上述溶液中溶质质量为 g,溶剂质量为 g,
(2)向上述溶液中加入10g水,所得溶液质量分数为
(3)向上述溶液中加入10g硝酸钠,完全溶解后,所得溶液溶质质量分数 .
24.农业生产上常需要用质量分数为12%的氯化钠溶液选种。下图是小军实验操作过程示
意图:
(1)图中一处明显错误的操作是 (填序号)
(2)改进图一中的错误操作后.经检测,所配制溶液的溶质质量分数偏小,其原因可能是 (填序号)。
21cnjy.com
①氯化钠固体不纯 ②称量时,砝码端忘垫质量相同的纸片
③量取水时,仰视读数 ④装瓶时,有少量溶液洒出
(3)现用质量分数为12%的氯化钠溶液,配制50克质量分数为6%的氯化钠溶液。需要 水多少毫升(水的密度为1克/立方厘米)。
2-1-c-n-j-y
25.为测定某纯碱样品(含少量硫酸钠杂质)中碳酸钠的质量分数,某化学兴趣小组进行以下实验.取一定质量的样品放置于烧杯中.向烧杯中滴加一定溶质质量分数的稀盐酸,实验测得烧杯中物质的总质量与加入稀盐酸的质量的关系如图所示.求:
(1)所取样品的质量是 g.
(2)样品中碳酸钠的质量分数是 (%).
(3)所用稀盐酸的溶质质量分数(写出具体的计算过程).
26.宁波地处东南沿海,有着丰富的海洋资源,请思考下列问题:
(1)已知宁波某盐场测得:①海水中含氯化钠约为3.5%;②在海边打深井,井水中含氯化钠约为8%。晒盐最好用 (填序号)作原料。
(2)关于晒盐原理的说法正确的是____。
A.利用阳光和风力,使水分蒸发,析出盐
B.日光照晒后,氯化钠的溶解度变小
(3)海水晒盐提取食盐晶体后留下的母液叫卤水,其中含有的氯化钾(KCl)、氯化镁(MgCl2)、硫酸镁(MgSO4)等物质可作为重要的化工原料,它们的溶解度曲线如图所示。
①40℃时,将50g硫酸镁加入100g水中,充分搅拌,所得溶液的溶质质量分数为 (结果精确到0.1%)。若使其形成饱和溶液,可采取的措施有 。
A.增加溶质 B.蒸发溶剂
C.升高温度 D.降低温度
②关于卤水中含有的氯化钾(KCl)、氯化镁(MgCl2)、硫酸镁(MgSO4)三种物质,下列说法正确的是 。
A.三种物质均为易溶物质
B.10℃时,向40g氯化钾(KCl)固体和40g氯化镁(MgCl2)固体中分别加入100g水充分溶解后,两种溶液均能达到饱和状态
C.60℃时,三种物质溶于水形成的溶液浓度可能相等
四、实验探究题
27.人类的生活和工农业生产都离不开水,如图流程可以对自然界的水进行净化操作,最终制得蒸馏水。请回答下列问题:
21教育名师原创作品
(1)过滤是将 进行分离的一种方法:过滤后向滤液中加入活性炭,利用其吸附性,除去水样中的 ;
(2)到清水后,要得到蒸馏水需要进行图二的蒸馏操作,在a中加入碎瓷片,其作用是 ,从物质组成分析,蒸馏水属于 物;
(3)写出什么是“蒸馏”的分离方法 。
28.地球上物质种类千差万别,但都有一定的规律可寻:
表一:硫酸的密度和溶质质量分数对照表(20 ℃)
密度(g/cm3) 1.01 1.07 1.14 1.22 1.30 1.40 1.50 1.61 1.73 1.81 1.84
溶质质量分数(%) 1 10 20 30 40 50 60 70 80 90 98
表二:氯化钠和碳酸钠晶体的溶解度对照表(0 ℃-30 ℃)
请你分析上述两个表中的内容,并探究下列问题:
(1)由表一可得出的规律是: 。
(2)由表二可得出物质溶解度随温度变化的不同规律是: 。
(3)我国有许多盐碱湖,湖水中溶有大量的氯化钠和碳酸钠。冬天湖中有大量晶体析出,其中主要成分是 。www.21-cn-jy.com
(4)如图,烧杯内盛有饱和氯化钠溶液,弹簧秤上挂了一块与氯化钠不反应且不溶解的金属块。向氯化钠溶液中加适量氯化钠晶体,则弹簧秤的示数将(填“变大”“变小”或“不变”) 。
29.某化学实验小组的同学要配制100g质量分数为10%的氯化钠(俗称食盐,化学式为NaCl)溶液,下面是他们配制溶液的实验操作示意图,如图:
2·1·c·n·j·y
(1)该实验正确的操作顺序为 。(填序号)
(2)用托盘天平称取所需氯化钠时,发现天平指针偏向左盘,应 (填字母)
A.增加适量氯化钠固体 B.减少适量氯化钠固体 C.向右移动砝码
(3)为提高精度,某同学们对粗盐进行了提纯,请参考上图回答:以下操作中,操作②的名称是 。
(4)用提纯得到的氯化钠配制上述溶液,经检测,溶质质量分数偏小,其原因可能是 (填序号)
①氯化钠固体仍然不纯 ②称量时,砝码端忘垫质量相同的纸片
③量取水时,仰视读数 ④装瓶时,有少量溶液洒出
五、综合说理题
30.生活中经常看到这样一种现象:夏季的湖面上,许多鱼会在水面上“吹气泡”甚至跃出水面,而冬季几乎没有。在夏季出现雷阵雨前,会有更多鱼会在水面处“吹气泡”,而在夏季的晴朗天,则很少出现这样的情况。请你用学过的科学知识解释以上现象。
答案解析部分
1.C
【解析】根据溶液的特点判断。
溶液具有均一性,即溶液的各个部分的性质完全相同,因此上下两个部分的密度相等,故C正确,而A、B、D错误。
故选C。
2.B
【解析】解:“恒大冰泉”属于溶液的依据是“恒大冰泉”具有均一性、稳定性,属于混合物.无色不是判断是否属于溶液的依据,溶液不一定都是无色的,有些溶液是带有颜色的,如硫酸铜溶液是蓝色的.
故选:B.
溶液是均一、稳定的混合物;溶液的本质特征是均一性、稳定性,属于混合物,据此进行分析判断.
3.C
【解析】根据溶液的特点分析判断。
溶液具有均一性,即各个部分的性质完全相同,因此剩下5g的硝酸钾溶液的质量分数不变,还是10%。
故选C。
4.C
【解析】根据水资源的分布及现状分析,结合保护水资源的方法判断。
A、通常所说的水资源是指能被人类利用的淡水资源,不符合题意;
B、冰川分布于两极和高山地区,但是目前还不能供人类利用,目前人类利用的淡水资源,主要是河湖水和浅层地下水,仅占全球淡水资源的0.3%,不符合题意;
C、目前使用的淡水资源,主要是指河流水、湖泊淡水河浅层地下水,符合题意;
D、水资源利用后不能恢复,所以应节约用水,不符合题意;
故答案为:C。
5.A
【解析】增大溶质质量分数的方法:①增加溶质;②减小溶剂,据此分析即可。
A.溶液升温后,蔗糖的溶解度会增大,杯中未溶的蔗糖会继续溶解,而溶剂的质量不变,因此溶质的质量分数会变大,故A正确;
B.降温时,蔗糖溶液的溶解度会减小,会有更多的蔗糖析出,溶质质量减小,而溶剂的质量不变,因此溶质的质量分数会变小,故B错误;
C.现在蔗糖溶液已经饱和,再加入蔗糖也不会溶解,因此溶质质量分数保持不变,故C错误;
D.搅拌不能使饱和溶液的溶质质量增大,因此溶质质量分数不变,故D错误。
故选A。【来源:21·世纪·教育·网】
6.D
【解析】根据饱和溶液中蒸发等量溶剂析出等量固体及溶解度定义分析。
A、 a溶液蒸发10克水析出1克物质,形成b饱和溶液,再蒸发掉10克水,析出5克固体,说明a一定是不饱和溶液 ,不符合题意;
B、c、b、 d溶液都是 20℃ 时甲的饱和溶液,溶质质量分数相等 ,不符合题意;
C、饱和溶液中蒸发10克水会析出5克甲,则n=5,不符合题意;
D、 20℃饱和溶液中蒸发10克水会析出5克甲,则20℃甲在水中的溶解度为50克 ,符合题意;
故选D。
7.B
【解析】根据溶液中存在自由移动的离子时可以导电分析。
A、 氯化钠固体中离子不能自由移动,不能导电 ,不符合题意;
B、氢氧化钠溶液中存在自由移动的离子,可以导电,不符合题意;
C、蔗糖溶液中存在的是分子,不可以导电,不符合题意;
D、酒精由分子构成,不可以导电,不符合题意;
故选B。
8.C
【解析】结晶方法一般为两种,一种是蒸发结晶,一种是降温结晶。蒸发结晶一般是指蒸发溶剂,使溶液由不饱和变为饱和,继续蒸发,过剩的溶质就会呈晶体析出的方法。降温结晶一般是指先加热溶液,蒸发溶剂成饱和溶液,此时降低热饱和溶液的温度,溶解度随温度变化较大的溶质就会呈晶体析出的方法。观察溶解度曲线,溶解度随温度升高而升高得很明显时,这个溶质叫陡升型,反之叫缓升型。当陡升型溶液中混有缓升型时,若要分离出陡升型的溶质,可以用降温结晶的方法分离,若要分离出缓升型的溶质,可以用蒸发结晶的方法。
根据盐的溶解度曲线可知其为缓升型曲线。因此,分离盐易用蒸发结晶的方法,即蒸发溶剂的方法;故C正确;AD都有提到降温结晶,故AD错误;氯化钠的溶解度随温度变化较小,故B错误。
故答案为:C。
9.B
【解析】此题考查的是赤潮形成的原因.在人类活动的影响下,排放含氮、磷等营养物质的工业废水和生活污水大量进入海湾等缓流水体,引起藻类及其他浮游生物迅速繁殖,水体溶解氧量下降,水质恶化,鱼类及其他生物大量死亡的现象.据此作答.
解:水华是水体富营养化的一种特征.水体富营养化是在人类活动的影响下,为生物所需的氮、磷等营养物质大量进入湖泊、河口、海湾等缓流水体,引起藻类及其他浮游生物迅速繁殖,水体溶解氧量下降,水质恶化,鱼类及其他生物大量死亡的现象.综上所述,湖水温度升高是引起藻类大量繁殖的主要因素的叙述是不正确的
故选:B
10.A
【解析】A、根据天平及量筒的使用要求分析;
B、根据配制一定质量分数溶液的操作步骤分析;
C、根据溶液的均一性分析;
D、根据溶质质量=溶液质量×溶质质量分数分析。
用天平称量固体药品时,药品应放在左盘,砝码放在右盘,图中操作错误;量取液体读数时视线应与液体凹液面的最低处相平,仰视读数会导致所量取水的体积偏大,图中操作错误,A正确。用固体配制一定溶质质量分数的溶液的步骤为:计算、称量、量取、溶解、装瓶,无蒸发步骤,B错误。若所有操作都正确,完全溶解后有液滴溅出,溶质的质量分数不受影响,C错误。所需氯化钠固体的质量为50g×15%=7.5g,D错误。
11.A
【解析】A、60℃时的一杯硝酸钾溶液降温至20℃,结果有晶体析出,原溶液可能接近饱和,也可能不饱和,故A错;
B、由于降温后有晶体析出,故20℃时的溶液一定是饱和溶液,故B正确;
C、60℃的硝酸钾溶液降温至20℃,有晶体析出,说明硝酸钾的溶解度随温度降低而减小,故C正确;
D、根据硝酸钾溶解度的变化特点,要得到硝酸钾的晶体可采用降温结晶的方法,故D正确;
故选A.
利用硝酸钾的溶解度随温度降低而减小的知识结合过程解决此题.60℃时的一杯硝酸钾溶液降温至20℃,结果有少量晶体析出,原溶液可能接近饱和,也可能不饱和;由于降温后有晶体析出,故20℃时的溶液是否饱和获得硝酸钾的晶体可采用降温结晶的方法得到.【出处:21教育名师】
12.D
【解析】根据温度不变,氯化钠的溶解度不变,相同温度下的饱和溶液溶质质量分数不变,不饱和溶液蒸发溶剂时溶质质量分数增加,达到饱和后,蒸发溶剂,溶质质量分数不变分析。
A. ①→②→③为恒温蒸发过程, 在①→③变化过程中,因温度不变,食盐的溶解度保持不变,不符合题意;
B. 在②→③变化过程中,溶剂的质量因蒸发而不断减少 ,不符合题意;
C. ③与④溶液为不同温度下的饱和溶液,溶质与溶剂的比值不可能相同 ,不符合题意;
D. 在①→④变化过程中,①→②中食盐的质量分数一直不断增大 ,②→③溶质质量分数可能增大可能不变, ③→④ 中溶质质量分数增大,符合题意;
故答案为:D。
13.C
【解析】根据图示可知,M点为饱和溶液,M点为不饱和溶液,通过改变条件,改变温度时析出晶体,浓度减小,变成不饱和溶液,浓度不变,N点蒸发溶剂浓度增加,达到饱和浓度不变分析。
A.饱和溶液浓度可利用溶解度/100+溶解度计算,饱和溶液溶质质量分数随温度升高而增大,说明溶解度随温度升高而增大, 都升温10℃后,溶液都变成不饱和溶液,M、N点均水平向右移,不符合题意;
B. 都降温10℃后,M点溶液析出晶体,沿曲线向左下移,N点向左平移 ,不符合题意;
C. 恒温下加水稀释,M、N点均竖直下移 ,符合题意;
D. 恒温下蒸发溶剂,M点仍是该温度下的饱和溶液,浓度不变,该点不动,N点对应溶液随水分蒸发,浓度变大,当达到饱和时,保持不变,该点先向上移至曲线再不动 ,不符合题意;
故答案为:C。
14.B
【解析】根据已知条件分别计算出10℃时甲的溶解度和30℃时乙的溶解度,然后根据二者的溶解度随温度变化的规律对20℃时的溶解度大小进行分析即可。
10℃时,20g水中最多溶解5g甲,那么100g水中最多溶解25g甲,即甲的溶解度为25g。因为甲的溶解度随温度的升高而增大,所以20℃时甲的溶解度肯定大于25g;
30℃时,乙物质的饱和溶液中溶质的质量分数为20%,设此时乙的溶解度为x,
;
解得:x=25g;
因为乙物质的溶解度随温度的升高而增大,所以20℃时乙的溶解度肯定小于25g。
那么20℃时两种物质的溶解度S甲>S乙。
故选B。【来源:21cnj*y.co*m】
15.D
【解析】根据溶液的均一性和稳定性可知,从某物质的不饱和溶液所分成三等份溶液是一模一样的.由题意可得,将其分别蒸发掉10g水,而析出ag晶体后都变成了饱和溶液;如果将其中的两份分别继续蒸发掉10g和20g溶剂(即题干中所说的蒸发20g和30g溶剂),那么它们所析出的晶体也一定会成倍数关系析出的.并且,还可以推断出将其饱和溶液蒸发掉10g溶剂时,会析出(b-a)g晶体.因此,蒸发掉20g溶剂时,会析出2(b-a)g晶体.这样即可进一步推断出c=a+2(b-a)=2b-a。
根据溶液的均一性、稳定性,以及不饱和溶液蒸发掉多余的水后,就会变成饱和溶液;如果继续蒸发水,就会有晶体析出的原理,并结合题意可得:
将其中的任意一份该物质的不饱和溶液蒸发掉10g水就会析出ag晶体,并且,将其中的另两份分别继续蒸发掉10g和20g溶剂(即题干中所说的蒸发20g和30g溶剂),那么它们又析出的(b-a)g和2(b-a)g晶体;致使它们析出晶体总质量分别是bg[即ag+(b-a)g]和cg[即ag+2(b-a)g]。因此,可以得出c=a+2(b-a)=2b-a。
故选D
16.(1)重度缺水
(2)82
【解析】我国水资源总储量约2.81万立方米,居世界第六位,但人均水资源量不足2400立方米,仅为世界人均占水量的1/4,被列为全球13个人均水资源贫乏国家之一。全世界有60多个国家和地区严重缺水,三分之一的人口得不到安全用水。90年代初,我国476个城市中缺水城市近300个,因此人人都要从自身做起,节约水资源。
(1)我国北方人均水量约为720米/年,结合表格信息水资源紧缺程度属于重度缺水范围。
(2) 60t×1000kg/t÷2÷365=82年。
故答案为:(1)重度缺水(2)82
www-2-1-cnjy-com
17.(1)氧气
(2)水---------氧气+氢气
【解析】电解水是水在通直流电的条件下会分解产生氢气和氧气,其中与电源正极连接的电极产生氧气,与电源负极连接的电极产生氢气,产生氢气和氧气的体积之比为2:1
(1)试管2与电源正极相连,故产生的是氧气,氧气有助燃性,能使带火星的木条复燃
(2)电解水的文字表达式:
故答案为 (1)氧气 (2)21教育网
18.(1)水汽输送
(2)海陆间循环
【解析】水循环过程:是指大自然的水通过B蒸发、D植物蒸腾、C水汽输送、A降水、E地表径流、下渗、F地下径流等环节,在水圈、大气圈、岩石圈、生物圈中进行连续运动的过程,这个过程被称为水循环。
(1)图中各字母在水循环中所代表的环节是:C水汽输送。
(2)上述A、B、C、D、E、F环节构成的水循环类型为海陆间循环,因为海陆间循环又称水的大循环,在太阳辐射能的作用下,从海陆表面蒸发的水分,上升到大气中;随着大气的运动和在一定的热力条件下,水汽凝结为液态水降落至地球表面;一部分降水可被植被拦截或被植物散发,降落到地面的水可以形成地表径流。渗入地下的水一部分从表层壤中流和地下径流形式进入河道,成为河川径流的一部分;贮于地下的水,一部分上升至地表供蒸发,一部分向深层渗透,在一定的条件下溢出成为不同形式的泉水;地表水和返回地面的地下水,最终都流入海洋或蒸发到大气中。这种循环能使陆地水不断得到补充更新,使水资源得以再生。
故答案为:(1)水汽输送(2)海陆间循环
19.(1)①
(2)正
(3)混合物;②
【解析】(1)乳浊液的分散质为不溶性的小液滴。
(2)在电解水的实验中,生成氢气的体积是氧气体积的2倍,且与正极相连的试管收集氧气,与负极相连的试管收集氢气。
(3)只由一种物质组成纯净物,多种物质组成混合物。根据过滤操作的注意事项判断。
(1)①菜油是不溶于水的液体,形成乳浊液;
②醋可溶于水,形成溶液;
③蔗糖可溶于水,形成溶液;
④胡椒粉是不溶于水的固体颗粒,形成悬浊液;
⑤味精粉可溶于水,形成溶液;
⑥面粉是不溶于水的固体颗粒,形成悬浊液。
则形成乳浊液的是①。
(2)根据图甲可知,与A相连的试管生成的气体小于与B相连的试管,则A这边生成氧气,B那边生成氢气。因为与正极相连的试管生成氧气,所以A是电源的正极。
(3)将浑浊的河水过滤后只能除去其中的泥沙,此时水中存在大量的可溶性物质,因此为混合物。在过滤操作中,玻璃棒一定要抵在滤纸最厚的地方,这样过滤效果最好,且滤纸不易破损,故选②。
20.(1)不饱和
(2)不变
(3)3.6
【解析】根据溶解度曲线横、纵坐标分别表示的意义,明确曲线的趋势及其含义,理解曲线上的点所表示的意义,整合溶液的相关知识,结合设置的问题情景来解决该问题。
(1)溶解度曲线上的点,表示该温度下的饱和溶液,曲线上面的点表示该温度下的饱和溶液,且溶质有剩余,曲线下面的点,表示该温度下的不饱和溶液。A点在曲线下面,所以表示该温度下氯化钠的不饱和溶液。
(2)由溶解度曲线图可知:曲线向上倾斜,说明该物质的溶解度随温度的升高而增大。将B点所示的溶液升高温度到40℃(忽略水的蒸发),该物质的溶解度增大,此时溶液中溶质质量不变,溶剂质量也不变,所以溶质质量分数不变。
(3)由图可知:20℃时氯化钠的溶解度为36.0g,即20℃时100g水溶解36g氯化钠得到饱和溶液,所以若将满足B点的饱和溶液恒温蒸发10g水,按比例会析出溶质质量为3.6g。
故答案为:(1)不饱和;(2)不变;(3)3.6
21.(1)50%
(2)C
(3)160
【解析】(1)根据溶质质量=溶液质量-溶剂质量计算出A点时的溶质质量,再根据计算出此时的溶质质量分数。
(2)将溶液质量与饱和时的溶液质量进行比较,二者一致的就是饱和溶液,否则,就是不饱和溶液。
(3)相同温度下,同种物质的溶解度相同,即饱和溶液的溶质质量分数相同,据此列式计算即可。
(1)A点时溶液质量为100g,此时溶质质量为:100g-50g=50g,则溶质质量分数为:。
(2)如下图所示,C点时的溶液质量小于60℃时饱和溶液的质量,即C点时的溶质质量小于饱和时的溶质质量,因此C属于不饱和溶液。
(3)40℃时,溶液质量为130g,则溶质质量为:130g-50g=80g;
设该温度下物质的溶解度为x,
;
解得:x=160g。
22.(1)不饱和
(2)丙丁
(3)50
【解析】(1)根据图片确定溶液饱和后蒸发10g水析出的晶体质量,据此判断乙溶液是否饱和;(2)溶质质量分数=;
(3)相同温度下,同种物质的溶解度相同,即饱和溶液的溶质质量分数相等,据此分析计算。
(1)丙中出现析出的晶体,则丙为饱和溶液,那么硝酸钾饱和溶液蒸发10g水会析出5g晶体。乙蒸发10g水只析出3g晶体,可见乙为不饱和溶液。
(2)甲和乙中溶质质量相等,而溶剂质量减小,根据“溶质质量分数=”可知,溶质质量分数甲<乙;
丙和丁中都出现晶体,则丙和丁为相同温度下硝酸钾的饱和溶液,那么二者溶质质量分数相等。
(3)t℃时,硝酸钾的饱和溶液蒸发10g水析出晶体5g,
设它的溶解度为x,
;
解得:x=50g。
23.(1)4;36
(2)8%
(3)28%
【解析】根据溶质的质量分数= ×100%,溶质质量=溶液质量×溶质的质量分数,溶剂质量=溶液质量﹣溶质质量,溶液稀释前后,溶质的质量不变,结合题意进行分析解答.
解:(1)40g质量分数为10%的硝酸钠溶液中含溶质的质量为:40g×10%=4g,溶剂质量=溶液质量﹣溶质质量,则所需水的质量=40g﹣4g=36g;(2)向上述溶液中加入10g水,所得溶液质量分数为: ×100%=8%;(3)向上述溶液中加入10g硝酸钠,完全溶解后,所得溶液溶质质量分数为: ×100%=28%.21*cnjy*com
故答案为:(1)4,36;(2)8%;(3)28%.
24.(1)B
(2)①②③
(3)解:m质=50g×6%=3g
m液=3g÷12%=25g
m水=50g-25g=25g
v水=m÷ρ=25g÷1g/cm3
=25cm3=25mL
【解析】(1)用天平称量药品时,砝码应该放在右盘,药品防止左盘;
(2)溶质质量分数偏小,可能原因有两个:①溶质质量偏小;②溶剂质量偏大;
(3)首先根据溶质质量=溶液质量×质量分数计算出6%的溶液中氯化钠的质量,然后再根据溶液质量=溶质质量÷质量分数计算出12%的溶液质量,而前后两个溶液的质量之差就是需要加水的质量,最后根据密度公式计算加水的体积。
(1) 图中一处明显错误的操作是砝码和药品放反了,故选B;
(2)①氯化钠固体不纯,那么溶质的质量偏小,故①符合题意;
②称量时,砝码端忘垫质量相同的纸片,那么称出的溶质质量偏小,故②符合题意;
③量取水时,仰视读数,那么读出的示数比实际体积偏小,即实际量取的水体积偏大,故③不合题意;
④装瓶时,有少量溶液洒出,不会影响溶质的质量分数,故④不合题意。
故选①②③。
(3) m质=50g×6%=3g;
m液=3g÷12%=25g;
m水=50g-25g=25g;
v水=m÷ρ=25g÷1g/cm3 =25cm3=25mL。
25.(1)25
(2)84.8%
(3)Na2CO3+2HCl═2NaCl+H2O+CO2↑
73 44
y 8.8g
y=14.6g
所用稀盐酸的溶质质量分数=
【解析】(1)据图可以看出,所取样品的质量为25g,故填:25;
根据图示,生成的二氧化碳的质量为:25g+100g﹣116.2g=8.8g,设碳酸钠的质量为x,消耗的盐酸的质量为y21·世纪*教育网
Na2CO3+2HCl═2NaCl+H2O+CO2↑
106 73 44
x y 8.8g
x=21.2g y=14.6g
(2)样品中碳酸钠的质量分数==84.8%,故填:84.8%;
(3)所用稀盐酸的溶质质量分数=.
根据图示可以确定所取样品的总质量,根据图示可以看出,当加入盐酸100g时碳酸钠全部反应,据此结合反应的化学方程式计算即可.
26.(1)②
(2)A
(3)33.3%;ABCD;AC
【解析】(1)氯化钠的含量越高,相同质量的盐水得到的盐越多,据此分析;
(2)根据氯化钠的溶解度随温度的变化规律选择合适的结晶方法;
(3)①首先将50g与40℃时硫酸镁的溶解度比较,确定溶液是否饱和,然后根据溶质质量分数=计算;使不包含溶液变成饱和溶液的方法:①蒸发溶剂;②增加溶质;③改变温度从而改变溶解度;
②a.微溶: 0.01~1g ;可溶: 1g~10g; 易溶:>10g;
b.将40g与10℃时氯化钾和氯化镁的溶解度进行比较;
c.浓度的大小与溶质质量分数有关,根据溶质质量分数=分析。
(1)因为②的氯化钠含量高,且它是经过土层过滤的,污染更小,故选②;
(2)因为氯化钠的溶解度受温度影响比较小,所以用蒸发结晶的方法从海水中提取食盐,故选A。
(3)①40℃时,硫酸镁的溶解度大于50g,所以在该温度下将50g硫酸镁加到100g水中,完全溶解后,所得溶液的溶质质量分数为 ×100%≈33.3%。
40℃时,硫酸镁的溶解度最大,若升温或降温,溶解度都会变小,所以可以采取升温或降温的方法使之转化为饱和溶液,也可以通过加溶质或蒸发溶剂的方法使之达到饱和,故选ABCD;
②由溶解度曲线可知,在20℃时,三者的溶解度均大于10g,所以均属于易溶物质,故A正确;
B.由溶解度曲线可知,10℃时氯化镁的溶解度大于40g,而氯化钾的溶解度小于40g,所以氯化钾能形成饱和溶液,而氯化镁形成不饱和溶液,故B错误;
C.60℃时,在三者都是不饱和溶液的情况下,只要溶质和溶剂的比值相同,那么它们的浓度就相同,故C正确。
故选AC。
27.(1)不溶性固体与液体;一些溶解的杂质和异味 (色素)
(2)防止液体暴沸;纯净物
(3)把液体加热至沸腾,产生的蒸气经冷却形成液体的方法。
【解析】(1)根据过滤操作原理及活性炭的吸附性分析;
(2)根据蒸馏时碎瓷片是防止液体暴沸及一种物质组成的为纯净物分析;
(3)根据蒸馏原理分析。
(1)过滤时将不溶性固体与液体进行分离的一种方法,活性炭具有吸附性,可除去水中 一些溶解的杂质和异味 ;
(2)蒸馏时加入碎瓷片,是为了防止液体暴沸,蒸馏水只一种物质组成,属于纯净物;
(3)蒸馏是把液体加热至沸腾,产生的蒸气经冷却形成液体的方法。
故答案为:(1)不溶性固体与液体;一些溶解的杂质和异味 (色素);(2)防止液体暴沸;纯净物;(3)把液体加热至沸腾,产生的蒸气经冷却形成液体的方法。
28.(1)溶液密度越大,溶质质量分数越大
(2)有的物质溶解度随温度变化显著,有的物质随温度变化不显著(温度变化相同时,这两种物质溶解度变化不同)
(3)碳酸钠
(4)不变
【解析】1、2两题可以通过看图得出结论,第三题可以根据结晶的方法来解答;第四题需要根据饱和溶液的概念来解题。
1、由表一我们可以看到溶液密度越大,溶质质量分数越大;
2、由表二可得出物质溶解度随温度变化的不同规律是:氯化钠的溶解度随温度变化不大,而碳酸钠的溶解度随温度变化较大;
3、因为碳酸钠的溶解度随温度升高而增大,而氯化钠的溶解度受温度影响较小,因此冬天气温较低,析出的是碳酸钠晶体;
4、往饱和的氯化钠溶液中加入氯化钠,氯化钠不再继续溶解,所以溶液的密度不变,弹簧秤的示数将不变。
29.(1)③②①⑤④
(2)B
(3)过滤
(4)①②③
【解析】(1)配制一定溶质质量分数的溶液时,先称量药品,再称取水,最后进行搅拌溶解,据此确定操作顺序。
(2)在进行定量的称量时,右盘的砝码和游码不能改变,只能通过调整左盘药品的质量实现天平平衡,
(3)过滤操作用于分离液体和不溶于液体的固态物质;
(4)根据“溶质质量分数=”可知,溶质质量分数偏小,要么是溶质的质量偏小,要么是溶剂的质量偏大,据此分析判断。
(1)该实验的操作步骤为:
③从试剂瓶中取出氯化钠;
②用天平称取规定质量的氯化钠;
①将称取到的氯化钠倒入烧杯中备用;
⑤用量筒量取规定体积的水,并倒入烧杯;
④用玻璃棒不断搅拌,直到完全溶解。
则正确顺序为:③②①⑤④。
(2)用托盘天平称取所需氯化钠时,发现天平指针偏向左盘,说明左盘氯化钠的质量偏大,应该适当减小氯化钠固体的质量,故选B。
(3)操作②用于将含有泥沙的混合液分离为泥沙和溶液,因此名称为过滤。
(4)①氯化钠固体仍然不纯,其中含有杂质,那么实际得到的溶质质量偏小,故①符合题意; ②称量时,砝码端忘垫质量相同的纸片,那么实际得到的氯化钠的质量等于右盘砝码的质量减去纸片的质量,即溶质质量偏小,故②符合题意;
③量取水时,仰视读数,根据“俯视大仰视小”的规律可知,读出的示数偏小,而实际得到水的体积偏大,故③符合题意;
④装瓶时,有少量溶液洒出,由于溶液具有均一性,因此不会影响溶质质量分数,故④不合题意。
故选①②③。
30..解:A夏季与冬季相比,气温较高,氧气的溶解度随温度升高而减小,故夏季湖水里的溶解氧较少,有鱼在水面“吹气泡”(呼吸); B夏季下雷阵雨天气与晴天相比,气压较低,氧气的溶解度随气压减小而减小,故夏季雷阵雨天气,湖水里的溶解氧会更少,会有更多的鱼浮出水面呼吸。
【解析】(1)气体在水中的溶解度受温度与气压的影响,温度越高溶解度越小,气压越小溶解度越小,反之越大;(2)鱼在水中依靠水中的溶解氧进行呼吸。
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
HYPERLINK "http://21世纪教育网(www.21cnjy.com)
" 21世纪教育网(www.21cnjy.com)
【备考2024】浙江省中考科学一轮复习专项练习12:水与溶液
一、单选题
1.从一杯蔗糖溶液的上部取一些溶液,测得它的密度为a克/厘米3,再从下部取一些溶液,测得它的密度为( )
A.大于a克/厘米3 B.小于a克/厘米3
C.等于a克/厘米3 D.无法判断
2. “恒大冰泉”是来自长白山的天然矿泉水,判断“恒大冰泉”属于溶液的依据是( )
①无色 ②混合物 ③化合物 ④均一性 ⑤稳定性.
A.①②④ B.②④⑤ C.①③⑤ D.③④⑤
3.从10 g质量分数为10%的硝酸钾溶液中取出5 g,那么剩下的5 g硝酸钾溶液的质量分数为( )
A.1% B.90% C.10% D.11.1%
4.下列关于水资源的叙述,正确的是( )
A.通常所说的水资源是指陆地上的所有水体
B.冰川分布于两极和高山地区,是目前可供人类利用的最重要的水资源之一
C.目前你用的淡水资源,主要是指河流水、湖泊淡水河浅层地下水
D.水资源开发利用后,都能很快恢复
5.如图表示一杯刚配制的饱和蔗糖溶液,要增加该溶液的溶质质量分数,下列操作正确的是( )
A.升温 B.降温 C.加糖 D.搅拌
6.如图是对20℃一定质量的甲的溶液进行恒温蒸发的结晶实验过程,下列判断正确的是( )
A.a溶液可能是饱和溶液
B.d溶液的溶质质量分数大于a、b、c溶液
C.“n”的值是6
D.20℃甲在水中的溶解度为50克
7.如图所示,要使其灯泡发光,需在广口瓶中加入以下哪种物质( )
A.氯化钠固体 B.氢氧化钠溶液
C.蔗糖溶液 D.酒精
8.海水晒盐是利用下列哪种方法结出晶体的( )
A.冷却热饱和溶液 B.升温使其溶解度下降
C.蒸发溶剂 D.降温使其溶解度下降
9.对湖泊出现的“水华”现象,下列叙述不正确的是( )
A.生活污水不经处理排入湖泊,容易引发藻类过度繁殖
B.湖水温度升高是引起藻类大量繁殖的主要因素
C.藻类植物过度繁殖,会破坏湖泊原有生态系统
D.藻类植物过度繁殖可导致鱼虾死亡
10.某同学需要配制50g质量分数为15%的氯化钠溶液,步骤如图所示,下列分析正确的是( )
A.配制过程中出现了两处操作错误
B.实验操作步骤为:计算、称量、量取、蒸发
C.若所有操作都正确,完全溶解后有液滴溅出,会导致溶质的质量分数偏小
D.配制时应称量氯化钠固体的质量为7.0g
11. 将60℃的硝酸钾溶液降温至20℃,有晶体析出.有关该过程的说法错误的是( )
A.60℃时的溶液一定是硝酸钾饱和溶液
B.20 摄氏度时的溶液一定是硝酸钾的饱和溶液
C.硝酸钾的溶解度随温度降低而减小
D.硝酸钾的晶体可采用降温结晶的方法得到
12.如图所示为蒸发食盐溶液的实验过程,其中①→②→③为恒温蒸发过程,③→④为升温蒸发过程,分析实验过程,可以作出如下判断,其中错误的是( ) 21·cn·jy·com
A.在①→③变化过程中,食盐的溶解度保持不变
B.在②→③变化过程中,溶剂的质量不断减少
C.③与④溶液中,溶质与溶剂的比值不可能相同
D.在①→④变化过程中,食盐的质量分数一直不断增大
13.如图为某固体饱和溶液浓度随温度变化的曲线。该固体从溶液中析出时不会带结晶水。M、N两点分别表示该固体形成的两份溶液在不同温度时的对应的浓度值。当条件改变时,M、N两点的位置可能也随之变化,其中判断错误的是( ) 21om
A.都升温10℃后,M、N点均水平向右移
B.都降温10℃后,M点沿曲线向左下移,N点向左平移
C.恒温下加水稀释,M、N点均不动
D.恒温下蒸发溶剂,M点不动,N点先向上移至曲线再不动
14.已知甲、乙两种物质的溶解度(S甲、S乙)均随着温度的升高而增大.10℃时,20克水中最多能溶解5克甲;30℃时,乙物质的饱和溶液中溶质的质量分数为20%,那么,在20℃时进行比较,正确的是( )
A.S甲=S乙 B.S甲>S乙 C.S甲<S乙 D.无法确定
15.t℃时,将一定量的某物质的溶液分成三等份,分别加热,再降温到t℃。已知从三份溶液中蒸发掉的溶剂分别为10克、20克、30克,析出的晶体分别为a克、b克、c克,则“a、b、c三者关系为 ( )
A.c=a+b B.c=a+2b C.c=2a+b D.c=2b-a
二、填空题
16.水是重要的自然资源,水资源不足,将严重影响人类的生存,请结合下表回答问题。
水资源紧缺程度 轻度缺水 中度缺水 重度缺水 极度缺水
人均水量(米/年) 1700~3000 1000~1700 500 ~ 1000 <500
(1)我国北方人均水量约为720米/年,水资源紧缺程度为 。
(2)研究表明 :1节含汞、镉、铅等金属的干电池所造成的污染,可使60吨水无法饮用。若成年人每人每天饮水约2千克,则60吨水可供1个人饮用约 年。
17.小刚利用下图所示的装置探究水的组成。
(1)通电一段时间后,试管2中所收集的气体为 ,能使带火星木条复燃.
(2)电解水属于化学变化,反应的文字表达式 ;
18.根据以下“水循环示意图”填空:
(1)图中各字母在水循环中所代表的环节是:C 。
(2)上述A、B、C、D、E、F环节构成的水循环类型为 ,这种循环能使陆地水不断得到补充更新,使水资源得以再生。
19.学习科学以后,我们对水有了更全面的认识。关于“水”回答下列问题:
(1)将少量①菜油、②醋、③蔗糖、④胡椒粉、⑤味精粉、⑥面粉分别加入水中振荡,其中 形成乳浊液。(填序号)
(2)下图甲为电解水的装置图,图中 A 端接的是电源的 极。(填“正”或“负”)
(3)将浑浊的河水用下图乙所示的装置进行净化,净化后得到的清澈的水是 (填“纯净物”或“混合物”)。在该装置中,其漏斗中滤纸的放置方向应为 (填序号)。
20.如图所示为氯化钠的溶解度曲线,请回答下列问题:
(1)A点所示溶液为某温度下氯化钠的 (填“饱和”或“不饱和”)溶液。
(2)将B点所示的溶液升高温度到40℃(忽略水的蒸发).此时溶液中溶质的质量分数将 (填“变大“、”变小”或“不变”)。
(3)B点代表20℃时氯化钠的溶解度为36.0克,若将满足B点的溶液恒温蒸发10克水,则会有 克氯化钠晶体析出。
21.将80gM物质加入50g水中,充分溶解,测得溶液的质量随温度的变化曲线如图所示,按要求填空。(该物质的溶解度与温度的升高而增大)
(1)A点时,该溶液的溶质质量分数为 。
(2)A,B,C三点所对应的溶液,属于不饱和溶液的是 (填字母)。
(3)在40℃时,M物质的溶解度为 g。
22.t℃时,100g某硝酸钾溶液在恒温条件下经过如图所示的变化。
(1)甲烧杯中的溶液是 溶液(选填“饱和”或“不饱和”)。
(2)甲、乙、丙、丁四个烧杯中溶液的溶质质量分数一定相等的是 。
(3)t℃时该物质的溶解度为 g。
三、解答题
23.现有40g质量分数为10%的硝酸钠溶液,回答下列问题:
(1)上述溶液中溶质质量为 g,溶剂质量为 g,
(2)向上述溶液中加入10g水,所得溶液质量分数为
(3)向上述溶液中加入10g硝酸钠,完全溶解后,所得溶液溶质质量分数 .
24.农业生产上常需要用质量分数为12%的氯化钠溶液选种。下图是小军实验操作过程示
意图:
(1)图中一处明显错误的操作是 (填序号)
(2)改进图一中的错误操作后.经检测,所配制溶液的溶质质量分数偏小,其原因可能是 (填序号)。
21cnjy.com
①氯化钠固体不纯 ②称量时,砝码端忘垫质量相同的纸片
③量取水时,仰视读数 ④装瓶时,有少量溶液洒出
(3)现用质量分数为12%的氯化钠溶液,配制50克质量分数为6%的氯化钠溶液。需要 水多少毫升(水的密度为1克/立方厘米)。
2-1-c-n-j-y
25.为测定某纯碱样品(含少量硫酸钠杂质)中碳酸钠的质量分数,某化学兴趣小组进行以下实验.取一定质量的样品放置于烧杯中.向烧杯中滴加一定溶质质量分数的稀盐酸,实验测得烧杯中物质的总质量与加入稀盐酸的质量的关系如图所示.求:
(1)所取样品的质量是 g.
(2)样品中碳酸钠的质量分数是 (%).
(3)所用稀盐酸的溶质质量分数(写出具体的计算过程).
26.宁波地处东南沿海,有着丰富的海洋资源,请思考下列问题:
(1)已知宁波某盐场测得:①海水中含氯化钠约为3.5%;②在海边打深井,井水中含氯化钠约为8%。晒盐最好用 (填序号)作原料。
(2)关于晒盐原理的说法正确的是____。
A.利用阳光和风力,使水分蒸发,析出盐
B.日光照晒后,氯化钠的溶解度变小
(3)海水晒盐提取食盐晶体后留下的母液叫卤水,其中含有的氯化钾(KCl)、氯化镁(MgCl2)、硫酸镁(MgSO4)等物质可作为重要的化工原料,它们的溶解度曲线如图所示。
①40℃时,将50g硫酸镁加入100g水中,充分搅拌,所得溶液的溶质质量分数为 (结果精确到0.1%)。若使其形成饱和溶液,可采取的措施有 。
A.增加溶质 B.蒸发溶剂
C.升高温度 D.降低温度
②关于卤水中含有的氯化钾(KCl)、氯化镁(MgCl2)、硫酸镁(MgSO4)三种物质,下列说法正确的是 。
A.三种物质均为易溶物质
B.10℃时,向40g氯化钾(KCl)固体和40g氯化镁(MgCl2)固体中分别加入100g水充分溶解后,两种溶液均能达到饱和状态
C.60℃时,三种物质溶于水形成的溶液浓度可能相等
四、实验探究题
27.人类的生活和工农业生产都离不开水,如图流程可以对自然界的水进行净化操作,最终制得蒸馏水。请回答下列问题:
21教育名师原创作品
(1)过滤是将 进行分离的一种方法:过滤后向滤液中加入活性炭,利用其吸附性,除去水样中的 ;
(2)到清水后,要得到蒸馏水需要进行图二的蒸馏操作,在a中加入碎瓷片,其作用是 ,从物质组成分析,蒸馏水属于 物;
(3)写出什么是“蒸馏”的分离方法 。
28.地球上物质种类千差万别,但都有一定的规律可寻:
表一:硫酸的密度和溶质质量分数对照表(20 ℃)
密度(g/cm3) 1.01 1.07 1.14 1.22 1.30 1.40 1.50 1.61 1.73 1.81 1.84
溶质质量分数(%) 1 10 20 30 40 50 60 70 80 90 98
表二:氯化钠和碳酸钠晶体的溶解度对照表(0 ℃-30 ℃)
请你分析上述两个表中的内容,并探究下列问题:
(1)由表一可得出的规律是: 。
(2)由表二可得出物质溶解度随温度变化的不同规律是: 。
(3)我国有许多盐碱湖,湖水中溶有大量的氯化钠和碳酸钠。冬天湖中有大量晶体析出,其中主要成分是 。www.21-cn-jy.com
(4)如图,烧杯内盛有饱和氯化钠溶液,弹簧秤上挂了一块与氯化钠不反应且不溶解的金属块。向氯化钠溶液中加适量氯化钠晶体,则弹簧秤的示数将(填“变大”“变小”或“不变”) 。
29.某化学实验小组的同学要配制100g质量分数为10%的氯化钠(俗称食盐,化学式为NaCl)溶液,下面是他们配制溶液的实验操作示意图,如图:
2·1·c·n·j·y
(1)该实验正确的操作顺序为 。(填序号)
(2)用托盘天平称取所需氯化钠时,发现天平指针偏向左盘,应 (填字母)
A.增加适量氯化钠固体 B.减少适量氯化钠固体 C.向右移动砝码
(3)为提高精度,某同学们对粗盐进行了提纯,请参考上图回答:以下操作中,操作②的名称是 。
(4)用提纯得到的氯化钠配制上述溶液,经检测,溶质质量分数偏小,其原因可能是 (填序号)
①氯化钠固体仍然不纯 ②称量时,砝码端忘垫质量相同的纸片
③量取水时,仰视读数 ④装瓶时,有少量溶液洒出
五、综合说理题
30.生活中经常看到这样一种现象:夏季的湖面上,许多鱼会在水面上“吹气泡”甚至跃出水面,而冬季几乎没有。在夏季出现雷阵雨前,会有更多鱼会在水面处“吹气泡”,而在夏季的晴朗天,则很少出现这样的情况。请你用学过的科学知识解释以上现象。
答案解析部分
1.C
【解析】根据溶液的特点判断。
溶液具有均一性,即溶液的各个部分的性质完全相同,因此上下两个部分的密度相等,故C正确,而A、B、D错误。
故选C。
2.B
【解析】解:“恒大冰泉”属于溶液的依据是“恒大冰泉”具有均一性、稳定性,属于混合物.无色不是判断是否属于溶液的依据,溶液不一定都是无色的,有些溶液是带有颜色的,如硫酸铜溶液是蓝色的.
故选:B.
溶液是均一、稳定的混合物;溶液的本质特征是均一性、稳定性,属于混合物,据此进行分析判断.
3.C
【解析】根据溶液的特点分析判断。
溶液具有均一性,即各个部分的性质完全相同,因此剩下5g的硝酸钾溶液的质量分数不变,还是10%。
故选C。
4.C
【解析】根据水资源的分布及现状分析,结合保护水资源的方法判断。
A、通常所说的水资源是指能被人类利用的淡水资源,不符合题意;
B、冰川分布于两极和高山地区,但是目前还不能供人类利用,目前人类利用的淡水资源,主要是河湖水和浅层地下水,仅占全球淡水资源的0.3%,不符合题意;
C、目前使用的淡水资源,主要是指河流水、湖泊淡水河浅层地下水,符合题意;
D、水资源利用后不能恢复,所以应节约用水,不符合题意;
故答案为:C。
5.A
【解析】增大溶质质量分数的方法:①增加溶质;②减小溶剂,据此分析即可。
A.溶液升温后,蔗糖的溶解度会增大,杯中未溶的蔗糖会继续溶解,而溶剂的质量不变,因此溶质的质量分数会变大,故A正确;
B.降温时,蔗糖溶液的溶解度会减小,会有更多的蔗糖析出,溶质质量减小,而溶剂的质量不变,因此溶质的质量分数会变小,故B错误;
C.现在蔗糖溶液已经饱和,再加入蔗糖也不会溶解,因此溶质质量分数保持不变,故C错误;
D.搅拌不能使饱和溶液的溶质质量增大,因此溶质质量分数不变,故D错误。
故选A。【来源:21·世纪·教育·网】
6.D
【解析】根据饱和溶液中蒸发等量溶剂析出等量固体及溶解度定义分析。
A、 a溶液蒸发10克水析出1克物质,形成b饱和溶液,再蒸发掉10克水,析出5克固体,说明a一定是不饱和溶液 ,不符合题意;
B、c、b、 d溶液都是 20℃ 时甲的饱和溶液,溶质质量分数相等 ,不符合题意;
C、饱和溶液中蒸发10克水会析出5克甲,则n=5,不符合题意;
D、 20℃饱和溶液中蒸发10克水会析出5克甲,则20℃甲在水中的溶解度为50克 ,符合题意;
故选D。
7.B
【解析】根据溶液中存在自由移动的离子时可以导电分析。
A、 氯化钠固体中离子不能自由移动,不能导电 ,不符合题意;
B、氢氧化钠溶液中存在自由移动的离子,可以导电,不符合题意;
C、蔗糖溶液中存在的是分子,不可以导电,不符合题意;
D、酒精由分子构成,不可以导电,不符合题意;
故选B。
8.C
【解析】结晶方法一般为两种,一种是蒸发结晶,一种是降温结晶。蒸发结晶一般是指蒸发溶剂,使溶液由不饱和变为饱和,继续蒸发,过剩的溶质就会呈晶体析出的方法。降温结晶一般是指先加热溶液,蒸发溶剂成饱和溶液,此时降低热饱和溶液的温度,溶解度随温度变化较大的溶质就会呈晶体析出的方法。观察溶解度曲线,溶解度随温度升高而升高得很明显时,这个溶质叫陡升型,反之叫缓升型。当陡升型溶液中混有缓升型时,若要分离出陡升型的溶质,可以用降温结晶的方法分离,若要分离出缓升型的溶质,可以用蒸发结晶的方法。
根据盐的溶解度曲线可知其为缓升型曲线。因此,分离盐易用蒸发结晶的方法,即蒸发溶剂的方法;故C正确;AD都有提到降温结晶,故AD错误;氯化钠的溶解度随温度变化较小,故B错误。
故答案为:C。
9.B
【解析】此题考查的是赤潮形成的原因.在人类活动的影响下,排放含氮、磷等营养物质的工业废水和生活污水大量进入海湾等缓流水体,引起藻类及其他浮游生物迅速繁殖,水体溶解氧量下降,水质恶化,鱼类及其他生物大量死亡的现象.据此作答.
解:水华是水体富营养化的一种特征.水体富营养化是在人类活动的影响下,为生物所需的氮、磷等营养物质大量进入湖泊、河口、海湾等缓流水体,引起藻类及其他浮游生物迅速繁殖,水体溶解氧量下降,水质恶化,鱼类及其他生物大量死亡的现象.综上所述,湖水温度升高是引起藻类大量繁殖的主要因素的叙述是不正确的
故选:B
10.A
【解析】A、根据天平及量筒的使用要求分析;
B、根据配制一定质量分数溶液的操作步骤分析;
C、根据溶液的均一性分析;
D、根据溶质质量=溶液质量×溶质质量分数分析。
用天平称量固体药品时,药品应放在左盘,砝码放在右盘,图中操作错误;量取液体读数时视线应与液体凹液面的最低处相平,仰视读数会导致所量取水的体积偏大,图中操作错误,A正确。用固体配制一定溶质质量分数的溶液的步骤为:计算、称量、量取、溶解、装瓶,无蒸发步骤,B错误。若所有操作都正确,完全溶解后有液滴溅出,溶质的质量分数不受影响,C错误。所需氯化钠固体的质量为50g×15%=7.5g,D错误。
11.A
【解析】A、60℃时的一杯硝酸钾溶液降温至20℃,结果有晶体析出,原溶液可能接近饱和,也可能不饱和,故A错;
B、由于降温后有晶体析出,故20℃时的溶液一定是饱和溶液,故B正确;
C、60℃的硝酸钾溶液降温至20℃,有晶体析出,说明硝酸钾的溶解度随温度降低而减小,故C正确;
D、根据硝酸钾溶解度的变化特点,要得到硝酸钾的晶体可采用降温结晶的方法,故D正确;
故选A.
利用硝酸钾的溶解度随温度降低而减小的知识结合过程解决此题.60℃时的一杯硝酸钾溶液降温至20℃,结果有少量晶体析出,原溶液可能接近饱和,也可能不饱和;由于降温后有晶体析出,故20℃时的溶液是否饱和获得硝酸钾的晶体可采用降温结晶的方法得到.【出处:21教育名师】
12.D
【解析】根据温度不变,氯化钠的溶解度不变,相同温度下的饱和溶液溶质质量分数不变,不饱和溶液蒸发溶剂时溶质质量分数增加,达到饱和后,蒸发溶剂,溶质质量分数不变分析。
A. ①→②→③为恒温蒸发过程, 在①→③变化过程中,因温度不变,食盐的溶解度保持不变,不符合题意;
B. 在②→③变化过程中,溶剂的质量因蒸发而不断减少 ,不符合题意;
C. ③与④溶液为不同温度下的饱和溶液,溶质与溶剂的比值不可能相同 ,不符合题意;
D. 在①→④变化过程中,①→②中食盐的质量分数一直不断增大 ,②→③溶质质量分数可能增大可能不变, ③→④ 中溶质质量分数增大,符合题意;
故答案为:D。
13.C
【解析】根据图示可知,M点为饱和溶液,M点为不饱和溶液,通过改变条件,改变温度时析出晶体,浓度减小,变成不饱和溶液,浓度不变,N点蒸发溶剂浓度增加,达到饱和浓度不变分析。
A.饱和溶液浓度可利用溶解度/100+溶解度计算,饱和溶液溶质质量分数随温度升高而增大,说明溶解度随温度升高而增大, 都升温10℃后,溶液都变成不饱和溶液,M、N点均水平向右移,不符合题意;
B. 都降温10℃后,M点溶液析出晶体,沿曲线向左下移,N点向左平移 ,不符合题意;
C. 恒温下加水稀释,M、N点均竖直下移 ,符合题意;
D. 恒温下蒸发溶剂,M点仍是该温度下的饱和溶液,浓度不变,该点不动,N点对应溶液随水分蒸发,浓度变大,当达到饱和时,保持不变,该点先向上移至曲线再不动 ,不符合题意;
故答案为:C。
14.B
【解析】根据已知条件分别计算出10℃时甲的溶解度和30℃时乙的溶解度,然后根据二者的溶解度随温度变化的规律对20℃时的溶解度大小进行分析即可。
10℃时,20g水中最多溶解5g甲,那么100g水中最多溶解25g甲,即甲的溶解度为25g。因为甲的溶解度随温度的升高而增大,所以20℃时甲的溶解度肯定大于25g;
30℃时,乙物质的饱和溶液中溶质的质量分数为20%,设此时乙的溶解度为x,
;
解得:x=25g;
因为乙物质的溶解度随温度的升高而增大,所以20℃时乙的溶解度肯定小于25g。
那么20℃时两种物质的溶解度S甲>S乙。
故选B。【来源:21cnj*y.co*m】
15.D
【解析】根据溶液的均一性和稳定性可知,从某物质的不饱和溶液所分成三等份溶液是一模一样的.由题意可得,将其分别蒸发掉10g水,而析出ag晶体后都变成了饱和溶液;如果将其中的两份分别继续蒸发掉10g和20g溶剂(即题干中所说的蒸发20g和30g溶剂),那么它们所析出的晶体也一定会成倍数关系析出的.并且,还可以推断出将其饱和溶液蒸发掉10g溶剂时,会析出(b-a)g晶体.因此,蒸发掉20g溶剂时,会析出2(b-a)g晶体.这样即可进一步推断出c=a+2(b-a)=2b-a。
根据溶液的均一性、稳定性,以及不饱和溶液蒸发掉多余的水后,就会变成饱和溶液;如果继续蒸发水,就会有晶体析出的原理,并结合题意可得:
将其中的任意一份该物质的不饱和溶液蒸发掉10g水就会析出ag晶体,并且,将其中的另两份分别继续蒸发掉10g和20g溶剂(即题干中所说的蒸发20g和30g溶剂),那么它们又析出的(b-a)g和2(b-a)g晶体;致使它们析出晶体总质量分别是bg[即ag+(b-a)g]和cg[即ag+2(b-a)g]。因此,可以得出c=a+2(b-a)=2b-a。
故选D
16.(1)重度缺水
(2)82
【解析】我国水资源总储量约2.81万立方米,居世界第六位,但人均水资源量不足2400立方米,仅为世界人均占水量的1/4,被列为全球13个人均水资源贫乏国家之一。全世界有60多个国家和地区严重缺水,三分之一的人口得不到安全用水。90年代初,我国476个城市中缺水城市近300个,因此人人都要从自身做起,节约水资源。
(1)我国北方人均水量约为720米/年,结合表格信息水资源紧缺程度属于重度缺水范围。
(2) 60t×1000kg/t÷2÷365=82年。
故答案为:(1)重度缺水(2)82
www-2-1-cnjy-com
17.(1)氧气
(2)水---------氧气+氢气
【解析】电解水是水在通直流电的条件下会分解产生氢气和氧气,其中与电源正极连接的电极产生氧气,与电源负极连接的电极产生氢气,产生氢气和氧气的体积之比为2:1
(1)试管2与电源正极相连,故产生的是氧气,氧气有助燃性,能使带火星的木条复燃
(2)电解水的文字表达式:
故答案为 (1)氧气 (2)21教育网
18.(1)水汽输送
(2)海陆间循环
【解析】水循环过程:是指大自然的水通过B蒸发、D植物蒸腾、C水汽输送、A降水、E地表径流、下渗、F地下径流等环节,在水圈、大气圈、岩石圈、生物圈中进行连续运动的过程,这个过程被称为水循环。
(1)图中各字母在水循环中所代表的环节是:C水汽输送。
(2)上述A、B、C、D、E、F环节构成的水循环类型为海陆间循环,因为海陆间循环又称水的大循环,在太阳辐射能的作用下,从海陆表面蒸发的水分,上升到大气中;随着大气的运动和在一定的热力条件下,水汽凝结为液态水降落至地球表面;一部分降水可被植被拦截或被植物散发,降落到地面的水可以形成地表径流。渗入地下的水一部分从表层壤中流和地下径流形式进入河道,成为河川径流的一部分;贮于地下的水,一部分上升至地表供蒸发,一部分向深层渗透,在一定的条件下溢出成为不同形式的泉水;地表水和返回地面的地下水,最终都流入海洋或蒸发到大气中。这种循环能使陆地水不断得到补充更新,使水资源得以再生。
故答案为:(1)水汽输送(2)海陆间循环
19.(1)①
(2)正
(3)混合物;②
【解析】(1)乳浊液的分散质为不溶性的小液滴。
(2)在电解水的实验中,生成氢气的体积是氧气体积的2倍,且与正极相连的试管收集氧气,与负极相连的试管收集氢气。
(3)只由一种物质组成纯净物,多种物质组成混合物。根据过滤操作的注意事项判断。
(1)①菜油是不溶于水的液体,形成乳浊液;
②醋可溶于水,形成溶液;
③蔗糖可溶于水,形成溶液;
④胡椒粉是不溶于水的固体颗粒,形成悬浊液;
⑤味精粉可溶于水,形成溶液;
⑥面粉是不溶于水的固体颗粒,形成悬浊液。
则形成乳浊液的是①。
(2)根据图甲可知,与A相连的试管生成的气体小于与B相连的试管,则A这边生成氧气,B那边生成氢气。因为与正极相连的试管生成氧气,所以A是电源的正极。
(3)将浑浊的河水过滤后只能除去其中的泥沙,此时水中存在大量的可溶性物质,因此为混合物。在过滤操作中,玻璃棒一定要抵在滤纸最厚的地方,这样过滤效果最好,且滤纸不易破损,故选②。
20.(1)不饱和
(2)不变
(3)3.6
【解析】根据溶解度曲线横、纵坐标分别表示的意义,明确曲线的趋势及其含义,理解曲线上的点所表示的意义,整合溶液的相关知识,结合设置的问题情景来解决该问题。
(1)溶解度曲线上的点,表示该温度下的饱和溶液,曲线上面的点表示该温度下的饱和溶液,且溶质有剩余,曲线下面的点,表示该温度下的不饱和溶液。A点在曲线下面,所以表示该温度下氯化钠的不饱和溶液。
(2)由溶解度曲线图可知:曲线向上倾斜,说明该物质的溶解度随温度的升高而增大。将B点所示的溶液升高温度到40℃(忽略水的蒸发),该物质的溶解度增大,此时溶液中溶质质量不变,溶剂质量也不变,所以溶质质量分数不变。
(3)由图可知:20℃时氯化钠的溶解度为36.0g,即20℃时100g水溶解36g氯化钠得到饱和溶液,所以若将满足B点的饱和溶液恒温蒸发10g水,按比例会析出溶质质量为3.6g。
故答案为:(1)不饱和;(2)不变;(3)3.6
21.(1)50%
(2)C
(3)160
【解析】(1)根据溶质质量=溶液质量-溶剂质量计算出A点时的溶质质量,再根据计算出此时的溶质质量分数。
(2)将溶液质量与饱和时的溶液质量进行比较,二者一致的就是饱和溶液,否则,就是不饱和溶液。
(3)相同温度下,同种物质的溶解度相同,即饱和溶液的溶质质量分数相同,据此列式计算即可。
(1)A点时溶液质量为100g,此时溶质质量为:100g-50g=50g,则溶质质量分数为:。
(2)如下图所示,C点时的溶液质量小于60℃时饱和溶液的质量,即C点时的溶质质量小于饱和时的溶质质量,因此C属于不饱和溶液。
(3)40℃时,溶液质量为130g,则溶质质量为:130g-50g=80g;
设该温度下物质的溶解度为x,
;
解得:x=160g。
22.(1)不饱和
(2)丙丁
(3)50
【解析】(1)根据图片确定溶液饱和后蒸发10g水析出的晶体质量,据此判断乙溶液是否饱和;(2)溶质质量分数=;
(3)相同温度下,同种物质的溶解度相同,即饱和溶液的溶质质量分数相等,据此分析计算。
(1)丙中出现析出的晶体,则丙为饱和溶液,那么硝酸钾饱和溶液蒸发10g水会析出5g晶体。乙蒸发10g水只析出3g晶体,可见乙为不饱和溶液。
(2)甲和乙中溶质质量相等,而溶剂质量减小,根据“溶质质量分数=”可知,溶质质量分数甲<乙;
丙和丁中都出现晶体,则丙和丁为相同温度下硝酸钾的饱和溶液,那么二者溶质质量分数相等。
(3)t℃时,硝酸钾的饱和溶液蒸发10g水析出晶体5g,
设它的溶解度为x,
;
解得:x=50g。
23.(1)4;36
(2)8%
(3)28%
【解析】根据溶质的质量分数= ×100%,溶质质量=溶液质量×溶质的质量分数,溶剂质量=溶液质量﹣溶质质量,溶液稀释前后,溶质的质量不变,结合题意进行分析解答.
解:(1)40g质量分数为10%的硝酸钠溶液中含溶质的质量为:40g×10%=4g,溶剂质量=溶液质量﹣溶质质量,则所需水的质量=40g﹣4g=36g;(2)向上述溶液中加入10g水,所得溶液质量分数为: ×100%=8%;(3)向上述溶液中加入10g硝酸钠,完全溶解后,所得溶液溶质质量分数为: ×100%=28%.21*cnjy*com
故答案为:(1)4,36;(2)8%;(3)28%.
24.(1)B
(2)①②③
(3)解:m质=50g×6%=3g
m液=3g÷12%=25g
m水=50g-25g=25g
v水=m÷ρ=25g÷1g/cm3
=25cm3=25mL
【解析】(1)用天平称量药品时,砝码应该放在右盘,药品防止左盘;
(2)溶质质量分数偏小,可能原因有两个:①溶质质量偏小;②溶剂质量偏大;
(3)首先根据溶质质量=溶液质量×质量分数计算出6%的溶液中氯化钠的质量,然后再根据溶液质量=溶质质量÷质量分数计算出12%的溶液质量,而前后两个溶液的质量之差就是需要加水的质量,最后根据密度公式计算加水的体积。
(1) 图中一处明显错误的操作是砝码和药品放反了,故选B;
(2)①氯化钠固体不纯,那么溶质的质量偏小,故①符合题意;
②称量时,砝码端忘垫质量相同的纸片,那么称出的溶质质量偏小,故②符合题意;
③量取水时,仰视读数,那么读出的示数比实际体积偏小,即实际量取的水体积偏大,故③不合题意;
④装瓶时,有少量溶液洒出,不会影响溶质的质量分数,故④不合题意。
故选①②③。
(3) m质=50g×6%=3g;
m液=3g÷12%=25g;
m水=50g-25g=25g;
v水=m÷ρ=25g÷1g/cm3 =25cm3=25mL。
25.(1)25
(2)84.8%
(3)Na2CO3+2HCl═2NaCl+H2O+CO2↑
73 44
y 8.8g
y=14.6g
所用稀盐酸的溶质质量分数=
【解析】(1)据图可以看出,所取样品的质量为25g,故填:25;
根据图示,生成的二氧化碳的质量为:25g+100g﹣116.2g=8.8g,设碳酸钠的质量为x,消耗的盐酸的质量为y21·世纪*教育网
Na2CO3+2HCl═2NaCl+H2O+CO2↑
106 73 44
x y 8.8g
x=21.2g y=14.6g
(2)样品中碳酸钠的质量分数==84.8%,故填:84.8%;
(3)所用稀盐酸的溶质质量分数=.
根据图示可以确定所取样品的总质量,根据图示可以看出,当加入盐酸100g时碳酸钠全部反应,据此结合反应的化学方程式计算即可.
26.(1)②
(2)A
(3)33.3%;ABCD;AC
【解析】(1)氯化钠的含量越高,相同质量的盐水得到的盐越多,据此分析;
(2)根据氯化钠的溶解度随温度的变化规律选择合适的结晶方法;
(3)①首先将50g与40℃时硫酸镁的溶解度比较,确定溶液是否饱和,然后根据溶质质量分数=计算;使不包含溶液变成饱和溶液的方法:①蒸发溶剂;②增加溶质;③改变温度从而改变溶解度;
②a.微溶: 0.01~1g ;可溶: 1g~10g; 易溶:>10g;
b.将40g与10℃时氯化钾和氯化镁的溶解度进行比较;
c.浓度的大小与溶质质量分数有关,根据溶质质量分数=分析。
(1)因为②的氯化钠含量高,且它是经过土层过滤的,污染更小,故选②;
(2)因为氯化钠的溶解度受温度影响比较小,所以用蒸发结晶的方法从海水中提取食盐,故选A。
(3)①40℃时,硫酸镁的溶解度大于50g,所以在该温度下将50g硫酸镁加到100g水中,完全溶解后,所得溶液的溶质质量分数为 ×100%≈33.3%。
40℃时,硫酸镁的溶解度最大,若升温或降温,溶解度都会变小,所以可以采取升温或降温的方法使之转化为饱和溶液,也可以通过加溶质或蒸发溶剂的方法使之达到饱和,故选ABCD;
②由溶解度曲线可知,在20℃时,三者的溶解度均大于10g,所以均属于易溶物质,故A正确;
B.由溶解度曲线可知,10℃时氯化镁的溶解度大于40g,而氯化钾的溶解度小于40g,所以氯化钾能形成饱和溶液,而氯化镁形成不饱和溶液,故B错误;
C.60℃时,在三者都是不饱和溶液的情况下,只要溶质和溶剂的比值相同,那么它们的浓度就相同,故C正确。
故选AC。
27.(1)不溶性固体与液体;一些溶解的杂质和异味 (色素)
(2)防止液体暴沸;纯净物
(3)把液体加热至沸腾,产生的蒸气经冷却形成液体的方法。
【解析】(1)根据过滤操作原理及活性炭的吸附性分析;
(2)根据蒸馏时碎瓷片是防止液体暴沸及一种物质组成的为纯净物分析;
(3)根据蒸馏原理分析。
(1)过滤时将不溶性固体与液体进行分离的一种方法,活性炭具有吸附性,可除去水中 一些溶解的杂质和异味 ;
(2)蒸馏时加入碎瓷片,是为了防止液体暴沸,蒸馏水只一种物质组成,属于纯净物;
(3)蒸馏是把液体加热至沸腾,产生的蒸气经冷却形成液体的方法。
故答案为:(1)不溶性固体与液体;一些溶解的杂质和异味 (色素);(2)防止液体暴沸;纯净物;(3)把液体加热至沸腾,产生的蒸气经冷却形成液体的方法。
28.(1)溶液密度越大,溶质质量分数越大
(2)有的物质溶解度随温度变化显著,有的物质随温度变化不显著(温度变化相同时,这两种物质溶解度变化不同)
(3)碳酸钠
(4)不变
【解析】1、2两题可以通过看图得出结论,第三题可以根据结晶的方法来解答;第四题需要根据饱和溶液的概念来解题。
1、由表一我们可以看到溶液密度越大,溶质质量分数越大;
2、由表二可得出物质溶解度随温度变化的不同规律是:氯化钠的溶解度随温度变化不大,而碳酸钠的溶解度随温度变化较大;
3、因为碳酸钠的溶解度随温度升高而增大,而氯化钠的溶解度受温度影响较小,因此冬天气温较低,析出的是碳酸钠晶体;
4、往饱和的氯化钠溶液中加入氯化钠,氯化钠不再继续溶解,所以溶液的密度不变,弹簧秤的示数将不变。
29.(1)③②①⑤④
(2)B
(3)过滤
(4)①②③
【解析】(1)配制一定溶质质量分数的溶液时,先称量药品,再称取水,最后进行搅拌溶解,据此确定操作顺序。
(2)在进行定量的称量时,右盘的砝码和游码不能改变,只能通过调整左盘药品的质量实现天平平衡,
(3)过滤操作用于分离液体和不溶于液体的固态物质;
(4)根据“溶质质量分数=”可知,溶质质量分数偏小,要么是溶质的质量偏小,要么是溶剂的质量偏大,据此分析判断。
(1)该实验的操作步骤为:
③从试剂瓶中取出氯化钠;
②用天平称取规定质量的氯化钠;
①将称取到的氯化钠倒入烧杯中备用;
⑤用量筒量取规定体积的水,并倒入烧杯;
④用玻璃棒不断搅拌,直到完全溶解。
则正确顺序为:③②①⑤④。
(2)用托盘天平称取所需氯化钠时,发现天平指针偏向左盘,说明左盘氯化钠的质量偏大,应该适当减小氯化钠固体的质量,故选B。
(3)操作②用于将含有泥沙的混合液分离为泥沙和溶液,因此名称为过滤。
(4)①氯化钠固体仍然不纯,其中含有杂质,那么实际得到的溶质质量偏小,故①符合题意; ②称量时,砝码端忘垫质量相同的纸片,那么实际得到的氯化钠的质量等于右盘砝码的质量减去纸片的质量,即溶质质量偏小,故②符合题意;
③量取水时,仰视读数,根据“俯视大仰视小”的规律可知,读出的示数偏小,而实际得到水的体积偏大,故③符合题意;
④装瓶时,有少量溶液洒出,由于溶液具有均一性,因此不会影响溶质质量分数,故④不合题意。
故选①②③。
30..解:A夏季与冬季相比,气温较高,氧气的溶解度随温度升高而减小,故夏季湖水里的溶解氧较少,有鱼在水面“吹气泡”(呼吸); B夏季下雷阵雨天气与晴天相比,气压较低,氧气的溶解度随气压减小而减小,故夏季雷阵雨天气,湖水里的溶解氧会更少,会有更多的鱼浮出水面呼吸。
【解析】(1)气体在水中的溶解度受温度与气压的影响,温度越高溶解度越小,气压越小溶解度越小,反之越大;(2)鱼在水中依靠水中的溶解氧进行呼吸。
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
HYPERLINK "http://21世纪教育网(www.21cnjy.com)
" 21世纪教育网(www.21cnjy.com)
同课章节目录
