人教版 高中化学 选择性必修1 3.2 水的电离和溶液的pH(共42张PPT)
文档属性
| 名称 | 人教版 高中化学 选择性必修1 3.2 水的电离和溶液的pH(共42张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 1.7MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-11-20 16:37:39 | ||
图片预览









文档简介
(共42张PPT)
汇报人:XXX
XX月XX日
第二节 水的电离和溶液的pH
人教版高中化学选择必修一
知 识 回 顾
分析HCl在水中的电离过程,写出电离方程式。
HCl = H+ + Cl-
Cl-
Cl-
Cl-
Cl-
Cl-
HCl是电解质
在水溶液中电离
强
完全
知 识 回 顾
分析CH3COOH在水中的电离过程,写出电离方程式。
CH3COOH是电解质
在水溶液中电离
弱
部分
CH3COOH H++CH3COO-
下列那幅电离示意图可以表示水的电离过程。
以分子形式存在
部分电离
完全电离
如何用实验探究水的电离过程?
OH-
OH-
OH-
OH-
OH-
OH-
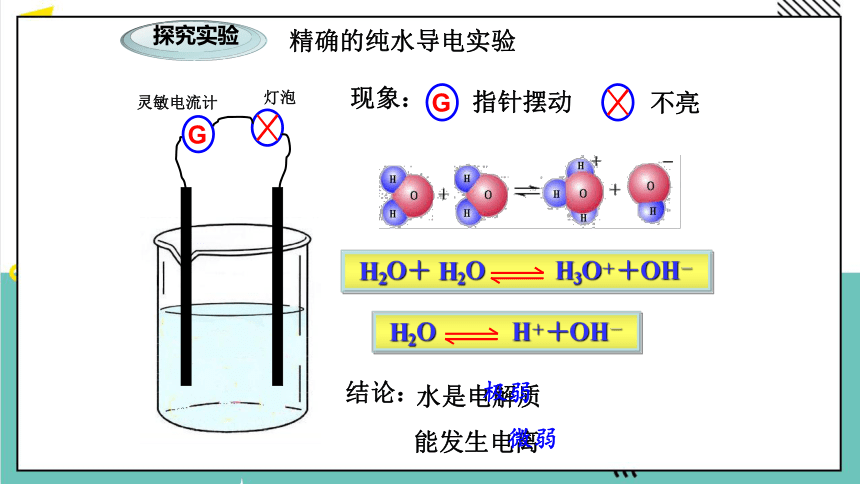
探究实验
精确的纯水导电实验
G
G
现象:
指针摆动
不亮
结论:
水是电解质
极弱
H2O+ H2O H3O++OH-
H2O H++OH-
能发生电离
微弱
灵敏电流计
灯泡
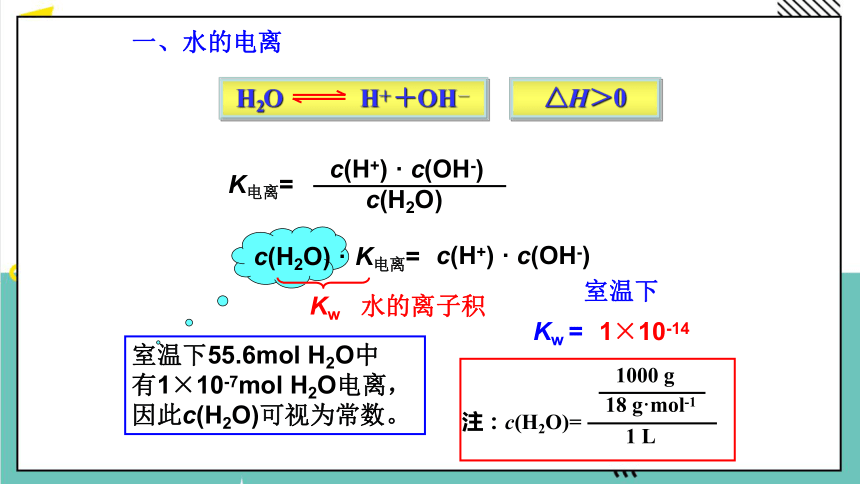
一、水的电离
H2O H++OH-
K电离=
c(H+) · c(OH-)
c(H2O)
c(H+) · c(OH-)
c(H2O) ·
K电离=
室温下55.6mol H2O中
有1×10-7mol H2O电离,
因此c(H2O)可视为常数。
Kw
水的离子积
Kw =
室温下
1×10-14
△H>0
注:c(H2O)=
1 L
1000 g
18 g·mol-1
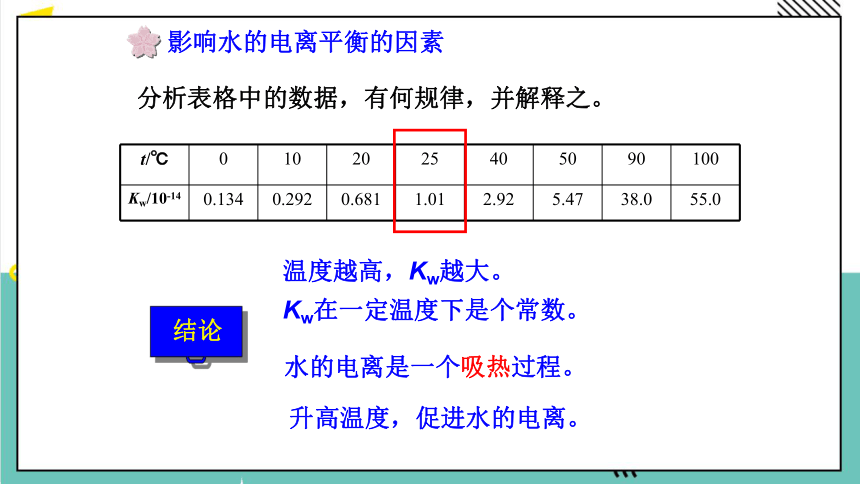
分析表格中的数据,有何规律,并解释之。
t/℃ 0 10 20 25 40 50 90 100
Kw/10-14 0.134 0.292 0.681 1.01 2.92 5.47 38.0 55.0
结论
温度越高,Kw越大。
Kw在一定温度下是个常数。
升高温度,促进水的电离。
水的电离是一个吸热过程。
影响水的电离平衡的因素
影响水的电离平衡的因素
H2O H++OH-
25℃时,在10 mL蒸馏水中c(H+) 和 c(OH-) 各是多少?
向其中加入10 mL0.2 mol/L 盐酸,c(H+) 和 c(OH-) 如
何变化?对水的电离平衡有何影响?
c(H+) c(OH-) c(H+) 和 c(OH-) 大小比较 酸碱性 平衡移动
蒸馏水
加酸后
10-7
10-7
10-1
10-13
c(H+) = c(OH-)
中性
c(H+) >c(OH-)
酸性
Kw =
加酸后
1×10-14
不变
=c(H+)水
酸溶液中Kw =
c(H+)酸·c(OH-)水
↓
↑
影响水的电离平衡的因素
H2O H++OH-
25℃时,在10 mL蒸馏水中c(H+) 和 c(OH-) 各是多少?
向其中加入10 mL0.2 mol/L 氢氧化钠,c(H+) 和 c(OH-)
如何变化?对水的电离平衡有何影响?
c(H+) c(OH-) c(H+) 和 c(OH-) 大小比较 酸碱性 平衡移动
蒸馏水
加碱后
10-7
10-7
10-1
10-13
c(H+) = c(OH-)
中性
c(H+) <c(OH-)
碱性
Kw =
加碱后
1×10-14
不变
=c(OH-)水
碱溶液中Kw =
c(H+)水·c(OH-)碱
↑
↓
小结
影响水的电离平衡的因素
1、温度
2、酸
3、碱
4、盐
升高温度促进水的电离,Kw增大
抑制水的电离,Kw保持不变
(第三节详细介绍)
c(H+)水=c(OH-)水<1×10-7 mol/L
巩固练习
(1)常温下,浓度为1×10-5 mol/L的盐酸溶液中,
由水电离产生的c(H+)是多少?
解:
酸溶液中Kw =
c(H+)酸·c(OH-)水
c(OH-)水=
c(H+)水 =
Kw
c(H+)酸
= 1×10-9 mol/L
=
1×10-14
1×10-5 mol/L
巩固练习
(2)常温下,浓度为1×10-5 mol/L的NaOH溶液中,
由水电离产生的c(OH-)是多少?
解:
碱溶液中Kw =
c(H+)水·c(OH-)碱
c(OH-)水=
c(H+)水 =
Kw
c(OH-)碱
=
1×10-14
1×10-5 mol/L
= 1×10-9 mol/L
在常温下,由水电离产生的c(H+) =1×10-9 mol/L
的溶液,则该溶液的酸碱性如何?
学 与 问
答:可能是酸性也可能是碱性
高考链接
A
(08上海卷)常温下,某溶液中由水电离出来的
c(H+)=1.0×10-13 mol/L,该溶液可能是( )
①二氧化硫 ②氯化铵水溶液
③硝酸钠水溶液 ④氢氧化钠水溶液
A.①④ B.①②
C.②③ D.③④
高考链接
√
【07北京】在由水电离产生的H+浓度为
1×10-13mol·L-1的溶液中,一定能大量共存的离子组是
① K+、Cl-、NO3-、S2-
② K+、Fe2+、I-、SO42-
③ Na+、Cl-、NO3-、SO42-
④Na+、Ca2+、Cl-、HCO3-
⑤ K+、Ba2+、Cl-、NO3-
A.①③ B.③⑤ C.③④ D.②⑤
酸性条件不能共存
碱性条件不能共存
能共存
酸、碱性条件都不能共存
能共存
二、c(H+) 和 c(OH-) 与溶液酸碱性、pH的关系
1、溶液酸碱性的表示法
(1)c(H+) 和 c(OH-)
(2)c(H+) 和 c(OH-)都较小的稀溶液(<1mol/L)
用pH表示。
pH = - lgc(H+)
例: c(H+) = 1×10-7
pH = - lg10-7 = 7
2、c(H+) 和 c(OH-) 与溶液酸碱性、pH的关系
溶液的酸碱性 c(H+) 和 c(OH-) 的关系 pH
酸性
中性
碱性
常温下
c(H+) >c(OH-)
c(H+) =c(OH-)
c(H+) <c(OH-)
>7
=7
<7
pH=7的溶液一定是中性溶液吗?
答:不一定,只有在常温下才显中性。
常温下
c(H+)与pH、溶液酸碱性的关系:
10-5
10-4
10-3
10-2
10-1
10-7
10-8
10-9
10-10
10-11
10-12
10-13
10-14
10-6
5
4
3
2
1
7
8
9
10
11
12
13
14
6
c(H+)
pH
c(H+)增大,pH减小
酸性增强
c(H+)减小,pH增大
碱性增强
c(OH-)减小
c(OH-)增大
pH的测定:
pH计(酸度计)
(2)pH试纸
注意:①不能用水润湿
②要放在玻璃片(或表面皿)上
③不是将试纸伸到溶液中
④广泛pH试纸只能读出整数
粗略测定:
(1)酸碱指示剂
甲基橙
石蕊
酚酞
酸色 碱色
红黄
红蓝
无 红
精确测定:
变色范围(pH)
3.1~4.4
5.0~8.0
8.2~10.0
了解
用法:用玻璃棒蘸溶液,点在pH试纸中央,半分钟后与比色卡比色
( 2007年高考广东卷)下列可用于测定溶液pH且精确度最高的是( )
(A)酸碱指示剂 (B)pH计
(C)精密pH试纸 (D)广泛pH试纸
高考链接
B
三、pH的应用
1、工农业生产
2、科学实验
3、人类的生活和健康
思考与交流
举例说明
4、环境保护
四、pH的简单计算
pH值计算1——单一溶液
例1:甲溶液的pH=3,乙溶液的pH=1,则甲溶液中c(H+)与乙溶液中c(H+)之比为 ( )
A.100 B. 1/100 C. 3 D. 1/3
pH相差a, c(H+)相差10a
B
例2:下列溶液在常温下酸性最强的是 ( )
A. pH=4的溶液
B. 1L 溶液里溶有22.4mL(STP)HCl的溶液
C. c(OH-)=10-12mol/L的溶液
D. c(H+)=10-3mol/L的溶液
C
例3:(1)0.1mol/L盐酸、硫酸、醋酸c(H+)、pH大小关系如何?
pH(醋酸) > pH(盐酸 ) > pH(硫酸)
c(醋酸) > c(盐酸 ) > c(硫酸)
(2) pH=1 的盐酸、硫酸、醋酸中的c(H+)及酸的物质的
量浓度关系如何?
c(H+)醋酸 < c(H+)盐酸 < c(H+)硫酸
c(H+)醋酸= c(H+)盐酸= c(H+)硫酸
解:
解:
pH值计算2——强酸的稀释
例:取1mL pH=3的硫酸溶液加水稀释到100mL,溶液的
pH变为多少?
解:
c(H+) =
pH = - lgc(H+) = - lg10-5 = 5
10-3 mol/L×10-3L
=10-5 mol/L
10-1 L
=
n(H+)
V[H2SO4(aq)]
若上述溶液加水稀释到体积为原来的1000倍,
则溶液的pH变为多少?
若稀释到体积为原来的105倍,则溶液的pH
变为多少?
102
103
pH = 6
pH = 8
pH 接近于7
7
3
pH
V水
pH值计算3——强碱的稀释
例:取 pH=11的NaOH溶液与水按1:99的体积比混合后,
溶液的pH变为多少?
解:
稀释前c(OH-) = 10-3mol/L
10-3mol/L
=10-5 mol/L
1+99
若上述溶液加水稀释到体积为原来的1000倍,
则溶液的pH变为多少?
若稀释到体积为原来的105倍,则溶液的pH
变为多少?
103
pH = 8
pH = 6
pH 接近于7
原来的102
稀释后c(OH-) =
稀释后溶液的pH =9
Kw
c(OH-)
c(H+)= =1×10-9 mol/L
11
7
pH
V水
11
7
pH
V水
3
弱酸稀释
例:pH=2的盐酸稀释10倍后pH=?
pH=2的醋酸稀释10倍后pH=?
结论:稀释10倍pH变化(增大)<1
<3
3
盐酸
醋酸
V水
3
2
pH
10倍
稀释相同倍数时
pH:
盐酸>醋酸
稀释到相同pH时
稀释的倍数:
醋酸>盐酸
pH值计算4——弱酸、弱碱的稀释
弱碱稀释
例:pH=12的NaOH溶液稀释10倍后pH=?
pH=12的氨水稀释10倍后pH=?
结论:稀释10倍pH变化(减小)<1.
>11
11
NaOH
氨水
V水
12
11
pH
10倍
稀释相同倍数时
pH:
氨水>NaOH
稀释到相同pH时
稀释的倍数:
氨水>NaOH
pH值计算4——弱酸、弱碱的稀释
小 结
酸或碱的稀释与pH的关系
强酸pH=a,加水稀释10n倍,则pH=a+n;
弱酸pH=a,加水稀释10n倍,则pH强碱pH=b,加水稀释10n倍,则pH=b-n;
弱碱pH=b,加水稀释10n倍,则pH>b-n;
酸、碱溶液无限稀释时,pH只能接近7,但酸
不能大于7,碱不能小于7;
对于浓度(或pH)相同的强酸和弱酸,稀释
相同倍数,强酸的pH变化幅度大。
(强碱、弱碱相似)
pH值计算5——强酸、强碱的混合
(1)酸过量:则c(H+)=
c(H+)V1- c(OH-)V2
V1+V2
(2)碱过量:则c(OH-)=
c(H+)= Kw/ c(OH-)
c(OH-)V2- c(H+)V1
V1+V2
取80 mL NaOH溶液加入到120mL盐酸中,所得溶液的
pH为2。如果混合前NaOH溶液和盐酸的物质的量浓度相
同,则它们的浓度是多少?
解:
(1)酸过量:则c(H+)=
c(H+)V1- c(OH-)V2
V1+V2
巩固练习
0.12c(H+)– 0.08c(OH-)
0.12+0.08
10-2 =
c(H+)= c(OH-) = 0.05moL/L
(2004年全国) 若1体积硫酸恰好与10体积pH=11的
氢氧化钠溶液完全反应,则二者物质的量浓度之
比应为 ( )
A.10:1 B.5:1
C.1:1 D.1:10
高考链接
B
实 践 活 动
中和滴定
1、定义:
2、原理:
用已知物质的量的浓度的酸(或碱)
来测定未知浓度的碱(或酸)的方法。
盐酸与NaOH溶液的酸碱中和反应的原理是什么?
两者的定量关系是什么?
c(H+)V(酸)= c(OH-)V(碱)
(一元强酸和一元强碱)
巩固练习
1.10mL0.100mol/L HCl溶液与10mL0.100mol/L
NaOH溶液混合后,溶液的pH是多少?
2.20mL0.100mol/L HCl溶液与10mL0.100mol/L
NaOH溶液混合后,溶液的pH是多少?
3.10mL0.100mol/L HCl溶液与10mL0.200mol/L
NaOH溶液混合后,溶液的pH是多少?
3、实验的关键:
(1)准确测量参加反应的两种溶液的体积。
(2)准确判断中和反应是否恰好完全反应。
4、实验仪器及试剂:
仪器: 酸式滴定管、碱式滴定管、锥形瓶、铁架台、
滴定管夹、烧杯、白纸、(pH计画曲线用)。
试剂:标准液、待测液、指示剂。
甲基橙
石 蕊
酚 酞
——— 3.1 ——— 4.4 ———
酸色 中间色 碱色
红色橙色
——— 5.0 ——— 8.0 ———
——— 8.2 ——— 10.0 ———
红色紫色 蓝色
粉红色
无色
红色
黄色
滴定终点应该是恰好反应的点,而常用指示剂没有在PH等于7时变色的
如果选用指示剂去判断滴定终点误差会不会很大
5、指示剂的选择:
思考与交流
加入NaOH (ml) 0.00 10.00 15.00 18.00 19.00 19.96 20.00 20.04
21.00
溶液PH值
1.0 1.2 1.8 2.3 2.6 3.9 7.0 10.0 11.4
问题1:滴定终点消耗碱多少 PH等于多少
向20.00mL 0.100mol/L HCl中滴加0.100mol/L NaOH
溶液过程中,溶液的pH变化如下,你发现了什么
现象与规律,在实际的中和滴定中,我们需要注意
哪些方面?
问题2:滴定终点时多半滴和少半滴溶液性质发生怎样改变
PH发生怎样改变
提示:0.04mL约1滴
PH
12
10
8
6
4
2
10
20
30
40
突变范围
加入NaOH(ml)
中和滴定曲线
如果酸碱指示剂的颜色在此pH突跃范围发生明显的改变,误差很大吗
0 10 20 30 40 V(NaOH)mL
12 10 8 6 4 2
PH
颜色突变范围
中和滴定曲线
7
酚 酞
0 10 20 30 40 V(NaOH)mL
12 10 8 6 4 2
PH
颜色突变范围
中和滴定曲线
7
4.4
甲基橙
左手
右手
视线与凹液
面水平相切
滴加速度先快后慢
眼睛注视瓶内颜色变化
半分钟颜色不变
滴定管保持垂直
酸式
碱式
碱式
实 践 活 动
中和滴定的步骤
(1)检漏 (2)洗涤润洗
(3)装液 (4)赶气泡调读数
(5)取液 (6)滴定
(7)记读数 (8)算
(08全国Ⅱ卷)实验室现有3种酸碱指示剂,其pH的变色范围如下:甲基橙:3.1~4.4 石蕊:50~8.0
酚酞:8.2~10.0 用0.1000 mol/L NaOH溶液滴定未知浓度的CH3COOH溶液,反应恰好完全时,下列叙述
正确的是( )
高考链接
D
A.溶液呈中性,可选用甲基橙或酚酞作指示剂
B.溶液呈中性,只能选用石蕊作指示剂
C.溶液呈碱性,可选用甲基橙或酚酞作指示剂
D.溶液呈碱性,只能选用酚酞作指示剂
提示: CH3COONa显碱性
汇报人:XXX
XX月XX日
第二节 水的电离和溶液的pH
人教版高中化学选择必修一
知 识 回 顾
分析HCl在水中的电离过程,写出电离方程式。
HCl = H+ + Cl-
Cl-
Cl-
Cl-
Cl-
Cl-
HCl是电解质
在水溶液中电离
强
完全
知 识 回 顾
分析CH3COOH在水中的电离过程,写出电离方程式。
CH3COOH是电解质
在水溶液中电离
弱
部分
CH3COOH H++CH3COO-
下列那幅电离示意图可以表示水的电离过程。
以分子形式存在
部分电离
完全电离
如何用实验探究水的电离过程?
OH-
OH-
OH-
OH-
OH-
OH-
探究实验
精确的纯水导电实验
G
G
现象:
指针摆动
不亮
结论:
水是电解质
极弱
H2O+ H2O H3O++OH-
H2O H++OH-
能发生电离
微弱
灵敏电流计
灯泡
一、水的电离
H2O H++OH-
K电离=
c(H+) · c(OH-)
c(H2O)
c(H+) · c(OH-)
c(H2O) ·
K电离=
室温下55.6mol H2O中
有1×10-7mol H2O电离,
因此c(H2O)可视为常数。
Kw
水的离子积
Kw =
室温下
1×10-14
△H>0
注:c(H2O)=
1 L
1000 g
18 g·mol-1
分析表格中的数据,有何规律,并解释之。
t/℃ 0 10 20 25 40 50 90 100
Kw/10-14 0.134 0.292 0.681 1.01 2.92 5.47 38.0 55.0
结论
温度越高,Kw越大。
Kw在一定温度下是个常数。
升高温度,促进水的电离。
水的电离是一个吸热过程。
影响水的电离平衡的因素
影响水的电离平衡的因素
H2O H++OH-
25℃时,在10 mL蒸馏水中c(H+) 和 c(OH-) 各是多少?
向其中加入10 mL0.2 mol/L 盐酸,c(H+) 和 c(OH-) 如
何变化?对水的电离平衡有何影响?
c(H+) c(OH-) c(H+) 和 c(OH-) 大小比较 酸碱性 平衡移动
蒸馏水
加酸后
10-7
10-7
10-1
10-13
c(H+) = c(OH-)
中性
c(H+) >c(OH-)
酸性
Kw =
加酸后
1×10-14
不变
=c(H+)水
酸溶液中Kw =
c(H+)酸·c(OH-)水
↓
↑
影响水的电离平衡的因素
H2O H++OH-
25℃时,在10 mL蒸馏水中c(H+) 和 c(OH-) 各是多少?
向其中加入10 mL0.2 mol/L 氢氧化钠,c(H+) 和 c(OH-)
如何变化?对水的电离平衡有何影响?
c(H+) c(OH-) c(H+) 和 c(OH-) 大小比较 酸碱性 平衡移动
蒸馏水
加碱后
10-7
10-7
10-1
10-13
c(H+) = c(OH-)
中性
c(H+) <c(OH-)
碱性
Kw =
加碱后
1×10-14
不变
=c(OH-)水
碱溶液中Kw =
c(H+)水·c(OH-)碱
↑
↓
小结
影响水的电离平衡的因素
1、温度
2、酸
3、碱
4、盐
升高温度促进水的电离,Kw增大
抑制水的电离,Kw保持不变
(第三节详细介绍)
c(H+)水=c(OH-)水<1×10-7 mol/L
巩固练习
(1)常温下,浓度为1×10-5 mol/L的盐酸溶液中,
由水电离产生的c(H+)是多少?
解:
酸溶液中Kw =
c(H+)酸·c(OH-)水
c(OH-)水=
c(H+)水 =
Kw
c(H+)酸
= 1×10-9 mol/L
=
1×10-14
1×10-5 mol/L
巩固练习
(2)常温下,浓度为1×10-5 mol/L的NaOH溶液中,
由水电离产生的c(OH-)是多少?
解:
碱溶液中Kw =
c(H+)水·c(OH-)碱
c(OH-)水=
c(H+)水 =
Kw
c(OH-)碱
=
1×10-14
1×10-5 mol/L
= 1×10-9 mol/L
在常温下,由水电离产生的c(H+) =1×10-9 mol/L
的溶液,则该溶液的酸碱性如何?
学 与 问
答:可能是酸性也可能是碱性
高考链接
A
(08上海卷)常温下,某溶液中由水电离出来的
c(H+)=1.0×10-13 mol/L,该溶液可能是( )
①二氧化硫 ②氯化铵水溶液
③硝酸钠水溶液 ④氢氧化钠水溶液
A.①④ B.①②
C.②③ D.③④
高考链接
√
【07北京】在由水电离产生的H+浓度为
1×10-13mol·L-1的溶液中,一定能大量共存的离子组是
① K+、Cl-、NO3-、S2-
② K+、Fe2+、I-、SO42-
③ Na+、Cl-、NO3-、SO42-
④Na+、Ca2+、Cl-、HCO3-
⑤ K+、Ba2+、Cl-、NO3-
A.①③ B.③⑤ C.③④ D.②⑤
酸性条件不能共存
碱性条件不能共存
能共存
酸、碱性条件都不能共存
能共存
二、c(H+) 和 c(OH-) 与溶液酸碱性、pH的关系
1、溶液酸碱性的表示法
(1)c(H+) 和 c(OH-)
(2)c(H+) 和 c(OH-)都较小的稀溶液(<1mol/L)
用pH表示。
pH = - lgc(H+)
例: c(H+) = 1×10-7
pH = - lg10-7 = 7
2、c(H+) 和 c(OH-) 与溶液酸碱性、pH的关系
溶液的酸碱性 c(H+) 和 c(OH-) 的关系 pH
酸性
中性
碱性
常温下
c(H+) >c(OH-)
c(H+) =c(OH-)
c(H+) <c(OH-)
>7
=7
<7
pH=7的溶液一定是中性溶液吗?
答:不一定,只有在常温下才显中性。
常温下
c(H+)与pH、溶液酸碱性的关系:
10-5
10-4
10-3
10-2
10-1
10-7
10-8
10-9
10-10
10-11
10-12
10-13
10-14
10-6
5
4
3
2
1
7
8
9
10
11
12
13
14
6
c(H+)
pH
c(H+)增大,pH减小
酸性增强
c(H+)减小,pH增大
碱性增强
c(OH-)减小
c(OH-)增大
pH的测定:
pH计(酸度计)
(2)pH试纸
注意:①不能用水润湿
②要放在玻璃片(或表面皿)上
③不是将试纸伸到溶液中
④广泛pH试纸只能读出整数
粗略测定:
(1)酸碱指示剂
甲基橙
石蕊
酚酞
酸色 碱色
红黄
红蓝
无 红
精确测定:
变色范围(pH)
3.1~4.4
5.0~8.0
8.2~10.0
了解
用法:用玻璃棒蘸溶液,点在pH试纸中央,半分钟后与比色卡比色
( 2007年高考广东卷)下列可用于测定溶液pH且精确度最高的是( )
(A)酸碱指示剂 (B)pH计
(C)精密pH试纸 (D)广泛pH试纸
高考链接
B
三、pH的应用
1、工农业生产
2、科学实验
3、人类的生活和健康
思考与交流
举例说明
4、环境保护
四、pH的简单计算
pH值计算1——单一溶液
例1:甲溶液的pH=3,乙溶液的pH=1,则甲溶液中c(H+)与乙溶液中c(H+)之比为 ( )
A.100 B. 1/100 C. 3 D. 1/3
pH相差a, c(H+)相差10a
B
例2:下列溶液在常温下酸性最强的是 ( )
A. pH=4的溶液
B. 1L 溶液里溶有22.4mL(STP)HCl的溶液
C. c(OH-)=10-12mol/L的溶液
D. c(H+)=10-3mol/L的溶液
C
例3:(1)0.1mol/L盐酸、硫酸、醋酸c(H+)、pH大小关系如何?
pH(醋酸) > pH(盐酸 ) > pH(硫酸)
c(醋酸) > c(盐酸 ) > c(硫酸)
(2) pH=1 的盐酸、硫酸、醋酸中的c(H+)及酸的物质的
量浓度关系如何?
c(H+)醋酸 < c(H+)盐酸 < c(H+)硫酸
c(H+)醋酸= c(H+)盐酸= c(H+)硫酸
解:
解:
pH值计算2——强酸的稀释
例:取1mL pH=3的硫酸溶液加水稀释到100mL,溶液的
pH变为多少?
解:
c(H+) =
pH = - lgc(H+) = - lg10-5 = 5
10-3 mol/L×10-3L
=10-5 mol/L
10-1 L
=
n(H+)
V[H2SO4(aq)]
若上述溶液加水稀释到体积为原来的1000倍,
则溶液的pH变为多少?
若稀释到体积为原来的105倍,则溶液的pH
变为多少?
102
103
pH = 6
pH = 8
pH 接近于7
7
3
pH
V水
pH值计算3——强碱的稀释
例:取 pH=11的NaOH溶液与水按1:99的体积比混合后,
溶液的pH变为多少?
解:
稀释前c(OH-) = 10-3mol/L
10-3mol/L
=10-5 mol/L
1+99
若上述溶液加水稀释到体积为原来的1000倍,
则溶液的pH变为多少?
若稀释到体积为原来的105倍,则溶液的pH
变为多少?
103
pH = 8
pH = 6
pH 接近于7
原来的102
稀释后c(OH-) =
稀释后溶液的pH =9
Kw
c(OH-)
c(H+)= =1×10-9 mol/L
11
7
pH
V水
11
7
pH
V水
3
弱酸稀释
例:pH=2的盐酸稀释10倍后pH=?
pH=2的醋酸稀释10倍后pH=?
结论:稀释10倍pH变化(增大)<1
<3
3
盐酸
醋酸
V水
3
2
pH
10倍
稀释相同倍数时
pH:
盐酸>醋酸
稀释到相同pH时
稀释的倍数:
醋酸>盐酸
pH值计算4——弱酸、弱碱的稀释
弱碱稀释
例:pH=12的NaOH溶液稀释10倍后pH=?
pH=12的氨水稀释10倍后pH=?
结论:稀释10倍pH变化(减小)<1.
>11
11
NaOH
氨水
V水
12
11
pH
10倍
稀释相同倍数时
pH:
氨水>NaOH
稀释到相同pH时
稀释的倍数:
氨水>NaOH
pH值计算4——弱酸、弱碱的稀释
小 结
酸或碱的稀释与pH的关系
强酸pH=a,加水稀释10n倍,则pH=a+n;
弱酸pH=a,加水稀释10n倍,则pH
弱碱pH=b,加水稀释10n倍,则pH>b-n;
酸、碱溶液无限稀释时,pH只能接近7,但酸
不能大于7,碱不能小于7;
对于浓度(或pH)相同的强酸和弱酸,稀释
相同倍数,强酸的pH变化幅度大。
(强碱、弱碱相似)
pH值计算5——强酸、强碱的混合
(1)酸过量:则c(H+)=
c(H+)V1- c(OH-)V2
V1+V2
(2)碱过量:则c(OH-)=
c(H+)= Kw/ c(OH-)
c(OH-)V2- c(H+)V1
V1+V2
取80 mL NaOH溶液加入到120mL盐酸中,所得溶液的
pH为2。如果混合前NaOH溶液和盐酸的物质的量浓度相
同,则它们的浓度是多少?
解:
(1)酸过量:则c(H+)=
c(H+)V1- c(OH-)V2
V1+V2
巩固练习
0.12c(H+)– 0.08c(OH-)
0.12+0.08
10-2 =
c(H+)= c(OH-) = 0.05moL/L
(2004年全国) 若1体积硫酸恰好与10体积pH=11的
氢氧化钠溶液完全反应,则二者物质的量浓度之
比应为 ( )
A.10:1 B.5:1
C.1:1 D.1:10
高考链接
B
实 践 活 动
中和滴定
1、定义:
2、原理:
用已知物质的量的浓度的酸(或碱)
来测定未知浓度的碱(或酸)的方法。
盐酸与NaOH溶液的酸碱中和反应的原理是什么?
两者的定量关系是什么?
c(H+)V(酸)= c(OH-)V(碱)
(一元强酸和一元强碱)
巩固练习
1.10mL0.100mol/L HCl溶液与10mL0.100mol/L
NaOH溶液混合后,溶液的pH是多少?
2.20mL0.100mol/L HCl溶液与10mL0.100mol/L
NaOH溶液混合后,溶液的pH是多少?
3.10mL0.100mol/L HCl溶液与10mL0.200mol/L
NaOH溶液混合后,溶液的pH是多少?
3、实验的关键:
(1)准确测量参加反应的两种溶液的体积。
(2)准确判断中和反应是否恰好完全反应。
4、实验仪器及试剂:
仪器: 酸式滴定管、碱式滴定管、锥形瓶、铁架台、
滴定管夹、烧杯、白纸、(pH计画曲线用)。
试剂:标准液、待测液、指示剂。
甲基橙
石 蕊
酚 酞
——— 3.1 ——— 4.4 ———
酸色 中间色 碱色
红色橙色
——— 5.0 ——— 8.0 ———
——— 8.2 ——— 10.0 ———
红色紫色 蓝色
粉红色
无色
红色
黄色
滴定终点应该是恰好反应的点,而常用指示剂没有在PH等于7时变色的
如果选用指示剂去判断滴定终点误差会不会很大
5、指示剂的选择:
思考与交流
加入NaOH (ml) 0.00 10.00 15.00 18.00 19.00 19.96 20.00 20.04
21.00
溶液PH值
1.0 1.2 1.8 2.3 2.6 3.9 7.0 10.0 11.4
问题1:滴定终点消耗碱多少 PH等于多少
向20.00mL 0.100mol/L HCl中滴加0.100mol/L NaOH
溶液过程中,溶液的pH变化如下,你发现了什么
现象与规律,在实际的中和滴定中,我们需要注意
哪些方面?
问题2:滴定终点时多半滴和少半滴溶液性质发生怎样改变
PH发生怎样改变
提示:0.04mL约1滴
PH
12
10
8
6
4
2
10
20
30
40
突变范围
加入NaOH(ml)
中和滴定曲线
如果酸碱指示剂的颜色在此pH突跃范围发生明显的改变,误差很大吗
0 10 20 30 40 V(NaOH)mL
12 10 8 6 4 2
PH
颜色突变范围
中和滴定曲线
7
酚 酞
0 10 20 30 40 V(NaOH)mL
12 10 8 6 4 2
PH
颜色突变范围
中和滴定曲线
7
4.4
甲基橙
左手
右手
视线与凹液
面水平相切
滴加速度先快后慢
眼睛注视瓶内颜色变化
半分钟颜色不变
滴定管保持垂直
酸式
碱式
碱式
实 践 活 动
中和滴定的步骤
(1)检漏 (2)洗涤润洗
(3)装液 (4)赶气泡调读数
(5)取液 (6)滴定
(7)记读数 (8)算
(08全国Ⅱ卷)实验室现有3种酸碱指示剂,其pH的变色范围如下:甲基橙:3.1~4.4 石蕊:50~8.0
酚酞:8.2~10.0 用0.1000 mol/L NaOH溶液滴定未知浓度的CH3COOH溶液,反应恰好完全时,下列叙述
正确的是( )
高考链接
D
A.溶液呈中性,可选用甲基橙或酚酞作指示剂
B.溶液呈中性,只能选用石蕊作指示剂
C.溶液呈碱性,可选用甲基橙或酚酞作指示剂
D.溶液呈碱性,只能选用酚酞作指示剂
提示: CH3COONa显碱性
