人教版 高中化学 选择性必修1 4.3金属的腐蚀和防护(共39张PPT)
文档属性
| 名称 | 人教版 高中化学 选择性必修1 4.3金属的腐蚀和防护(共39张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 1.7MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-11-20 16:38:24 | ||
图片预览








文档简介
(共39张PPT)
汇报人:XXX
XX月XX日
第三节 金属的腐蚀与防护
人教版高中化学选择必修一
知识铺垫
必备知识
正误判断
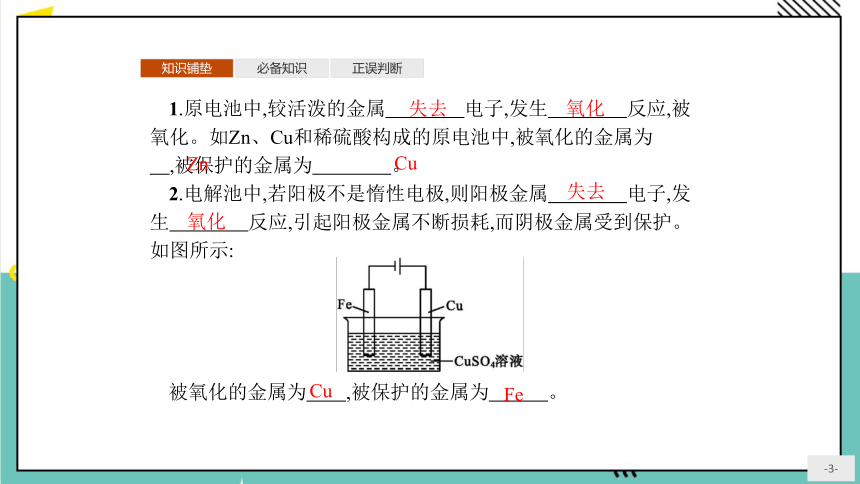
1.原电池中,较活泼的金属 电子,发生 反应,被氧化。如Zn、Cu和稀硫酸构成的原电池中,被氧化的金属为 ,被保护的金属为 。
2.电解池中,若阳极不是惰性电极,则阳极金属 电子,发生 反应,引起阳极金属不断损耗,而阴极金属受到保护。如图所示:
被氧化的金属为 ,被保护的金属为 。
失去
氧化
Zn
Cu
失去
氧化
Cu
Fe
知识铺垫
必备知识
正误判断
一、金属的腐蚀
1.定义
金属或合金与周围的 发生 而引起损耗的现象。
2.本质
金属原子 电子变为 离子,金属发生 反应。
3.分类
(1)化学腐蚀:金属与其表面接触的一些物质(如O2、Cl2、SO2等)直接反应而引起的腐蚀。
(2)电化学腐蚀:当不纯的金属与电解质溶液接触时会发生原电池反应,比较活泼的金属发生氧化反应而被腐蚀。
气体或液体
氧化还原反应
失去
阳
氧化
知识铺垫
必备知识
正误判断
【微思考1】在潮湿空气中,钢铁制品表面会形成一层水膜,空气中的哪些气体会溶解在其中形成电解质溶液
提示:CO2、SO2、H2S等气体。
知识铺垫
必备知识
正误判断
4.钢铁的电化学腐蚀
(1)钢铁的电化学腐蚀的分类:
知识铺垫
必备知识
正误判断
(2)钢铁的析氢腐蚀和吸氧腐蚀比较:
酸性较强
中性
酸性很弱
2H++2e-== H2↑
O2+2H2O+4e-== 4OH-
Fe+2H+== Fe2++H2↑
2Fe+2H2O+O2== 2Fe(OH)2
4.3金属的腐蚀与防护课件【新教材】人教版(2019)高中化学选择性必修一(共38张PPT)
4.3金属的腐蚀与防护课件【新教材】人教版(2019)高中化学选择性必修一(共38张PPT)
知识铺垫
必备知识
正误判断
【微思考2】在钢铁的锈蚀过程中,Fe(OH)2如何变为Fe2O3·xH2O
提示:氢氧化亚铁进一步被空气中的氧气氧化为氢氧化铁,氢氧化铁再失去部分水生成Fe2O3·xH2O。
4.3金属的腐蚀与防护课件【新教材】人教版(2019)高中化学选择性必修一(共38张PPT)
4.3金属的腐蚀与防护课件【新教材】人教版(2019)高中化学选择性必修一(共38张PPT)
知识铺垫
必备知识
正误判断
二、金属的防护
1.改变金属材料的组成
铬
镍
抗腐蚀
生物兼容
4.3金属的腐蚀与防护课件【新教材】人教版(2019)高中化学选择性必修一(共38张PPT)
4.3金属的腐蚀与防护课件【新教材】人教版(2019)高中化学选择性必修一(共38张PPT)
知识铺垫
必备知识
正误判断
2.在金属表面覆盖保护层
覆盖致密保护层
油漆
电镀
发蓝
四氧化三铁
阳极
钝化
4.3金属的腐蚀与防护课件【新教材】人教版(2019)高中化学选择性必修一(共38张PPT)
4.3金属的腐蚀与防护课件【新教材】人教版(2019)高中化学选择性必修一(共38张PPT)
知识铺垫
必备知识
正误判断
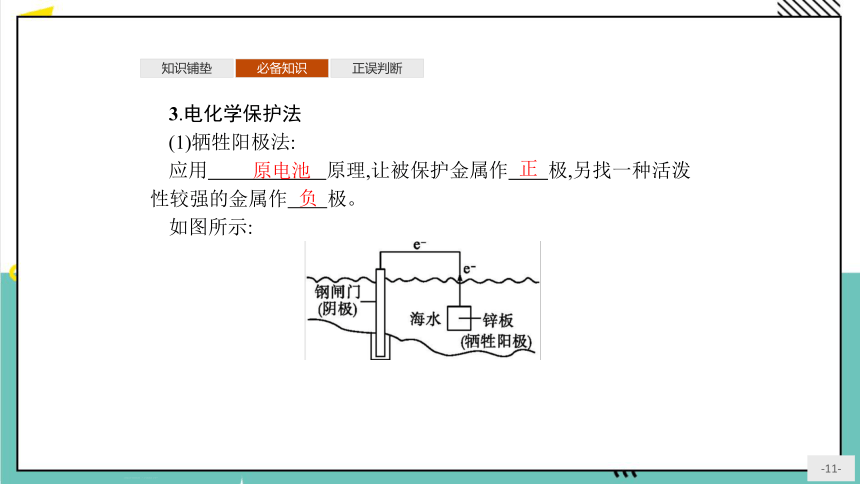
3.电化学保护法
(1)牺牲阳极法:
应用 原理,让被保护金属作 极,另找一种活泼性较强的金属作 极。
如图所示:
原电池
正
负
4.3金属的腐蚀与防护课件【新教材】人教版(2019)高中化学选择性必修一(共38张PPT)
4.3金属的腐蚀与防护课件【新教材】人教版(2019)高中化学选择性必修一(共38张PPT)
知识铺垫
必备知识
正误判断
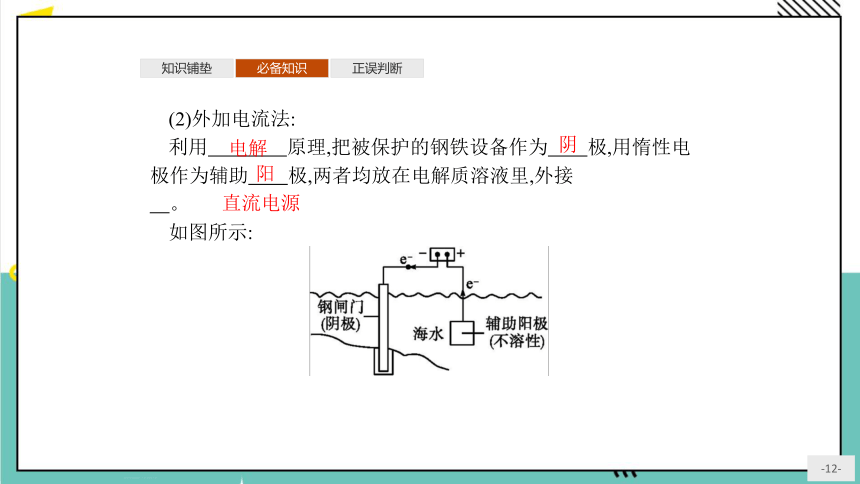
(2)外加电流法:
利用 原理,把被保护的钢铁设备作为 极,用惰性电极作为辅助 极,两者均放在电解质溶液里,外接 。
如图所示:
电解
阴
阳
直流电源
4.3金属的腐蚀与防护课件【新教材】人教版(2019)高中化学选择性必修一(共38张PPT)
4.3金属的腐蚀与防护课件【新教材】人教版(2019)高中化学选择性必修一(共38张PPT)
01
复习巩固
知识铺垫
必备知识
正误判断
【微思考3】在探究保护铁的牺牲阳极法的实验中,所用试剂K3[Fe(CN)6]溶液的作用是什么
提示:利用K3[Fe(CN)6]溶液可与Fe2+反应生成KFe[Fe(CN)6]特征蓝色沉淀,来检验溶液中是否生成了Fe2+。
4.3金属的腐蚀与防护课件【新教材】人教版(2019)高中化学选择性必修一(共38张PPT)
4.3金属的腐蚀与防护课件【新教材】人教版(2019)高中化学选择性必修一(共38张PPT)
知识铺垫
必备知识
正误判断
(1)Al、Fe、Cu在潮湿的空气中腐蚀均生成氧化物。 ( )
(2)铜在酸性较强的溶液中均可发生析氢腐蚀。 ( )
(3)钢铁发生电化学腐蚀时,负极铁失去电子生成Fe3+。 ( )
(4)纯银器表面变黑和钢铁表面生锈腐蚀原理一样。 ( )
(5)镀铜铁制品镀层受损后,铁制品比镀铜前更容易生锈。 ( )
(6)外加电流法是将被保护金属接在直流电源的正极。 ( )
(7)在船体外嵌入锌块,可以减缓船体的腐蚀,属于牺牲阴极法。 ( )
(8)在潮湿空气中,钢铁表面形成水膜,金属发生的一定是吸氧腐蚀。 ( )
答案:(1)× (2)× (3)× (4)× (5)√ (6)× (7)×
4.3金属的腐蚀与防护课件【新教材】人教版(2019)高中化学选择性必修一(共38张PPT)
4.3金属的腐蚀与防护课件【新教材】人教版(2019)高中化学选择性必修一(共38张PPT)
任务一
任务二
素养脉络
随堂检测
化学腐蚀与电化学腐蚀的比较
问题探究
1.与铜质水龙头连接处的钢质水管易生锈,为什么
2.你认为在硫酸厂附近的金属发生的主要是哪一类腐蚀
答案:铁与铜及空气中的水蒸气构成原电池,发生电化学腐蚀,增大腐蚀速率,铁作负极,易失电子,所以易生锈。
答案:析氢腐蚀;硫酸厂附近空气中的二氧化硫的含量较高,导致金属接触到的溶液酸性较强,所以易发生析氢腐蚀。
4.3金属的腐蚀与防护课件【新教材】人教版(2019)高中化学选择性必修一(共38张PPT)
4.3金属的腐蚀与防护课件【新教材】人教版(2019)高中化学选择性必修一(共38张PPT)
任务一
任务二
素养脉络
随堂检测
深化拓展
化学腐蚀与电化学腐蚀的区别与联系
4.3金属的腐蚀与防护课件【新教材】人教版(2019)高中化学选择性必修一(共38张PPT)
4.3金属的腐蚀与防护课件【新教材】人教版(2019)高中化学选择性必修一(共38张PPT)
任务一
任务二
素养脉络
随堂检测
4.3金属的腐蚀与防护课件【新教材】人教版(2019)高中化学选择性必修一(共38张PPT)
4.3金属的腐蚀与防护课件【新教材】人教版(2019)高中化学选择性必修一(共38张PPT)
任务一
任务二
素养脉络
随堂检测
素能应用
典例1下列有关金属腐蚀的说法中正确的是 ( )
A.金属腐蚀指不纯金属与接触到的电解质溶液进行化学反应而损耗的过程
B.电化学腐蚀指在外加电流的作用下不纯金属发生化学反应而损耗的过程
C.钢铁腐蚀最普遍的是吸氧腐蚀,负极吸收氧气,产物最终转化为铁锈
D.金属的电化学腐蚀和化学腐蚀本质相同,但电化学腐蚀伴有电流产生
4.3金属的腐蚀与防护课件【新教材】人教版(2019)高中化学选择性必修一(共38张PPT)
4.3金属的腐蚀与防护课件【新教材】人教版(2019)高中化学选择性必修一(共38张PPT)
任务一
任务二
素养脉络
随堂检测
答案:D
解析:金属腐蚀的本质,主要是金属原子失电子被氧化,腐蚀的内因是金属的化学性质比较活泼,外因是金属与空气、水和其他腐蚀性的物质接触,腐蚀主要包括化学腐蚀和电化学腐蚀,所以A错误;电化学腐蚀指不纯金属发生原电池反应而损耗的过程,不需要外加电流,所以B错误;钢铁腐蚀最普遍的是吸氧腐蚀,正极吸收氧气,所以C错误;只有选项D正确。
4.3金属的腐蚀与防护课件【新教材】人教版(2019)高中化学选择性必修一(共38张PPT)
4.3金属的腐蚀与防护课件【新教材】人教版(2019)高中化学选择性必修一(共38张PPT)
任务一
任务二
素养脉络
随堂检测
金属腐蚀类型的判断方法
(1)根据是否发生原电池反应来判断。
发生原电池反应引起的金属腐蚀,属于电化学腐蚀,否则属于化学腐蚀。
(2)根据金属的活动性及电解质溶液的酸性强弱判断,位于金属活动性顺序中氢前面的金属,在酸性较强的电解质溶液中发生析氢腐蚀,在中性或酸性较弱的电解质溶液中发生吸氧腐蚀;位于金属活动性顺序氢后面的金属只可能发生吸氧腐蚀。
4.3金属的腐蚀与防护课件【新教材】人教版(2019)高中化学选择性必修一(共38张PPT)
4.3金属的腐蚀与防护课件【新教材】人教版(2019)高中化学选择性必修一(共38张PPT)
任务一
任务二
素养脉络
随堂检测
变式训练1(2019江苏卷)将铁粉和活性炭的混合物用NaCl溶液湿润后,置于如图所示装置中,进行铁的电化学腐蚀实验。下列有关该实验的说法正确的是( )
A.铁被氧化的电极反应式为Fe-3e-=Fe3+
B.铁腐蚀过程中化学能全部转化为电能
C.活性炭的存在会加速铁的腐蚀
D.以水代替NaCl溶液,铁不能发生吸氧腐蚀
4.3金属的腐蚀与防护课件【新教材】人教版(2019)高中化学选择性必修一(共38张PPT)
4.3金属的腐蚀与防护课件【新教材】人教版(2019)高中化学选择性必修一(共38张PPT)
任务一
任务二
素养脉络
随堂检测
答案:C
解析:题述条件下铁粉发生了吸氧腐蚀,Fe失电子生成Fe2+,A项错误;在铁的腐蚀过程中,化学能会转换为电能和热能,B项错误;活性炭与Fe、NaCl溶液构成原电池,可加快铁的腐蚀速率,C项正确;以水代替NaCl溶液,水虽是一种弱电解质,但也能使铁发生吸氧腐蚀,只是速率会变慢,D项错误。
4.3金属的腐蚀与防护课件【新教材】人教版(2019)高中化学选择性必修一(共38张PPT)
4.3金属的腐蚀与防护课件【新教材】人教版(2019)高中化学选择性必修一(共38张PPT)
任务一
任务二
素养脉络
随堂检测
金属腐蚀快慢的判断及金属的防护
问题探究
1.镀锌铁和镀锡铁均是在铁片表面覆盖了保护层,当保护层损坏时,哪类铁腐蚀速率较大
2.在同一电解质溶液中,对于电解原理引起的腐蚀(金属作电解池的阳极)、原电池原理引起的腐蚀(金属作原电池的负极)、化学腐蚀、有防护措施的腐蚀,这些腐蚀由快到慢的顺序是怎样的
答案:镀锡铁。
答案:在同一电解质溶液中:电解原理引起的腐蚀(金属作电解池的阳极)>原电池原理引起的腐蚀(金属作原电池的负极)>化学腐蚀>有防护措施的腐蚀。
任务一
任务二
素养脉络
随堂检测
深化拓展
1.金属的防护措施
任务一
任务二
素养脉络
随堂检测
2.牺牲阳极法与外加电流法的比较
任务一
任务二
素养脉络
随堂检测
素能应用
典例2如图,各烧杯中盛有海水,铁在其中被腐蚀由快到慢的顺序为( )
A.②①③④ B.④③①②
C.④②①③ D.③②④①
答案:C
解析:②③④实质均为原电池装置。③中Fe为正极被保护;②④中Fe为负极,均被腐蚀,但相对来说,Fe和Cu的金属活动性的差别比Fe和Sn的大,故Fe-Cu原电池中Fe被腐蚀得快;①中发生化学腐蚀。
任务一
任务二
素养脉络
随堂检测
不同条件下金属腐蚀快慢的判断
(1)在同一电解质溶液中:电解原理引起的腐蚀>原电池原理引起的腐蚀>化学腐蚀>有防护措施的腐蚀。
(2)同一种金属在不同电解质溶液中腐蚀由快到慢的顺序为(其他条件相同):强电解质溶液>弱电解质溶液>非电解质溶液。
(3)无保护措施的金属腐蚀>有一定保护措施的金属腐蚀>原电池正极金属的腐蚀>电解池阴极金属腐蚀。
(4)对同一种电解质溶液来说,电解质溶液浓度越大,腐蚀一般越快。
任务一
任务二
素养脉络
随堂检测
典例3钢铁很容易生锈而被腐蚀,每年因腐蚀而损失的钢材占世界钢铁年产量的四分之一。
(1)钢铁腐蚀主要是吸氧腐蚀,该腐蚀过程中的电极反应式为 。
(2)为了减小某水库铁闸门被腐蚀的速率,可以采用图甲所示的方案,其中焊接在铁闸门上的固体材料R可以采用 (填写字母序号)。该防护方法属于 法。
A.铜 B.钠 C.锌 D.石墨
任务一
任务二
素养脉络
随堂检测
(3)图乙所示的方案也可以减小铁闸门的腐蚀速率,其中铁闸门应该连接在直流电源的 极。该防护方法称为 。
任务一
任务二
素养脉络
随堂检测
答案:(1)负极:2Fe-4e-== 2Fe2+,正极:O2+2H2O+4e-== 4OH-
(2)C 牺牲阳极 (3)负 外加电流法
解析:(1)发生吸氧腐蚀时,负极上Fe失电子,正极上O2得到电子。(2)铁闸门上连接一块比铁活泼的金属如锌,则锌会失去电子而溶解,Fe被保护,属于牺牲阳极法,Na会与水反应生成NaOH,达不到保护铁闸门的目的。(3)中防护方法属于外加电流法,需把被保护的铁闸门连接在电源的负极。
任务一
任务二
素养脉络
随堂检测
(1)判断电化学保护法的类型,应分清其基本原理,看是利用电解原理的外加电流法还是应用原电池原理的牺牲阳极法,两者不能混淆。
(2)无论是吸氧腐蚀还是析氢腐蚀,作为负极的铁都不断地被氧化。
(3)由于通常情况下,金属表面不会接触到酸性较强的溶液,所以金属腐蚀的主要形式是电化学腐蚀中的吸氧腐蚀,而且析氢腐蚀最终也会被吸氧腐蚀代替。金属活动性顺序中位于氢前和氢后的金属都能发生吸氧腐蚀,但只有在氢前的金属才会发生析氢腐蚀。
任务一
任务二
素养脉络
随堂检测
变式训练2下列有关金属腐蚀与防护的说法不正确的是( )
A.纯银器的表面在空气中因化学腐蚀渐渐变暗
B.当镀锡铁制品的镀层破损时,镀层不能对铁制品起保护作用
C.在海轮外壳连接锌块保护外壳不受腐蚀是采用了牺牲阳极法
D.可将地下输油钢管与外加直流电源的正极相连以保护它不受腐蚀
答案:D
解析:纯银器的表面在空气中易生成硫化物失去光泽,属于化学腐蚀,A项正确;当镀锡铁制品镀层破损后,由于铁比锡活泼,形成原电池时,铁作原电池的负极,加快铁的腐蚀,B项正确;锌比铁活泼,当在海轮外壳上连接锌块后,锌失电子而海轮外壳被保护,此法为牺牲阳极法,C项正确;要采用电解原理保护金属,应将金属与直流电源的负极相连,即作电解池的阴极,D项错误。
任务一
任务二
素养脉络
随堂检测
任务一
任务二
素养脉络
随堂检测
1.下列关于电化学腐蚀和化学腐蚀的说法正确的是( )
A.电化学腐蚀没有发生氧化还原反应
B.化学腐蚀发生氧化还原反应
C.电化学腐蚀没有发生化学反应,化学腐蚀发生化学反应
D.电化学腐蚀有电子转移,化学腐蚀没有电子转移
答案:B
解析:电化学腐蚀和化学腐蚀实质一样,两者都发生氧化还原反应,都是金属失电子,被氧化,但电化学腐蚀构成原电池,有电流产生,而化学腐蚀没有产生电流。
任务一
任务二
素养脉络
随堂检测
2.钢铁在潮湿的空气中往往发生电化学反应而被腐蚀,下列方程式在钢铁的电化学腐蚀过程中不存在的是( )
答案:D
解析:钢铁在潮湿的空气中可发生吸氧腐蚀,其电极反应式分别为负极:2Fe-4e-== 2Fe2+,正极:O2+4e-+2H2O== 4OH-,总反应:2Fe+2H2O+O2== 2Fe(OH)2。
任务一
任务二
素养脉络
随堂检测
3.关于右图所示装置(只是个示意图),叙述错误的是( )
A.石墨电极反应式:2H+-2e-=H2↑
B.鼓入少量空气,会加快Fe的腐蚀
C.加入少量NaCl,会加快Fe的腐蚀
D.加入HCl,石墨电极反应式:2H++2e-=H2↑
答案:A
解析:该装置中发生Fe的吸氧腐蚀,石墨电极反应式为O2+2H2O+4e-== 4OH-,A项错误。
任务一
任务二
素养脉络
随堂检测
4.(双选)下列有关金属的保护方法的说法中正确的是 ( )
A.常使用的快餐杯表面有一层搪瓷,搪瓷层破损后仍能起到防止铁生锈的作用
B.白铁(镀锌铁)镀层破损后,铁皮的腐蚀仍很慢
C.轮船的船壳水线以下常装有一些锌块,这是利用了牺牲阳极法
D.钢铁制造的暖气管道外常涂有一层沥青,这是钢铁的电化学保护法
答案:BC
解析:A项中搪瓷层破损后,铁直接暴露在空气中,因而搪瓷层不能对破损部分进行保护;B项中镀层破损后,由于锌的活动性比铁强,与铁构成原电池,锌作负极,保护铁不被腐蚀;C选项采取的是牺牲阳极法;D项中用沥青作涂层不是电化学保护法。
任务一
任务二
素养脉络
随堂检测
5.潜艇的金属外壳浸在海水中,在海水和空气的作用下会被腐蚀。
(1)若海水呈中性,一艘钢制外壳的潜艇在海水中发生腐蚀的电极反应式为:
正极: ,
负极: 。
(2)为有效地保护潜艇,下列措施中最好的是 。
A.采用纯铁制造潜艇外壳
B.在潜艇外壳上涂一层油
C.在潜艇外壳上装一定数量的锌块
答案:(1)O2+2H2O+4e-== 4OH- 2Fe-4e-== 2Fe2+ (2)C
汇报人:XXX
XX月XX日
第三节 金属的腐蚀与防护
人教版高中化学选择必修一
知识铺垫
必备知识
正误判断
1.原电池中,较活泼的金属 电子,发生 反应,被氧化。如Zn、Cu和稀硫酸构成的原电池中,被氧化的金属为 ,被保护的金属为 。
2.电解池中,若阳极不是惰性电极,则阳极金属 电子,发生 反应,引起阳极金属不断损耗,而阴极金属受到保护。如图所示:
被氧化的金属为 ,被保护的金属为 。
失去
氧化
Zn
Cu
失去
氧化
Cu
Fe
知识铺垫
必备知识
正误判断
一、金属的腐蚀
1.定义
金属或合金与周围的 发生 而引起损耗的现象。
2.本质
金属原子 电子变为 离子,金属发生 反应。
3.分类
(1)化学腐蚀:金属与其表面接触的一些物质(如O2、Cl2、SO2等)直接反应而引起的腐蚀。
(2)电化学腐蚀:当不纯的金属与电解质溶液接触时会发生原电池反应,比较活泼的金属发生氧化反应而被腐蚀。
气体或液体
氧化还原反应
失去
阳
氧化
知识铺垫
必备知识
正误判断
【微思考1】在潮湿空气中,钢铁制品表面会形成一层水膜,空气中的哪些气体会溶解在其中形成电解质溶液
提示:CO2、SO2、H2S等气体。
知识铺垫
必备知识
正误判断
4.钢铁的电化学腐蚀
(1)钢铁的电化学腐蚀的分类:
知识铺垫
必备知识
正误判断
(2)钢铁的析氢腐蚀和吸氧腐蚀比较:
酸性较强
中性
酸性很弱
2H++2e-== H2↑
O2+2H2O+4e-== 4OH-
Fe+2H+== Fe2++H2↑
2Fe+2H2O+O2== 2Fe(OH)2
4.3金属的腐蚀与防护课件【新教材】人教版(2019)高中化学选择性必修一(共38张PPT)
4.3金属的腐蚀与防护课件【新教材】人教版(2019)高中化学选择性必修一(共38张PPT)
知识铺垫
必备知识
正误判断
【微思考2】在钢铁的锈蚀过程中,Fe(OH)2如何变为Fe2O3·xH2O
提示:氢氧化亚铁进一步被空气中的氧气氧化为氢氧化铁,氢氧化铁再失去部分水生成Fe2O3·xH2O。
4.3金属的腐蚀与防护课件【新教材】人教版(2019)高中化学选择性必修一(共38张PPT)
4.3金属的腐蚀与防护课件【新教材】人教版(2019)高中化学选择性必修一(共38张PPT)
知识铺垫
必备知识
正误判断
二、金属的防护
1.改变金属材料的组成
铬
镍
抗腐蚀
生物兼容
4.3金属的腐蚀与防护课件【新教材】人教版(2019)高中化学选择性必修一(共38张PPT)
4.3金属的腐蚀与防护课件【新教材】人教版(2019)高中化学选择性必修一(共38张PPT)
知识铺垫
必备知识
正误判断
2.在金属表面覆盖保护层
覆盖致密保护层
油漆
电镀
发蓝
四氧化三铁
阳极
钝化
4.3金属的腐蚀与防护课件【新教材】人教版(2019)高中化学选择性必修一(共38张PPT)
4.3金属的腐蚀与防护课件【新教材】人教版(2019)高中化学选择性必修一(共38张PPT)
知识铺垫
必备知识
正误判断
3.电化学保护法
(1)牺牲阳极法:
应用 原理,让被保护金属作 极,另找一种活泼性较强的金属作 极。
如图所示:
原电池
正
负
4.3金属的腐蚀与防护课件【新教材】人教版(2019)高中化学选择性必修一(共38张PPT)
4.3金属的腐蚀与防护课件【新教材】人教版(2019)高中化学选择性必修一(共38张PPT)
知识铺垫
必备知识
正误判断
(2)外加电流法:
利用 原理,把被保护的钢铁设备作为 极,用惰性电极作为辅助 极,两者均放在电解质溶液里,外接 。
如图所示:
电解
阴
阳
直流电源
4.3金属的腐蚀与防护课件【新教材】人教版(2019)高中化学选择性必修一(共38张PPT)
4.3金属的腐蚀与防护课件【新教材】人教版(2019)高中化学选择性必修一(共38张PPT)
01
复习巩固
知识铺垫
必备知识
正误判断
【微思考3】在探究保护铁的牺牲阳极法的实验中,所用试剂K3[Fe(CN)6]溶液的作用是什么
提示:利用K3[Fe(CN)6]溶液可与Fe2+反应生成KFe[Fe(CN)6]特征蓝色沉淀,来检验溶液中是否生成了Fe2+。
4.3金属的腐蚀与防护课件【新教材】人教版(2019)高中化学选择性必修一(共38张PPT)
4.3金属的腐蚀与防护课件【新教材】人教版(2019)高中化学选择性必修一(共38张PPT)
知识铺垫
必备知识
正误判断
(1)Al、Fe、Cu在潮湿的空气中腐蚀均生成氧化物。 ( )
(2)铜在酸性较强的溶液中均可发生析氢腐蚀。 ( )
(3)钢铁发生电化学腐蚀时,负极铁失去电子生成Fe3+。 ( )
(4)纯银器表面变黑和钢铁表面生锈腐蚀原理一样。 ( )
(5)镀铜铁制品镀层受损后,铁制品比镀铜前更容易生锈。 ( )
(6)外加电流法是将被保护金属接在直流电源的正极。 ( )
(7)在船体外嵌入锌块,可以减缓船体的腐蚀,属于牺牲阴极法。 ( )
(8)在潮湿空气中,钢铁表面形成水膜,金属发生的一定是吸氧腐蚀。 ( )
答案:(1)× (2)× (3)× (4)× (5)√ (6)× (7)×
4.3金属的腐蚀与防护课件【新教材】人教版(2019)高中化学选择性必修一(共38张PPT)
4.3金属的腐蚀与防护课件【新教材】人教版(2019)高中化学选择性必修一(共38张PPT)
任务一
任务二
素养脉络
随堂检测
化学腐蚀与电化学腐蚀的比较
问题探究
1.与铜质水龙头连接处的钢质水管易生锈,为什么
2.你认为在硫酸厂附近的金属发生的主要是哪一类腐蚀
答案:铁与铜及空气中的水蒸气构成原电池,发生电化学腐蚀,增大腐蚀速率,铁作负极,易失电子,所以易生锈。
答案:析氢腐蚀;硫酸厂附近空气中的二氧化硫的含量较高,导致金属接触到的溶液酸性较强,所以易发生析氢腐蚀。
4.3金属的腐蚀与防护课件【新教材】人教版(2019)高中化学选择性必修一(共38张PPT)
4.3金属的腐蚀与防护课件【新教材】人教版(2019)高中化学选择性必修一(共38张PPT)
任务一
任务二
素养脉络
随堂检测
深化拓展
化学腐蚀与电化学腐蚀的区别与联系
4.3金属的腐蚀与防护课件【新教材】人教版(2019)高中化学选择性必修一(共38张PPT)
4.3金属的腐蚀与防护课件【新教材】人教版(2019)高中化学选择性必修一(共38张PPT)
任务一
任务二
素养脉络
随堂检测
4.3金属的腐蚀与防护课件【新教材】人教版(2019)高中化学选择性必修一(共38张PPT)
4.3金属的腐蚀与防护课件【新教材】人教版(2019)高中化学选择性必修一(共38张PPT)
任务一
任务二
素养脉络
随堂检测
素能应用
典例1下列有关金属腐蚀的说法中正确的是 ( )
A.金属腐蚀指不纯金属与接触到的电解质溶液进行化学反应而损耗的过程
B.电化学腐蚀指在外加电流的作用下不纯金属发生化学反应而损耗的过程
C.钢铁腐蚀最普遍的是吸氧腐蚀,负极吸收氧气,产物最终转化为铁锈
D.金属的电化学腐蚀和化学腐蚀本质相同,但电化学腐蚀伴有电流产生
4.3金属的腐蚀与防护课件【新教材】人教版(2019)高中化学选择性必修一(共38张PPT)
4.3金属的腐蚀与防护课件【新教材】人教版(2019)高中化学选择性必修一(共38张PPT)
任务一
任务二
素养脉络
随堂检测
答案:D
解析:金属腐蚀的本质,主要是金属原子失电子被氧化,腐蚀的内因是金属的化学性质比较活泼,外因是金属与空气、水和其他腐蚀性的物质接触,腐蚀主要包括化学腐蚀和电化学腐蚀,所以A错误;电化学腐蚀指不纯金属发生原电池反应而损耗的过程,不需要外加电流,所以B错误;钢铁腐蚀最普遍的是吸氧腐蚀,正极吸收氧气,所以C错误;只有选项D正确。
4.3金属的腐蚀与防护课件【新教材】人教版(2019)高中化学选择性必修一(共38张PPT)
4.3金属的腐蚀与防护课件【新教材】人教版(2019)高中化学选择性必修一(共38张PPT)
任务一
任务二
素养脉络
随堂检测
金属腐蚀类型的判断方法
(1)根据是否发生原电池反应来判断。
发生原电池反应引起的金属腐蚀,属于电化学腐蚀,否则属于化学腐蚀。
(2)根据金属的活动性及电解质溶液的酸性强弱判断,位于金属活动性顺序中氢前面的金属,在酸性较强的电解质溶液中发生析氢腐蚀,在中性或酸性较弱的电解质溶液中发生吸氧腐蚀;位于金属活动性顺序氢后面的金属只可能发生吸氧腐蚀。
4.3金属的腐蚀与防护课件【新教材】人教版(2019)高中化学选择性必修一(共38张PPT)
4.3金属的腐蚀与防护课件【新教材】人教版(2019)高中化学选择性必修一(共38张PPT)
任务一
任务二
素养脉络
随堂检测
变式训练1(2019江苏卷)将铁粉和活性炭的混合物用NaCl溶液湿润后,置于如图所示装置中,进行铁的电化学腐蚀实验。下列有关该实验的说法正确的是( )
A.铁被氧化的电极反应式为Fe-3e-=Fe3+
B.铁腐蚀过程中化学能全部转化为电能
C.活性炭的存在会加速铁的腐蚀
D.以水代替NaCl溶液,铁不能发生吸氧腐蚀
4.3金属的腐蚀与防护课件【新教材】人教版(2019)高中化学选择性必修一(共38张PPT)
4.3金属的腐蚀与防护课件【新教材】人教版(2019)高中化学选择性必修一(共38张PPT)
任务一
任务二
素养脉络
随堂检测
答案:C
解析:题述条件下铁粉发生了吸氧腐蚀,Fe失电子生成Fe2+,A项错误;在铁的腐蚀过程中,化学能会转换为电能和热能,B项错误;活性炭与Fe、NaCl溶液构成原电池,可加快铁的腐蚀速率,C项正确;以水代替NaCl溶液,水虽是一种弱电解质,但也能使铁发生吸氧腐蚀,只是速率会变慢,D项错误。
4.3金属的腐蚀与防护课件【新教材】人教版(2019)高中化学选择性必修一(共38张PPT)
4.3金属的腐蚀与防护课件【新教材】人教版(2019)高中化学选择性必修一(共38张PPT)
任务一
任务二
素养脉络
随堂检测
金属腐蚀快慢的判断及金属的防护
问题探究
1.镀锌铁和镀锡铁均是在铁片表面覆盖了保护层,当保护层损坏时,哪类铁腐蚀速率较大
2.在同一电解质溶液中,对于电解原理引起的腐蚀(金属作电解池的阳极)、原电池原理引起的腐蚀(金属作原电池的负极)、化学腐蚀、有防护措施的腐蚀,这些腐蚀由快到慢的顺序是怎样的
答案:镀锡铁。
答案:在同一电解质溶液中:电解原理引起的腐蚀(金属作电解池的阳极)>原电池原理引起的腐蚀(金属作原电池的负极)>化学腐蚀>有防护措施的腐蚀。
任务一
任务二
素养脉络
随堂检测
深化拓展
1.金属的防护措施
任务一
任务二
素养脉络
随堂检测
2.牺牲阳极法与外加电流法的比较
任务一
任务二
素养脉络
随堂检测
素能应用
典例2如图,各烧杯中盛有海水,铁在其中被腐蚀由快到慢的顺序为( )
A.②①③④ B.④③①②
C.④②①③ D.③②④①
答案:C
解析:②③④实质均为原电池装置。③中Fe为正极被保护;②④中Fe为负极,均被腐蚀,但相对来说,Fe和Cu的金属活动性的差别比Fe和Sn的大,故Fe-Cu原电池中Fe被腐蚀得快;①中发生化学腐蚀。
任务一
任务二
素养脉络
随堂检测
不同条件下金属腐蚀快慢的判断
(1)在同一电解质溶液中:电解原理引起的腐蚀>原电池原理引起的腐蚀>化学腐蚀>有防护措施的腐蚀。
(2)同一种金属在不同电解质溶液中腐蚀由快到慢的顺序为(其他条件相同):强电解质溶液>弱电解质溶液>非电解质溶液。
(3)无保护措施的金属腐蚀>有一定保护措施的金属腐蚀>原电池正极金属的腐蚀>电解池阴极金属腐蚀。
(4)对同一种电解质溶液来说,电解质溶液浓度越大,腐蚀一般越快。
任务一
任务二
素养脉络
随堂检测
典例3钢铁很容易生锈而被腐蚀,每年因腐蚀而损失的钢材占世界钢铁年产量的四分之一。
(1)钢铁腐蚀主要是吸氧腐蚀,该腐蚀过程中的电极反应式为 。
(2)为了减小某水库铁闸门被腐蚀的速率,可以采用图甲所示的方案,其中焊接在铁闸门上的固体材料R可以采用 (填写字母序号)。该防护方法属于 法。
A.铜 B.钠 C.锌 D.石墨
任务一
任务二
素养脉络
随堂检测
(3)图乙所示的方案也可以减小铁闸门的腐蚀速率,其中铁闸门应该连接在直流电源的 极。该防护方法称为 。
任务一
任务二
素养脉络
随堂检测
答案:(1)负极:2Fe-4e-== 2Fe2+,正极:O2+2H2O+4e-== 4OH-
(2)C 牺牲阳极 (3)负 外加电流法
解析:(1)发生吸氧腐蚀时,负极上Fe失电子,正极上O2得到电子。(2)铁闸门上连接一块比铁活泼的金属如锌,则锌会失去电子而溶解,Fe被保护,属于牺牲阳极法,Na会与水反应生成NaOH,达不到保护铁闸门的目的。(3)中防护方法属于外加电流法,需把被保护的铁闸门连接在电源的负极。
任务一
任务二
素养脉络
随堂检测
(1)判断电化学保护法的类型,应分清其基本原理,看是利用电解原理的外加电流法还是应用原电池原理的牺牲阳极法,两者不能混淆。
(2)无论是吸氧腐蚀还是析氢腐蚀,作为负极的铁都不断地被氧化。
(3)由于通常情况下,金属表面不会接触到酸性较强的溶液,所以金属腐蚀的主要形式是电化学腐蚀中的吸氧腐蚀,而且析氢腐蚀最终也会被吸氧腐蚀代替。金属活动性顺序中位于氢前和氢后的金属都能发生吸氧腐蚀,但只有在氢前的金属才会发生析氢腐蚀。
任务一
任务二
素养脉络
随堂检测
变式训练2下列有关金属腐蚀与防护的说法不正确的是( )
A.纯银器的表面在空气中因化学腐蚀渐渐变暗
B.当镀锡铁制品的镀层破损时,镀层不能对铁制品起保护作用
C.在海轮外壳连接锌块保护外壳不受腐蚀是采用了牺牲阳极法
D.可将地下输油钢管与外加直流电源的正极相连以保护它不受腐蚀
答案:D
解析:纯银器的表面在空气中易生成硫化物失去光泽,属于化学腐蚀,A项正确;当镀锡铁制品镀层破损后,由于铁比锡活泼,形成原电池时,铁作原电池的负极,加快铁的腐蚀,B项正确;锌比铁活泼,当在海轮外壳上连接锌块后,锌失电子而海轮外壳被保护,此法为牺牲阳极法,C项正确;要采用电解原理保护金属,应将金属与直流电源的负极相连,即作电解池的阴极,D项错误。
任务一
任务二
素养脉络
随堂检测
任务一
任务二
素养脉络
随堂检测
1.下列关于电化学腐蚀和化学腐蚀的说法正确的是( )
A.电化学腐蚀没有发生氧化还原反应
B.化学腐蚀发生氧化还原反应
C.电化学腐蚀没有发生化学反应,化学腐蚀发生化学反应
D.电化学腐蚀有电子转移,化学腐蚀没有电子转移
答案:B
解析:电化学腐蚀和化学腐蚀实质一样,两者都发生氧化还原反应,都是金属失电子,被氧化,但电化学腐蚀构成原电池,有电流产生,而化学腐蚀没有产生电流。
任务一
任务二
素养脉络
随堂检测
2.钢铁在潮湿的空气中往往发生电化学反应而被腐蚀,下列方程式在钢铁的电化学腐蚀过程中不存在的是( )
答案:D
解析:钢铁在潮湿的空气中可发生吸氧腐蚀,其电极反应式分别为负极:2Fe-4e-== 2Fe2+,正极:O2+4e-+2H2O== 4OH-,总反应:2Fe+2H2O+O2== 2Fe(OH)2。
任务一
任务二
素养脉络
随堂检测
3.关于右图所示装置(只是个示意图),叙述错误的是( )
A.石墨电极反应式:2H+-2e-=H2↑
B.鼓入少量空气,会加快Fe的腐蚀
C.加入少量NaCl,会加快Fe的腐蚀
D.加入HCl,石墨电极反应式:2H++2e-=H2↑
答案:A
解析:该装置中发生Fe的吸氧腐蚀,石墨电极反应式为O2+2H2O+4e-== 4OH-,A项错误。
任务一
任务二
素养脉络
随堂检测
4.(双选)下列有关金属的保护方法的说法中正确的是 ( )
A.常使用的快餐杯表面有一层搪瓷,搪瓷层破损后仍能起到防止铁生锈的作用
B.白铁(镀锌铁)镀层破损后,铁皮的腐蚀仍很慢
C.轮船的船壳水线以下常装有一些锌块,这是利用了牺牲阳极法
D.钢铁制造的暖气管道外常涂有一层沥青,这是钢铁的电化学保护法
答案:BC
解析:A项中搪瓷层破损后,铁直接暴露在空气中,因而搪瓷层不能对破损部分进行保护;B项中镀层破损后,由于锌的活动性比铁强,与铁构成原电池,锌作负极,保护铁不被腐蚀;C选项采取的是牺牲阳极法;D项中用沥青作涂层不是电化学保护法。
任务一
任务二
素养脉络
随堂检测
5.潜艇的金属外壳浸在海水中,在海水和空气的作用下会被腐蚀。
(1)若海水呈中性,一艘钢制外壳的潜艇在海水中发生腐蚀的电极反应式为:
正极: ,
负极: 。
(2)为有效地保护潜艇,下列措施中最好的是 。
A.采用纯铁制造潜艇外壳
B.在潜艇外壳上涂一层油
C.在潜艇外壳上装一定数量的锌块
答案:(1)O2+2H2O+4e-== 4OH- 2Fe-4e-== 2Fe2+ (2)C
