人教版 高中化学 选择性必修1 3.4 沉淀溶解平衡(共37张PPT)
文档属性
| 名称 | 人教版 高中化学 选择性必修1 3.4 沉淀溶解平衡(共37张PPT) |

|
|
| 格式 | pptx | ||
| 文件大小 | 1.6MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-11-20 00:00:00 | ||
图片预览











文档简介
(共37张PPT)
汇报人:XXX
XX月XX日
第四节 沉淀溶解平衡
人教版高中化学选择必修一
知识铺垫
必备知识
正误判断
1.固体物质的溶解度(S)与溶解性的关系:
2.浓度商Q与化学平衡常数K的关系
①Q=K时,反应达到 状态。
②Q>K时,反应向 方向进行。
③Q0.01 g
1 g
10 g
平衡
逆反应
正反应
知识铺垫
必备知识
正误判断
一、难溶电解质的沉淀溶解平衡
1.定义
在一定温度下,当沉淀 和 的速率相等时,即建立了动态平衡,叫做难溶电解质的溶解平衡。如AgCl溶于水的溶解平衡表示为: 。
2.特征
溶解
生成
不等于零
相等
保持不变
发生移动
知识铺垫
必备知识
正误判断
【微思考1】难溶电解质是否在水中一点也不溶解 难溶电解质沉淀完全的标准是什么
提示:否,尽管难溶电解质的溶解度很小,但在水中并不是绝对不溶。在一般情况下,当剩余离子的浓度小于1×10-5 mol·L-1时,化学上通常认为沉淀完全了。
知识铺垫
必备知识
正误判断
3.溶度积
(1)定义:在一定温度下,难溶强电解质MmNn溶于水形成饱和溶液时,溶质的离子与该固态物质之间建立动态平衡,这时的离子浓度幂的乘积是一个常数,叫做溶度积常数,简称溶度积。符号为Ksp。
(3)意义:溶度积Ksp反映了物质在水中的溶解能力。
(4)影响Ksp的因素:温度。
绝大多数难溶电解质的溶解是吸热过程,升高温度,向溶解方向移动,Ksp增大。少数难溶电解质的溶解是放热过程,升高温度,向生成沉淀的方向移动,Ksp减小,如Ca(OH)2。
知识铺垫
必备知识
正误判断
4.溶度积Ksp与离子积Q的关系
通过比较某温度下难溶电解质的溶度积与溶液中有关离子浓度幂的乘积——离子积Q的相对大小,可以判断难溶电解质在该温度下溶液中的沉淀或溶解情况。
(1)Q>Ksp,溶液过饱和,有沉淀析出,直至溶液饱和达到新的平衡;
(2)Q=Ksp,溶液饱和,沉淀与溶解处于平衡状态;
(3)Q知识铺垫
必备知识
正误判断
特殊说明:
(1)Ksp反映了难溶电解质在水中的溶解能力,当化学式所表示的组成中阴离子与阳离子个数分别相同时,Ksp数值越大,难溶电解质在水中的溶解能力越强。
(2)Ksp只与温度有关,有的沉淀溶解平衡是吸热的,升高温度,Ksp增大;有的沉淀溶解平衡是放热的,升高温度,Ksp减小。
知识铺垫
必备知识
正误判断
二、沉淀溶解平衡的应用
1.沉淀的生成
(1)调节pH法:
如加入氨水调节pH=4,可除去氯化铵中的杂质氯化铁。反应的离子方程式: 。
(2)加沉淀剂法:
以Na2S、H2S等作沉淀剂,使Cu2+、Hg2+等生成极难溶的硫化物CuS、HgS等沉淀。反应的离子方程式如下:
①加Na2S生成CuS: 。
②通入H2S生成CuS: 。
知识铺垫
必备知识
正误判断
2.沉淀的溶解
(1)原理:
根据平衡移动原理,对于在水中难溶的电解质,只要不断 溶解平衡体系中的相应离子,平衡就向沉淀溶解的方向移动,从而使沉淀溶解。
(2)实例:
①CaCO3沉淀溶于盐酸中:
移去
H2CO3
知识铺垫
必备知识
正误判断
CO2气体的生成和逸出,使CaCO3溶解平衡体系中的C 浓度不断减小,平衡向 的方向移动。
②Mg(OH)2沉淀溶于浓NH4Cl溶液中:
由于NH3·H2O的生成,使Mg(OH)2溶解体系中的c(OH-) ,平衡向 的方向移动。
沉淀溶解
减小
沉淀溶解
知识铺垫
必备知识
正误判断
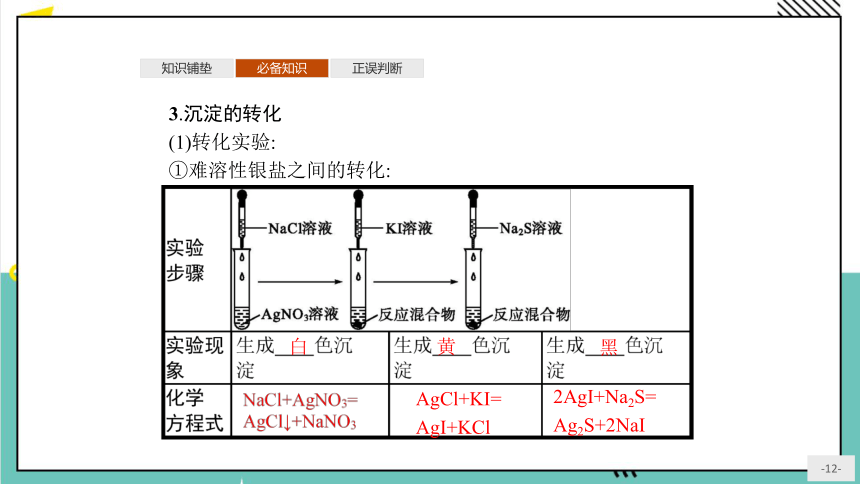
3.沉淀的转化
(1)转化实验:
①难溶性银盐之间的转化:
白
黄
黑
AgCl+KI=
AgI+KCl
2AgI+Na2S=
Ag2S+2NaI
知识铺垫
必备知识
正误判断
②Mg(OH)2与Fe(OH)3之间的转化:
产生白色沉淀
产生的白色沉淀逐渐
变为红褐色
MgCl2+2NaOH=
Mg(OH)2↓+2NaCl
3Mg(OH)2+2FeCl3=
2Fe(OH)3+3MgCl2
知识铺垫
必备知识
正误判断
(2)转化的实质:
沉淀转化的实质就是沉淀溶解平衡的移动。一般来说,溶解度小的沉淀转化成溶解度更小的沉淀容易实现,两种沉淀的溶解度差别 ,转化越容易。
(3)转化的应用:
①锅炉除水垢:
②自然界中矿物的转化:
越大
CuSO4
铜蓝(CuS)
知识铺垫
必备知识
正误判断
(1)沉淀溶解达到平衡时,溶液中溶质的离子浓度相等,且保持不变。 ( )
(2)室温下,AgCl在水中的溶解度小于在食盐水中的溶解度。 ( )
(3)BaSO4在同物质的量浓度的硫酸钠和硫酸铝溶液中的溶解度相同。 ( )
(4)升高温度,沉淀溶解平衡一定正向移动。 ( )
(5)为减少洗涤过程中固体的损耗,最好选用稀硫酸代替H2O来洗涤BaSO4沉淀。 ( )
(6)向一定量的饱和NaOH溶液中加入少量Na2O固体,恢复到原来温度时,溶液中的Na+总数不变。 ( )
答案:(1)× (2)× (3)× (4)× (5)√ (6)×
任务一
任务二
素养脉络
随堂检测
沉淀溶解平衡及其影响因素
问题探究
1.常温下,分别将AgCl溶于水和0.1 mol·L-1的NaCl溶液中,其溶解度相同吗 为什么
2.同一难溶物,其电离方程式和沉淀溶解平衡的方程式有哪些不同 (以BaSO4为例)
答案:不相同。在NaCl溶液中,Cl-的存在会使平衡AgCl(s) Ag+(aq)+Cl-(aq)逆向移动,AgCl溶解度减小。
任务一
任务二
素养脉络
随堂检测
深化拓展
沉淀溶解平衡
沉淀溶解平衡包含沉淀的溶解和溶解后的电解质的电离过程。如:
任务一
任务二
素养脉络
随堂检测
1.沉淀溶解平衡与电离平衡的比较
(1)从物质类别方面看
①难溶电解质:可以是强电解质也可以是弱电解质。
②难电离物质:只能是弱电解质。
(2)从变化的过程看
①沉淀溶解平衡:已溶解溶质与未溶解溶质之间形成的沉淀与溶解的平衡状态。
②电离平衡:溶解的弱电解质分子与离子之间的转化达到的平衡状态。
任务一
任务二
素养脉络
随堂检测
(3)沉淀溶解平衡与难溶电解质电离的比较
①平衡状态
沉淀溶解平衡指已溶溶质的离子与未溶溶质之间的平衡;
难溶电解质中:可能存在电离平衡,如Al(OH)3,可能不存在电离平衡,如BaSO4。
②表示方法
任务一
任务二
素养脉络
随堂检测
2.影响沉淀溶解平衡的因素
(1)内因:电解质本身的性质。
(2)外因:
①温度:温度升高,多数沉淀溶解平衡向溶解的方向移动;
②稀释:向溶解方向移动;
③同离子效应:加入相同离子,向生成沉淀的方向移动。
任务一
任务二
素养脉络
随堂检测
素能应用
典例1现向含AgBr的饱和溶液中:
(1)加入固体AgNO3,则c(Ag+) (填“变大”“变小”或“不变”,下同);
(2)加入更多的AgBr固体,则c(Ag+) ;
(3)加入AgCl固体,则c(Br-) ,c(Ag+) ;
(4)加入Na2S固体,则c(Br-) ,c(Ag+) 。
任务一
任务二
素养脉络
随堂检测
答案:(1)变大 (2)不变 (3)变小 变大 (4)变大
变小
解析:(1)向AgBr饱和溶液中加入AgNO3,AgBr沉淀溶解平衡逆向移动,但c(Ag+)变大。
(2)加入AgBr固体,对溶解平衡无影响,c(Ag+)不变。
(3)因AgCl溶解度大于AgBr,加入AgCl固体时,c(Ag+)变大,溶解平衡向左移动,c(Br-)变小。
(4)因Ag2S溶解度小于AgBr,加入Na2S固体时,生成Ag2S,AgBr沉淀溶解平衡向右移动,c(Br-)变大,但c(Ag+)变小。
任务一
任务二
素养脉络
随堂检测
变式训练1将足量AgCl分别放入:①5 mL水,②10 mL 0.2 mol·L-1的MgCl2溶液,③20 mL 0.5 mol·L-1的NaCl溶液,④40 mL 0.1 mol·L-1的盐酸中溶解至溶液饱和,各溶液中Ag+的浓度分别为a、b、c、d,它们由大到小的排列顺序是 。
答案:a>d>b>c
解析:AgCl在溶液中存在沉淀溶解平衡AgCl(s) Cl-(aq)+
Ag+(aq),所以氯离子浓度越大,Ag+的浓度就越小。②③④中氯离子的浓度分别是0.4 mol·L-1、0.5 mol·L-1、0.1 mol·L-1,所以各溶液中Ag+浓度的大小顺序是a>d>b>c。
任务一
任务二
素养脉络
随堂检测
沉淀溶解平衡的应用
问题探究
2.根据你现有的知识,你认为判断沉淀能否生成可从哪方面考虑 对于要除去的离子能否通过沉淀反应全部除去 请说明原因。
答案:从溶解度方面可判断沉淀能否生成;对于要除去的离子不能通过沉淀完全除去,因为不溶是相对的,沉淀物在溶液中存在溶解平衡。
任务一
任务二
素养脉络
随堂检测
深化拓展
沉淀溶解平衡应用中的一些问题
生成难溶电解质而形成沉淀,是工业生产、环保工程和科学研究中除杂质或提纯物质的重要方法之一。
(1)沉淀剂的选择:要求除去溶液中的某种离子,又不能影响其他离子的存在,并且由沉淀剂引入溶液的杂质离子还要便于除去。
(2)在遇到含有多种弱碱阳离子的混合溶液中离子分离及除杂时,往往通过改变溶液的酸碱性使离子分别沉淀而除去,过程中要注意控制形成沉淀的pH。
(3)利用生成沉淀分离或除去某种离子,首先要使生成沉淀的反应能够发生;其次沉淀生成的反应进行得越完全越好。
任务一
任务二
素养脉络
随堂检测
素能应用
典例2(1)已知在25 ℃时,Ksp[Mg(OH)2]=3.2×10-11,假设饱和Mg(OH)2溶液的密度为1 g·mL-1,试求Mg(OH)2的溶解度为 g。
(2)在25 ℃时,向0.02 mol·L-1的MgCl2溶液中加入NaOH固体,如要生成Mg(OH)2沉淀,应使溶液中的c(OH-)最小为 mol·L-1。
(3)25 ℃时,向浓度均为0.02 mol·L-1的MgCl2和CuCl2混合溶液中逐滴加入NaOH溶液,先生成 (填化学式)沉淀;当两种
{已知25 ℃时,Ksp[Cu(OH)2]=2.0×10-20}
任务一
任务二
素养脉络
随堂检测
答案:(1)1.16×10-3 (2)4×10-5 (3)Cu(OH)2 1.6×109
解析:(1)设c(Mg2+)为x,则c(OH-)为2x。由Ksp[Mg(OH)2]=3.2×10-11=c(Mg2+)·c2(OH-)=x×(2x)2=4x3,解得c(Mg2+)=2×10-4 mol·L-1,则1 L溶液中(相当于1 L水中)溶解Mg(OH)2的物质的量为2×10-4 mol,即1 000 g 水中溶解Mg(OH)2的质量为:2×10-4 mol×58 g·mol-1=1.16×10-2 g,所以Mg(OH)2的溶解度为1.16×10-3 g。
(2)当c(Mg2+)·c2(OH-)=3.2×10-11时开始生成Mg(OH)2沉淀,则
【名师示范课】沉淀溶解平衡 -PPT课件(新)部编版新高中化学选择性必修一-公开课课件(推荐)
【名师示范课】沉淀溶解平衡 -PPT课件(新)部编版新高中化学选择性必修一-公开课课件(推荐)
任务一
任务二
素养脉络
随堂检测
(1)在计算难溶电解质溶液中离子平衡浓度时不要搞错计量数关系。如x mol·L-1铬酸银(Ag2CrO4)溶液中c(Ag+)是2x mol·L-1而不是x mol·L-1。
(2)类型不同的难溶电解质的溶度积大小不能直接反映出它们的溶液中离子浓度的大小,因为它们的溶度积表达式是不同的。Ksp与S的换算没有一个统一的公式,因难溶电解质类型的不同而相异。
【名师示范课】沉淀溶解平衡 -PPT课件(新)部编版新高中化学选择性必修一-公开课课件(推荐)
【名师示范课】沉淀溶解平衡 -PPT课件(新)部编版新高中化学选择性必修一-公开课课件(推荐)
任务一
任务二
素养脉络
随堂检测
变式训练2已知:某温度时,Ksp(AgCl)=1.8×10-10,
Ksp(Ag2CrO4)=1.1×10-12。向Cl-和Cr 的浓度都为0.100 mol·L-1的混合溶液中逐滴加入AgNO3溶液(忽略体积的变化)。下列说法中正确的是( )
A.首先得到的沉淀是Ag2CrO4
B.首先得到的沉淀是AgCl
C.同时得到AgCl与Ag2CrO4沉淀
D.将Ag2CrO4转化为AgCl比将AgCl转化为Ag2CrO4要难
【名师示范课】沉淀溶解平衡 -PPT课件(新)部编版新高中化学选择性必修一-公开课课件(推荐)
【名师示范课】沉淀溶解平衡 -PPT课件(新)部编版新高中化学选择性必修一-公开课课件(推荐)
任务一
任务二
素养脉络
随堂检测
答案:B
【名师示范课】沉淀溶解平衡 -PPT课件(新)部编版新高中化学选择性必修一-公开课课件(推荐)
【名师示范课】沉淀溶解平衡 -PPT课件(新)部编版新高中化学选择性必修一-公开课课件(推荐)
任务一
任务二
素养脉络
随堂检测
【名师示范课】沉淀溶解平衡 -PPT课件(新)部编版新高中化学选择性必修一-公开课课件(推荐)
【名师示范课】沉淀溶解平衡 -PPT课件(新)部编版新高中化学选择性必修一-公开课课件(推荐)
任务一
任务二
素养脉络
随堂检测
1.下列说法中正确的是( )
A.只有易溶电解质在溶液中才存在沉淀溶解平衡
B.难溶电解质在溶液中只存在沉淀溶解平衡,不存在电离平衡
C.沉淀溶解平衡只能通过电解质溶解于水时建立
D.达到沉淀溶解平衡时,电解质表面上的离子或分子脱离电解质的速率与溶液中的离子或分子回到电解质表面的速率相等
答案:D
解析:沉淀溶解平衡发生在固体表面,是在一定条件下离子向溶剂中扩散和溶剂中离子在固体表面析出建立的平衡。
【名师示范课】沉淀溶解平衡 -PPT课件(新)部编版新高中化学选择性必修一-公开课课件(推荐)
【名师示范课】沉淀溶解平衡 -PPT课件(新)部编版新高中化学选择性必修一-公开课课件(推荐)
任务一
任务二
素养脉络
随堂检测
2.下列有关沉淀溶解平衡的说法正确的是( )
A.Ksp(AB2)小于Ksp(CD),则AB2的溶解度小于CD的溶解度
B.在氯化银的沉淀溶解平衡体系中,加入蒸馏水,氯化银的Ksp增大
C.在氯化银的沉淀溶解平衡体系中,加入碘化钾固体,氯化银沉淀可转化为碘化银沉淀
D.在碳酸钙的沉淀溶解平衡体系中,通入CO2气体,溶解平衡不移动
答案:C
【名师示范课】沉淀溶解平衡 -PPT课件(新)部编版新高中化学选择性必修一-公开课课件(推荐)
【名师示范课】沉淀溶解平衡 -PPT课件(新)部编版新高中化学选择性必修一-公开课课件(推荐)
任务一
任务二
素养脉络
随堂检测
3.(双选)某温度时,BaSO4在水中的沉淀溶解平衡曲线如图所示。下列说法正确的是( )
A.加入Na2SO4可以使溶液由a点变到b点
B.通过蒸发可以使溶液由d点变到c点
C.d点无BaSO4沉淀生成
D.a点对应的Ksp等于c点对应的Ksp
答案:CD
【名师示范课】沉淀溶解平衡 -PPT课件(新)部编版新高中化学选择性必修一-公开课课件(推荐)
【名师示范课】沉淀溶解平衡 -PPT课件(新)部编版新高中化学选择性必修一-公开课课件(推荐)
任务一
任务二
素养脉络
随堂检测
4.向5 mL NaCl溶液中滴入一滴AgNO3溶液,出现白色沉淀,继续滴加一滴KI溶液并振荡,沉淀变为黄色,再滴入一滴Na2S溶液并振荡,沉淀又变成黑色,根据上述变化过程,分析此三种沉淀物的溶解度关系为( )
A.AgCl=AgI=Ag2S B.AgClC.AgCl>AgI>Ag2S D.AgI>AgCl>Ag2S
答案:C
解析:沉淀溶解平衡总是向更难溶的方向转化,由转化现象可知,三种沉淀物的溶解度关系为AgCl>AgI>Ag2S。
【名师示范课】沉淀溶解平衡 -PPT课件(新)部编版新高中化学选择性必修一-公开课课件(推荐)
【名师示范课】沉淀溶解平衡 -PPT课件(新)部编版新高中化学选择性必修一-公开课课件(推荐)
任务一
任务二
素养脉络
随堂检测
5.工业上制取纯净的CuCl2·2H2O的主要过程是:①将粗制氧化铜(含少量FeO)溶解于稀盐酸中,加热、过滤;②对①所得滤液(pH为3)按下列步骤进行操作:
已知Cu2+、Fe2+在pH为4~5时不水解,Fe3+却几乎完全水解形成沉淀。请回答下列问题:
(1)X是 (填化学式),其反应的离子方程式是 。
(2)Y物质应具备的条件是 ,生产中Y可选 。
(3)溶液乙在蒸发结晶时应注意 。
【名师示范课】沉淀溶解平衡 -PPT课件(新)部编版新高中化学选择性必修一-公开课课件(推荐)
【名师示范课】沉淀溶解平衡 -PPT课件(新)部编版新高中化学选择性必修一-公开课课件(推荐)
任务一
任务二
素养脉络
随堂检测
答案:(1)Cl2(或H2O2) 2Fe2++Cl2=2Fe3++2Cl-(或2Fe2++H2O2+2H+=2Fe3++2H2O)
(2)调节溶液酸碱性,使pH为4~5,且不引进新杂质CuO、Cu(OH)2等
(3)通入HCl气体(或加入盐酸),并用玻璃棒不断搅拌且不能蒸干
解析:(1)根据框图,加入氧化剂X可把Fe2+氧化为Fe3+,而没有增加新杂质,所以X为Cl2或H2O2等。(2)结合题中信息,调节pH至4~5,使Fe3+完全沉淀,同时不引进新杂质,所以Y最好为CuO、Cu(OH)2等。(3)蒸发结晶CuCl2溶液会促进Cu2+水解Cu2++2H2O Cu(OH)2+2H+,故可加入盐酸以抑制其水解,在蒸发时要用玻璃棒不断搅拌且不能蒸干。
【名师示范课】沉淀溶解平衡 -PPT课件(新)部编版新高中化学选择性必修一-公开课课件(推荐)
【名师示范课】沉淀溶解平衡 -PPT课件(新)部编版新高中化学选择性必修一-公开课课件(推荐)
汇报人:XXX
XX月XX日
第四节 沉淀溶解平衡
人教版高中化学选择必修一
知识铺垫
必备知识
正误判断
1.固体物质的溶解度(S)与溶解性的关系:
2.浓度商Q与化学平衡常数K的关系
①Q=K时,反应达到 状态。
②Q>K时,反应向 方向进行。
③Q
1 g
10 g
平衡
逆反应
正反应
知识铺垫
必备知识
正误判断
一、难溶电解质的沉淀溶解平衡
1.定义
在一定温度下,当沉淀 和 的速率相等时,即建立了动态平衡,叫做难溶电解质的溶解平衡。如AgCl溶于水的溶解平衡表示为: 。
2.特征
溶解
生成
不等于零
相等
保持不变
发生移动
知识铺垫
必备知识
正误判断
【微思考1】难溶电解质是否在水中一点也不溶解 难溶电解质沉淀完全的标准是什么
提示:否,尽管难溶电解质的溶解度很小,但在水中并不是绝对不溶。在一般情况下,当剩余离子的浓度小于1×10-5 mol·L-1时,化学上通常认为沉淀完全了。
知识铺垫
必备知识
正误判断
3.溶度积
(1)定义:在一定温度下,难溶强电解质MmNn溶于水形成饱和溶液时,溶质的离子与该固态物质之间建立动态平衡,这时的离子浓度幂的乘积是一个常数,叫做溶度积常数,简称溶度积。符号为Ksp。
(3)意义:溶度积Ksp反映了物质在水中的溶解能力。
(4)影响Ksp的因素:温度。
绝大多数难溶电解质的溶解是吸热过程,升高温度,向溶解方向移动,Ksp增大。少数难溶电解质的溶解是放热过程,升高温度,向生成沉淀的方向移动,Ksp减小,如Ca(OH)2。
知识铺垫
必备知识
正误判断
4.溶度积Ksp与离子积Q的关系
通过比较某温度下难溶电解质的溶度积与溶液中有关离子浓度幂的乘积——离子积Q的相对大小,可以判断难溶电解质在该温度下溶液中的沉淀或溶解情况。
(1)Q>Ksp,溶液过饱和,有沉淀析出,直至溶液饱和达到新的平衡;
(2)Q=Ksp,溶液饱和,沉淀与溶解处于平衡状态;
(3)Q
必备知识
正误判断
特殊说明:
(1)Ksp反映了难溶电解质在水中的溶解能力,当化学式所表示的组成中阴离子与阳离子个数分别相同时,Ksp数值越大,难溶电解质在水中的溶解能力越强。
(2)Ksp只与温度有关,有的沉淀溶解平衡是吸热的,升高温度,Ksp增大;有的沉淀溶解平衡是放热的,升高温度,Ksp减小。
知识铺垫
必备知识
正误判断
二、沉淀溶解平衡的应用
1.沉淀的生成
(1)调节pH法:
如加入氨水调节pH=4,可除去氯化铵中的杂质氯化铁。反应的离子方程式: 。
(2)加沉淀剂法:
以Na2S、H2S等作沉淀剂,使Cu2+、Hg2+等生成极难溶的硫化物CuS、HgS等沉淀。反应的离子方程式如下:
①加Na2S生成CuS: 。
②通入H2S生成CuS: 。
知识铺垫
必备知识
正误判断
2.沉淀的溶解
(1)原理:
根据平衡移动原理,对于在水中难溶的电解质,只要不断 溶解平衡体系中的相应离子,平衡就向沉淀溶解的方向移动,从而使沉淀溶解。
(2)实例:
①CaCO3沉淀溶于盐酸中:
移去
H2CO3
知识铺垫
必备知识
正误判断
CO2气体的生成和逸出,使CaCO3溶解平衡体系中的C 浓度不断减小,平衡向 的方向移动。
②Mg(OH)2沉淀溶于浓NH4Cl溶液中:
由于NH3·H2O的生成,使Mg(OH)2溶解体系中的c(OH-) ,平衡向 的方向移动。
沉淀溶解
减小
沉淀溶解
知识铺垫
必备知识
正误判断
3.沉淀的转化
(1)转化实验:
①难溶性银盐之间的转化:
白
黄
黑
AgCl+KI=
AgI+KCl
2AgI+Na2S=
Ag2S+2NaI
知识铺垫
必备知识
正误判断
②Mg(OH)2与Fe(OH)3之间的转化:
产生白色沉淀
产生的白色沉淀逐渐
变为红褐色
MgCl2+2NaOH=
Mg(OH)2↓+2NaCl
3Mg(OH)2+2FeCl3=
2Fe(OH)3+3MgCl2
知识铺垫
必备知识
正误判断
(2)转化的实质:
沉淀转化的实质就是沉淀溶解平衡的移动。一般来说,溶解度小的沉淀转化成溶解度更小的沉淀容易实现,两种沉淀的溶解度差别 ,转化越容易。
(3)转化的应用:
①锅炉除水垢:
②自然界中矿物的转化:
越大
CuSO4
铜蓝(CuS)
知识铺垫
必备知识
正误判断
(1)沉淀溶解达到平衡时,溶液中溶质的离子浓度相等,且保持不变。 ( )
(2)室温下,AgCl在水中的溶解度小于在食盐水中的溶解度。 ( )
(3)BaSO4在同物质的量浓度的硫酸钠和硫酸铝溶液中的溶解度相同。 ( )
(4)升高温度,沉淀溶解平衡一定正向移动。 ( )
(5)为减少洗涤过程中固体的损耗,最好选用稀硫酸代替H2O来洗涤BaSO4沉淀。 ( )
(6)向一定量的饱和NaOH溶液中加入少量Na2O固体,恢复到原来温度时,溶液中的Na+总数不变。 ( )
答案:(1)× (2)× (3)× (4)× (5)√ (6)×
任务一
任务二
素养脉络
随堂检测
沉淀溶解平衡及其影响因素
问题探究
1.常温下,分别将AgCl溶于水和0.1 mol·L-1的NaCl溶液中,其溶解度相同吗 为什么
2.同一难溶物,其电离方程式和沉淀溶解平衡的方程式有哪些不同 (以BaSO4为例)
答案:不相同。在NaCl溶液中,Cl-的存在会使平衡AgCl(s) Ag+(aq)+Cl-(aq)逆向移动,AgCl溶解度减小。
任务一
任务二
素养脉络
随堂检测
深化拓展
沉淀溶解平衡
沉淀溶解平衡包含沉淀的溶解和溶解后的电解质的电离过程。如:
任务一
任务二
素养脉络
随堂检测
1.沉淀溶解平衡与电离平衡的比较
(1)从物质类别方面看
①难溶电解质:可以是强电解质也可以是弱电解质。
②难电离物质:只能是弱电解质。
(2)从变化的过程看
①沉淀溶解平衡:已溶解溶质与未溶解溶质之间形成的沉淀与溶解的平衡状态。
②电离平衡:溶解的弱电解质分子与离子之间的转化达到的平衡状态。
任务一
任务二
素养脉络
随堂检测
(3)沉淀溶解平衡与难溶电解质电离的比较
①平衡状态
沉淀溶解平衡指已溶溶质的离子与未溶溶质之间的平衡;
难溶电解质中:可能存在电离平衡,如Al(OH)3,可能不存在电离平衡,如BaSO4。
②表示方法
任务一
任务二
素养脉络
随堂检测
2.影响沉淀溶解平衡的因素
(1)内因:电解质本身的性质。
(2)外因:
①温度:温度升高,多数沉淀溶解平衡向溶解的方向移动;
②稀释:向溶解方向移动;
③同离子效应:加入相同离子,向生成沉淀的方向移动。
任务一
任务二
素养脉络
随堂检测
素能应用
典例1现向含AgBr的饱和溶液中:
(1)加入固体AgNO3,则c(Ag+) (填“变大”“变小”或“不变”,下同);
(2)加入更多的AgBr固体,则c(Ag+) ;
(3)加入AgCl固体,则c(Br-) ,c(Ag+) ;
(4)加入Na2S固体,则c(Br-) ,c(Ag+) 。
任务一
任务二
素养脉络
随堂检测
答案:(1)变大 (2)不变 (3)变小 变大 (4)变大
变小
解析:(1)向AgBr饱和溶液中加入AgNO3,AgBr沉淀溶解平衡逆向移动,但c(Ag+)变大。
(2)加入AgBr固体,对溶解平衡无影响,c(Ag+)不变。
(3)因AgCl溶解度大于AgBr,加入AgCl固体时,c(Ag+)变大,溶解平衡向左移动,c(Br-)变小。
(4)因Ag2S溶解度小于AgBr,加入Na2S固体时,生成Ag2S,AgBr沉淀溶解平衡向右移动,c(Br-)变大,但c(Ag+)变小。
任务一
任务二
素养脉络
随堂检测
变式训练1将足量AgCl分别放入:①5 mL水,②10 mL 0.2 mol·L-1的MgCl2溶液,③20 mL 0.5 mol·L-1的NaCl溶液,④40 mL 0.1 mol·L-1的盐酸中溶解至溶液饱和,各溶液中Ag+的浓度分别为a、b、c、d,它们由大到小的排列顺序是 。
答案:a>d>b>c
解析:AgCl在溶液中存在沉淀溶解平衡AgCl(s) Cl-(aq)+
Ag+(aq),所以氯离子浓度越大,Ag+的浓度就越小。②③④中氯离子的浓度分别是0.4 mol·L-1、0.5 mol·L-1、0.1 mol·L-1,所以各溶液中Ag+浓度的大小顺序是a>d>b>c。
任务一
任务二
素养脉络
随堂检测
沉淀溶解平衡的应用
问题探究
2.根据你现有的知识,你认为判断沉淀能否生成可从哪方面考虑 对于要除去的离子能否通过沉淀反应全部除去 请说明原因。
答案:从溶解度方面可判断沉淀能否生成;对于要除去的离子不能通过沉淀完全除去,因为不溶是相对的,沉淀物在溶液中存在溶解平衡。
任务一
任务二
素养脉络
随堂检测
深化拓展
沉淀溶解平衡应用中的一些问题
生成难溶电解质而形成沉淀,是工业生产、环保工程和科学研究中除杂质或提纯物质的重要方法之一。
(1)沉淀剂的选择:要求除去溶液中的某种离子,又不能影响其他离子的存在,并且由沉淀剂引入溶液的杂质离子还要便于除去。
(2)在遇到含有多种弱碱阳离子的混合溶液中离子分离及除杂时,往往通过改变溶液的酸碱性使离子分别沉淀而除去,过程中要注意控制形成沉淀的pH。
(3)利用生成沉淀分离或除去某种离子,首先要使生成沉淀的反应能够发生;其次沉淀生成的反应进行得越完全越好。
任务一
任务二
素养脉络
随堂检测
素能应用
典例2(1)已知在25 ℃时,Ksp[Mg(OH)2]=3.2×10-11,假设饱和Mg(OH)2溶液的密度为1 g·mL-1,试求Mg(OH)2的溶解度为 g。
(2)在25 ℃时,向0.02 mol·L-1的MgCl2溶液中加入NaOH固体,如要生成Mg(OH)2沉淀,应使溶液中的c(OH-)最小为 mol·L-1。
(3)25 ℃时,向浓度均为0.02 mol·L-1的MgCl2和CuCl2混合溶液中逐滴加入NaOH溶液,先生成 (填化学式)沉淀;当两种
{已知25 ℃时,Ksp[Cu(OH)2]=2.0×10-20}
任务一
任务二
素养脉络
随堂检测
答案:(1)1.16×10-3 (2)4×10-5 (3)Cu(OH)2 1.6×109
解析:(1)设c(Mg2+)为x,则c(OH-)为2x。由Ksp[Mg(OH)2]=3.2×10-11=c(Mg2+)·c2(OH-)=x×(2x)2=4x3,解得c(Mg2+)=2×10-4 mol·L-1,则1 L溶液中(相当于1 L水中)溶解Mg(OH)2的物质的量为2×10-4 mol,即1 000 g 水中溶解Mg(OH)2的质量为:2×10-4 mol×58 g·mol-1=1.16×10-2 g,所以Mg(OH)2的溶解度为1.16×10-3 g。
(2)当c(Mg2+)·c2(OH-)=3.2×10-11时开始生成Mg(OH)2沉淀,则
【名师示范课】沉淀溶解平衡 -PPT课件(新)部编版新高中化学选择性必修一-公开课课件(推荐)
【名师示范课】沉淀溶解平衡 -PPT课件(新)部编版新高中化学选择性必修一-公开课课件(推荐)
任务一
任务二
素养脉络
随堂检测
(1)在计算难溶电解质溶液中离子平衡浓度时不要搞错计量数关系。如x mol·L-1铬酸银(Ag2CrO4)溶液中c(Ag+)是2x mol·L-1而不是x mol·L-1。
(2)类型不同的难溶电解质的溶度积大小不能直接反映出它们的溶液中离子浓度的大小,因为它们的溶度积表达式是不同的。Ksp与S的换算没有一个统一的公式,因难溶电解质类型的不同而相异。
【名师示范课】沉淀溶解平衡 -PPT课件(新)部编版新高中化学选择性必修一-公开课课件(推荐)
【名师示范课】沉淀溶解平衡 -PPT课件(新)部编版新高中化学选择性必修一-公开课课件(推荐)
任务一
任务二
素养脉络
随堂检测
变式训练2已知:某温度时,Ksp(AgCl)=1.8×10-10,
Ksp(Ag2CrO4)=1.1×10-12。向Cl-和Cr 的浓度都为0.100 mol·L-1的混合溶液中逐滴加入AgNO3溶液(忽略体积的变化)。下列说法中正确的是( )
A.首先得到的沉淀是Ag2CrO4
B.首先得到的沉淀是AgCl
C.同时得到AgCl与Ag2CrO4沉淀
D.将Ag2CrO4转化为AgCl比将AgCl转化为Ag2CrO4要难
【名师示范课】沉淀溶解平衡 -PPT课件(新)部编版新高中化学选择性必修一-公开课课件(推荐)
【名师示范课】沉淀溶解平衡 -PPT课件(新)部编版新高中化学选择性必修一-公开课课件(推荐)
任务一
任务二
素养脉络
随堂检测
答案:B
【名师示范课】沉淀溶解平衡 -PPT课件(新)部编版新高中化学选择性必修一-公开课课件(推荐)
【名师示范课】沉淀溶解平衡 -PPT课件(新)部编版新高中化学选择性必修一-公开课课件(推荐)
任务一
任务二
素养脉络
随堂检测
【名师示范课】沉淀溶解平衡 -PPT课件(新)部编版新高中化学选择性必修一-公开课课件(推荐)
【名师示范课】沉淀溶解平衡 -PPT课件(新)部编版新高中化学选择性必修一-公开课课件(推荐)
任务一
任务二
素养脉络
随堂检测
1.下列说法中正确的是( )
A.只有易溶电解质在溶液中才存在沉淀溶解平衡
B.难溶电解质在溶液中只存在沉淀溶解平衡,不存在电离平衡
C.沉淀溶解平衡只能通过电解质溶解于水时建立
D.达到沉淀溶解平衡时,电解质表面上的离子或分子脱离电解质的速率与溶液中的离子或分子回到电解质表面的速率相等
答案:D
解析:沉淀溶解平衡发生在固体表面,是在一定条件下离子向溶剂中扩散和溶剂中离子在固体表面析出建立的平衡。
【名师示范课】沉淀溶解平衡 -PPT课件(新)部编版新高中化学选择性必修一-公开课课件(推荐)
【名师示范课】沉淀溶解平衡 -PPT课件(新)部编版新高中化学选择性必修一-公开课课件(推荐)
任务一
任务二
素养脉络
随堂检测
2.下列有关沉淀溶解平衡的说法正确的是( )
A.Ksp(AB2)小于Ksp(CD),则AB2的溶解度小于CD的溶解度
B.在氯化银的沉淀溶解平衡体系中,加入蒸馏水,氯化银的Ksp增大
C.在氯化银的沉淀溶解平衡体系中,加入碘化钾固体,氯化银沉淀可转化为碘化银沉淀
D.在碳酸钙的沉淀溶解平衡体系中,通入CO2气体,溶解平衡不移动
答案:C
【名师示范课】沉淀溶解平衡 -PPT课件(新)部编版新高中化学选择性必修一-公开课课件(推荐)
【名师示范课】沉淀溶解平衡 -PPT课件(新)部编版新高中化学选择性必修一-公开课课件(推荐)
任务一
任务二
素养脉络
随堂检测
3.(双选)某温度时,BaSO4在水中的沉淀溶解平衡曲线如图所示。下列说法正确的是( )
A.加入Na2SO4可以使溶液由a点变到b点
B.通过蒸发可以使溶液由d点变到c点
C.d点无BaSO4沉淀生成
D.a点对应的Ksp等于c点对应的Ksp
答案:CD
【名师示范课】沉淀溶解平衡 -PPT课件(新)部编版新高中化学选择性必修一-公开课课件(推荐)
【名师示范课】沉淀溶解平衡 -PPT课件(新)部编版新高中化学选择性必修一-公开课课件(推荐)
任务一
任务二
素养脉络
随堂检测
4.向5 mL NaCl溶液中滴入一滴AgNO3溶液,出现白色沉淀,继续滴加一滴KI溶液并振荡,沉淀变为黄色,再滴入一滴Na2S溶液并振荡,沉淀又变成黑色,根据上述变化过程,分析此三种沉淀物的溶解度关系为( )
A.AgCl=AgI=Ag2S B.AgCl
答案:C
解析:沉淀溶解平衡总是向更难溶的方向转化,由转化现象可知,三种沉淀物的溶解度关系为AgCl>AgI>Ag2S。
【名师示范课】沉淀溶解平衡 -PPT课件(新)部编版新高中化学选择性必修一-公开课课件(推荐)
【名师示范课】沉淀溶解平衡 -PPT课件(新)部编版新高中化学选择性必修一-公开课课件(推荐)
任务一
任务二
素养脉络
随堂检测
5.工业上制取纯净的CuCl2·2H2O的主要过程是:①将粗制氧化铜(含少量FeO)溶解于稀盐酸中,加热、过滤;②对①所得滤液(pH为3)按下列步骤进行操作:
已知Cu2+、Fe2+在pH为4~5时不水解,Fe3+却几乎完全水解形成沉淀。请回答下列问题:
(1)X是 (填化学式),其反应的离子方程式是 。
(2)Y物质应具备的条件是 ,生产中Y可选 。
(3)溶液乙在蒸发结晶时应注意 。
【名师示范课】沉淀溶解平衡 -PPT课件(新)部编版新高中化学选择性必修一-公开课课件(推荐)
【名师示范课】沉淀溶解平衡 -PPT课件(新)部编版新高中化学选择性必修一-公开课课件(推荐)
任务一
任务二
素养脉络
随堂检测
答案:(1)Cl2(或H2O2) 2Fe2++Cl2=2Fe3++2Cl-(或2Fe2++H2O2+2H+=2Fe3++2H2O)
(2)调节溶液酸碱性,使pH为4~5,且不引进新杂质CuO、Cu(OH)2等
(3)通入HCl气体(或加入盐酸),并用玻璃棒不断搅拌且不能蒸干
解析:(1)根据框图,加入氧化剂X可把Fe2+氧化为Fe3+,而没有增加新杂质,所以X为Cl2或H2O2等。(2)结合题中信息,调节pH至4~5,使Fe3+完全沉淀,同时不引进新杂质,所以Y最好为CuO、Cu(OH)2等。(3)蒸发结晶CuCl2溶液会促进Cu2+水解Cu2++2H2O Cu(OH)2+2H+,故可加入盐酸以抑制其水解,在蒸发时要用玻璃棒不断搅拌且不能蒸干。
【名师示范课】沉淀溶解平衡 -PPT课件(新)部编版新高中化学选择性必修一-公开课课件(推荐)
【名师示范课】沉淀溶解平衡 -PPT课件(新)部编版新高中化学选择性必修一-公开课课件(推荐)
