人教版 高中化学 选择性必修1 3.3 盐类的水解(共29张PPT)
文档属性
| 名称 | 人教版 高中化学 选择性必修1 3.3 盐类的水解(共29张PPT) |

|
|
| 格式 | pptx | ||
| 文件大小 | 1021.3KB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-11-20 00:00:00 | ||
图片预览






文档简介
(共29张PPT)
汇报人:XXX
XX月XX日
第三节 盐类的水解
人教版高中化学选择必修一
被蜂蛰伤莫大意--采槐花的老太差点送了命!
某日上午10点左右,家住市区的李老太与邻居到附近的山上采槐树花时,不慎被蜜蜂蛰伤,当时她并未在意.回家后李老太感.到伤处疼痛加重、呼吸困难、意识不清,家人急忙拨打急救电话,经医生对症处理,李老太已脱离危险。
被黄蜂或蜜蜂叮咬后,都会感到非常疼痛,但处理的方法却不相同,这是因为黄蜂分泌物中含有的是一种碱性物质(主要成分为组胺、五羟色胺),而蜜蜂分泌物中含有的是一种酸性物质(主要成分是蚁酸).
【文献查阅】
【思考】
当黄蜂或蜜蜂叮咬后,应如何利用家庭常用的物质加以处理?
被黄蜂叮咬:
在患处涂抹食醋即可.
被蜜蜂叮咬:
在患处涂抹纯碱、小苏打或肥皂水溶液.
①.为什么在黄蜂蛰过的地方涂抹食醋可以有效减轻疼痛呢?
②.Na2CO3、NaHCO3和肥皂水溶液能减轻蜜蜂蛰后带来的痛楚说明了什么?
③.Na2CO3、NaHCO3和肥皂水的主要成分硬脂酸钠属于哪类物质?
【思考与交流】
属于盐类!
【思考ing!】酸溶液呈酸性,碱溶液呈碱性,那么盐溶液呢?一定只呈中性吗?C(H+)一定等于C(OH-)吗?
往纯水中加酸或碱后,水的电离平衡受到怎样的影响?
【H2O H++OH-】
(同离子效应:抑制了水的电离.)
纯水中加盐后,会影响水的电离平衡吗?
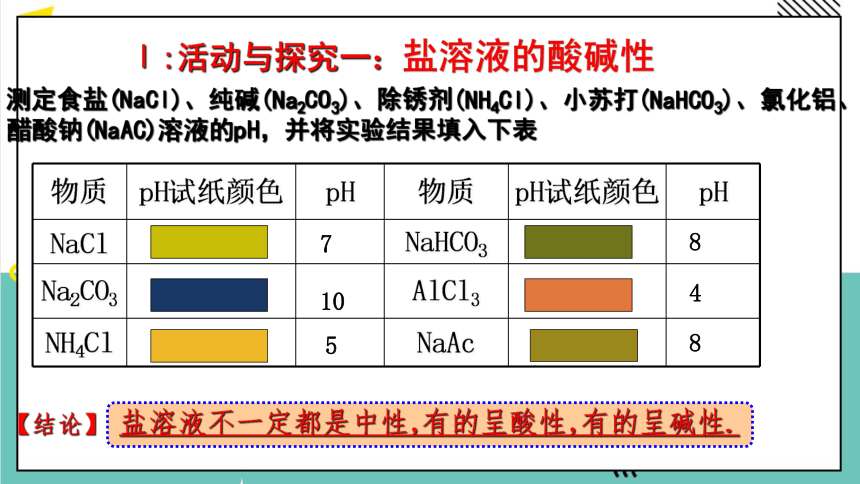
测定食盐(NaCl)、纯碱(Na2CO3)、除锈剂(NH4Cl)、小苏打(NaHCO3)、氯化铝、醋酸钠(NaAC)溶液的pH,并将实验结果填入下表
Ⅰ:活动与探究一:盐溶液的酸碱性
物质 pH试纸颜色 pH 物质 pH试纸颜色 pH
NaCl NaHCO3
Na2CO3 AlCl3
NH4Cl NaAc
7
10
5
8
4
【结论】
盐溶液不一定都是中性,有的呈酸性,有的呈碱性.
8
1、盐溶液的酸碱性是随机出现的,还是有规律可循呢?
2、有规律可循!
用什么方法总结现象背后的规律?
【思考与反思】
【刨根问底】
盐可以如何分类呢?而不同种类的盐,其酸碱性又是否相同呢?
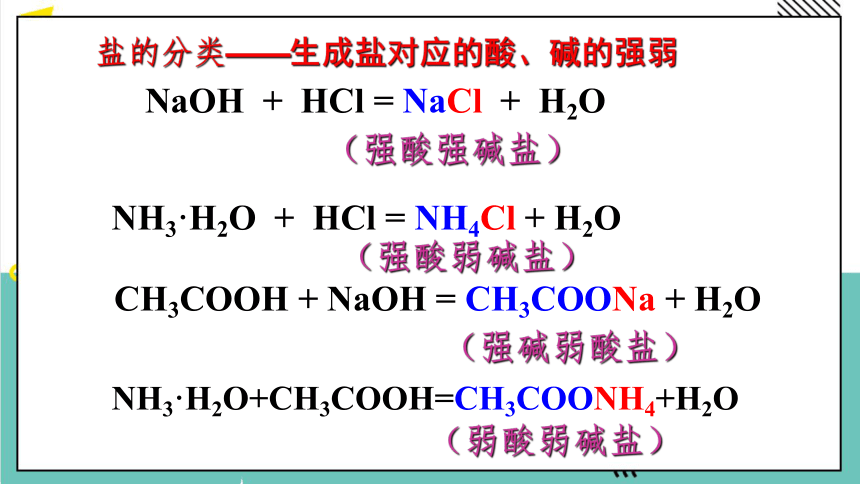
(强碱弱酸盐)
(强酸弱碱盐)
(强酸强碱盐)
CH3COOH + NaOH = CH3COONa + H2O
NH3·H2O + HCl = NH4Cl + H2O
NaOH + HCl = NaCl + H2O
(弱酸弱碱盐)
NH3·H2O+CH3COOH=CH3COONH4+H2O
盐的分类——生成盐对应的酸、碱的强弱
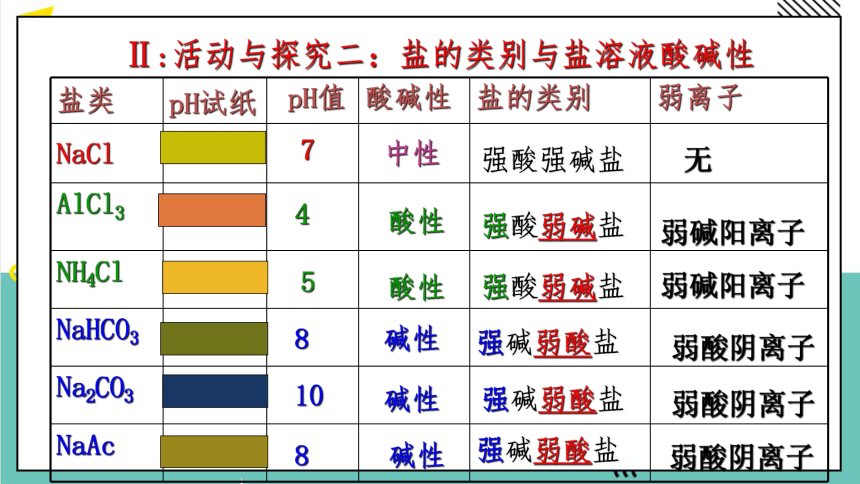
Ⅱ:活动与探究二:盐的类别与盐溶液酸碱性
盐类 pH试纸 pH值 酸碱性 盐的类别 弱离子
NaCl
AlCl3
NH4Cl
NaHCO3
Na2CO3
NaAc
7
8
4
5
10
8
中性
酸性
酸性
碱性
碱性
碱性
强酸强碱盐
强酸弱碱盐
强酸弱碱盐
强碱弱酸盐
强碱弱酸盐
强碱弱酸盐
无
弱碱阳离子
弱碱阳离子
弱酸阴离子
弱酸阴离子
弱酸阴离子
盐溶液酸碱性与盐类型的关系盐的类型强酸强碱盐强酸弱碱盐强碱弱酸盐溶液的酸碱性中 性酸 性碱 性【谁强显谁性,同强显中性】【归纳总结】【课堂练习】
1. 下列溶液pH小于7的是( )
A、 溴化钾 B、 硫酸铜 C、 硫化钠 D、 硝酸钡
2. 下列溶液能使酚酞指示剂显红色的是( )
A 、碳酸钾 B、 硫酸氢钠 C、 碳酸氢钠 D、 氯化铁
1.试推测CH3COONa溶液显碱性原因.
推测Ⅰ:水能电离出OH-,使溶液显碱性.
推测Ⅱ:醋酸钠本身具有碱性.
推测Ⅲ:醋酸钠与水反应的生成物具有碱性.
活动与探究三:盐溶液呈酸碱性的原因
2.对比实验:
实验Ⅰ:
H2O+酚酞.
实验Ⅱ:
CH3COONa的乙醇溶液+酚酞.
实验Ⅱ混合液+H2O.
实验Ⅲ:
无色
无色
红色
3.分析CH3COONa水溶液显碱性的原因:
Ⅰ CH3COONa水溶液中存在哪些电离?
Ⅱ. CH3COONa水溶液中存在哪些粒子?它们能否结合成难电离的弱电解质物质?
Ⅲ.离子相互作用时对水的电离平衡有何影响?
Ⅳ.最终会引起溶液中的c(H+)和c(OH-)如何变化?
H2O H+ + OH-
CH3COONa = CH3COO- + Na+
+
CH3COOH
总反应: CH3COONa+H2O CH3COOH + NaOH
离子方程式: CH3COO- +H2O CH3COOH + OH-
结论:CH3COONa溶液呈碱性原因是由于盐电离产生的弱酸阴离子与水电离产生的阳离子(H+)结合生成弱电解质,导致溶液中
c(OH-)>c(H+)而使溶液呈碱性。
CH3COONa溶液呈碱性的原因?
请同学们试着仿照醋酸钠溶液,分析一下NH4Cl溶液呈酸性的原因?
【思考时间】
以NH4Cl为例分析其溶液为什么呈酸性?
NH4Cl = NH4+ + Cl-
+
NH3·H2O
总反应:NH4Cl+H2O NH3·H2O + HCl
离子方程式:NH4+ + H2O NH3·H2O + H+
结论:强酸弱碱盐溶液呈酸性原因是由于盐电离产生的弱碱阳离子与水电离产生的阴离子(OH-)结合生成弱电解质,导致溶液中c(H+)>c(OH-)而使溶液呈酸性。
H2O OH- + H+
弱酸阴离子
或弱碱阳离子
1.盐类水解的概念
B: 盐类的水解一般比较小
溶液中盐电离出来的离子跟水电离出来的H+或OH-结合生成弱电解质的反应,叫做盐类的水解。
C: 盐类的水解是吸热反应。升温促进水解。
A :盐类水解是酸碱中和反应的逆反应。
(2)盐类水解的特点
(1)实质
盐类水解的本质是破坏了水的电离平衡,而使溶液呈现一定的酸性或碱性。
2、盐类水解的规律
有弱才水解,谁弱谁水解;都弱都水解。
谁强显谁性,同强显中性;
习题1:向水中加入下列物质,哪些对水的电离平衡有影响?平衡怎么移动?
【课堂练习】
H2SO4
BaSO4
KOH
FeCl3
NaClO
NH4Ac
?
NaNO3
(NH4)2SO4
NaHSO4
KHCO3
盐类水解是可逆反应,反应方程式中要写“ ”符号
2.盐类水解方程式的书写
一般盐类水解的程度很小,水解产物很少。通常不生成沉淀或气体,也不发生分解。一般不标“↓”或“↑”,也不把生成物(如H2CO3、NH3·H2O等)写成分解产物的形式。
多元弱酸酸根离子分步水解,以第一步为主,水解方程式一般只写第一步。
多元弱碱的阳离子水解过程较为复杂,通常写成一步完成。
盐 + 水 酸 + 碱
弱离子 + H2O 弱酸(或弱碱) + OH-(或H+)
阴生阴(OH-)
阳生阳(H+)
【随堂练习】
1.盐类水解的过程中正确的说法是( )
A.盐的电离平衡破坏 B.水的电离平衡发生移动
C.溶液的pH减小 D.没有发生中和反应
B
D
2.下列水解离子方程式正确的是 ( )
A. Fe3++3H2O Fe(OH)3↓+3H+
B. Br-+H2O HBr+OH-
C. CO32-+H2O H2CO3+2OH-
D. NH4++ H2O NH3.H2O +H+
Na2SO4 、Na2CO3、 NH4NO3、AlCl3 、NaF 、 NaClO 、
CuSO4 、Fe2(SO4)3 、NaHSO3、(NH4)2CO3 、 KBr
【思考与交流】
请从形成盐的酸碱的强弱判断下列盐的类别:
分析上述盐是否会发生水解,写出其水解过程的离子方程式
弱酸弱碱盐水解
1、不完全双水解,如:
(CH3COO-、 NH4+、CO32-、HCO3-可以大量共存)
CH3COO– + NH4+ + H2O CH3COOH + NH3·H2O
CH3COONH 4、 (NH4)2CO3、NH4HCO3
2、“完全双水解”(阴阳离子之间的水解能进行彻底,离子不能大量共存,一定有沉淀生成), 水解方程式用“ = ”、并标“↑”、“↓”。
①AlCl3溶液与NaHCO3溶液反应离子方程式为:
Al3+ + 3HCO3- = Al(OH)3↓ + 3CO2↑
如:①AlCl3溶液与NaAlO2溶液反应离子方程式为:
Al3++3AlO2-+6H2O = 4Al(OH)3↓
②AlCl3溶液与Na2CO3溶液反应离子方程式为:
常见的完全双水解离子有:
Al 3+与AlO2-,CO32-,HCO3-,S2-,HS-
Fe3+与AlO2-,CO32-,HCO3-,
NH4+与SiO32-, AlO2-
以上离子相互之间不能大量共存
还有些离子看似会发生双水解,但不能共存并非因为双水解,如 Cu2+和S2-、Fe2+和S2-、Fe3+和S2-
1.下列离子能大量共存的是( )
A、AlO2-、HCO3-、K+ B、Al3+、 HCO3-、Cl-
C、NH4+、SO32-、Na+ D、Fe2+、NO3-、H+
E、NH4+、SiO32-、Na+ F、AlO2-、HCO3-、K+
AC
能力提高:
若某盐溶液呈中性,能否判断该盐未发生
水解反应?该盐可能是什么盐?为什么?
醋酸的ka(1.76×10-5)和氨水的kb(1.77×10-5)相当,因此醋酸根的水解程度与铵根离子的水解程度相当,醋酸铵溶液呈中性。
(2)将盐的电离方程式与盐类水解的离子方程式区别开来
HS-+H2O S2-+H3O+ 是HS-的电离方程式
HS-+H2O H2S+OH- 是HS-的水解方程式
(1)盐类水解的离子方程式遵循质量守恒和电荷守恒
(3)能发生双水解的离子,在同一溶液中能否大量共存,看情况
总结感悟
①强酸的酸式盐(如NaHSO4),只有盐的完全电离而无水解,溶液呈酸性。
②弱酸的酸式盐,弱酸的酸式酸根既有电离又有水解,溶液的酸碱性取决于两者相对大小
电离>水解,呈酸性:如HSO3-、H2PO4-
电离<水解,呈碱性:如HCO3-、HS-、 HPO42-
电离:HA- H+ + A2- (显酸性)
水解:HA- + H2O H2A + OH- (显碱性)
酸式盐(NaHA)的酸碱性
常见的弱电解质:弱酸:HF、HClO、H2S、H2SO3、H3PO4、H2CO3、CH3COOH等弱碱:NH3·H2O、Fe(OH)3、Al(OH)3、Cu(OH)2等常见的弱离子:弱酸阴离子:F-、ClO-、S2-、SO32-、PO43-、CO32-、CH3COO-、HS-HSO3-HPO42-HCO3-弱碱阳离子:NH4+、Fe3+、Al3+、Cu2+等答案:
取一定量NaA溶液,测定其大于7,故HA酸为弱酸
实验设计
请设计一个合理而比较容易进行的方案证明某酸HA酸是弱电解质(应用水解原理,做简明扼要表述)
汇报人:XXX
XX月XX日
第三节 盐类的水解
人教版高中化学选择必修一
被蜂蛰伤莫大意--采槐花的老太差点送了命!
某日上午10点左右,家住市区的李老太与邻居到附近的山上采槐树花时,不慎被蜜蜂蛰伤,当时她并未在意.回家后李老太感.到伤处疼痛加重、呼吸困难、意识不清,家人急忙拨打急救电话,经医生对症处理,李老太已脱离危险。
被黄蜂或蜜蜂叮咬后,都会感到非常疼痛,但处理的方法却不相同,这是因为黄蜂分泌物中含有的是一种碱性物质(主要成分为组胺、五羟色胺),而蜜蜂分泌物中含有的是一种酸性物质(主要成分是蚁酸).
【文献查阅】
【思考】
当黄蜂或蜜蜂叮咬后,应如何利用家庭常用的物质加以处理?
被黄蜂叮咬:
在患处涂抹食醋即可.
被蜜蜂叮咬:
在患处涂抹纯碱、小苏打或肥皂水溶液.
①.为什么在黄蜂蛰过的地方涂抹食醋可以有效减轻疼痛呢?
②.Na2CO3、NaHCO3和肥皂水溶液能减轻蜜蜂蛰后带来的痛楚说明了什么?
③.Na2CO3、NaHCO3和肥皂水的主要成分硬脂酸钠属于哪类物质?
【思考与交流】
属于盐类!
【思考ing!】酸溶液呈酸性,碱溶液呈碱性,那么盐溶液呢?一定只呈中性吗?C(H+)一定等于C(OH-)吗?
往纯水中加酸或碱后,水的电离平衡受到怎样的影响?
【H2O H++OH-】
(同离子效应:抑制了水的电离.)
纯水中加盐后,会影响水的电离平衡吗?
测定食盐(NaCl)、纯碱(Na2CO3)、除锈剂(NH4Cl)、小苏打(NaHCO3)、氯化铝、醋酸钠(NaAC)溶液的pH,并将实验结果填入下表
Ⅰ:活动与探究一:盐溶液的酸碱性
物质 pH试纸颜色 pH 物质 pH试纸颜色 pH
NaCl NaHCO3
Na2CO3 AlCl3
NH4Cl NaAc
7
10
5
8
4
【结论】
盐溶液不一定都是中性,有的呈酸性,有的呈碱性.
8
1、盐溶液的酸碱性是随机出现的,还是有规律可循呢?
2、有规律可循!
用什么方法总结现象背后的规律?
【思考与反思】
【刨根问底】
盐可以如何分类呢?而不同种类的盐,其酸碱性又是否相同呢?
(强碱弱酸盐)
(强酸弱碱盐)
(强酸强碱盐)
CH3COOH + NaOH = CH3COONa + H2O
NH3·H2O + HCl = NH4Cl + H2O
NaOH + HCl = NaCl + H2O
(弱酸弱碱盐)
NH3·H2O+CH3COOH=CH3COONH4+H2O
盐的分类——生成盐对应的酸、碱的强弱
Ⅱ:活动与探究二:盐的类别与盐溶液酸碱性
盐类 pH试纸 pH值 酸碱性 盐的类别 弱离子
NaCl
AlCl3
NH4Cl
NaHCO3
Na2CO3
NaAc
7
8
4
5
10
8
中性
酸性
酸性
碱性
碱性
碱性
强酸强碱盐
强酸弱碱盐
强酸弱碱盐
强碱弱酸盐
强碱弱酸盐
强碱弱酸盐
无
弱碱阳离子
弱碱阳离子
弱酸阴离子
弱酸阴离子
弱酸阴离子
盐溶液酸碱性与盐类型的关系盐的类型强酸强碱盐强酸弱碱盐强碱弱酸盐溶液的酸碱性中 性酸 性碱 性【谁强显谁性,同强显中性】【归纳总结】【课堂练习】
1. 下列溶液pH小于7的是( )
A、 溴化钾 B、 硫酸铜 C、 硫化钠 D、 硝酸钡
2. 下列溶液能使酚酞指示剂显红色的是( )
A 、碳酸钾 B、 硫酸氢钠 C、 碳酸氢钠 D、 氯化铁
1.试推测CH3COONa溶液显碱性原因.
推测Ⅰ:水能电离出OH-,使溶液显碱性.
推测Ⅱ:醋酸钠本身具有碱性.
推测Ⅲ:醋酸钠与水反应的生成物具有碱性.
活动与探究三:盐溶液呈酸碱性的原因
2.对比实验:
实验Ⅰ:
H2O+酚酞.
实验Ⅱ:
CH3COONa的乙醇溶液+酚酞.
实验Ⅱ混合液+H2O.
实验Ⅲ:
无色
无色
红色
3.分析CH3COONa水溶液显碱性的原因:
Ⅰ CH3COONa水溶液中存在哪些电离?
Ⅱ. CH3COONa水溶液中存在哪些粒子?它们能否结合成难电离的弱电解质物质?
Ⅲ.离子相互作用时对水的电离平衡有何影响?
Ⅳ.最终会引起溶液中的c(H+)和c(OH-)如何变化?
H2O H+ + OH-
CH3COONa = CH3COO- + Na+
+
CH3COOH
总反应: CH3COONa+H2O CH3COOH + NaOH
离子方程式: CH3COO- +H2O CH3COOH + OH-
结论:CH3COONa溶液呈碱性原因是由于盐电离产生的弱酸阴离子与水电离产生的阳离子(H+)结合生成弱电解质,导致溶液中
c(OH-)>c(H+)而使溶液呈碱性。
CH3COONa溶液呈碱性的原因?
请同学们试着仿照醋酸钠溶液,分析一下NH4Cl溶液呈酸性的原因?
【思考时间】
以NH4Cl为例分析其溶液为什么呈酸性?
NH4Cl = NH4+ + Cl-
+
NH3·H2O
总反应:NH4Cl+H2O NH3·H2O + HCl
离子方程式:NH4+ + H2O NH3·H2O + H+
结论:强酸弱碱盐溶液呈酸性原因是由于盐电离产生的弱碱阳离子与水电离产生的阴离子(OH-)结合生成弱电解质,导致溶液中c(H+)>c(OH-)而使溶液呈酸性。
H2O OH- + H+
弱酸阴离子
或弱碱阳离子
1.盐类水解的概念
B: 盐类的水解一般比较小
溶液中盐电离出来的离子跟水电离出来的H+或OH-结合生成弱电解质的反应,叫做盐类的水解。
C: 盐类的水解是吸热反应。升温促进水解。
A :盐类水解是酸碱中和反应的逆反应。
(2)盐类水解的特点
(1)实质
盐类水解的本质是破坏了水的电离平衡,而使溶液呈现一定的酸性或碱性。
2、盐类水解的规律
有弱才水解,谁弱谁水解;都弱都水解。
谁强显谁性,同强显中性;
习题1:向水中加入下列物质,哪些对水的电离平衡有影响?平衡怎么移动?
【课堂练习】
H2SO4
BaSO4
KOH
FeCl3
NaClO
NH4Ac
?
NaNO3
(NH4)2SO4
NaHSO4
KHCO3
盐类水解是可逆反应,反应方程式中要写“ ”符号
2.盐类水解方程式的书写
一般盐类水解的程度很小,水解产物很少。通常不生成沉淀或气体,也不发生分解。一般不标“↓”或“↑”,也不把生成物(如H2CO3、NH3·H2O等)写成分解产物的形式。
多元弱酸酸根离子分步水解,以第一步为主,水解方程式一般只写第一步。
多元弱碱的阳离子水解过程较为复杂,通常写成一步完成。
盐 + 水 酸 + 碱
弱离子 + H2O 弱酸(或弱碱) + OH-(或H+)
阴生阴(OH-)
阳生阳(H+)
【随堂练习】
1.盐类水解的过程中正确的说法是( )
A.盐的电离平衡破坏 B.水的电离平衡发生移动
C.溶液的pH减小 D.没有发生中和反应
B
D
2.下列水解离子方程式正确的是 ( )
A. Fe3++3H2O Fe(OH)3↓+3H+
B. Br-+H2O HBr+OH-
C. CO32-+H2O H2CO3+2OH-
D. NH4++ H2O NH3.H2O +H+
Na2SO4 、Na2CO3、 NH4NO3、AlCl3 、NaF 、 NaClO 、
CuSO4 、Fe2(SO4)3 、NaHSO3、(NH4)2CO3 、 KBr
【思考与交流】
请从形成盐的酸碱的强弱判断下列盐的类别:
分析上述盐是否会发生水解,写出其水解过程的离子方程式
弱酸弱碱盐水解
1、不完全双水解,如:
(CH3COO-、 NH4+、CO32-、HCO3-可以大量共存)
CH3COO– + NH4+ + H2O CH3COOH + NH3·H2O
CH3COONH 4、 (NH4)2CO3、NH4HCO3
2、“完全双水解”(阴阳离子之间的水解能进行彻底,离子不能大量共存,一定有沉淀生成), 水解方程式用“ = ”、并标“↑”、“↓”。
①AlCl3溶液与NaHCO3溶液反应离子方程式为:
Al3+ + 3HCO3- = Al(OH)3↓ + 3CO2↑
如:①AlCl3溶液与NaAlO2溶液反应离子方程式为:
Al3++3AlO2-+6H2O = 4Al(OH)3↓
②AlCl3溶液与Na2CO3溶液反应离子方程式为:
常见的完全双水解离子有:
Al 3+与AlO2-,CO32-,HCO3-,S2-,HS-
Fe3+与AlO2-,CO32-,HCO3-,
NH4+与SiO32-, AlO2-
以上离子相互之间不能大量共存
还有些离子看似会发生双水解,但不能共存并非因为双水解,如 Cu2+和S2-、Fe2+和S2-、Fe3+和S2-
1.下列离子能大量共存的是( )
A、AlO2-、HCO3-、K+ B、Al3+、 HCO3-、Cl-
C、NH4+、SO32-、Na+ D、Fe2+、NO3-、H+
E、NH4+、SiO32-、Na+ F、AlO2-、HCO3-、K+
AC
能力提高:
若某盐溶液呈中性,能否判断该盐未发生
水解反应?该盐可能是什么盐?为什么?
醋酸的ka(1.76×10-5)和氨水的kb(1.77×10-5)相当,因此醋酸根的水解程度与铵根离子的水解程度相当,醋酸铵溶液呈中性。
(2)将盐的电离方程式与盐类水解的离子方程式区别开来
HS-+H2O S2-+H3O+ 是HS-的电离方程式
HS-+H2O H2S+OH- 是HS-的水解方程式
(1)盐类水解的离子方程式遵循质量守恒和电荷守恒
(3)能发生双水解的离子,在同一溶液中能否大量共存,看情况
总结感悟
①强酸的酸式盐(如NaHSO4),只有盐的完全电离而无水解,溶液呈酸性。
②弱酸的酸式盐,弱酸的酸式酸根既有电离又有水解,溶液的酸碱性取决于两者相对大小
电离>水解,呈酸性:如HSO3-、H2PO4-
电离<水解,呈碱性:如HCO3-、HS-、 HPO42-
电离:HA- H+ + A2- (显酸性)
水解:HA- + H2O H2A + OH- (显碱性)
酸式盐(NaHA)的酸碱性
常见的弱电解质:弱酸:HF、HClO、H2S、H2SO3、H3PO4、H2CO3、CH3COOH等弱碱:NH3·H2O、Fe(OH)3、Al(OH)3、Cu(OH)2等常见的弱离子:弱酸阴离子:F-、ClO-、S2-、SO32-、PO43-、CO32-、CH3COO-、HS-HSO3-HPO42-HCO3-弱碱阳离子:NH4+、Fe3+、Al3+、Cu2+等答案:
取一定量NaA溶液,测定其大于7,故HA酸为弱酸
实验设计
请设计一个合理而比较容易进行的方案证明某酸HA酸是弱电解质(应用水解原理,做简明扼要表述)
