2.3 氧化还原反应 同步练习 (含解析)2023-2024学年高一上学期化学鲁科版(2019)必修第一册
文档属性
| 名称 | 2.3 氧化还原反应 同步练习 (含解析)2023-2024学年高一上学期化学鲁科版(2019)必修第一册 |  | |
| 格式 | docx | ||
| 文件大小 | 373.0KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-11-20 13:55:30 | ||
图片预览




文档简介
2.3 氧化还原反应 同步练习
一、单选题
1.下列叙述涉及氧化还原反应的是( )
A.根瘤菌固氮 B.生石灰作干燥剂
C.氢氧化铝作胃酸中和剂 D.用纯碱清洗铁屑表面油脂
2.下列生活中的化学现象与氧化还原知识有关的是( )
A.用食醋可以洗水垢
B.菜刀洗过后如果没擦干,放置一段时间就会出现斑点
C.蔗糖放在水中片刻后消失了
D.稀盐酸洒在大理石台面上产生大量气泡
3.下列中国传统工艺, 利用氧化还原反应原理实现的是( )
A.A B.B C.C D.D
4.下列属于氧化还原反应的是( )
A.SO3+H2O = H2SO4
B.CaCO3+SiO2 CaSiO3+CO2↑
C.NaCl+CO2+NH3+H2O=NaHCO3↓+NH4Cl
D.N2+3H2 2NH3
5.在2KMnO4+16HCl=2KCl+2MnCl2+5Cl2↑+8H2O反应中( )
A.氧化剂与还原剂的物质的量之比为1∶8
B.氧化剂与还原剂的物质的量之比为5∶1
C.氧化产物与还原产物的物质的量之比为5∶2
D.氧化产物与还原产物的物质的量之比为2∶5
6.下列化学反应属于氧化还原反应,且水做氧化剂的是( )
A.2F2+2H2O=4HF+O2 B.2Na+2H2O=2NaOH+H2↑
C.CaO+H2O=Ca(OH)2 D.H2+CuO = Cu+H2O
7.下列实验过程中的颜色变化,与氧化还原反应无关的是( )
A.淡黄色Na2O2固体露置于空气中,逐渐变成白色
B.用强光照射氯水,一段时间后溶液变成无色
C.向氯水中滴加KI溶液,溶液变成棕黄色
D.向FeCl3溶液中滴加NaOH溶液,产生红褐色沉淀
8.下列化学反应中水作氧化剂的是( )
A.SO2+H2O B.Fe+H2O C.Cl2+H2O D.NO2+H2O
9.将7.28g Fe溶于过量的稀H2SO4中,在加热的条件下,用2.02gKNO3去氧化溶液中Fe2+,待反应完全后,剩余Fe2+还需0.4mol/L KMnO4溶液25mL才能完全氧化,则KNO3的还原产物( )
A.NO B.NO2 C.N2O D.N2O3
10.常温下,下列各组离子在指定溶液中能大量共存的是( )
A.0.1mol·L-1KI溶液中:Na+、K+、ClO-、OH-
B.0.1mol·L-1Fe2(SO4)3溶液中:K+、Cu2+、I-、Cl-
C.pH=7的溶液中:Al3+、Na+、SO 、SO
D.pH=11的溶液中:Na+、NO 、S2-、SO
11.已知下列反应:Co2O3+6HCl(浓)═2CoCl2+Cl2↑+3H2O (I) 5Cl2+I2+6H2O═10HCl+2HIO3 (II)下列说法正确的是( )
A.反应Ⅱ中Cl2发生氧化反应 B.反应I中HCl是氧化剂
C.还原性:CoCl2>HCl> I2 D.氧化性:Co2O3>Cl2>HIO3
12.已知:①Br2+2Fe2+=2Fe3++2Br-②Cl2+2Br-=Br2+2Cl-。下列说法错误的是( )
A.向FeBr2溶液滴入少量新制氯水,Br-先被氧化
B.向FeBr2溶液滴入少量新制氯水,Fe2+先被氧化
C.2FeCl2+Cl2=2FeCl3反应能发生
D.氧化性:Cl2>Br2>Fe3+
13.宋代著名法医学家宋慈的《洗冤集录》中有﹣银针验毒的记载,“银针验毒”的原理是 4Ag+2H2S+O2═2X+2H2O,下列说法正确的是( )
A.X的化学式为AgS
B.银针验毒时,空气中氧气失去电子
C.反应中Ag和H2S均是还原剂
D.每生成1mo1X,反应转移2mo1 e﹣
14.某离子反应涉及H2O、 、 、H+、N2、 六种微粒。其中 随反应进行逐渐减小(溶液的总体积不变)。下列判断正确的是( )
A.反应的氧化产物是
B.反应后溶液的酸性明显增强
C.氧化剂与还原剂的物质的量之比为
D.反应方程式中H2O出现在反应物
15.3S+ 6KOH =2K2S+ K2SO3+3H2O中氧化剂与还原剂的物质的量之比为( )
A.1∶2 B.1∶1 C.2∶1 D.3∶1
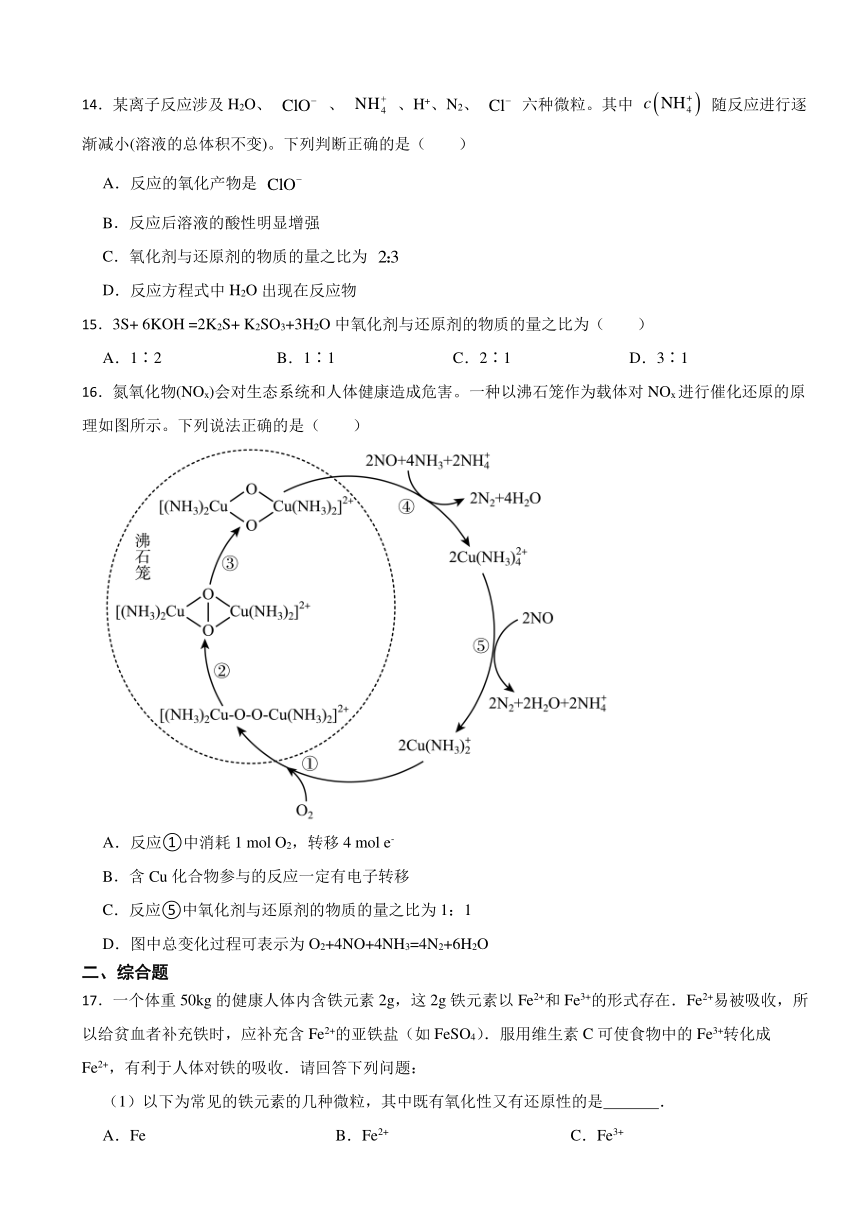
16.氮氧化物(NOx)会对生态系统和人体健康造成危害。一种以沸石笼作为载体对NOx进行催化还原的原理如图所示。下列说法正确的是( )
A.反应①中消耗1 mol O2,转移4 mol e-
B.含Cu化合物参与的反应一定有电子转移
C.反应⑤中氧化剂与还原剂的物质的量之比为1:1
D.图中总变化过程可表示为O2+4NO+4NH3=4N2+6H2O
二、综合题
17.一个体重50kg的健康人体内含铁元素2g,这2g铁元素以Fe2+和Fe3+的形式存在.Fe2+易被吸收,所以给贫血者补充铁时,应补充含Fe2+的亚铁盐(如FeSO4).服用维生素C可使食物中的Fe3+转化成Fe2+,有利于人体对铁的吸收.请回答下列问题:
(1)以下为常见的铁元素的几种微粒,其中既有氧化性又有还原性的是 .
A.Fe B.Fe2+ C.Fe3+
(2)维生素C可使食物中的Fe3+转化为Fe2+,在此过程中 是氧化剂,说明维生素C具有 性.
(3)在人体中进行Fe2+ Fe3+的转化时,
①反应中的Fe2+发生 反应,②反应中的Fe3+被 .
(4)市场上出售的某种麦片中含有微量的颗粒细小的还原性铁粉,这些铁粉在人体胃酸(主要成分是盐酸)的作用下转化成亚铁盐.此反应的化学方程式为 ,离子方程式为 .
(5)已知下列反应:
①H2O2+2Fe3+=2Fe2++O2↑+2H+②2Fe2++H2O2+2H+=2Fe3++2H2O
反应①中生成1molO2转移电子的物质的量为 ,反应①、②的总反应方程式为 ,
在该反应中Fe3+的作用为 .
(6)在Fe+4HNO3=Fe(NO3)3+NO↑+2H2O的反应中,HNO3表现了 性和 性,毎有1molFe参加反应转移电子 mol.
18.HNO2是一种弱酸,且不稳定,易分解生成NO和NO2;它能被常见的强氧化剂氧化;在酸性溶液中它也是一种氧化剂,如能把Fe2+氧化成Fe3+.AgNO2是一种难溶于水、易溶于酸的化合物.试回答下列问题:
(1)人体正常的血红蛋白含有Fe2+.若误食亚硝酸盐(如NaNO2),则导致血红蛋白中的Fe2+转化为Fe3+而中毒,服用维生素C可解毒.下列叙述不正确的是 (填序号).
A.亚硝酸盐被还原 B.维生素C是还原剂
C.维生素C将Fe3+还原为Fe2+ D.亚硝酸盐是还原剂
(2)下列方法中,不能用来区分NaNO2和NaCl的是 (填序号).
A.测定这两种溶液的pH
B.分别在两种溶液中滴加甲基橙
C.在酸性条件下加入KI﹣淀粉溶液来区别
D.用AgNO3和HNO3两种试剂来区别
(3)某同学把新制的氯水加到NaNO2溶液中,观察到氯水褪色,请写出反应的离子方式: .
(4)Fe与过量稀硫酸反应可以制取FeSO4.若用反应所得的酸性溶液,将Fe2+转化为Fe3+,要
求产物纯净,可选用的最佳试剂是 (填序号).
a.Cl2 b.Fe c.H2O2 d.HNO3
(5)若FeSO4和O2的化学计量数比为2:1,试配平下列方程式:
FeSO4+ K2O2→ K2FeO4+ K2O+ K2SO4+ O2↑
当转移了1.5NA个电子时,在标况下可收集到 L氧气.
19.
(1)现有8种物质:①②③浓硫酸④铝⑤胶体 ⑥蔗糖溶液⑦⑧上述物质中属于电解质的有 (选填序号);写出②的溶液与⑤反应的离子方程式
(2)饮用水中的对人类健康会产生危害,为了降低饮用水中的浓度,研究人员提出,在碱性条件下可以用铝粉处理,发生反应的化学方程式为:,该反应中,还原剂为 ,若反应过程中转移,则生成标准状况下的体积为 。
(3)在含有一定量和溶质的溶液中,逐滴滴入一定浓度的稀盐酸,产生的物质的量与滴入盐酸的量的关系如图,回答下列问题:
①点发生反应的离子方程式为
②与物质的量之比为
③ (用含的代数式表示)
(4)现有密度为,浓度为的浓硫酸,则该溶液中溶质的质量分数为
20.根据问题填空:
(1)完成下列离子方程式(已给出的化学计量数不可变动): +3H+═Fe3++
(2)各写出一个符合以下离子方程式的化学方程式:Ba2++SO ═BaSO4↓
(3)写出下列反应的离子方程式:
①硫酸镁溶液与氢氧化钡溶液反应:②氢氧化铜溶于稀硝酸中:
(4)NaBrO3是一种分析试剂.向硫酸酸化的NaI溶液中逐滴加入NaBrO3溶液,当加入2.6mol NaBrO3时,测得反应后溶液中溴和碘的存在形式及物质的量分别为
粒子 I2 Br2 IO3﹣
物质的量/mol 0.5 1.3
则原溶液中NaI的物质的量为 mol.
21.对于数以千万计的化学物质和为数众多的化学反应,分类法的作用几乎是无可代替的。
(1)Ⅰ现有以下物质:①冰水混合物 ②水银 ③铁红 ④氯水 ⑤乙醇 ⑥干冰 ⑦浓硫酸 ⑧液氯
以上物质中属于混合物的是 (填序号,下同)。
(2)属于电解质的是 ,属于非电解质的是 。
(3)Ⅱ.虽然分类的方法不同,但四种基本反应类型和离子反应、氧化还原反应之间也存在着一定的关系。
下图为离子反应、氧化还原反应和置换反应三者之间的关系,其中表示置换反应的是 (填字母)。
(4)有同学认为所有酸碱中和反应均可表示为。请举个例子反驳上述观点(用化学方程式表示) 。
(5)宋代著名法医学家宋慈的《洗冤集录》中有“银针验毒”的记载,“银针验毒”的原理为:。则X的化学式是 。其中H2S在该反应中作 (填字母)。
A.氧化剂 B.还原剂
C.既是氧化剂又是还原剂 D.既不是氧化剂又不是还原剂
答案解析部分
1.【答案】A
【解析】【解答】A.根瘤菌固氮为游离态的氮转化为化合态的氮,为氧化还原反应,故A符合题意;
B.生石灰作干燥剂为CaO+H2O=Ca(OH)2,为非氧化还原反应,故B不符合题意;
C.氢氧化铝作胃酸中和剂发生反应Al(OH)3+3H+=Al3++3H2O,为非氧化还原反应,故C不符合题意;
D.用纯碱清洗铁屑表面油脂是油脂的水解反应,为非氧化还原反应,故D不符合题意;
故答案为:A。
【分析】发生氧化还原反应说明有元素的化合价发生变化。
A.根瘤菌固氮将氮气转化为化合态的氮,有元素化合价变化,发生氧化还原反应;
B.生石灰吸水生成氢氧化钙,无元素化合价变化;
C.氢氧化铝中和胃酸生成氯化铝和水,无元素化合价变化;
D.油脂的水解无元素化合价变化。
2.【答案】B
【解析】【解答】A.食醋中含醋酸,水垢中主要含难溶的钙盐和氢氧化镁等,所以用食醋可以洗水垢涉及复分解反应,不涉及氧化还原反应,A不符合题意;
B.菜刀上出现斑点,是铁发生腐蚀生成了铁锈,有元素化合价的升降,发生了氧化还原反应,B符合题意;
C.蔗糖放在水中片刻后消失了,是因为蔗糖溶于水,是物理变化,C不符合题意;
D.发生复分解反应,与氧化还原知识无关,D不符合题意;
故答案为:B。
【分析】分析变化过程中是否有元素化合价发生变化,若有元素化合价发生变化,则与氧化还原知识有关;若无元素化合价变化,则与氧化还原知识无关。
3.【答案】A
【解析】【解答】A. 硫化汞在空气中焙烧得到汞,汞的化合价由+2价降低到0价,该过程发生的是氧化还原反应,A符合题意;
B. 石灰石高温分解生成生石灰,该过程中所有元素的化合价没有变化,不是氧化还原反应,B不符合题意;
C.酒精蒸馏过程中只发生了物理变化,C不符合题意;
D. 蚕丝织锦只发生了物理变化,D不符合题意;
故答案为:A
【分析】分析反应过程中是否涉有元素化合价发生变化,若有元素化合价发生变化,则利用氧化还原反应原理;若无元素化合价发生变化,则没有利用氧化还原反应原理。
4.【答案】D
【解析】【解答】A、各元素化合价没有发生变化,故不是氧化还原反应;故A不符合题意;
B、各元素化合价没有发生变化,故不是氧化还原反应;故B不符合题意;
C、各元素化合价没有发生变化,故不是氧化还原反应;故C不符合题意;
D、N元素由0价变为-3价,H元素由0价变为+1价,为氧化还原反应,故D符合题意;
故答案为:D。
【分析】氧化还原反应判断依据:有无化合价的升降。
5.【答案】C
【解析】【解答】在2KMnO4+16HCl═2KCl+2MnCl2+5Cl2↑+8H2O反应中,Mn元素化合价降低,被还原,Cl元素化合价升高,被氧化,KMnO4为氧化剂,HCl为还原剂,Cl2为氧化产物,MnCl2为还原产物,当有2molKMnO4参加反应时,有10molHCl被氧化,则氧化剂与还原剂的物质的量之比为1:5,氧化产物与还原产物的物质的量之比为5:2,C符合题意;
故答案为:C。
【分析】在氧化还原反应中,化合价升高的为还原剂,被氧化,生成氧化产物;化合价降低的为氧化剂,被还原,生成还原产物。
6.【答案】B
【解析】【解答】A、O和F元素的化合价发生变化,属于氧化还原反应,水为还原剂,故A不符合题意;
B、H元素的化合价发生变化,属于氧化还原反应,水为氧化剂,故B符合题意;
C、各元素的化合价都没有发生变化,不是氧化还原反应,故C不符合题意;
D、H、Cu元素的化合价发生变化,属于氧化还原反应,水既不作氧化剂又不作还原剂,不符合题意;
故答案为:B。
【分析】氧化还原反应中,化合价升高的元素作还原剂,降低的元素作氧化剂;
A、水中氧元素化合价由-2升高到0,作还原剂;
B、水中氧元素化合价不变,氢元素化合价由+1降低到0;
C、氧化钙与水生成氢氧化钙,化合价不变;
D、氢气还原氧化铜生成铜单质和水,水为氧化产物;
7.【答案】D
【解析】【解答】A.淡黄色Na2O2固体露置于空气中,逐渐变成白色,Na2O2与空气中CO2或水反应反应过程中生成O2,是氧化还原反应,A有关;
B.氯水中含有HClO,HClO见光易分解,是氧化还原反应,B有关;
C.Cl2具有氧化性,可以氧化I-,该反应是氧化还原反应,C有关;
D.Fe3+与OH-反应生成沉淀,该反应不属氧化还原反应,D无关;
故答案为:D。
【分析】发生的反应中,存在元素的化合价变化,与氧化还原反应有关;反之,不存在元素的化合价变化,则与氧化还原反应无关,以此解答该题。
8.【答案】B
【解析】【解答】解:A、SO2+H2O=H2SO3反应中各元素的化合价不变,所以不是氧化还原反应,故A错误.
B、3Fe+4H2O(g) Fe3O4+4H2↑反应中氢元素化合价降低,所以该反应是氧化还原反应且水作氧化剂,故B正确.
C、Cl2+H2O=HCl+HClO反应中氯元素的化合价部分升高部分降低,所以该反应是氧化还原反应,但水中的氢、氧元素化合价不变,所以水既不做氧化剂也不做还原剂,故C错误.
D、3NO2+H2O=2HNO3+NO反应中氮元素的化合价部分升高部分降低,所以该反应是氧化还原反应,但水中的氢、氧元素化合价不变,所以水既不做氧化剂也不做还原剂,故D错误.
故选B.
【分析】有元素化合价变化的化学反应是氧化还原反应,化合价降低的反应物作氧化剂,水只作氧化剂说明水中的氢元素化合价降低(注意氧元素化合价不能再降低),据此分析.
9.【答案】C
【解析】【解答】解:铁和稀硫酸反应生成Fe2+,亚铁离子被硝酸钾、被高锰酸钾氧化生成生成铁离子,高锰酸钾的物质的量=0.4mol/L×0.025L=0.01mol,硝酸钾的物质的量为: =0.02mol,铁的物质的量为: =0.13mol,
设硝酸钾的还原产物中N元素的化合价为x,
根据转移电子守恒得:0.13mol×(3﹣2)=0.02mol×(5﹣x)+0.01mol×(7﹣2),
解得:x=1,
所以反应生成的还原产物为N2O,
故选C.
【分析】铁和稀硫酸反应生成Fe2+,亚铁离子被硝酸钾、被高锰酸钾氧化生成生成铁离子,根据得失电子守恒进行计算,高锰酸钾的物质的量=0.4mol/L×0.025L=0.01mol,硝酸钾的物质的量= =0.02mol,铁的物质的量= =0.13mol,然后利用电子守恒列式计算.
10.【答案】D
【解析】【解答】A.ClO-具有氧化性,I-具有还原性,两者会发生氧化还原反应不能大量共存,故A不选;
B.Fe3+具有氧化性,I-具有还原性,两者会发生氧化还原反应不能大量共存,故B不选;
C.Al3+与SO 会发生双水解反应不能大量共存,故C不选;
D.pH=11的溶液呈碱性,Na+、NO 、S2-、SO 可以大量共存,故D选。
故答案为:D。
【分析】离子之间相互发生反应,需满足以下条件:
1、生成难溶物,如Ba2+与SO42-等;
2、生成易挥发物,如CO32-与H+等;
3、生成难电离物,如H+与CH3COO-等;
4、发生氧化还原反应:如Fe3+与I-、S2-,NO3-(H+)与Fe2+等;
5、发生彻底双水解反应:如Al3+与CO32-、HCO3-或AlO2-等;
6、发生络合反应:如Fe3+与SCN-等;
若不发生以上任何反应,则可以大量共存。
11.【答案】D
【解析】【解答】A、反应II中Cl元素的化合价降低,则氯气为氧化剂被还原,发生还原反应,A不符合题意;
B、反应I中Cl元素的化合价升高,则HCl为还原剂,B不符合题意;
C、由还原剂的还原性大于还原产物的还原性可知,I中还原性为HCl>CoCl2,II中还原性为I2>HCl,所以还原性:I2>HCl>CoCl2,C不符合题意;
D、由氧化剂的氧化性大于氧化产物的氧化性可知,I中氧化性为Co2O3>Cl2,II中氧化性为Cl2>HIO3,则氧化性为Co2O3>Cl2>HIO3,D符合题意;
故答案为:D
【分析】A、反应Ⅱ中氯元素的化合价降低,被还原;
B、反应Ⅰ中氯元素的化合价升高,被氧化;
C、在氧化还原反应中,还原剂的还原性比还原产物的还原性强;
D、在氧化还原反应中,氧化剂的氧化性比氧化产物的氧化性强;
12.【答案】A
【解析】【解答】A.还原性:Fe2+>Br-,故向FeBr2溶液滴入少量新制氯水,Fe2+先被氧化,A符合题意;
B.还原性:Fe2+>Br-,故向FeBr2溶液滴入少量新制氯水,Fe2+先被氧化,B不符合题意;
C.氧化性:Cl2>Br2>Fe3+,还原性:Fe2+>Br->Cl-,则2FeCl2+Cl2=2FeCl3反应能发生,C不符合题意;
D.由分析可知,氧化性:Cl2>Br2>Fe3+,D不符合题意。
故答案为:A。
【分析】①Br2+2Fe2+=2Fe3++2Br-,氧化性:Br2>Fe3+,还原性:Fe2+>Br-;
②Cl2+2Br-=Br2+2Cl-,氧化性:Cl2>Br2,还原性:Br->Cl-;
综上所述,氧化性:Cl2>Br2>Fe3+,还原性:Fe2+>Br->Cl-。
13.【答案】D
【解析】【解答】解:A.由质量守恒定律可知X的化学式为Ag2S,故A错误;
B.反应中O元素化合价降低,得电子被还原,故B错误;
C.反应中S元素的化合价没有变化,故C错误;
D.根据化合价的变化可知每生成1mo1X,反应转移2mo1e﹣,故D正确.
故选D.
【分析】从质量守恒的角度判断X的化学式,根据元素化合价的变化判断物质在氧化还原反应中的作用,并计算转移的电子的物质的量.
14.【答案】B
【解析】【解答】A.具有氧化性的 ClO 为反应物,做氧化剂,N2为氧化产物,故A不符合题意;
B.由方程式可知,生成了氢离子,所以反应后溶液的酸性明显增强,故B符合题意;
C. 由方程式可知,氧化剂 ClO 和还原剂 的物质的量之比为 3:2 ,故C不符合题意;
D.由方程式可知,反应方程式中H2O出现在生成物中,故D不符合题意;
故答案为:B。
【分析】 随反应进行逐渐减小, 应是反应物,N元素化合价发生变化,具有氧化性的ClO-为反应物,由氯元素守恒可知Cl-是生成物,则反应的方程式应为3ClO-+2=N2↑+3H2O+3Cl-+2H+。
15.【答案】C
【解析】【解答】S在反应中既是氧化剂又是还原剂,S元素的化合价从0降低到-2价,化合价降低,K2S是还原产物,对应的S是氧化产物,因此根据反应方程式有2molS作为氧化剂参加反应,部分S从0价到+4价,化合价升高,K2SO3是氧化产物,对应的S是还原剂,因此根据反应方程式有1molS作为还原剂参加反应,氧化剂和还原剂的质量比2×32:1×32=2:1;
故答案为:C。
【分析】氧化剂指的是化合价降低的元素,还原剂指的是化合价升高的元素,根据化学方程式,可知3mol硫原子中有2mol硫原子化合价降低,1mol化合价升高。
16.【答案】D
【解析】【解答】A.根据图示可知在反应①中0价的O2反应后在生成物中含有-O-O,O元素化合价变为-1价,则反应消耗1 mol O2,转移2 mol e-,A不符合题意;
B.根据图示可知反应③中只有O-O非极性键断裂,元素化合价不变,反应为非氧化还原反应,因此含Cu化合物参与的反应比一定有电子转移,B不符合题意;
C.在反应⑤中,氧化剂是NO、,还原剂是,每2个NO得到2×2e-被还原为N2,同时2个得到电子2×e-变为,反应过程共得到电子6e-;同时2个中的2个配位体NH3中N元素失去电子2×3e-=6e-,被氧化为N2,故氧化剂与还原剂的物质的量之比为2:1,C不符合题意;
D.根据图示可知图中总变化过程可表示为O2+4NO+4NH3=4N2+6H2O,D符合题意;
故答案为:D。
【分析】A.根据得失电子守恒计算;
B.有电子转移的反应为氧化还原反应;
C.反应⑤中氧化剂是NO、,还原剂是。
17.【答案】(1)B
(2)Fe3+;还原
(3)氧化;还原
(4)Fe+2HCl═FeCl2+H2↑;Fe+2H+═Fe2++H2↑
(5)2mol;2H2O2═2H2O+O2↑;催化剂
(6)氧化;酸;3
【解析】【解答】解:(1)+2价为Fe元素的中间价态,所以亚铁离子既有氧化性,也有还原性,故答案为:B;(2)维生素C可使食物中的Fe3+转化成Fe2+,Fe元素的化合价降低,所以Fe3+ 是氧化剂,维生素C是还原剂,则维生素C具有还原性,
故答案为:Fe3+;还原;(3)由Fe2+ Fe3+可知,在过程①中Fe2+元素的化合价升高,所以①反应中的Fe2+发生氧化 反应,在过程②中Fe3+元素的化合价降低,则②反应中的Fe3+被还原;故答案为:①氧化;②还原;(4)铁粉在人体胃酸(主要成分时盐酸)的作用下转化成亚铁盐,反应化学方程式为:Fe+2HCl═FeCl2+H2↑,离子方程式为:Fe+2H+═Fe2++H2↑,故答案为:Fe+2HCl═FeCl2+H2↑;Fe+2H+═Fe2++H2↑;(5)H2O2+2Fe3+═2Fe2++O2↑+2H+,氧元素从﹣1价升高到0价,所以生成1mol O2转移电子的物质的量为2mol;反应①、②的总反应方程式为 2H2O2═2H2O+O2↑,Fe3+在反应前后质量不变,性质不变,所以是催化剂,
故答案为:2mol;2H2O2═2H2O+O2↑;催化剂;(6)Fe+4HNO3=Fe(NO3)3+NO↑+2H2O,反应中N元素化合价降低,当4molHNO3参加反应时,有1mol被还原,表现为氧化性,3molHNO3表现为酸性,则反应中硝酸既表现了氧化性又表现了硝酸的酸性;毎有1molFe参加反应转移电子1mol×(3﹣0)=3mol;
故答案为:氧化;酸;3.
【分析】(1)处于中间价态的微粒既有氧化性,也有还原性;(2)维生素C可使食物中的Fe3+转化为Fe2+,Fe元素的化合价降低,则维生素C中某元素的化合价升高;(3)由Fe2+ Fe3+可知,在过程①中Fe2+元素的化合价升高,在过程②中Fe3+元素的化合价降低;(4)铁粉在人体胃酸(主要成分时盐酸)的作用下转化成氯化亚铁和氢气;(5)根据方程式中化合价的变化判断;催化剂在反应前后质量不变,性质不变;(6)Fe+4HNO3=Fe(NO3)3+NO↑+2H2O,反应中N元素化合价降低,当4molHNO3参加反应时,有1mol被还原,表现为氧化性,3molHNO3表现为酸性.
18.【答案】(1)D
(2)B
(3)NO2﹣+Cl2+H2O=NO3﹣+2H++2Cl﹣
(4)c
(5)6;2;2;2;1;3.36
【解析】【解答】解:(1)服用维生素C可以解毒,说明在维生素C作用下Fe3+又转化为Fe2+,Fe元素化合价降低,被氧化,则维生素具有还原性,而亚硝酸盐,会导致Fe2+转化为Fe3+,说明亚硝酸盐具有氧化性被还原,在反应中为氧化剂,所以维生素C是还原剂,
故答案为:D;(2)A.亚硝酸钠是强碱弱酸盐其水溶液呈碱性,氯化钠是强酸强碱盐其水溶液呈中性,相同物质的量浓度的两种溶液的pH不同,所以可以用测定这两种溶液的pH值鉴别,故A不选;
B.亚硝酸钠是强碱弱酸盐其水溶液呈碱性,氯化钠是强酸强碱盐其水溶液呈中性,甲基橙的变色范围是3.1﹣4.4,所以亚硝酸钠和氯化钠溶液加入甲基橙后溶液都呈黄色,反应现象相同,所以不能用甲基橙鉴别,故B选;
C.在酸性条件下,亚硝酸钠和碘离子反应方程式为2NO2﹣+2I﹣+4H+=2NO↑+I2+2H2O,碘遇淀粉变蓝色,氯离子和碘离子不反应,所以反应现象不同,所以可以用酸性条件下的KI淀粉试液来区别,故C不选;
D.亚硝酸根离子不和银离子反应,氯离子和银离子反应生成不溶于硝酸的白色沉淀,反应现象不同,所以可以用AgNO3和HNO3两种试剂来区别,故D不选;
故答案为:B;(3)观察到氯水褪色,同时生成NaNO3和HCl,反应的离子方程式为:NO2﹣+Cl2+H2O=NO3﹣+2H++2Cl﹣,
故答案为:NO2﹣+Cl2+H2O=NO3﹣+2H++2Cl﹣;(4)ad都能氧化亚铁离子,但能引入新的杂质,铁不能氧化亚铁离子,双氧水的还原产物是水,不引入杂质,所以正确额的答案选c;
故选:c;(5)根据方程式可知,铁元素的化合价从+2价升高到+6价,失去4个电子;氧元素的化合价从﹣1价升高到0价,失去1个电子,氧元素的化合价从﹣1价降低到﹣2价,得到1个电子,最小公倍数是8,所以硫酸亚铁前面配2,K2O2前面配6,再根据质量守恒配平其他物质,配平后的方程式为:2FeSO4+6K2O2═2K2FeO4+2K2SO4+2K2O+O2;由反应方程式可知转移10NA个电子,生成22.4L的氧气,转移了1.5NA个电子时,在标况下可收集到 ×22.4L=3.36L;
故答案为:2、6、2、2、2、1;3.36.
【分析】(1)由题给信息可知Fe2+转化为Fe3+而中毒,服用维生素C可以解毒,说明在维生素C作用下Fe3+又转化为Fe2+;(2)A.亚硝酸钠是强碱弱酸盐其水溶液呈碱性,氯化钠是强酸强碱盐其水溶液呈中性;
B.甲基橙的变色范围是3.1﹣4.4;
C.酸性条件下,亚硝酸根离子能被碘离子还原生成一氧化氮,同时生成碘单质;
D.亚硝酸根离子不和银离子反应,氯离子和银离子反应生成白色沉淀;(3)把新制的氯水加到NaNO2溶液中,观察到氯水褪色,同时生成NaNO3和HCl,二者发生氧化还原反应;(4)Cl2、HNO3都能氧化亚铁离子,但能引入新的杂质,铁不能氧化亚铁离子,双氧水的还原产物是水,不引入杂质;(5)根据方程式可知,铁元素的化合价从+2价升高到+6价,失去4个电子;氧元素的化合价从﹣1价升高到0价,失去1个电子,氧元素的化合价从﹣1价降低到﹣2价,得到1个电子,然后根据电子的得失守恒和质量守恒定律配平方程式.
19.【答案】(1)①②;
(2);
(3);;
(4)
【解析】【解答】(1)电解质:在水溶液里或熔融状态下能导电的化合物:①在水溶液里能导电的化合物②在水溶液里和熔融状态下能导电的化合物③浓硫酸是混合物④铝是单质⑤胶体是混合物⑥蔗糖溶液是混合物⑦是单质⑧属于非电解质,上述物质中属于电解质的有①②(选填序号);②的溶液中氢离子与⑤中氢氧化铝反应生成铝离子和水,离子方程式;故答案为:①②;;
(2),该反应中,铝失电子,还原剂为;由方程式每转移30mol电子,生成3mol氮气,若反应过程中转移,则生成标准状况下0.1mol,体积为0.1mol×22.4L mol-1=。故答案为:;;
(3)在含有一定量和溶质的溶液中,逐滴滴入一定浓度的稀盐酸,先发生,再发生,由图产生的物质的量与滴入盐酸的量的关系得:
①点发生反应的离子方程式为,故答案为:;
②与物质的量之比为=(3.5a-2a):a=,故答案为:;
③(3.5a-a)=(用含的代数式表示),故答案为:;
(4)现有密度为,浓度为的浓硫酸,设取1L溶液,则该溶液中溶质的质量分数为 =,故答案为:。
【分析】(1)电解质:在水溶液或熔融状态下能够导电的化合物,常见的有酸、碱、盐、活泼金属氧化物、水;氢氧化铝和强酸反应生成铝离子和水;
(2)化合价升高的元素,其物质作为还原剂;根据化合价变化进行计算,每生成3molN2,转移30mol电子;
(3)稀盐酸先和碳酸钠反应生成碳酸氢钠,此时不会产生气体,为0a段,稀盐酸再和碳酸氢钠反应生成二氧化碳,此时为ab段;
① 为碳酸钠和盐酸反应生成碳酸氢钠和氯化钠;
② 碳酸钠和盐酸按照1:1生成碳酸氢钠,可以据此算出碳酸钠物质的量,碳酸氢钠和盐酸按照1:1生成二氧化碳,可以据此算出碳酸氢钠总量;
③ b为二氧化碳的物质的量,碳酸氢钠和盐酸按照1:1反应生成二氧化碳,碳酸氢钠和二氧化碳的物质的量之比为1:1。
20.【答案】(1)Fe(OH)3;3H2O
(2)BaCl2+H2SO4═BaSO4↓+H2O
(3)Mg2++2OH﹣+Ba2++SO42﹣=BaSO4↓+Mg(OH)2↓
(4)3
【解析】【解答】解:(1)由反应后生成铁离子,则反应为氧化铁或氢氧化铁与酸反应,氧化铁与氢离子反应为:Fe2O3+6H+═2Fe3++3H2O,则该反应物为Fe(OH)3,
故答案为:Fe(OH)3;3H2O;(2)Ba2++SO42﹣═BaSO4↓中保留化学式的只有硫酸钡,其它物质都是易溶强电解质,满足体积的化学方程式如:BaCl2+H2SO4═BaSO4↓+H2O,
故答案为:BaCl2+H2SO4═BaSO4↓+H2O;(3)①硫酸镁和氢氧化钡溶液反应生成氢氧化镁和硫酸钡,离子方程式为Mg2++2OH﹣+Ba2++SO42﹣=BaSO4↓+Mg(OH)2↓,
故答案为:Mg2++2OH﹣+Ba2++SO42﹣=BaSO4↓+Mg(OH)2↓;②氢氧化铜和稀硝酸反应生成硝酸铜和水,反应的离子方程式为:Cu(OH)2+2H+=Cu2++2H2O,
故答案为:Cu(OH)2+2H+=Cu2++2H2O;(4)2.6mol NaBrO3反应生成溴单质时转移的电子数为2.6×5=13mol,生成碘为0.5mol,转移的电子为1mol,则生成IO3﹣转移的电子数为12mol,生成IO3﹣的物质的量为2mol,根据碘原子守恒,则原溶液中NaI的物质的量为2+1=3mol,
故答案为:3.
【分析】(1)与酸反应后生成铁离子,则反应前未知物为氧化铁或氢氧化铁,根据消耗氢离子判断反应物;(2)该反应为可溶性钡盐与硫酸或可溶性硫酸盐的反应;(3)①硫酸镁和氢氧化钡溶液反应生成氢氧化镁和硫酸钡;②氢氧化铜和稀硝酸反应生成硝酸铜和水;(4)根据离子反应情况以及电子守恒来计算.
21.【答案】(1)④⑦
(2)①③;⑤⑥
(3)B
(4)(合理均可)
(5)Ag2S;D
【解析】【解答】(1)④氯水是氯气的水溶液,含有Cl2、H2O、HClO、H+、Cl-、ClO-、OH-多种微粒,因此属于混合物;
⑦浓硫酸中含有H2SO4、H2O、H+、 、OH-多种微粒,因此属于混合物;
故属于混合物的物质序号是①④;
(2)①冰水混合物中只含有一种化合物H2O,其中含有的H2O能够微弱的电离产生H+、OH-,故H2O属于电解质;
③铁红是Fe2O3,属于金属氧化物,在熔融状态下能够发生电离而导电,属于电解质;则属于电解质的物质序号是①③;
⑤乙醇、⑥干冰都是由分子构成的化合物,在水溶液中和熔融状态下都不能因自身发生电离而导电,因此它们都是非电解质,故属于非电解质的物质序号是⑤⑥;
(3)置换反应都是氧化还原反应,置换反应有一部分属于离子反应,氧化还原反应一部分是离子反应,一部分不是氧化还原反应,则上述关系中能够表示置换反应的是B;A表示氧化还原反应,C表示离子反应;
(4) 只能表示强酸与强碱生成可溶性盐和水的反应,而H2SO4与Ba(OH)2发生中和反应除生成H2O外,还产生BaSO4沉淀,该反应就不能用上述离子方程式表示,该反应的化学方程式为: ,其离子方程式为:Ba2++2OH-+2H++ =BaSO4↓+2H2O;
(5)“银针验毒”的原理为: 。根据质量守恒定律可知反应前后各种元素守恒,则X的化学式是Ag2S。在该反应中Ag元素化合价升高,O元素化合价降低,所以单质Ag为还原剂,O2为氧化剂,而H2S的组成元素在反应前后元素化合价都不变,因此H2S既不是氧化剂又不是还原剂,故答案为:D。
【分析】(1)、(2)物质根据组成的种类分为混合物和纯净物,纯净物根据组成的元素种类分为单质和化合物,化合物中的酸、碱、盐、活泼金属氧化物、水属于电解质;
(3)置换反应一定是氧化还原反应,在溶液中发生的置换反应是离子反应,所以A是氧化还原反应,C是离子反应,B是置换反应;
(4)OH-+H+=H2O表示可溶性强酸和强碱只生成盐和水的反应,弱酸和难溶性见弱碱不可拆,还生成其他沉淀的反应,不可以用这个离子反应表示;
(5) 根据化学反应前后原子的种类不变判断X的化学式, H2S 在反应元素化合价都不变,因此H2S既不是氧化剂又不是还原剂。
一、单选题
1.下列叙述涉及氧化还原反应的是( )
A.根瘤菌固氮 B.生石灰作干燥剂
C.氢氧化铝作胃酸中和剂 D.用纯碱清洗铁屑表面油脂
2.下列生活中的化学现象与氧化还原知识有关的是( )
A.用食醋可以洗水垢
B.菜刀洗过后如果没擦干,放置一段时间就会出现斑点
C.蔗糖放在水中片刻后消失了
D.稀盐酸洒在大理石台面上产生大量气泡
3.下列中国传统工艺, 利用氧化还原反应原理实现的是( )
A.A B.B C.C D.D
4.下列属于氧化还原反应的是( )
A.SO3+H2O = H2SO4
B.CaCO3+SiO2 CaSiO3+CO2↑
C.NaCl+CO2+NH3+H2O=NaHCO3↓+NH4Cl
D.N2+3H2 2NH3
5.在2KMnO4+16HCl=2KCl+2MnCl2+5Cl2↑+8H2O反应中( )
A.氧化剂与还原剂的物质的量之比为1∶8
B.氧化剂与还原剂的物质的量之比为5∶1
C.氧化产物与还原产物的物质的量之比为5∶2
D.氧化产物与还原产物的物质的量之比为2∶5
6.下列化学反应属于氧化还原反应,且水做氧化剂的是( )
A.2F2+2H2O=4HF+O2 B.2Na+2H2O=2NaOH+H2↑
C.CaO+H2O=Ca(OH)2 D.H2+CuO = Cu+H2O
7.下列实验过程中的颜色变化,与氧化还原反应无关的是( )
A.淡黄色Na2O2固体露置于空气中,逐渐变成白色
B.用强光照射氯水,一段时间后溶液变成无色
C.向氯水中滴加KI溶液,溶液变成棕黄色
D.向FeCl3溶液中滴加NaOH溶液,产生红褐色沉淀
8.下列化学反应中水作氧化剂的是( )
A.SO2+H2O B.Fe+H2O C.Cl2+H2O D.NO2+H2O
9.将7.28g Fe溶于过量的稀H2SO4中,在加热的条件下,用2.02gKNO3去氧化溶液中Fe2+,待反应完全后,剩余Fe2+还需0.4mol/L KMnO4溶液25mL才能完全氧化,则KNO3的还原产物( )
A.NO B.NO2 C.N2O D.N2O3
10.常温下,下列各组离子在指定溶液中能大量共存的是( )
A.0.1mol·L-1KI溶液中:Na+、K+、ClO-、OH-
B.0.1mol·L-1Fe2(SO4)3溶液中:K+、Cu2+、I-、Cl-
C.pH=7的溶液中:Al3+、Na+、SO 、SO
D.pH=11的溶液中:Na+、NO 、S2-、SO
11.已知下列反应:Co2O3+6HCl(浓)═2CoCl2+Cl2↑+3H2O (I) 5Cl2+I2+6H2O═10HCl+2HIO3 (II)下列说法正确的是( )
A.反应Ⅱ中Cl2发生氧化反应 B.反应I中HCl是氧化剂
C.还原性:CoCl2>HCl> I2 D.氧化性:Co2O3>Cl2>HIO3
12.已知:①Br2+2Fe2+=2Fe3++2Br-②Cl2+2Br-=Br2+2Cl-。下列说法错误的是( )
A.向FeBr2溶液滴入少量新制氯水,Br-先被氧化
B.向FeBr2溶液滴入少量新制氯水,Fe2+先被氧化
C.2FeCl2+Cl2=2FeCl3反应能发生
D.氧化性:Cl2>Br2>Fe3+
13.宋代著名法医学家宋慈的《洗冤集录》中有﹣银针验毒的记载,“银针验毒”的原理是 4Ag+2H2S+O2═2X+2H2O,下列说法正确的是( )
A.X的化学式为AgS
B.银针验毒时,空气中氧气失去电子
C.反应中Ag和H2S均是还原剂
D.每生成1mo1X,反应转移2mo1 e﹣
14.某离子反应涉及H2O、 、 、H+、N2、 六种微粒。其中 随反应进行逐渐减小(溶液的总体积不变)。下列判断正确的是( )
A.反应的氧化产物是
B.反应后溶液的酸性明显增强
C.氧化剂与还原剂的物质的量之比为
D.反应方程式中H2O出现在反应物
15.3S+ 6KOH =2K2S+ K2SO3+3H2O中氧化剂与还原剂的物质的量之比为( )
A.1∶2 B.1∶1 C.2∶1 D.3∶1
16.氮氧化物(NOx)会对生态系统和人体健康造成危害。一种以沸石笼作为载体对NOx进行催化还原的原理如图所示。下列说法正确的是( )
A.反应①中消耗1 mol O2,转移4 mol e-
B.含Cu化合物参与的反应一定有电子转移
C.反应⑤中氧化剂与还原剂的物质的量之比为1:1
D.图中总变化过程可表示为O2+4NO+4NH3=4N2+6H2O
二、综合题
17.一个体重50kg的健康人体内含铁元素2g,这2g铁元素以Fe2+和Fe3+的形式存在.Fe2+易被吸收,所以给贫血者补充铁时,应补充含Fe2+的亚铁盐(如FeSO4).服用维生素C可使食物中的Fe3+转化成Fe2+,有利于人体对铁的吸收.请回答下列问题:
(1)以下为常见的铁元素的几种微粒,其中既有氧化性又有还原性的是 .
A.Fe B.Fe2+ C.Fe3+
(2)维生素C可使食物中的Fe3+转化为Fe2+,在此过程中 是氧化剂,说明维生素C具有 性.
(3)在人体中进行Fe2+ Fe3+的转化时,
①反应中的Fe2+发生 反应,②反应中的Fe3+被 .
(4)市场上出售的某种麦片中含有微量的颗粒细小的还原性铁粉,这些铁粉在人体胃酸(主要成分是盐酸)的作用下转化成亚铁盐.此反应的化学方程式为 ,离子方程式为 .
(5)已知下列反应:
①H2O2+2Fe3+=2Fe2++O2↑+2H+②2Fe2++H2O2+2H+=2Fe3++2H2O
反应①中生成1molO2转移电子的物质的量为 ,反应①、②的总反应方程式为 ,
在该反应中Fe3+的作用为 .
(6)在Fe+4HNO3=Fe(NO3)3+NO↑+2H2O的反应中,HNO3表现了 性和 性,毎有1molFe参加反应转移电子 mol.
18.HNO2是一种弱酸,且不稳定,易分解生成NO和NO2;它能被常见的强氧化剂氧化;在酸性溶液中它也是一种氧化剂,如能把Fe2+氧化成Fe3+.AgNO2是一种难溶于水、易溶于酸的化合物.试回答下列问题:
(1)人体正常的血红蛋白含有Fe2+.若误食亚硝酸盐(如NaNO2),则导致血红蛋白中的Fe2+转化为Fe3+而中毒,服用维生素C可解毒.下列叙述不正确的是 (填序号).
A.亚硝酸盐被还原 B.维生素C是还原剂
C.维生素C将Fe3+还原为Fe2+ D.亚硝酸盐是还原剂
(2)下列方法中,不能用来区分NaNO2和NaCl的是 (填序号).
A.测定这两种溶液的pH
B.分别在两种溶液中滴加甲基橙
C.在酸性条件下加入KI﹣淀粉溶液来区别
D.用AgNO3和HNO3两种试剂来区别
(3)某同学把新制的氯水加到NaNO2溶液中,观察到氯水褪色,请写出反应的离子方式: .
(4)Fe与过量稀硫酸反应可以制取FeSO4.若用反应所得的酸性溶液,将Fe2+转化为Fe3+,要
求产物纯净,可选用的最佳试剂是 (填序号).
a.Cl2 b.Fe c.H2O2 d.HNO3
(5)若FeSO4和O2的化学计量数比为2:1,试配平下列方程式:
FeSO4+ K2O2→ K2FeO4+ K2O+ K2SO4+ O2↑
当转移了1.5NA个电子时,在标况下可收集到 L氧气.
19.
(1)现有8种物质:①②③浓硫酸④铝⑤胶体 ⑥蔗糖溶液⑦⑧上述物质中属于电解质的有 (选填序号);写出②的溶液与⑤反应的离子方程式
(2)饮用水中的对人类健康会产生危害,为了降低饮用水中的浓度,研究人员提出,在碱性条件下可以用铝粉处理,发生反应的化学方程式为:,该反应中,还原剂为 ,若反应过程中转移,则生成标准状况下的体积为 。
(3)在含有一定量和溶质的溶液中,逐滴滴入一定浓度的稀盐酸,产生的物质的量与滴入盐酸的量的关系如图,回答下列问题:
①点发生反应的离子方程式为
②与物质的量之比为
③ (用含的代数式表示)
(4)现有密度为,浓度为的浓硫酸,则该溶液中溶质的质量分数为
20.根据问题填空:
(1)完成下列离子方程式(已给出的化学计量数不可变动): +3H+═Fe3++
(2)各写出一个符合以下离子方程式的化学方程式:Ba2++SO ═BaSO4↓
(3)写出下列反应的离子方程式:
①硫酸镁溶液与氢氧化钡溶液反应:②氢氧化铜溶于稀硝酸中:
(4)NaBrO3是一种分析试剂.向硫酸酸化的NaI溶液中逐滴加入NaBrO3溶液,当加入2.6mol NaBrO3时,测得反应后溶液中溴和碘的存在形式及物质的量分别为
粒子 I2 Br2 IO3﹣
物质的量/mol 0.5 1.3
则原溶液中NaI的物质的量为 mol.
21.对于数以千万计的化学物质和为数众多的化学反应,分类法的作用几乎是无可代替的。
(1)Ⅰ现有以下物质:①冰水混合物 ②水银 ③铁红 ④氯水 ⑤乙醇 ⑥干冰 ⑦浓硫酸 ⑧液氯
以上物质中属于混合物的是 (填序号,下同)。
(2)属于电解质的是 ,属于非电解质的是 。
(3)Ⅱ.虽然分类的方法不同,但四种基本反应类型和离子反应、氧化还原反应之间也存在着一定的关系。
下图为离子反应、氧化还原反应和置换反应三者之间的关系,其中表示置换反应的是 (填字母)。
(4)有同学认为所有酸碱中和反应均可表示为。请举个例子反驳上述观点(用化学方程式表示) 。
(5)宋代著名法医学家宋慈的《洗冤集录》中有“银针验毒”的记载,“银针验毒”的原理为:。则X的化学式是 。其中H2S在该反应中作 (填字母)。
A.氧化剂 B.还原剂
C.既是氧化剂又是还原剂 D.既不是氧化剂又不是还原剂
答案解析部分
1.【答案】A
【解析】【解答】A.根瘤菌固氮为游离态的氮转化为化合态的氮,为氧化还原反应,故A符合题意;
B.生石灰作干燥剂为CaO+H2O=Ca(OH)2,为非氧化还原反应,故B不符合题意;
C.氢氧化铝作胃酸中和剂发生反应Al(OH)3+3H+=Al3++3H2O,为非氧化还原反应,故C不符合题意;
D.用纯碱清洗铁屑表面油脂是油脂的水解反应,为非氧化还原反应,故D不符合题意;
故答案为:A。
【分析】发生氧化还原反应说明有元素的化合价发生变化。
A.根瘤菌固氮将氮气转化为化合态的氮,有元素化合价变化,发生氧化还原反应;
B.生石灰吸水生成氢氧化钙,无元素化合价变化;
C.氢氧化铝中和胃酸生成氯化铝和水,无元素化合价变化;
D.油脂的水解无元素化合价变化。
2.【答案】B
【解析】【解答】A.食醋中含醋酸,水垢中主要含难溶的钙盐和氢氧化镁等,所以用食醋可以洗水垢涉及复分解反应,不涉及氧化还原反应,A不符合题意;
B.菜刀上出现斑点,是铁发生腐蚀生成了铁锈,有元素化合价的升降,发生了氧化还原反应,B符合题意;
C.蔗糖放在水中片刻后消失了,是因为蔗糖溶于水,是物理变化,C不符合题意;
D.发生复分解反应,与氧化还原知识无关,D不符合题意;
故答案为:B。
【分析】分析变化过程中是否有元素化合价发生变化,若有元素化合价发生变化,则与氧化还原知识有关;若无元素化合价变化,则与氧化还原知识无关。
3.【答案】A
【解析】【解答】A. 硫化汞在空气中焙烧得到汞,汞的化合价由+2价降低到0价,该过程发生的是氧化还原反应,A符合题意;
B. 石灰石高温分解生成生石灰,该过程中所有元素的化合价没有变化,不是氧化还原反应,B不符合题意;
C.酒精蒸馏过程中只发生了物理变化,C不符合题意;
D. 蚕丝织锦只发生了物理变化,D不符合题意;
故答案为:A
【分析】分析反应过程中是否涉有元素化合价发生变化,若有元素化合价发生变化,则利用氧化还原反应原理;若无元素化合价发生变化,则没有利用氧化还原反应原理。
4.【答案】D
【解析】【解答】A、各元素化合价没有发生变化,故不是氧化还原反应;故A不符合题意;
B、各元素化合价没有发生变化,故不是氧化还原反应;故B不符合题意;
C、各元素化合价没有发生变化,故不是氧化还原反应;故C不符合题意;
D、N元素由0价变为-3价,H元素由0价变为+1价,为氧化还原反应,故D符合题意;
故答案为:D。
【分析】氧化还原反应判断依据:有无化合价的升降。
5.【答案】C
【解析】【解答】在2KMnO4+16HCl═2KCl+2MnCl2+5Cl2↑+8H2O反应中,Mn元素化合价降低,被还原,Cl元素化合价升高,被氧化,KMnO4为氧化剂,HCl为还原剂,Cl2为氧化产物,MnCl2为还原产物,当有2molKMnO4参加反应时,有10molHCl被氧化,则氧化剂与还原剂的物质的量之比为1:5,氧化产物与还原产物的物质的量之比为5:2,C符合题意;
故答案为:C。
【分析】在氧化还原反应中,化合价升高的为还原剂,被氧化,生成氧化产物;化合价降低的为氧化剂,被还原,生成还原产物。
6.【答案】B
【解析】【解答】A、O和F元素的化合价发生变化,属于氧化还原反应,水为还原剂,故A不符合题意;
B、H元素的化合价发生变化,属于氧化还原反应,水为氧化剂,故B符合题意;
C、各元素的化合价都没有发生变化,不是氧化还原反应,故C不符合题意;
D、H、Cu元素的化合价发生变化,属于氧化还原反应,水既不作氧化剂又不作还原剂,不符合题意;
故答案为:B。
【分析】氧化还原反应中,化合价升高的元素作还原剂,降低的元素作氧化剂;
A、水中氧元素化合价由-2升高到0,作还原剂;
B、水中氧元素化合价不变,氢元素化合价由+1降低到0;
C、氧化钙与水生成氢氧化钙,化合价不变;
D、氢气还原氧化铜生成铜单质和水,水为氧化产物;
7.【答案】D
【解析】【解答】A.淡黄色Na2O2固体露置于空气中,逐渐变成白色,Na2O2与空气中CO2或水反应反应过程中生成O2,是氧化还原反应,A有关;
B.氯水中含有HClO,HClO见光易分解,是氧化还原反应,B有关;
C.Cl2具有氧化性,可以氧化I-,该反应是氧化还原反应,C有关;
D.Fe3+与OH-反应生成沉淀,该反应不属氧化还原反应,D无关;
故答案为:D。
【分析】发生的反应中,存在元素的化合价变化,与氧化还原反应有关;反之,不存在元素的化合价变化,则与氧化还原反应无关,以此解答该题。
8.【答案】B
【解析】【解答】解:A、SO2+H2O=H2SO3反应中各元素的化合价不变,所以不是氧化还原反应,故A错误.
B、3Fe+4H2O(g) Fe3O4+4H2↑反应中氢元素化合价降低,所以该反应是氧化还原反应且水作氧化剂,故B正确.
C、Cl2+H2O=HCl+HClO反应中氯元素的化合价部分升高部分降低,所以该反应是氧化还原反应,但水中的氢、氧元素化合价不变,所以水既不做氧化剂也不做还原剂,故C错误.
D、3NO2+H2O=2HNO3+NO反应中氮元素的化合价部分升高部分降低,所以该反应是氧化还原反应,但水中的氢、氧元素化合价不变,所以水既不做氧化剂也不做还原剂,故D错误.
故选B.
【分析】有元素化合价变化的化学反应是氧化还原反应,化合价降低的反应物作氧化剂,水只作氧化剂说明水中的氢元素化合价降低(注意氧元素化合价不能再降低),据此分析.
9.【答案】C
【解析】【解答】解:铁和稀硫酸反应生成Fe2+,亚铁离子被硝酸钾、被高锰酸钾氧化生成生成铁离子,高锰酸钾的物质的量=0.4mol/L×0.025L=0.01mol,硝酸钾的物质的量为: =0.02mol,铁的物质的量为: =0.13mol,
设硝酸钾的还原产物中N元素的化合价为x,
根据转移电子守恒得:0.13mol×(3﹣2)=0.02mol×(5﹣x)+0.01mol×(7﹣2),
解得:x=1,
所以反应生成的还原产物为N2O,
故选C.
【分析】铁和稀硫酸反应生成Fe2+,亚铁离子被硝酸钾、被高锰酸钾氧化生成生成铁离子,根据得失电子守恒进行计算,高锰酸钾的物质的量=0.4mol/L×0.025L=0.01mol,硝酸钾的物质的量= =0.02mol,铁的物质的量= =0.13mol,然后利用电子守恒列式计算.
10.【答案】D
【解析】【解答】A.ClO-具有氧化性,I-具有还原性,两者会发生氧化还原反应不能大量共存,故A不选;
B.Fe3+具有氧化性,I-具有还原性,两者会发生氧化还原反应不能大量共存,故B不选;
C.Al3+与SO 会发生双水解反应不能大量共存,故C不选;
D.pH=11的溶液呈碱性,Na+、NO 、S2-、SO 可以大量共存,故D选。
故答案为:D。
【分析】离子之间相互发生反应,需满足以下条件:
1、生成难溶物,如Ba2+与SO42-等;
2、生成易挥发物,如CO32-与H+等;
3、生成难电离物,如H+与CH3COO-等;
4、发生氧化还原反应:如Fe3+与I-、S2-,NO3-(H+)与Fe2+等;
5、发生彻底双水解反应:如Al3+与CO32-、HCO3-或AlO2-等;
6、发生络合反应:如Fe3+与SCN-等;
若不发生以上任何反应,则可以大量共存。
11.【答案】D
【解析】【解答】A、反应II中Cl元素的化合价降低,则氯气为氧化剂被还原,发生还原反应,A不符合题意;
B、反应I中Cl元素的化合价升高,则HCl为还原剂,B不符合题意;
C、由还原剂的还原性大于还原产物的还原性可知,I中还原性为HCl>CoCl2,II中还原性为I2>HCl,所以还原性:I2>HCl>CoCl2,C不符合题意;
D、由氧化剂的氧化性大于氧化产物的氧化性可知,I中氧化性为Co2O3>Cl2,II中氧化性为Cl2>HIO3,则氧化性为Co2O3>Cl2>HIO3,D符合题意;
故答案为:D
【分析】A、反应Ⅱ中氯元素的化合价降低,被还原;
B、反应Ⅰ中氯元素的化合价升高,被氧化;
C、在氧化还原反应中,还原剂的还原性比还原产物的还原性强;
D、在氧化还原反应中,氧化剂的氧化性比氧化产物的氧化性强;
12.【答案】A
【解析】【解答】A.还原性:Fe2+>Br-,故向FeBr2溶液滴入少量新制氯水,Fe2+先被氧化,A符合题意;
B.还原性:Fe2+>Br-,故向FeBr2溶液滴入少量新制氯水,Fe2+先被氧化,B不符合题意;
C.氧化性:Cl2>Br2>Fe3+,还原性:Fe2+>Br->Cl-,则2FeCl2+Cl2=2FeCl3反应能发生,C不符合题意;
D.由分析可知,氧化性:Cl2>Br2>Fe3+,D不符合题意。
故答案为:A。
【分析】①Br2+2Fe2+=2Fe3++2Br-,氧化性:Br2>Fe3+,还原性:Fe2+>Br-;
②Cl2+2Br-=Br2+2Cl-,氧化性:Cl2>Br2,还原性:Br->Cl-;
综上所述,氧化性:Cl2>Br2>Fe3+,还原性:Fe2+>Br->Cl-。
13.【答案】D
【解析】【解答】解:A.由质量守恒定律可知X的化学式为Ag2S,故A错误;
B.反应中O元素化合价降低,得电子被还原,故B错误;
C.反应中S元素的化合价没有变化,故C错误;
D.根据化合价的变化可知每生成1mo1X,反应转移2mo1e﹣,故D正确.
故选D.
【分析】从质量守恒的角度判断X的化学式,根据元素化合价的变化判断物质在氧化还原反应中的作用,并计算转移的电子的物质的量.
14.【答案】B
【解析】【解答】A.具有氧化性的 ClO 为反应物,做氧化剂,N2为氧化产物,故A不符合题意;
B.由方程式可知,生成了氢离子,所以反应后溶液的酸性明显增强,故B符合题意;
C. 由方程式可知,氧化剂 ClO 和还原剂 的物质的量之比为 3:2 ,故C不符合题意;
D.由方程式可知,反应方程式中H2O出现在生成物中,故D不符合题意;
故答案为:B。
【分析】 随反应进行逐渐减小, 应是反应物,N元素化合价发生变化,具有氧化性的ClO-为反应物,由氯元素守恒可知Cl-是生成物,则反应的方程式应为3ClO-+2=N2↑+3H2O+3Cl-+2H+。
15.【答案】C
【解析】【解答】S在反应中既是氧化剂又是还原剂,S元素的化合价从0降低到-2价,化合价降低,K2S是还原产物,对应的S是氧化产物,因此根据反应方程式有2molS作为氧化剂参加反应,部分S从0价到+4价,化合价升高,K2SO3是氧化产物,对应的S是还原剂,因此根据反应方程式有1molS作为还原剂参加反应,氧化剂和还原剂的质量比2×32:1×32=2:1;
故答案为:C。
【分析】氧化剂指的是化合价降低的元素,还原剂指的是化合价升高的元素,根据化学方程式,可知3mol硫原子中有2mol硫原子化合价降低,1mol化合价升高。
16.【答案】D
【解析】【解答】A.根据图示可知在反应①中0价的O2反应后在生成物中含有-O-O,O元素化合价变为-1价,则反应消耗1 mol O2,转移2 mol e-,A不符合题意;
B.根据图示可知反应③中只有O-O非极性键断裂,元素化合价不变,反应为非氧化还原反应,因此含Cu化合物参与的反应比一定有电子转移,B不符合题意;
C.在反应⑤中,氧化剂是NO、,还原剂是,每2个NO得到2×2e-被还原为N2,同时2个得到电子2×e-变为,反应过程共得到电子6e-;同时2个中的2个配位体NH3中N元素失去电子2×3e-=6e-,被氧化为N2,故氧化剂与还原剂的物质的量之比为2:1,C不符合题意;
D.根据图示可知图中总变化过程可表示为O2+4NO+4NH3=4N2+6H2O,D符合题意;
故答案为:D。
【分析】A.根据得失电子守恒计算;
B.有电子转移的反应为氧化还原反应;
C.反应⑤中氧化剂是NO、,还原剂是。
17.【答案】(1)B
(2)Fe3+;还原
(3)氧化;还原
(4)Fe+2HCl═FeCl2+H2↑;Fe+2H+═Fe2++H2↑
(5)2mol;2H2O2═2H2O+O2↑;催化剂
(6)氧化;酸;3
【解析】【解答】解:(1)+2价为Fe元素的中间价态,所以亚铁离子既有氧化性,也有还原性,故答案为:B;(2)维生素C可使食物中的Fe3+转化成Fe2+,Fe元素的化合价降低,所以Fe3+ 是氧化剂,维生素C是还原剂,则维生素C具有还原性,
故答案为:Fe3+;还原;(3)由Fe2+ Fe3+可知,在过程①中Fe2+元素的化合价升高,所以①反应中的Fe2+发生氧化 反应,在过程②中Fe3+元素的化合价降低,则②反应中的Fe3+被还原;故答案为:①氧化;②还原;(4)铁粉在人体胃酸(主要成分时盐酸)的作用下转化成亚铁盐,反应化学方程式为:Fe+2HCl═FeCl2+H2↑,离子方程式为:Fe+2H+═Fe2++H2↑,故答案为:Fe+2HCl═FeCl2+H2↑;Fe+2H+═Fe2++H2↑;(5)H2O2+2Fe3+═2Fe2++O2↑+2H+,氧元素从﹣1价升高到0价,所以生成1mol O2转移电子的物质的量为2mol;反应①、②的总反应方程式为 2H2O2═2H2O+O2↑,Fe3+在反应前后质量不变,性质不变,所以是催化剂,
故答案为:2mol;2H2O2═2H2O+O2↑;催化剂;(6)Fe+4HNO3=Fe(NO3)3+NO↑+2H2O,反应中N元素化合价降低,当4molHNO3参加反应时,有1mol被还原,表现为氧化性,3molHNO3表现为酸性,则反应中硝酸既表现了氧化性又表现了硝酸的酸性;毎有1molFe参加反应转移电子1mol×(3﹣0)=3mol;
故答案为:氧化;酸;3.
【分析】(1)处于中间价态的微粒既有氧化性,也有还原性;(2)维生素C可使食物中的Fe3+转化为Fe2+,Fe元素的化合价降低,则维生素C中某元素的化合价升高;(3)由Fe2+ Fe3+可知,在过程①中Fe2+元素的化合价升高,在过程②中Fe3+元素的化合价降低;(4)铁粉在人体胃酸(主要成分时盐酸)的作用下转化成氯化亚铁和氢气;(5)根据方程式中化合价的变化判断;催化剂在反应前后质量不变,性质不变;(6)Fe+4HNO3=Fe(NO3)3+NO↑+2H2O,反应中N元素化合价降低,当4molHNO3参加反应时,有1mol被还原,表现为氧化性,3molHNO3表现为酸性.
18.【答案】(1)D
(2)B
(3)NO2﹣+Cl2+H2O=NO3﹣+2H++2Cl﹣
(4)c
(5)6;2;2;2;1;3.36
【解析】【解答】解:(1)服用维生素C可以解毒,说明在维生素C作用下Fe3+又转化为Fe2+,Fe元素化合价降低,被氧化,则维生素具有还原性,而亚硝酸盐,会导致Fe2+转化为Fe3+,说明亚硝酸盐具有氧化性被还原,在反应中为氧化剂,所以维生素C是还原剂,
故答案为:D;(2)A.亚硝酸钠是强碱弱酸盐其水溶液呈碱性,氯化钠是强酸强碱盐其水溶液呈中性,相同物质的量浓度的两种溶液的pH不同,所以可以用测定这两种溶液的pH值鉴别,故A不选;
B.亚硝酸钠是强碱弱酸盐其水溶液呈碱性,氯化钠是强酸强碱盐其水溶液呈中性,甲基橙的变色范围是3.1﹣4.4,所以亚硝酸钠和氯化钠溶液加入甲基橙后溶液都呈黄色,反应现象相同,所以不能用甲基橙鉴别,故B选;
C.在酸性条件下,亚硝酸钠和碘离子反应方程式为2NO2﹣+2I﹣+4H+=2NO↑+I2+2H2O,碘遇淀粉变蓝色,氯离子和碘离子不反应,所以反应现象不同,所以可以用酸性条件下的KI淀粉试液来区别,故C不选;
D.亚硝酸根离子不和银离子反应,氯离子和银离子反应生成不溶于硝酸的白色沉淀,反应现象不同,所以可以用AgNO3和HNO3两种试剂来区别,故D不选;
故答案为:B;(3)观察到氯水褪色,同时生成NaNO3和HCl,反应的离子方程式为:NO2﹣+Cl2+H2O=NO3﹣+2H++2Cl﹣,
故答案为:NO2﹣+Cl2+H2O=NO3﹣+2H++2Cl﹣;(4)ad都能氧化亚铁离子,但能引入新的杂质,铁不能氧化亚铁离子,双氧水的还原产物是水,不引入杂质,所以正确额的答案选c;
故选:c;(5)根据方程式可知,铁元素的化合价从+2价升高到+6价,失去4个电子;氧元素的化合价从﹣1价升高到0价,失去1个电子,氧元素的化合价从﹣1价降低到﹣2价,得到1个电子,最小公倍数是8,所以硫酸亚铁前面配2,K2O2前面配6,再根据质量守恒配平其他物质,配平后的方程式为:2FeSO4+6K2O2═2K2FeO4+2K2SO4+2K2O+O2;由反应方程式可知转移10NA个电子,生成22.4L的氧气,转移了1.5NA个电子时,在标况下可收集到 ×22.4L=3.36L;
故答案为:2、6、2、2、2、1;3.36.
【分析】(1)由题给信息可知Fe2+转化为Fe3+而中毒,服用维生素C可以解毒,说明在维生素C作用下Fe3+又转化为Fe2+;(2)A.亚硝酸钠是强碱弱酸盐其水溶液呈碱性,氯化钠是强酸强碱盐其水溶液呈中性;
B.甲基橙的变色范围是3.1﹣4.4;
C.酸性条件下,亚硝酸根离子能被碘离子还原生成一氧化氮,同时生成碘单质;
D.亚硝酸根离子不和银离子反应,氯离子和银离子反应生成白色沉淀;(3)把新制的氯水加到NaNO2溶液中,观察到氯水褪色,同时生成NaNO3和HCl,二者发生氧化还原反应;(4)Cl2、HNO3都能氧化亚铁离子,但能引入新的杂质,铁不能氧化亚铁离子,双氧水的还原产物是水,不引入杂质;(5)根据方程式可知,铁元素的化合价从+2价升高到+6价,失去4个电子;氧元素的化合价从﹣1价升高到0价,失去1个电子,氧元素的化合价从﹣1价降低到﹣2价,得到1个电子,然后根据电子的得失守恒和质量守恒定律配平方程式.
19.【答案】(1)①②;
(2);
(3);;
(4)
【解析】【解答】(1)电解质:在水溶液里或熔融状态下能导电的化合物:①在水溶液里能导电的化合物②在水溶液里和熔融状态下能导电的化合物③浓硫酸是混合物④铝是单质⑤胶体是混合物⑥蔗糖溶液是混合物⑦是单质⑧属于非电解质,上述物质中属于电解质的有①②(选填序号);②的溶液中氢离子与⑤中氢氧化铝反应生成铝离子和水,离子方程式;故答案为:①②;;
(2),该反应中,铝失电子,还原剂为;由方程式每转移30mol电子,生成3mol氮气,若反应过程中转移,则生成标准状况下0.1mol,体积为0.1mol×22.4L mol-1=。故答案为:;;
(3)在含有一定量和溶质的溶液中,逐滴滴入一定浓度的稀盐酸,先发生,再发生,由图产生的物质的量与滴入盐酸的量的关系得:
①点发生反应的离子方程式为,故答案为:;
②与物质的量之比为=(3.5a-2a):a=,故答案为:;
③(3.5a-a)=(用含的代数式表示),故答案为:;
(4)现有密度为,浓度为的浓硫酸,设取1L溶液,则该溶液中溶质的质量分数为 =,故答案为:。
【分析】(1)电解质:在水溶液或熔融状态下能够导电的化合物,常见的有酸、碱、盐、活泼金属氧化物、水;氢氧化铝和强酸反应生成铝离子和水;
(2)化合价升高的元素,其物质作为还原剂;根据化合价变化进行计算,每生成3molN2,转移30mol电子;
(3)稀盐酸先和碳酸钠反应生成碳酸氢钠,此时不会产生气体,为0a段,稀盐酸再和碳酸氢钠反应生成二氧化碳,此时为ab段;
① 为碳酸钠和盐酸反应生成碳酸氢钠和氯化钠;
② 碳酸钠和盐酸按照1:1生成碳酸氢钠,可以据此算出碳酸钠物质的量,碳酸氢钠和盐酸按照1:1生成二氧化碳,可以据此算出碳酸氢钠总量;
③ b为二氧化碳的物质的量,碳酸氢钠和盐酸按照1:1反应生成二氧化碳,碳酸氢钠和二氧化碳的物质的量之比为1:1。
20.【答案】(1)Fe(OH)3;3H2O
(2)BaCl2+H2SO4═BaSO4↓+H2O
(3)Mg2++2OH﹣+Ba2++SO42﹣=BaSO4↓+Mg(OH)2↓
(4)3
【解析】【解答】解:(1)由反应后生成铁离子,则反应为氧化铁或氢氧化铁与酸反应,氧化铁与氢离子反应为:Fe2O3+6H+═2Fe3++3H2O,则该反应物为Fe(OH)3,
故答案为:Fe(OH)3;3H2O;(2)Ba2++SO42﹣═BaSO4↓中保留化学式的只有硫酸钡,其它物质都是易溶强电解质,满足体积的化学方程式如:BaCl2+H2SO4═BaSO4↓+H2O,
故答案为:BaCl2+H2SO4═BaSO4↓+H2O;(3)①硫酸镁和氢氧化钡溶液反应生成氢氧化镁和硫酸钡,离子方程式为Mg2++2OH﹣+Ba2++SO42﹣=BaSO4↓+Mg(OH)2↓,
故答案为:Mg2++2OH﹣+Ba2++SO42﹣=BaSO4↓+Mg(OH)2↓;②氢氧化铜和稀硝酸反应生成硝酸铜和水,反应的离子方程式为:Cu(OH)2+2H+=Cu2++2H2O,
故答案为:Cu(OH)2+2H+=Cu2++2H2O;(4)2.6mol NaBrO3反应生成溴单质时转移的电子数为2.6×5=13mol,生成碘为0.5mol,转移的电子为1mol,则生成IO3﹣转移的电子数为12mol,生成IO3﹣的物质的量为2mol,根据碘原子守恒,则原溶液中NaI的物质的量为2+1=3mol,
故答案为:3.
【分析】(1)与酸反应后生成铁离子,则反应前未知物为氧化铁或氢氧化铁,根据消耗氢离子判断反应物;(2)该反应为可溶性钡盐与硫酸或可溶性硫酸盐的反应;(3)①硫酸镁和氢氧化钡溶液反应生成氢氧化镁和硫酸钡;②氢氧化铜和稀硝酸反应生成硝酸铜和水;(4)根据离子反应情况以及电子守恒来计算.
21.【答案】(1)④⑦
(2)①③;⑤⑥
(3)B
(4)(合理均可)
(5)Ag2S;D
【解析】【解答】(1)④氯水是氯气的水溶液,含有Cl2、H2O、HClO、H+、Cl-、ClO-、OH-多种微粒,因此属于混合物;
⑦浓硫酸中含有H2SO4、H2O、H+、 、OH-多种微粒,因此属于混合物;
故属于混合物的物质序号是①④;
(2)①冰水混合物中只含有一种化合物H2O,其中含有的H2O能够微弱的电离产生H+、OH-,故H2O属于电解质;
③铁红是Fe2O3,属于金属氧化物,在熔融状态下能够发生电离而导电,属于电解质;则属于电解质的物质序号是①③;
⑤乙醇、⑥干冰都是由分子构成的化合物,在水溶液中和熔融状态下都不能因自身发生电离而导电,因此它们都是非电解质,故属于非电解质的物质序号是⑤⑥;
(3)置换反应都是氧化还原反应,置换反应有一部分属于离子反应,氧化还原反应一部分是离子反应,一部分不是氧化还原反应,则上述关系中能够表示置换反应的是B;A表示氧化还原反应,C表示离子反应;
(4) 只能表示强酸与强碱生成可溶性盐和水的反应,而H2SO4与Ba(OH)2发生中和反应除生成H2O外,还产生BaSO4沉淀,该反应就不能用上述离子方程式表示,该反应的化学方程式为: ,其离子方程式为:Ba2++2OH-+2H++ =BaSO4↓+2H2O;
(5)“银针验毒”的原理为: 。根据质量守恒定律可知反应前后各种元素守恒,则X的化学式是Ag2S。在该反应中Ag元素化合价升高,O元素化合价降低,所以单质Ag为还原剂,O2为氧化剂,而H2S的组成元素在反应前后元素化合价都不变,因此H2S既不是氧化剂又不是还原剂,故答案为:D。
【分析】(1)、(2)物质根据组成的种类分为混合物和纯净物,纯净物根据组成的元素种类分为单质和化合物,化合物中的酸、碱、盐、活泼金属氧化物、水属于电解质;
(3)置换反应一定是氧化还原反应,在溶液中发生的置换反应是离子反应,所以A是氧化还原反应,C是离子反应,B是置换反应;
(4)OH-+H+=H2O表示可溶性强酸和强碱只生成盐和水的反应,弱酸和难溶性见弱碱不可拆,还生成其他沉淀的反应,不可以用这个离子反应表示;
(5) 根据化学反应前后原子的种类不变判断X的化学式, H2S 在反应元素化合价都不变,因此H2S既不是氧化剂又不是还原剂。
