4.1空气的成分 第1课时 课件(共23张PPT)---2023--2024学年九年级化学鲁教版上册
文档属性
| 名称 | 4.1空气的成分 第1课时 课件(共23张PPT)---2023--2024学年九年级化学鲁教版上册 |  | |
| 格式 | pptx | ||
| 文件大小 | 2.5MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-11-20 15:13:40 | ||
图片预览







文档简介
(共23张PPT)
空气的成分
九年级上册 LJ
初中化学
第四单元 第一节 第1课时
1.了解空气的组成。
2.能设计实验并准确测得空气中氧气的含量,在实验过程中体会从混合气体中除去某种气体进而测定其含量的方法。
学习目标
新知导入
一物到处有,
用棒赶不走;
眼睛看不见,
手摸也没有;
咀嚼无滋味,
没它活不久。
空气
知识点 认识空气的组成
新知探究
你有办法证明空气的存在吗?
窗帘飘动
风吹动树叶
空气的发现史
18世纪中叶以前,人们把空气看作是一种单一成分的物质。
18世纪70年代,法国化学家拉瓦锡通过实验得出“空气由氧气和氮气组成”的结论。
19世纪末,英国物理学家瑞利与化学家拉姆齐合作,发现了氩气。之后其他稀有气体陆续被发现。
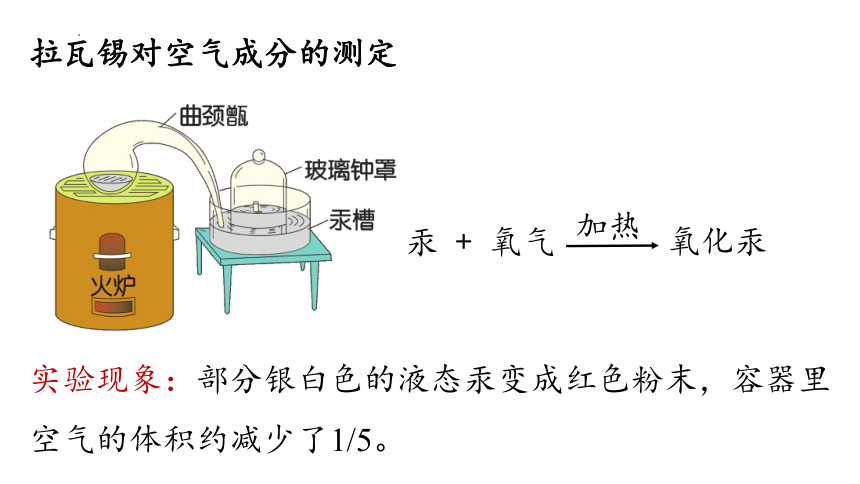
拉瓦锡对空气成分的测定
汞 + 氧气
实验现象:部分银白色的液态汞变成红色粉末,容器里空气的体积约减少了1/5。
加热
氧化汞
结论:空气由氧气和氮气组成,其中氧气约占空气总体积的五分之一。
氧化汞 汞 + 氧气
实验现象:红色粉末又变成了银白色物质,得到的气体的体积恰好等于密闭容器里所减少的体积。
加强热
拉瓦锡对空气成分的测定
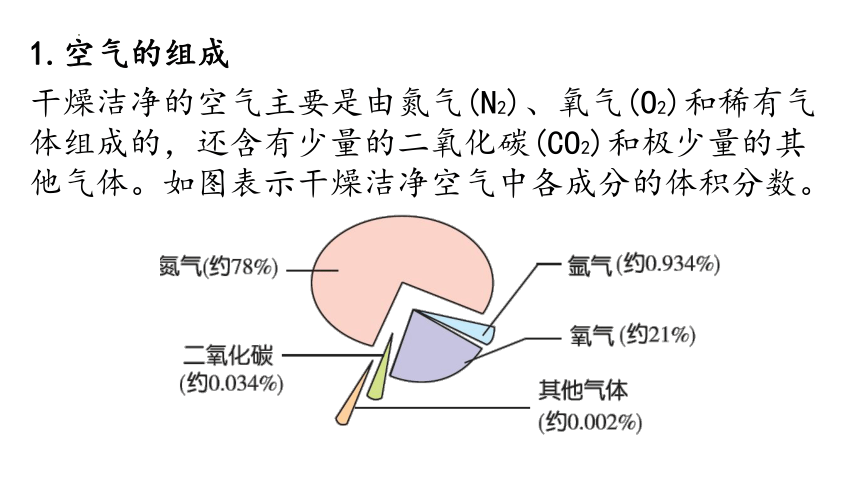
1.空气的组成
干燥洁净的空气主要是由氮气(N2)、氧气(O2)和稀有气体组成的,还含有少量的二氧化碳(CO2)和极少量的其他气体。如图表示干燥洁净空气中各成分的体积分数。
特别提醒
1.稀有气体主要为氩气,还有有氦气、氖气、氪气等。
2.空气的各成分是按体积分数计算的,而不是质量分数。如“氮气约占78%”,是指每100体积的空气中约含有78体积的氮气。
3.空气中各成分的含量一般来说是固定的,但不是一成不变的,在不同地区或同一地区的不同时间,空气中各成分的含量也可能略有不同。
【提出问题】
空气中约含1/5体积的氧气,你能通过实验测定空气中氧气的含量吗?
思路1:将其他气体除去,只剩下氧气,测定氧气体积。
思路2:将氧气除去,然后通过减少的体积来测定氧气的体积。
思路2相对容易!
2.测定空气中氧气的含量
①木炭 + 氧气 二氧化碳
固 气 气
②铜 + 氧气 氧化铜
固 气 固
★
点燃
选择实验药品的依据:
①所选物质只能与氧气反应,而不与其他气体反应;②生成物为固体。
点燃
③磷 + 氧气 五氧化二磷 固 气 固
④镁 + 氧气 氧化镁
固 气 固
(也与氮气发生反应)
点燃
点燃
★
实验原理及实验装置:
铜在加热的条件下能跟空气中的氧气反应,生成黑色固体氧化铜;将此反应在密闭容器内进行,消耗了容器内的氧气,因没有产生其他气体,故减少的气体体积即为空气中氧气的体积。
反应的文字表达式为:
铜 + 氧气 氧化铜
实验步骤:
①将一支硬质玻璃管注满水(两端用橡皮塞封住)。然后打开上端橡皮塞,将水倒入量筒中,记录体积。
②在另一支相同规格的干燥的硬质玻璃管中装入铜粉,两端塞上带玻璃导管的橡皮塞,其中一端用气球密封。移动注射器活塞,在注射器中留下一定体积的气体,记录体积后与硬质玻璃管另一端密封连接。根据酒精灯的高度,将玻璃管固定在铁架台上。
③用酒精灯在铜粉部位加热,加热时不断推拉注射器。
④停止加热后,待玻璃管冷却至室温,将气球内的气体全部挤出。待注射器活塞稳定后,记录注射器中气体的体积。
思考
1.小气球的作用是什么
加热时,气体受热膨胀,小气球起缓冲作用。
2.实验中不断推拉注射器的原因是什么
使氧气与铜粉充分接触,保证铜粉与氧气充分反应。
实验现象:
红色物质加热后变成黑色物质,冷却至室温后,注射器内气体的体积减少了原体积的1/5。
1.铜粉要足量;
2.装置必须密封;
3.加热时温度要高一些,时间要稍长一些;
4.加热时要不断推拉注射器活塞;
5.冷却至室温后,将气球内的气体全部挤出。
想一想,实验成功的关键是什么?
实验记录:
实验结论:
①空气中氧气约占空气总体积的1/5;
②氮气在加热条件下不与铜反应。
实验结果误差分析
误差 因素 影响
测量结果偏小 装置漏气 冷却至室温后,外界空气会进入装置,导致空气体积的变化减小
铜粉量不足 不能将装置内的氧气完全消耗,仍有少量氧气存在
加热时间短 未不断推拉注射器活塞 反应不充分,氧气不能被完全消耗
未冷却到室温就读数 剩余气体处于受热膨胀状态,压强变化不明显
误差:测量结果偏大
因素:反应结束气球内的气体没全部挤出;
影响:有一部分气体留在气球内,会使反应后注射器中气体体积读数偏小,计算出的氧气的体积偏大。
1.测量进入容器内水的体积或容器内水的体积变化
实验原理:
红磷、白磷燃烧产物相同,文字表达式均为
磷+氧气 五氧化二磷
点燃
测定空气中氧气含量的其他方法
注意:
①装置必须密封好,不能漏气;
②红磷必须足量,完全消耗掉集气瓶内的氧气;
③不能用木炭、硫粉等代替红磷。
④实验前,要夹紧弹簧夹。
实验现象:
红磷燃烧,产生大量白烟,烧杯中的水倒流进集气瓶,液面上升约为集气瓶容积的1/5。
实验结论:
①氧气约占空气体积的1/5;
②氮气不能燃烧,也不支持燃烧(不与红磷反应),且不溶于水。
实验原理:
磷+氧气 五氧化二磷
点燃
2.利用刻度测量密闭容器内气体体积的减少量
实验原理:
铜+氧气 氧化铜
1.空气是一种重要的自然资源,其中体积含量最大的气体是( )
A.氮气 B.氧气
C.二氧化碳 D.稀有气体
A
课堂达标
2.如图装置常用来测定空气中氧气的含量。下列对该实验的认识正确的是( )
A.红磷燃烧产生大量白色烟雾
B.燃烧匙中的红磷可以换成硫
C.该实验说明氮气难溶于水
D.红磷过量会导致进入集气瓶中水的体积大于1/5
C
烟
燃烧生成气体
空气的成分
九年级上册 LJ
初中化学
第四单元 第一节 第1课时
1.了解空气的组成。
2.能设计实验并准确测得空气中氧气的含量,在实验过程中体会从混合气体中除去某种气体进而测定其含量的方法。
学习目标
新知导入
一物到处有,
用棒赶不走;
眼睛看不见,
手摸也没有;
咀嚼无滋味,
没它活不久。
空气
知识点 认识空气的组成
新知探究
你有办法证明空气的存在吗?
窗帘飘动
风吹动树叶
空气的发现史
18世纪中叶以前,人们把空气看作是一种单一成分的物质。
18世纪70年代,法国化学家拉瓦锡通过实验得出“空气由氧气和氮气组成”的结论。
19世纪末,英国物理学家瑞利与化学家拉姆齐合作,发现了氩气。之后其他稀有气体陆续被发现。
拉瓦锡对空气成分的测定
汞 + 氧气
实验现象:部分银白色的液态汞变成红色粉末,容器里空气的体积约减少了1/5。
加热
氧化汞
结论:空气由氧气和氮气组成,其中氧气约占空气总体积的五分之一。
氧化汞 汞 + 氧气
实验现象:红色粉末又变成了银白色物质,得到的气体的体积恰好等于密闭容器里所减少的体积。
加强热
拉瓦锡对空气成分的测定
1.空气的组成
干燥洁净的空气主要是由氮气(N2)、氧气(O2)和稀有气体组成的,还含有少量的二氧化碳(CO2)和极少量的其他气体。如图表示干燥洁净空气中各成分的体积分数。
特别提醒
1.稀有气体主要为氩气,还有有氦气、氖气、氪气等。
2.空气的各成分是按体积分数计算的,而不是质量分数。如“氮气约占78%”,是指每100体积的空气中约含有78体积的氮气。
3.空气中各成分的含量一般来说是固定的,但不是一成不变的,在不同地区或同一地区的不同时间,空气中各成分的含量也可能略有不同。
【提出问题】
空气中约含1/5体积的氧气,你能通过实验测定空气中氧气的含量吗?
思路1:将其他气体除去,只剩下氧气,测定氧气体积。
思路2:将氧气除去,然后通过减少的体积来测定氧气的体积。
思路2相对容易!
2.测定空气中氧气的含量
①木炭 + 氧气 二氧化碳
固 气 气
②铜 + 氧气 氧化铜
固 气 固
★
点燃
选择实验药品的依据:
①所选物质只能与氧气反应,而不与其他气体反应;②生成物为固体。
点燃
③磷 + 氧气 五氧化二磷 固 气 固
④镁 + 氧气 氧化镁
固 气 固
(也与氮气发生反应)
点燃
点燃
★
实验原理及实验装置:
铜在加热的条件下能跟空气中的氧气反应,生成黑色固体氧化铜;将此反应在密闭容器内进行,消耗了容器内的氧气,因没有产生其他气体,故减少的气体体积即为空气中氧气的体积。
反应的文字表达式为:
铜 + 氧气 氧化铜
实验步骤:
①将一支硬质玻璃管注满水(两端用橡皮塞封住)。然后打开上端橡皮塞,将水倒入量筒中,记录体积。
②在另一支相同规格的干燥的硬质玻璃管中装入铜粉,两端塞上带玻璃导管的橡皮塞,其中一端用气球密封。移动注射器活塞,在注射器中留下一定体积的气体,记录体积后与硬质玻璃管另一端密封连接。根据酒精灯的高度,将玻璃管固定在铁架台上。
③用酒精灯在铜粉部位加热,加热时不断推拉注射器。
④停止加热后,待玻璃管冷却至室温,将气球内的气体全部挤出。待注射器活塞稳定后,记录注射器中气体的体积。
思考
1.小气球的作用是什么
加热时,气体受热膨胀,小气球起缓冲作用。
2.实验中不断推拉注射器的原因是什么
使氧气与铜粉充分接触,保证铜粉与氧气充分反应。
实验现象:
红色物质加热后变成黑色物质,冷却至室温后,注射器内气体的体积减少了原体积的1/5。
1.铜粉要足量;
2.装置必须密封;
3.加热时温度要高一些,时间要稍长一些;
4.加热时要不断推拉注射器活塞;
5.冷却至室温后,将气球内的气体全部挤出。
想一想,实验成功的关键是什么?
实验记录:
实验结论:
①空气中氧气约占空气总体积的1/5;
②氮气在加热条件下不与铜反应。
实验结果误差分析
误差 因素 影响
测量结果偏小 装置漏气 冷却至室温后,外界空气会进入装置,导致空气体积的变化减小
铜粉量不足 不能将装置内的氧气完全消耗,仍有少量氧气存在
加热时间短 未不断推拉注射器活塞 反应不充分,氧气不能被完全消耗
未冷却到室温就读数 剩余气体处于受热膨胀状态,压强变化不明显
误差:测量结果偏大
因素:反应结束气球内的气体没全部挤出;
影响:有一部分气体留在气球内,会使反应后注射器中气体体积读数偏小,计算出的氧气的体积偏大。
1.测量进入容器内水的体积或容器内水的体积变化
实验原理:
红磷、白磷燃烧产物相同,文字表达式均为
磷+氧气 五氧化二磷
点燃
测定空气中氧气含量的其他方法
注意:
①装置必须密封好,不能漏气;
②红磷必须足量,完全消耗掉集气瓶内的氧气;
③不能用木炭、硫粉等代替红磷。
④实验前,要夹紧弹簧夹。
实验现象:
红磷燃烧,产生大量白烟,烧杯中的水倒流进集气瓶,液面上升约为集气瓶容积的1/5。
实验结论:
①氧气约占空气体积的1/5;
②氮气不能燃烧,也不支持燃烧(不与红磷反应),且不溶于水。
实验原理:
磷+氧气 五氧化二磷
点燃
2.利用刻度测量密闭容器内气体体积的减少量
实验原理:
铜+氧气 氧化铜
1.空气是一种重要的自然资源,其中体积含量最大的气体是( )
A.氮气 B.氧气
C.二氧化碳 D.稀有气体
A
课堂达标
2.如图装置常用来测定空气中氧气的含量。下列对该实验的认识正确的是( )
A.红磷燃烧产生大量白色烟雾
B.燃烧匙中的红磷可以换成硫
C.该实验说明氮气难溶于水
D.红磷过量会导致进入集气瓶中水的体积大于1/5
C
烟
燃烧生成气体
同课章节目录
- 第一单元 步入化学殿堂
- 第一节 化学真奇妙
- 第二节 体验化学探究
- 到实验室去:化学实验基本技能训练(一)
- 第二单元 探秘水世界
- 第一节 运动的水分子
- 第二节 水分子的变化
- 第三节 原子的构成
- 第四节 元素
- 到实验室去:化学实验基本技能训练(二)
- 第三单元 溶液
- 第一节 溶液的形成
- 第二节 溶液组成的定量表示
- 到实验室去:配制一定溶质质量分数的溶液
- 第四单元 我们周围的空气
- 第一节 空气的成分
- 第二节 物质组成的表示
- 第三节 氧气
- 到实验室去:氧气的实验室制取与性质
- 第五单元 定量研究化学反应
- 第一节 化学反应中的质量守恒
- 第二节 化学反应的表示
- 第三节 化学反应中的有关计算
- 到实验室去:探究燃烧的条件
- 第六单元 燃烧与燃料
- 第一节 燃烧与灭火
- 第二节 化石燃料的利用
- 第三节 大自然中的二氧化碳
- 到实验室去:二氧化碳的实验室制取与性质
