3.1.1铁的单质、铁的氧化物、铁的氢氧化物课件(共29张PPT)2023-2024学年高一上学期人教版(2019)必修第一册
文档属性
| 名称 | 3.1.1铁的单质、铁的氧化物、铁的氢氧化物课件(共29张PPT)2023-2024学年高一上学期人教版(2019)必修第一册 |  | |
| 格式 | pptx | ||
| 文件大小 | 7.5MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-11-20 18:40:37 | ||
图片预览






文档简介
(共29张PPT)
第1课时 铁的单质
铁的氧化物
铁的氢氧化物
素养目标
1.了解单质铁的还原性,一定条件下能与非金属单质、酸和某些盐反应,初步学会根据铁与水蒸气反应的原理,Fe(OH)2、Fe(OH)3的制备方法,设计实验装置,培养科学探究与创新意识。
2.能用氧化还原反应原理进一步认识铁的化学性质,基于实验事实书写铁与水蒸气反应的方程式,形成宏观辨识与微观探析的意识。
3.通过实验探究铁的氧化物、铁的氢氧化物的化学性质,体会实验对认识和研究物质性质的重要作用,形成证据意识。
4.了解铁元素在自然界的存在形态、与人体健康的关系,体会化学对人类生活的重要意义。从我国古代应用铁的化学史感受中华民族在科技发展进程中的贡献,增强科学态度与社会责任。
【温顾】
1.铁生锈的条件是与水、空气同时接触。
2.光亮的铁丝在空气中能否燃烧 铁丝在纯氧中燃烧的现象如何
请写出相应的化学方程式。
提示 铁丝在空气中不能燃烧。铁丝在氧气中剧烈燃烧,火星四射,生成黑色固体。
3.铁与盐酸、CuSO4溶液发生反应的离子方程式分别为
一、铁元素概述
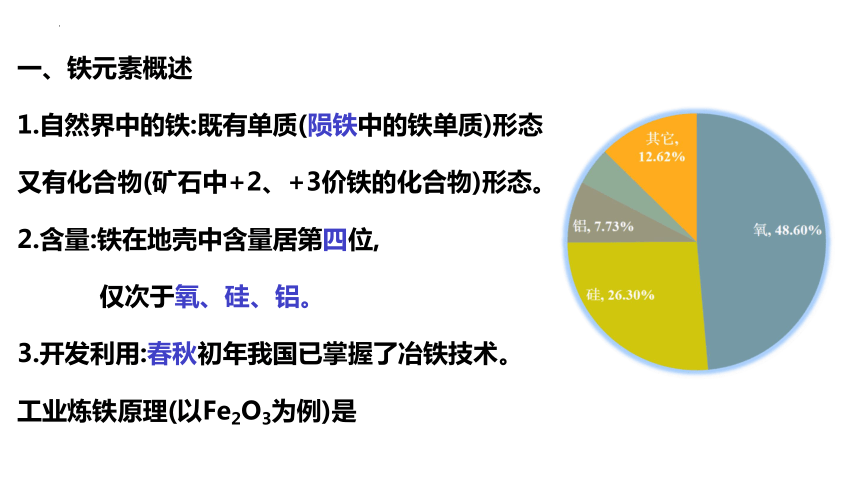
1.自然界中的铁:既有单质(陨铁中的铁单质)形态又有化合物(矿石中+2、+3价铁的化合物)形态。
2.含量:铁在地壳中含量居第四位,
仅次于氧、硅、铝。
3.开发利用:春秋初年我国已掌握了冶铁技术。
工业炼铁原理(以Fe2O3为例)是
元素 人体内质量分数% 日需量( mg/天 )
Fe 6.0×10-3 13
F 3.7×10-3 3
Zn 3.3×10-3 13
Cu 1.0×10-4 5
Sn 4.3×10-5 7.3
V 3.0×10-5 1.2×10-1
Mn 2.0×10-5 3
Cr 2.0×10-5 5×10-1
I 2.0×10-5 1×10-1
…… …… ……
铁的化合物一般存在于矿石中,如磁铁矿、赤铁矿、菱铁矿、黄铁矿、褐铁矿等等,其中磁铁矿和赤铁矿中含铁量较高,达到70%以上,比较适合工业炼铁。
磁铁矿
(主要成分是Fe304)
赤铁矿
(主要成分是Fe2O3)
褐铁矿FeO(OH)·nH2O
黄铁矿(主要成分是FeS2)
菱铁矿(主要成分是FeCO3)
二、铁的单质
1.物理性质
铁有延展性、导热性、导电性,但其导电性不如铜和铝,铁还能被磁铁吸引。其熔、沸点较高,熔点:1 535 ℃、沸点:2 750 ℃。密度:7.86 g·cm-3。
【微思考1】你能用一种最简单的方法分离铁粉和铜粉的混合物吗
提示 可以用磁铁吸引法分离。
2.化学性质
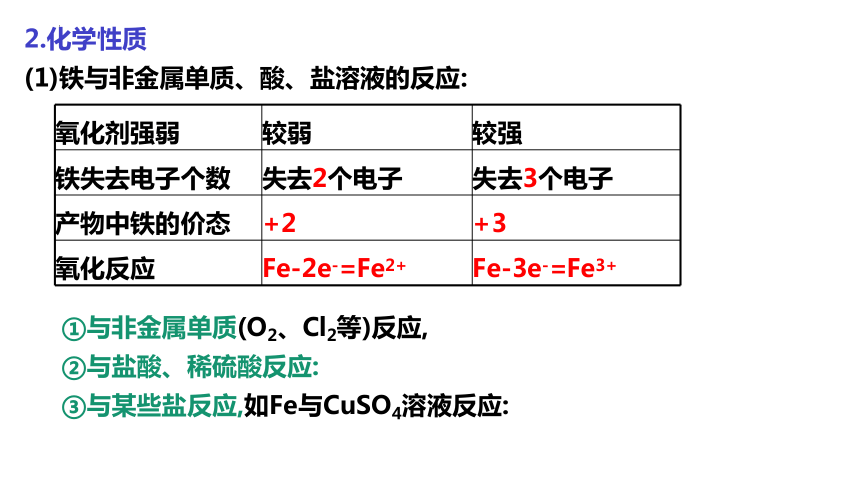
(1)铁与非金属单质、酸、盐溶液的反应:
氧化剂强弱 较弱 较强
铁失去电子个数 失去2个电子 失去3个电子
产物中铁的价态 +2 +3
氧化反应 Fe-2e-=Fe2+ Fe-3e-=Fe3+
①与非金属单质(O2、Cl2等)反应,
②与盐酸、稀硫酸反应:
③与某些盐反应,如Fe与CuSO4溶液反应:
水蒸气发生器 主反应装置 除杂装置 收集检验装置
【情境链接】铁与水蒸气可以反应,为什么在日常生活中可以用铁壶烧水
提示 铁与冷水、热水均不易反应,只有在高温下才能与水蒸气反应,所以可以用铁壶烧水。
与水的反应
K Ca Na Mg Al Zn Fe Sn Pb (H) Cu Hg Ag Pt Au
三、铁的氧化物
名 称 氧化亚铁 氧化铁 四氧化三铁
化学式 FeO Fe2O3 Fe3O4
俗 名 — 铁红 磁性氧化铁
铁的化合价 +2 +3 +2、+3
颜 色 黑色 红棕色 黑色
溶解性 不溶于水 不溶于水 不溶于水
稳定性 不稳定 稳定 稳定
氧化物类别 碱性氧化物 碱性氧化物 复杂氧化物
与盐酸反应的离子 方程式 FeO+2H+=Fe2++H2O、Fe2O3+6H+=2Fe3++3H2O、 Fe3O4+8H+=2Fe3++Fe2++4H2O 用 途 氧化铁:油漆、涂料、油墨和橡胶的红色颜料
Fe2O3
+3
物质类别:
氧化性
Fe2O3 + 6H+ 2Fe3+ + 3H2O
2Fe(OH)3 Fe2O3 + 3H2O
△
Fe2O3 + 3CO 2Fe + 3CO2
高温
元素价态:
碱性氧化物
预测Fe2O3的化学性质,说出依据
FeO
+2
物质类别:
氧化性
FeO + 2H+ Fe2+ + H2O
FeO + CO Fe + CO2
高温
元素价态:
碱性氧化物
还原性
6FeO + O2 2Fe3O4
△
预测FeO的化学性质,说出依据
Fe3O4
物质类别:
氧化性
元素价态:
特殊氧化物
Fe3O4 + 8H+ Fe2+ + 2Fe3+ + 4H2O
Fe3O4 + 4CO 3Fe + 4CO2
高温
预测Fe3O4的化学性质,说出依据
【情境链接】杜甫是唐代伟大诗人,他的代表作之一——《自京赴奉先县咏怀五百字》中有句千古名句:“朱门酒肉臭,路有冻死骨。”这里为何称为“朱门”呢
提示 古代王公贵族的住宅大门用氧化铁漆成红色,表示尊贵,称为“朱门”,后来借指豪富人家。
四、铁的氢氧化物
化学式 Fe(OH)2 Fe(OH)3
颜 色 白色 红褐色
溶解性 不溶于水 不溶于水
稳定性 易被溶解在溶液中的氧气氧化为Fe(OH)3 2Fe(OH)3 Fe2O3+3H2O
4Fe(OH)2+O2+2H2O=4Fe(OH)3
化学式 Fe(OH)2 Fe(OH)3
与盐酸反应 (离子方程式) Fe(OH)2+2H+=Fe2++2H2O Fe(OH)3+3H+=Fe3++3H2O
制备 Fe2++2OH-=Fe(OH)2↓ Fe3++3OH-=Fe(OH)3↓
转化 化学方程式 4Fe(OH)2+O2+2H2O=4Fe(OH)3 现象 白色絮状沉淀迅速变成灰绿色,一段时间后变成红褐色
【实验探究】在两支试管里分别加入少量的FeCl3和新制FeSO4溶液,
然后滴入NaOH溶液,观察并记录现象。
FeCl3溶液 新制FeSO4溶液
实验操作 甲
乙
思考探究下列问题:
1.两试管中有什么现象 久置于空气中又有什么现象
提示 甲中生成红褐色沉淀,久置不变色;
乙中生成白色沉淀,且沉淀迅速变成灰绿色,过一段时间后有红褐色物质生成。
2.在制备Fe(OH)2时,为什么要用新制的FeSO4溶液并将吸有NaOH溶液的胶头滴管尖嘴插入液面以下
提示 用新制的FeSO4溶液是为了防止Fe2+被氧化成Fe3+;
滴管尖嘴插入液面以下是为了防止生成的Fe(OH)2与O2接触而被氧化。
3.在实验中,若想长时间观察到生成的白色Fe(OH)2沉淀,除使用新制FeSO4溶液外,还应创造一个怎样的反应环境
提示 因为Fe(OH)2易被氧气氧化而发生颜色变化,故应尽可能创造无氧环境以防止Fe(OH)2被氧化。
【深化拓展】Fe(OH)2的制备方法创新
(1)有机覆盖层法
将吸有NaOH溶液的胶头滴管插到液面以下,
并在液面上覆盖一层苯或煤油(不能用CCl4,
因其密度大于水),以防止空气与Fe(OH)2
接触发生反应,如图1所示。
(2)还原性气体保护法
用H2将装置内的空气排尽后,再将亚铁盐
溶液与NaOH溶液混合,这样可长时间观察
到白色沉淀,如图2所示。
下列图示中能较长时间看到Fe(OH)2白色沉淀的是( )
A.①②③④ B.只有①③④ C.只有①②④ D.只有②③④
C
规律方法制备Fe(OH)2的关键
制备Fe(OH)2的关键是降低反应体系中氧气的存在量和操作过程中氧气的引入量。可采用的方法:
(1)采用新制备的纯亚铁盐溶液(Fe2+易被空气中的氧气氧化成Fe3+);
(2)将溶解亚铁盐的蒸馏水煮沸(除去溶解在蒸馏水中的氧气);
(3)将碱直接加到亚铁盐溶液的底部[使Fe(OH)2与空气隔离];
(4)在亚铁盐溶液液面上加隔氧剂(如加入苯等密度比水小,而又不溶于水的有机溶剂)。
【素能应用】如图所示装置可用来制取和
观察Fe(OH)2在空气中被氧化时颜色的变化。
实验时必须使用铁屑和6 mol·L-1的硫酸,
其他试剂任选。
(1)B中盛一定量的NaOH溶液,A中应预先加入的试剂是 ,
A中反应的离子方程式是 。
(2)实验开始时先将止水夹E (填“打开”或“关闭”),
C中收集到气体的主要成分是 。
(3)简述生成Fe(OH)2的操作过程: 。
(4)拔去装置B中的橡皮塞,使空气进入,写出有关反应的化学方程式: 。
(1)铁屑 Fe+2H+ = Fe2++H2↑
(2)打开 H2
(3)关闭止水夹E,使FeSO4溶液被压入B瓶中进行反应
(4)4Fe(OH)2+O2+2H2O = 4Fe(OH)3
1.误以为自然界中没有游离态的铁单质。
其实不然,自然界中有少量游离态的铁单质,主要存在于陨铁中。
2.误以为氯化亚铁既可由铁与盐酸反应制取,也可由铁与氯气化合制取。
其实不然,氯气的氧化性较强,与铁反应生成氯化铁,不能得到氯化亚铁。
3.误以为钠与水反应生成NaOH和H2,所以铁与水蒸气反应生成Fe(OH)3和H2。
其实不然,铁与水蒸气在高温下反应生成Fe3O4和H2。
4.Fe3O4中铁有+2、+3两种价态,可以写成FeO·Fe2O3的形式,但它是一种化合物,
不是混合物。
5.Fe(OH)3在空气中灼烧得到Fe2O3粉末,但Fe(OH)2在空气中灼烧不能得到FeO粉末。
6.误以为Fe(OH)3只能由可溶性铁盐和碱通过复分解反应制得,不能通过化合反应制得。其实不然,氢氧化亚铁被氧气氧化也可转化为Fe(OH)3,此反应为化合反应。
判断正误:
(1)Fe与H2O(g)反应生成Fe2O3和H2。( )
(2)铁有多种氧化物,且均为黑色固体。( )
(3)Fe3O4中的Fe化合价有+2和+3价,Fe3O4为混合物。( )
(4)Fe(OH)2和Fe(OH)3均为弱碱,均与盐酸反应生成盐和H2O。( )
(5)Fe(OH)2易被溶解在溶液中的O2氧化为Fe(OH)3。( )
答案 (1)× (2)× (3)× (4)√ (5)√
指南针是我国的四大发明之一,制造指南针的磁性物质是( )
A.FeO B.Fe2O3 C.Fe3O4 D.Fe
解析 Fe3O4具有磁性,俗称磁性氧化铁,铁是能被磁化的物质,本身没有磁性。
C
下列变化中,加入铁粉不可能实现的是( )
A.Ag+→Ag B.H2O(g)→H2
C.H+→H2 D.Fe(OH)2→Fe(OH)3
D
下列有关说法不正确的是( )
A.Fe3O4为磁性氧化铁,其中铁的化合价为+2和+3价
B.FeO、Fe2O3均为碱性氧化物,均与盐酸反应
C.Fe(OH)2不稳定,具有较强的氧化性
D.Fe(OH)3比Fe(OH)2稳定
C
下列有关氢氧化亚铁及其制备方法的叙述中,不正确的是( )
A.氢氧化亚铁易被空气氧化
B.氢氧化亚铁为灰绿色絮状沉淀
C.可利用如图所示装置制备氢氧化亚铁
D.实验中所用氢氧化钠溶液应预先煮沸
B
根据下列流程图回答问题。
(1)写出F的化学式: ,H的化学式: 。
(2)写出由E转变成F的化学方程式: 。
(3)向B溶液中加入A的有关离子反应方程式: 。
(4)写出A在一定条件下与水反应的化学方程式: 。
(1)Fe(OH)3 AgCl
(2)4Fe(OH)2+O2+2H2O === 4Fe(OH)3
(3)2H++Fe === Fe2++H2↑
(4)3Fe+4H2O(g) Fe3O4+4H2
A为Fe, B为FeCl2, C为KOH,D为KCl,
E为Fe(OH)2, F为Fe(OH)3, G为FeCl3, H为AgCl
第1课时 铁的单质
铁的氧化物
铁的氢氧化物
素养目标
1.了解单质铁的还原性,一定条件下能与非金属单质、酸和某些盐反应,初步学会根据铁与水蒸气反应的原理,Fe(OH)2、Fe(OH)3的制备方法,设计实验装置,培养科学探究与创新意识。
2.能用氧化还原反应原理进一步认识铁的化学性质,基于实验事实书写铁与水蒸气反应的方程式,形成宏观辨识与微观探析的意识。
3.通过实验探究铁的氧化物、铁的氢氧化物的化学性质,体会实验对认识和研究物质性质的重要作用,形成证据意识。
4.了解铁元素在自然界的存在形态、与人体健康的关系,体会化学对人类生活的重要意义。从我国古代应用铁的化学史感受中华民族在科技发展进程中的贡献,增强科学态度与社会责任。
【温顾】
1.铁生锈的条件是与水、空气同时接触。
2.光亮的铁丝在空气中能否燃烧 铁丝在纯氧中燃烧的现象如何
请写出相应的化学方程式。
提示 铁丝在空气中不能燃烧。铁丝在氧气中剧烈燃烧,火星四射,生成黑色固体。
3.铁与盐酸、CuSO4溶液发生反应的离子方程式分别为
一、铁元素概述
1.自然界中的铁:既有单质(陨铁中的铁单质)形态又有化合物(矿石中+2、+3价铁的化合物)形态。
2.含量:铁在地壳中含量居第四位,
仅次于氧、硅、铝。
3.开发利用:春秋初年我国已掌握了冶铁技术。
工业炼铁原理(以Fe2O3为例)是
元素 人体内质量分数% 日需量( mg/天 )
Fe 6.0×10-3 13
F 3.7×10-3 3
Zn 3.3×10-3 13
Cu 1.0×10-4 5
Sn 4.3×10-5 7.3
V 3.0×10-5 1.2×10-1
Mn 2.0×10-5 3
Cr 2.0×10-5 5×10-1
I 2.0×10-5 1×10-1
…… …… ……
铁的化合物一般存在于矿石中,如磁铁矿、赤铁矿、菱铁矿、黄铁矿、褐铁矿等等,其中磁铁矿和赤铁矿中含铁量较高,达到70%以上,比较适合工业炼铁。
磁铁矿
(主要成分是Fe304)
赤铁矿
(主要成分是Fe2O3)
褐铁矿FeO(OH)·nH2O
黄铁矿(主要成分是FeS2)
菱铁矿(主要成分是FeCO3)
二、铁的单质
1.物理性质
铁有延展性、导热性、导电性,但其导电性不如铜和铝,铁还能被磁铁吸引。其熔、沸点较高,熔点:1 535 ℃、沸点:2 750 ℃。密度:7.86 g·cm-3。
【微思考1】你能用一种最简单的方法分离铁粉和铜粉的混合物吗
提示 可以用磁铁吸引法分离。
2.化学性质
(1)铁与非金属单质、酸、盐溶液的反应:
氧化剂强弱 较弱 较强
铁失去电子个数 失去2个电子 失去3个电子
产物中铁的价态 +2 +3
氧化反应 Fe-2e-=Fe2+ Fe-3e-=Fe3+
①与非金属单质(O2、Cl2等)反应,
②与盐酸、稀硫酸反应:
③与某些盐反应,如Fe与CuSO4溶液反应:
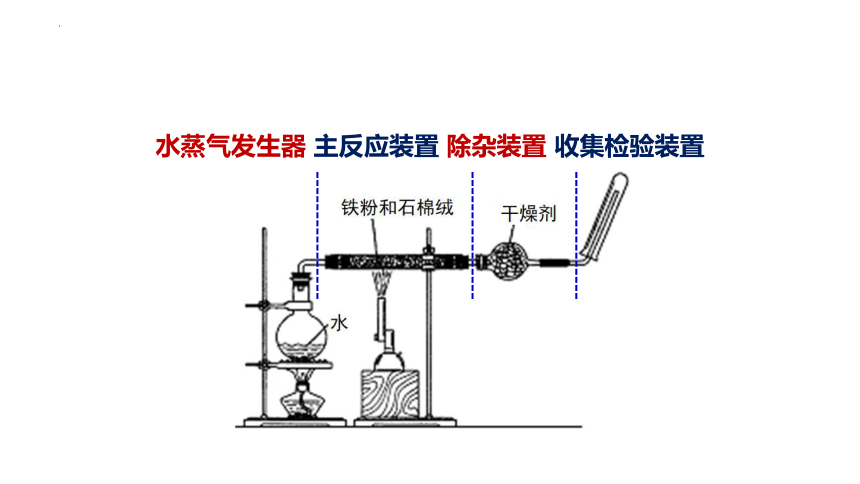
水蒸气发生器 主反应装置 除杂装置 收集检验装置
【情境链接】铁与水蒸气可以反应,为什么在日常生活中可以用铁壶烧水
提示 铁与冷水、热水均不易反应,只有在高温下才能与水蒸气反应,所以可以用铁壶烧水。
与水的反应
K Ca Na Mg Al Zn Fe Sn Pb (H) Cu Hg Ag Pt Au
三、铁的氧化物
名 称 氧化亚铁 氧化铁 四氧化三铁
化学式 FeO Fe2O3 Fe3O4
俗 名 — 铁红 磁性氧化铁
铁的化合价 +2 +3 +2、+3
颜 色 黑色 红棕色 黑色
溶解性 不溶于水 不溶于水 不溶于水
稳定性 不稳定 稳定 稳定
氧化物类别 碱性氧化物 碱性氧化物 复杂氧化物
与盐酸反应的离子 方程式 FeO+2H+=Fe2++H2O、Fe2O3+6H+=2Fe3++3H2O、 Fe3O4+8H+=2Fe3++Fe2++4H2O 用 途 氧化铁:油漆、涂料、油墨和橡胶的红色颜料
Fe2O3
+3
物质类别:
氧化性
Fe2O3 + 6H+ 2Fe3+ + 3H2O
2Fe(OH)3 Fe2O3 + 3H2O
△
Fe2O3 + 3CO 2Fe + 3CO2
高温
元素价态:
碱性氧化物
预测Fe2O3的化学性质,说出依据
FeO
+2
物质类别:
氧化性
FeO + 2H+ Fe2+ + H2O
FeO + CO Fe + CO2
高温
元素价态:
碱性氧化物
还原性
6FeO + O2 2Fe3O4
△
预测FeO的化学性质,说出依据
Fe3O4
物质类别:
氧化性
元素价态:
特殊氧化物
Fe3O4 + 8H+ Fe2+ + 2Fe3+ + 4H2O
Fe3O4 + 4CO 3Fe + 4CO2
高温
预测Fe3O4的化学性质,说出依据
【情境链接】杜甫是唐代伟大诗人,他的代表作之一——《自京赴奉先县咏怀五百字》中有句千古名句:“朱门酒肉臭,路有冻死骨。”这里为何称为“朱门”呢
提示 古代王公贵族的住宅大门用氧化铁漆成红色,表示尊贵,称为“朱门”,后来借指豪富人家。
四、铁的氢氧化物
化学式 Fe(OH)2 Fe(OH)3
颜 色 白色 红褐色
溶解性 不溶于水 不溶于水
稳定性 易被溶解在溶液中的氧气氧化为Fe(OH)3 2Fe(OH)3 Fe2O3+3H2O
4Fe(OH)2+O2+2H2O=4Fe(OH)3
化学式 Fe(OH)2 Fe(OH)3
与盐酸反应 (离子方程式) Fe(OH)2+2H+=Fe2++2H2O Fe(OH)3+3H+=Fe3++3H2O
制备 Fe2++2OH-=Fe(OH)2↓ Fe3++3OH-=Fe(OH)3↓
转化 化学方程式 4Fe(OH)2+O2+2H2O=4Fe(OH)3 现象 白色絮状沉淀迅速变成灰绿色,一段时间后变成红褐色
【实验探究】在两支试管里分别加入少量的FeCl3和新制FeSO4溶液,
然后滴入NaOH溶液,观察并记录现象。
FeCl3溶液 新制FeSO4溶液
实验操作 甲
乙
思考探究下列问题:
1.两试管中有什么现象 久置于空气中又有什么现象
提示 甲中生成红褐色沉淀,久置不变色;
乙中生成白色沉淀,且沉淀迅速变成灰绿色,过一段时间后有红褐色物质生成。
2.在制备Fe(OH)2时,为什么要用新制的FeSO4溶液并将吸有NaOH溶液的胶头滴管尖嘴插入液面以下
提示 用新制的FeSO4溶液是为了防止Fe2+被氧化成Fe3+;
滴管尖嘴插入液面以下是为了防止生成的Fe(OH)2与O2接触而被氧化。
3.在实验中,若想长时间观察到生成的白色Fe(OH)2沉淀,除使用新制FeSO4溶液外,还应创造一个怎样的反应环境
提示 因为Fe(OH)2易被氧气氧化而发生颜色变化,故应尽可能创造无氧环境以防止Fe(OH)2被氧化。
【深化拓展】Fe(OH)2的制备方法创新
(1)有机覆盖层法
将吸有NaOH溶液的胶头滴管插到液面以下,
并在液面上覆盖一层苯或煤油(不能用CCl4,
因其密度大于水),以防止空气与Fe(OH)2
接触发生反应,如图1所示。
(2)还原性气体保护法
用H2将装置内的空气排尽后,再将亚铁盐
溶液与NaOH溶液混合,这样可长时间观察
到白色沉淀,如图2所示。
下列图示中能较长时间看到Fe(OH)2白色沉淀的是( )
A.①②③④ B.只有①③④ C.只有①②④ D.只有②③④
C
规律方法制备Fe(OH)2的关键
制备Fe(OH)2的关键是降低反应体系中氧气的存在量和操作过程中氧气的引入量。可采用的方法:
(1)采用新制备的纯亚铁盐溶液(Fe2+易被空气中的氧气氧化成Fe3+);
(2)将溶解亚铁盐的蒸馏水煮沸(除去溶解在蒸馏水中的氧气);
(3)将碱直接加到亚铁盐溶液的底部[使Fe(OH)2与空气隔离];
(4)在亚铁盐溶液液面上加隔氧剂(如加入苯等密度比水小,而又不溶于水的有机溶剂)。
【素能应用】如图所示装置可用来制取和
观察Fe(OH)2在空气中被氧化时颜色的变化。
实验时必须使用铁屑和6 mol·L-1的硫酸,
其他试剂任选。
(1)B中盛一定量的NaOH溶液,A中应预先加入的试剂是 ,
A中反应的离子方程式是 。
(2)实验开始时先将止水夹E (填“打开”或“关闭”),
C中收集到气体的主要成分是 。
(3)简述生成Fe(OH)2的操作过程: 。
(4)拔去装置B中的橡皮塞,使空气进入,写出有关反应的化学方程式: 。
(1)铁屑 Fe+2H+ = Fe2++H2↑
(2)打开 H2
(3)关闭止水夹E,使FeSO4溶液被压入B瓶中进行反应
(4)4Fe(OH)2+O2+2H2O = 4Fe(OH)3
1.误以为自然界中没有游离态的铁单质。
其实不然,自然界中有少量游离态的铁单质,主要存在于陨铁中。
2.误以为氯化亚铁既可由铁与盐酸反应制取,也可由铁与氯气化合制取。
其实不然,氯气的氧化性较强,与铁反应生成氯化铁,不能得到氯化亚铁。
3.误以为钠与水反应生成NaOH和H2,所以铁与水蒸气反应生成Fe(OH)3和H2。
其实不然,铁与水蒸气在高温下反应生成Fe3O4和H2。
4.Fe3O4中铁有+2、+3两种价态,可以写成FeO·Fe2O3的形式,但它是一种化合物,
不是混合物。
5.Fe(OH)3在空气中灼烧得到Fe2O3粉末,但Fe(OH)2在空气中灼烧不能得到FeO粉末。
6.误以为Fe(OH)3只能由可溶性铁盐和碱通过复分解反应制得,不能通过化合反应制得。其实不然,氢氧化亚铁被氧气氧化也可转化为Fe(OH)3,此反应为化合反应。
判断正误:
(1)Fe与H2O(g)反应生成Fe2O3和H2。( )
(2)铁有多种氧化物,且均为黑色固体。( )
(3)Fe3O4中的Fe化合价有+2和+3价,Fe3O4为混合物。( )
(4)Fe(OH)2和Fe(OH)3均为弱碱,均与盐酸反应生成盐和H2O。( )
(5)Fe(OH)2易被溶解在溶液中的O2氧化为Fe(OH)3。( )
答案 (1)× (2)× (3)× (4)√ (5)√
指南针是我国的四大发明之一,制造指南针的磁性物质是( )
A.FeO B.Fe2O3 C.Fe3O4 D.Fe
解析 Fe3O4具有磁性,俗称磁性氧化铁,铁是能被磁化的物质,本身没有磁性。
C
下列变化中,加入铁粉不可能实现的是( )
A.Ag+→Ag B.H2O(g)→H2
C.H+→H2 D.Fe(OH)2→Fe(OH)3
D
下列有关说法不正确的是( )
A.Fe3O4为磁性氧化铁,其中铁的化合价为+2和+3价
B.FeO、Fe2O3均为碱性氧化物,均与盐酸反应
C.Fe(OH)2不稳定,具有较强的氧化性
D.Fe(OH)3比Fe(OH)2稳定
C
下列有关氢氧化亚铁及其制备方法的叙述中,不正确的是( )
A.氢氧化亚铁易被空气氧化
B.氢氧化亚铁为灰绿色絮状沉淀
C.可利用如图所示装置制备氢氧化亚铁
D.实验中所用氢氧化钠溶液应预先煮沸
B
根据下列流程图回答问题。
(1)写出F的化学式: ,H的化学式: 。
(2)写出由E转变成F的化学方程式: 。
(3)向B溶液中加入A的有关离子反应方程式: 。
(4)写出A在一定条件下与水反应的化学方程式: 。
(1)Fe(OH)3 AgCl
(2)4Fe(OH)2+O2+2H2O === 4Fe(OH)3
(3)2H++Fe === Fe2++H2↑
(4)3Fe+4H2O(g) Fe3O4+4H2
A为Fe, B为FeCl2, C为KOH,D为KCl,
E为Fe(OH)2, F为Fe(OH)3, G为FeCl3, H为AgCl
