【全国百强校】江西省临川区第二中学2014-2015学年高中化学必修一同步课件:第三章 第二节 铝的重要化合物[新课](共22张PPT)
文档属性
| 名称 | 【全国百强校】江西省临川区第二中学2014-2015学年高中化学必修一同步课件:第三章 第二节 铝的重要化合物[新课](共22张PPT) |  | |
| 格式 | zip | ||
| 文件大小 | 536.6KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2015-04-08 15:17:28 | ||
图片预览







文档简介
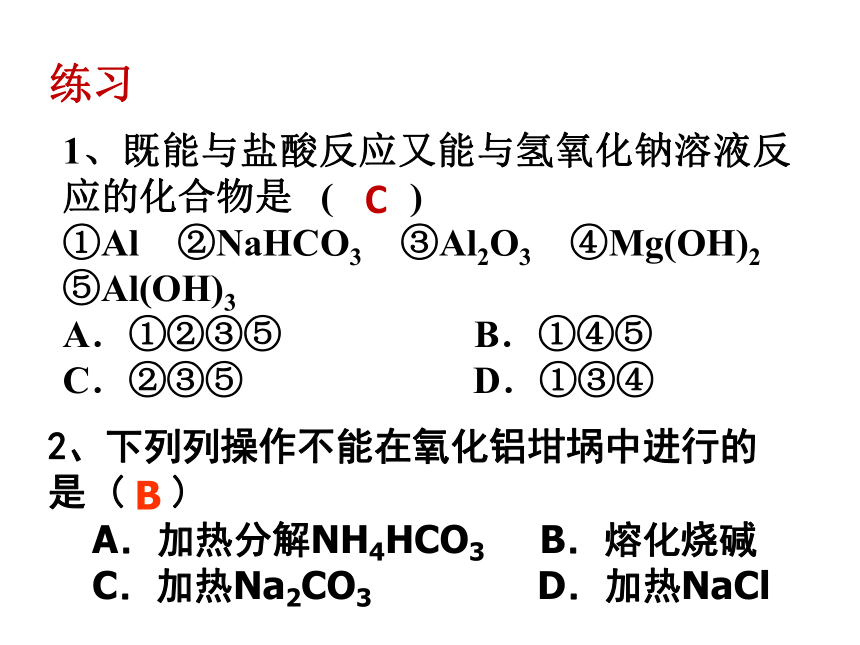
课件22张PPT。铝的重要化合物二、铝的重要化合物(一)氧化铝(Al2O3)白色固体,不溶于水,熔点高,良好的耐火材料。自然界中纯净的Al2O3为无色晶体,俗称刚玉。红宝石、蓝宝石的主成份皆为氧化铝。1、物理性质2、化学性质和酸反应:和强碱反应:例:Al2O3 + 6HCl == 2AlCl3 + 3H2O例:Al2O3 + 2NaOH === 2NaAlO2 + H2O注意:氧化铝既能跟酸反应生成盐和水,又能跟强碱反应生成盐和水,所以氧化铝是两性氧化物。 氧化物的分类1、既能与盐酸反应又能与氢氧化钠溶液反应的化合物是 ( )
①Al ②NaHCO3 ③Al2O3 ④Mg(OH)2
⑤Al(OH)3
A.①②③⑤ B.①④⑤
C.②③⑤ D.①③④ 练习C2、下列列操作不能在氧化铝坩埚中进行的
是 (??? )
A.加热分解NH4HCO3??? B.熔化烧碱?
C.加热Na2CO3??? ?? D.加热NaClB(二)氢氧化铝【Al(OH)3】氢氧化铝是白色胶状沉淀,它能凝聚水中的悬浮物,并能吸附色素。1、物理性质2、化学性质和酸反应:和强碱反应:Al(OH)3+ NaOH== NaAlO2+ 2H2O Al(OH)3+ 3HCl== AlCl3+ 3H2O注:氢氧化铝既能跟酸反应,又能跟强碱反应生成盐和水,所以属于两性氢氧化物。不稳定性:氢氧化铝不稳定,受热易分解。注意:难溶性碱受热易分解成金属氧化物和水,而可溶性碱不会分解(氨水除外). Al3++3OH-===Al(OH)3↓(OH-适量)
AlO2-+H++H2O===Al(OH)3↓(H+适量)
AlO2-+CO2+2H2O===Al(OH)3↓+HCO3-
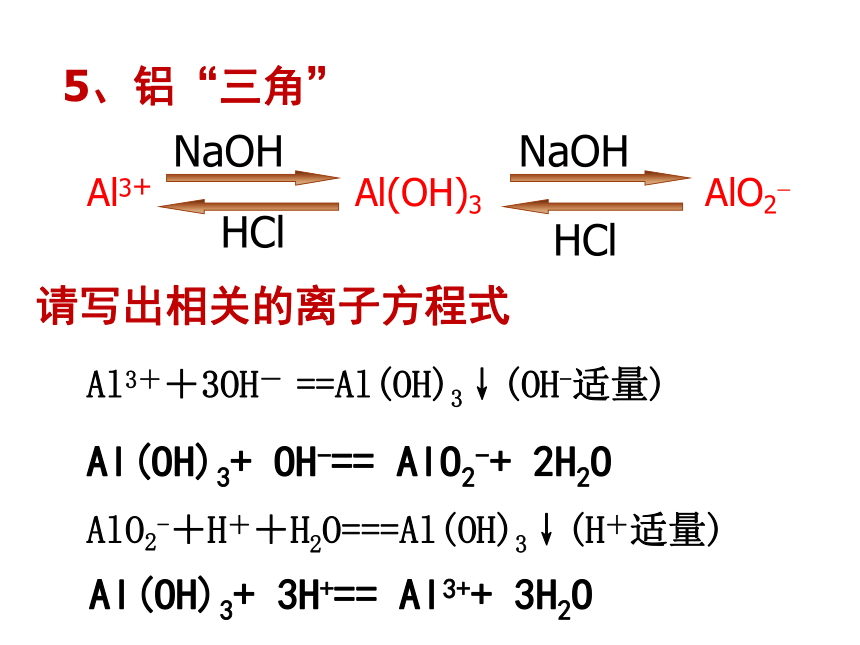
Al3++3AlO2-+6H2O===4Al(OH)3↓ 3、实验室制法Al2(SO4)3+ 6NH3.H2O==2Al(OH)3↓+3(NH4)2SO4见教材P58“实验3-7”Al3++3NH3·H2O===Al(OH)3↓+3NH4+能产生氢氧化铝的反应还有:4、用途中和胃酸净水作用(胶体)【因为Al(OH)3能凝聚水中的悬浮物,并能吸附色素。】 KAl(SO4)2·12H2O(明矾)(白矾)明矾又属于矾类物质。矾,即某些硫酸盐的含水结晶。在中学化学里常见的矾,除明矾以外,还有蓝矾(CuSO4·5H2O)、绿矾(FeSO4·7H2O)等。 阅读教材P59“资料卡片” Al3+ Al(OH)3 AlO2? HCl NaOH NaOHHCl5、铝“三角”Al3++3OH- ==Al(OH)3↓(OH-适量)Al(OH)3+ OH-== AlO2-+ 2H2O Al(OH)3+ 3H+== Al3++ 3H2OAlO2-+H++H2O===Al(OH)3↓(H+适量)请写出相关的离子方程式Al3+Al(OH)33OH-AlO2-OH-3H+H++ H2O4OH-4H+6、有关铝三角的基本图象:(1)铝盐溶液和氨水的反应原理:Al3++3NH3· H2O = Al(OH)3 ↓ +3NH4+3(2)在一定量AlCl3溶液中逐滴加入NaOH溶液原理:Al3++3OH- = Al(OH)3↓Al(OH)3+OH- = AlO2-+2H2O
34(3)若溶液中有Al(OH)3沉淀0.78g时,用去NaOH溶液的体积为 。若有沉淀0.52g,此时用去NaOH溶液体积为 。0.5210mL1、向20mLAlCl3溶液中滴入2mol/LNaOH溶液时,得到Al(OH)3沉淀的质量与所滴加NaOH溶液的体积有如图关系:
(1)图中A点表示的意义
是_________________。
(2)图中B点表示的意义
是_______________。Al3+完全生成沉淀沉淀完全溶解或 16.7mL15mL(3)向一定量NaAlO2溶液中逐滴加入HCl溶液14原理: H+ +AlO2- + H2O = Al(OH)3 ↓
Al(OH)3 +3H+ = Al3+ + 3H2O (4)向偏铝酸盐溶液中通入CO2原理:CO2 +2AlO2- + 3H2O = 2Al(OH)3 ↓+CO32-
(5)向氯化镁和氯化铝的混合溶液中加足量的氢氧化钠原理:氢氧化钠先与氯化镁和氯化铝反应,生成氢氧化镁和氢氧化铝沉淀,然后氢氧化铝溶解,但氢氧化镁不溶。氢氧化镁氢氧化铝1、有一镁、铝合金,用适量稀硫酸恰好完全溶解,再加入氢氧化钠溶液,析出沉淀的物质的量随氢氧化钠的体积关系如下图所示,则原合金中镁、铝物质的量比为 ( )A.2︰1 B.4︰1
C.1︰1 D.1︰2D3、现有总物质的量为0.1mol的Mg、Al混合物,将其溶于100mL2mol/L的H2SO4溶液中,然后再滴加1mol/L的NaOH溶液,得到Mg(OH)2、Al(OH)3沉淀的质量与所滴加NaOH溶液的体积有如图关系:
①Al ②NaHCO3 ③Al2O3 ④Mg(OH)2
⑤Al(OH)3
A.①②③⑤ B.①④⑤
C.②③⑤ D.①③④ 练习C2、下列列操作不能在氧化铝坩埚中进行的
是 (??? )
A.加热分解NH4HCO3??? B.熔化烧碱?
C.加热Na2CO3??? ?? D.加热NaClB(二)氢氧化铝【Al(OH)3】氢氧化铝是白色胶状沉淀,它能凝聚水中的悬浮物,并能吸附色素。1、物理性质2、化学性质和酸反应:和强碱反应:Al(OH)3+ NaOH== NaAlO2+ 2H2O Al(OH)3+ 3HCl== AlCl3+ 3H2O注:氢氧化铝既能跟酸反应,又能跟强碱反应生成盐和水,所以属于两性氢氧化物。不稳定性:氢氧化铝不稳定,受热易分解。注意:难溶性碱受热易分解成金属氧化物和水,而可溶性碱不会分解(氨水除外). Al3++3OH-===Al(OH)3↓(OH-适量)
AlO2-+H++H2O===Al(OH)3↓(H+适量)
AlO2-+CO2+2H2O===Al(OH)3↓+HCO3-
Al3++3AlO2-+6H2O===4Al(OH)3↓ 3、实验室制法Al2(SO4)3+ 6NH3.H2O==2Al(OH)3↓+3(NH4)2SO4见教材P58“实验3-7”Al3++3NH3·H2O===Al(OH)3↓+3NH4+能产生氢氧化铝的反应还有:4、用途中和胃酸净水作用(胶体)【因为Al(OH)3能凝聚水中的悬浮物,并能吸附色素。】 KAl(SO4)2·12H2O(明矾)(白矾)明矾又属于矾类物质。矾,即某些硫酸盐的含水结晶。在中学化学里常见的矾,除明矾以外,还有蓝矾(CuSO4·5H2O)、绿矾(FeSO4·7H2O)等。 阅读教材P59“资料卡片” Al3+ Al(OH)3 AlO2? HCl NaOH NaOHHCl5、铝“三角”Al3++3OH- ==Al(OH)3↓(OH-适量)Al(OH)3+ OH-== AlO2-+ 2H2O Al(OH)3+ 3H+== Al3++ 3H2OAlO2-+H++H2O===Al(OH)3↓(H+适量)请写出相关的离子方程式Al3+Al(OH)33OH-AlO2-OH-3H+H++ H2O4OH-4H+6、有关铝三角的基本图象:(1)铝盐溶液和氨水的反应原理:Al3++3NH3· H2O = Al(OH)3 ↓ +3NH4+3(2)在一定量AlCl3溶液中逐滴加入NaOH溶液原理:Al3++3OH- = Al(OH)3↓Al(OH)3+OH- = AlO2-+2H2O
34(3)若溶液中有Al(OH)3沉淀0.78g时,用去NaOH溶液的体积为 。若有沉淀0.52g,此时用去NaOH溶液体积为 。0.5210mL1、向20mLAlCl3溶液中滴入2mol/LNaOH溶液时,得到Al(OH)3沉淀的质量与所滴加NaOH溶液的体积有如图关系:
(1)图中A点表示的意义
是_________________。
(2)图中B点表示的意义
是_______________。Al3+完全生成沉淀沉淀完全溶解或 16.7mL15mL(3)向一定量NaAlO2溶液中逐滴加入HCl溶液14原理: H+ +AlO2- + H2O = Al(OH)3 ↓
Al(OH)3 +3H+ = Al3+ + 3H2O (4)向偏铝酸盐溶液中通入CO2原理:CO2 +2AlO2- + 3H2O = 2Al(OH)3 ↓+CO32-
(5)向氯化镁和氯化铝的混合溶液中加足量的氢氧化钠原理:氢氧化钠先与氯化镁和氯化铝反应,生成氢氧化镁和氢氧化铝沉淀,然后氢氧化铝溶解,但氢氧化镁不溶。氢氧化镁氢氧化铝1、有一镁、铝合金,用适量稀硫酸恰好完全溶解,再加入氢氧化钠溶液,析出沉淀的物质的量随氢氧化钠的体积关系如下图所示,则原合金中镁、铝物质的量比为 ( )A.2︰1 B.4︰1
C.1︰1 D.1︰2D3、现有总物质的量为0.1mol的Mg、Al混合物,将其溶于100mL2mol/L的H2SO4溶液中,然后再滴加1mol/L的NaOH溶液,得到Mg(OH)2、Al(OH)3沉淀的质量与所滴加NaOH溶液的体积有如图关系:
