【全国百强校】江西省临川区第二中学2014-2015学年高中化学必修一同步课件:第四章 第一节 无机非金属材料的主角——硅[新课](共30张PPT)
文档属性
| 名称 | 【全国百强校】江西省临川区第二中学2014-2015学年高中化学必修一同步课件:第四章 第一节 无机非金属材料的主角——硅[新课](共30张PPT) | 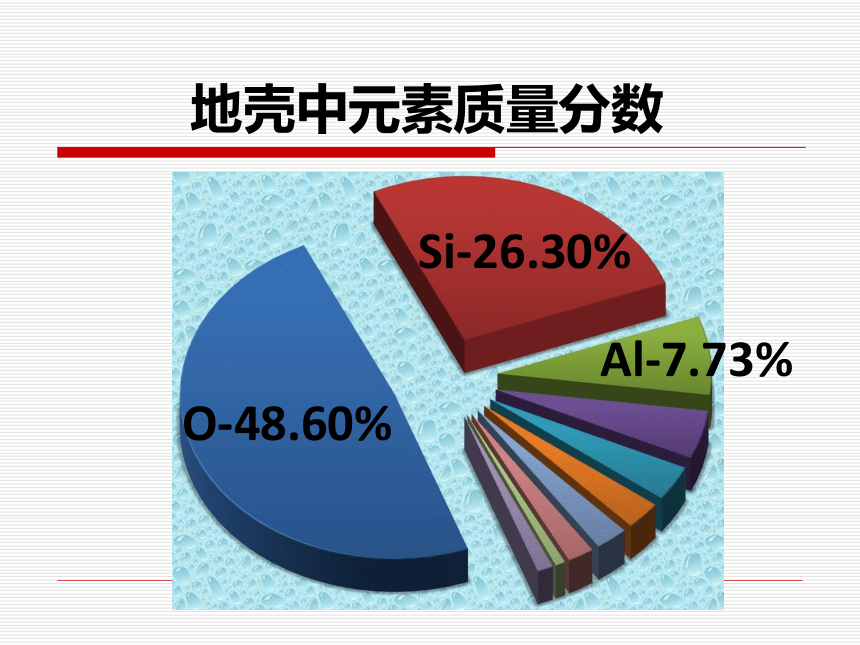 | |
| 格式 | zip | ||
| 文件大小 | 3.8MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2015-04-08 15:29:29 | ||
图片预览








文档简介
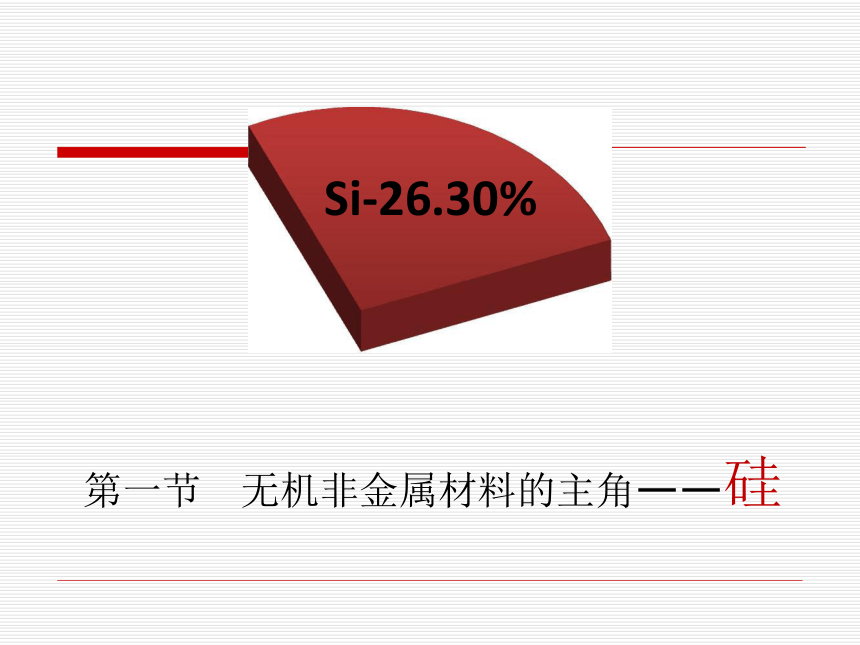
课件30张PPT。Al-7.73%O-48.60%Si-26.30%地壳中元素质量分数第一节 无机非金属材料的主角——硅Si-26.30%一、硅在自然界的存在:硅的氧化物
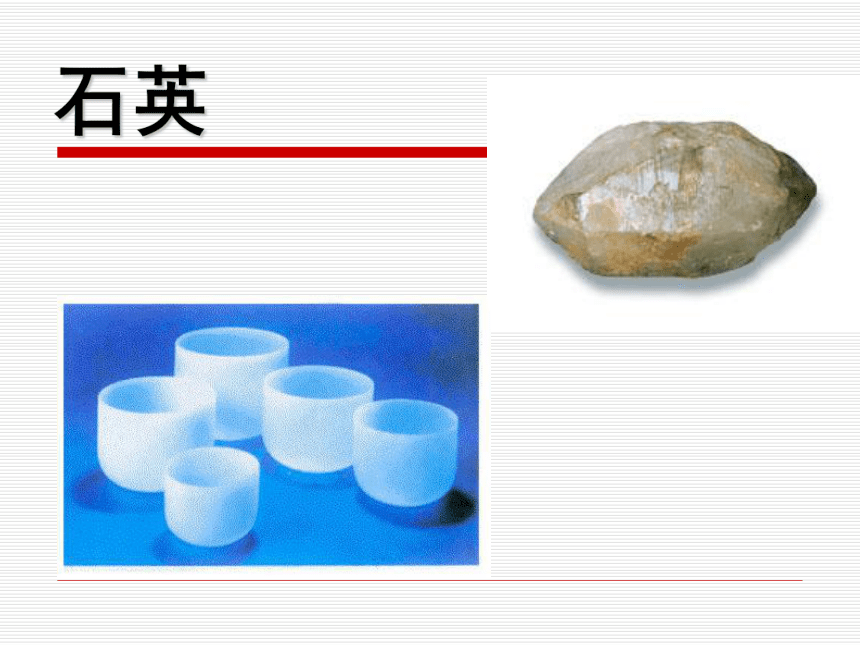
硅酸盐约占地壳质量的90%硅在地壳中含量第二,是构成岩石与许多矿物的基本元素。硅是一种亲氧元素,无游离态,在自然界中它总是与氧相互化合的石英水晶大而透明棱柱状的石英叫水晶。因含有微量杂质的水晶会带有不同颜色,有紫水晶、茶晶、墨晶等玛瑙具有彩色环带状或层状的石英称为玛瑙沙子二、二氧化硅(SiO2)1.天然SiO2的存在形式结晶形
(石英晶体)
无定形二氧化硅 (统称硅石)水晶
玛瑙
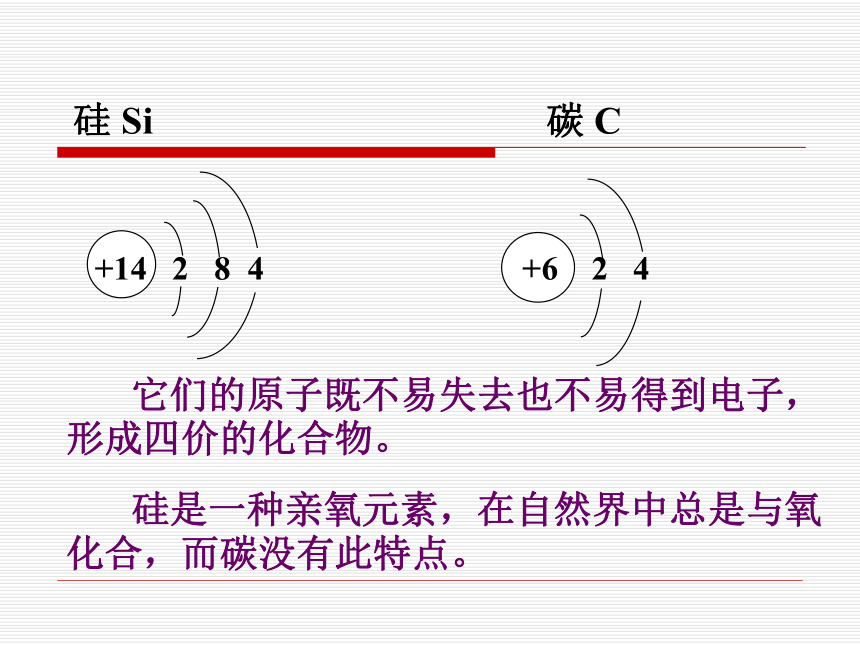
沙子硅藻土,硅藻的遗体硅硅 Si碳 C 它们的原子既不易失去也不易得到电子,形成四价的化合物。
硅是一种亲氧元素,在自然界中总是与氧化合,而碳没有此特点。2.结构:原子晶体3.物理性质:
不溶、熔点高、硬度大SiO2晶体:由Si和O按1:2的比例组成的正四面体立体网状结构的晶体(无单个SiO2分子存在)注意:SiO?是表示组成的最简化学式,仅表示二氧化硅晶体中硅和氧的原子个数之比109028’(2)氧化性
SiO2 + 2C == Si + 2CO ↑ 4.化学性质:(稳定)(1)酸性氧化物
① SiO2 + 2NaOH == Na2SiO3 + H2O
应用:装NaOH的试剂瓶不能用玻璃塞,要用橡胶塞高温(3)特性:与氢氟酸(HF)反应
SiO2 + 4HF == SiF4↑+ 2H2O
应用:①HF用于刻蚀玻璃;②用塑料瓶装HF思考题
下列说法错误的是( ) A. SiO2 是二氧化硅的化学式 B. SiO2 晶体是由Si和O按1:2的比例所组成的立体网状结构的晶体
C. 沙子里含无定形二氧化硅 D. 石英就是水晶 E. SiO2 从古到今被人类广泛地应用着,是因为SiO2 的立体网状结构和它在自然界的广泛存在 C D1.要除去SiO2中混有的少量CaO杂质,最适宜的试剂是
A. 纯碱溶液 B. 盐酸 C. 硫酸 D. 苛性钠溶液
2.下列反应能说明二氧化硅是酸性氧化物的是
A.SiO2 +2C=====Si+2CO↑
B.SiO2 +2NaOH=====Na2SiO3+H2O
C.SiO2 +4HF=====SiF4↑+2H2O
D.SiO2 +CaCO3=====CaSiO3+CO2↑
3.下列物质中,不能用玻璃瓶来盛装的是
A. 烧碱溶液 B. 浓硫酸 C. 氢氟酸 D. 碳酸钠溶液BBC沙子——建筑材料
纯净的SiO2——现代光学及光纤制品、光导纤维
水晶、玛瑙——饰物和工艺品5.用途:(P75)光导纤维内窥镜三、硅酸(H2SiO3)
1.制备:Na2SiO3 + 2HCl == H2SiO3(胶体) + 2NaCl强酸 弱酸Na2SiO3 + H2O + CO2 == H2SiO3(胶体) + Na2CO3弱酸 更弱酸2.物理性质:不溶于水的白色胶状沉淀3.用途:溶胶 → 凝胶 → 硅胶
硅胶用作 干燥剂、催化剂的载体酸性思考:
设计实验一次性证明酸性:盐酸>碳酸>硅酸,并试着画出装置图。稀盐酸大理石饱和NaHCO3溶液Na2SiO3溶液4.化学性质:
酸性比碳酸还弱的弱酸
(1)与碱反应H2SiO3 + 2NaOH== Na2SiO3+ 2H2O(2)不稳定性H2SiO3 == SiO2+ H2O△2.Na2SiO3——泡花碱
(1)可溶于水,其水溶液俗称水玻璃,显碱性
(2)用途:制备硅胶和木材防火剂等的原料1.存在形式天然:岩石、土壤等
合成:陶瓷、玻璃、水泥等四、硅酸盐(很稳定,大多不溶于水)3.硅酸盐材料高温高温1、将足量CO2气体通入水玻璃中,然后加热蒸干,再在高温下充分灼烧,最后所得的固体物质是( )
? A. Na2SiO3? B. Na2CO3、Na2SiO3
? C. Na2CO3、SiO2?????????????? D. SiO2练习A几种常见玻璃简介普通玻璃因混有铁的化合物显浅绿色蓝玻璃红玻璃铅玻璃光学仪器玻璃钢化玻璃光纤玻璃光导纤维:1964年8月华裔科学家高锟首先提出用玻璃纤维代替金属导线,被誉为“纤维光学之父”。比头发丝还细的一对光导纤维上同时传送3万门电话且中继距离长达20—50Km,保密性能好。
在原料里加入某些金属氧化物均匀地分散到玻璃态物质里,使玻璃呈现出特征颜色。 把普通玻璃放在电炉里加热,使它软化,然后急速冷却,得到钢化玻璃。其机械强度比普通玻璃大4—6倍,不易破碎。几种常见的玻璃Na2SiO3 :Al2(Si2O5)(OH)4 :Ca(Al2Si3O10)·3H2O钙沸石正长石高岭石CaO·Al2O3·3SiO2·3H2OK2O·Al2O3·6SiO2活泼金属氧化物 · 较活泼金属氧化物 · 二氧化硅 · 水Na2O·SiO2Al2O3·2SiO2·2H2OKAlSi3O8 4.硅酸盐的表示方法种类繁多、复杂(常用氧化物形式表示)无机非金属材料的主角——硅五、硅单质2.单质硅晶体
无定形1.晶体硅:有金属光泽的灰黑色固体,熔点高、硬度大、质脆。SiO2 + 3C === SiC (金刚砂)+ 2CO ↑制备:SiO2 + 2C === Si(粗硅) + 2CO ↑提纯:Si(粗硅) + 2Cl2 === SiCl4 SiCl4 + 2H2 === Si(纯) + 4HCl高温高温△△原子晶体,正四面体立体网状结构3、化学性质常温下化学性质不活泼,单质硅在常温下只与F2、NaOH溶液、HF三种物质反应Si + O2 === SiO2Si + 2F2 ===SiF4 ↑(1)与非金属反应高温(2)与NaOH(强碱)反应Si + 2NaOH + H2O===Na2SiO3 + 2H2 ↑(3)与HF反应Si + 4HF === SiF4 ↑ + 2H2 ↑集成电路太阳能电池变压器芯片4.应用:
良好的半导体、计算机芯片、太阳能电池
硅酸盐约占地壳质量的90%硅在地壳中含量第二,是构成岩石与许多矿物的基本元素。硅是一种亲氧元素,无游离态,在自然界中它总是与氧相互化合的石英水晶大而透明棱柱状的石英叫水晶。因含有微量杂质的水晶会带有不同颜色,有紫水晶、茶晶、墨晶等玛瑙具有彩色环带状或层状的石英称为玛瑙沙子二、二氧化硅(SiO2)1.天然SiO2的存在形式结晶形
(石英晶体)
无定形二氧化硅 (统称硅石)水晶
玛瑙
沙子硅藻土,硅藻的遗体硅硅 Si碳 C 它们的原子既不易失去也不易得到电子,形成四价的化合物。
硅是一种亲氧元素,在自然界中总是与氧化合,而碳没有此特点。2.结构:原子晶体3.物理性质:
不溶、熔点高、硬度大SiO2晶体:由Si和O按1:2的比例组成的正四面体立体网状结构的晶体(无单个SiO2分子存在)注意:SiO?是表示组成的最简化学式,仅表示二氧化硅晶体中硅和氧的原子个数之比109028’(2)氧化性
SiO2 + 2C == Si + 2CO ↑ 4.化学性质:(稳定)(1)酸性氧化物
① SiO2 + 2NaOH == Na2SiO3 + H2O
应用:装NaOH的试剂瓶不能用玻璃塞,要用橡胶塞高温(3)特性:与氢氟酸(HF)反应
SiO2 + 4HF == SiF4↑+ 2H2O
应用:①HF用于刻蚀玻璃;②用塑料瓶装HF思考题
下列说法错误的是( ) A. SiO2 是二氧化硅的化学式 B. SiO2 晶体是由Si和O按1:2的比例所组成的立体网状结构的晶体
C. 沙子里含无定形二氧化硅 D. 石英就是水晶 E. SiO2 从古到今被人类广泛地应用着,是因为SiO2 的立体网状结构和它在自然界的广泛存在 C D1.要除去SiO2中混有的少量CaO杂质,最适宜的试剂是
A. 纯碱溶液 B. 盐酸 C. 硫酸 D. 苛性钠溶液
2.下列反应能说明二氧化硅是酸性氧化物的是
A.SiO2 +2C=====Si+2CO↑
B.SiO2 +2NaOH=====Na2SiO3+H2O
C.SiO2 +4HF=====SiF4↑+2H2O
D.SiO2 +CaCO3=====CaSiO3+CO2↑
3.下列物质中,不能用玻璃瓶来盛装的是
A. 烧碱溶液 B. 浓硫酸 C. 氢氟酸 D. 碳酸钠溶液BBC沙子——建筑材料
纯净的SiO2——现代光学及光纤制品、光导纤维
水晶、玛瑙——饰物和工艺品5.用途:(P75)光导纤维内窥镜三、硅酸(H2SiO3)
1.制备:Na2SiO3 + 2HCl == H2SiO3(胶体) + 2NaCl强酸 弱酸Na2SiO3 + H2O + CO2 == H2SiO3(胶体) + Na2CO3弱酸 更弱酸2.物理性质:不溶于水的白色胶状沉淀3.用途:溶胶 → 凝胶 → 硅胶
硅胶用作 干燥剂、催化剂的载体酸性思考:
设计实验一次性证明酸性:盐酸>碳酸>硅酸,并试着画出装置图。稀盐酸大理石饱和NaHCO3溶液Na2SiO3溶液4.化学性质:
酸性比碳酸还弱的弱酸
(1)与碱反应H2SiO3 + 2NaOH== Na2SiO3+ 2H2O(2)不稳定性H2SiO3 == SiO2+ H2O△2.Na2SiO3——泡花碱
(1)可溶于水,其水溶液俗称水玻璃,显碱性
(2)用途:制备硅胶和木材防火剂等的原料1.存在形式天然:岩石、土壤等
合成:陶瓷、玻璃、水泥等四、硅酸盐(很稳定,大多不溶于水)3.硅酸盐材料高温高温1、将足量CO2气体通入水玻璃中,然后加热蒸干,再在高温下充分灼烧,最后所得的固体物质是( )
? A. Na2SiO3? B. Na2CO3、Na2SiO3
? C. Na2CO3、SiO2?????????????? D. SiO2练习A几种常见玻璃简介普通玻璃因混有铁的化合物显浅绿色蓝玻璃红玻璃铅玻璃光学仪器玻璃钢化玻璃光纤玻璃光导纤维:1964年8月华裔科学家高锟首先提出用玻璃纤维代替金属导线,被誉为“纤维光学之父”。比头发丝还细的一对光导纤维上同时传送3万门电话且中继距离长达20—50Km,保密性能好。
在原料里加入某些金属氧化物均匀地分散到玻璃态物质里,使玻璃呈现出特征颜色。 把普通玻璃放在电炉里加热,使它软化,然后急速冷却,得到钢化玻璃。其机械强度比普通玻璃大4—6倍,不易破碎。几种常见的玻璃Na2SiO3 :Al2(Si2O5)(OH)4 :Ca(Al2Si3O10)·3H2O钙沸石正长石高岭石CaO·Al2O3·3SiO2·3H2OK2O·Al2O3·6SiO2活泼金属氧化物 · 较活泼金属氧化物 · 二氧化硅 · 水Na2O·SiO2Al2O3·2SiO2·2H2OKAlSi3O8 4.硅酸盐的表示方法种类繁多、复杂(常用氧化物形式表示)无机非金属材料的主角——硅五、硅单质2.单质硅晶体
无定形1.晶体硅:有金属光泽的灰黑色固体,熔点高、硬度大、质脆。SiO2 + 3C === SiC (金刚砂)+ 2CO ↑制备:SiO2 + 2C === Si(粗硅) + 2CO ↑提纯:Si(粗硅) + 2Cl2 === SiCl4 SiCl4 + 2H2 === Si(纯) + 4HCl高温高温△△原子晶体,正四面体立体网状结构3、化学性质常温下化学性质不活泼,单质硅在常温下只与F2、NaOH溶液、HF三种物质反应Si + O2 === SiO2Si + 2F2 ===SiF4 ↑(1)与非金属反应高温(2)与NaOH(强碱)反应Si + 2NaOH + H2O===Na2SiO3 + 2H2 ↑(3)与HF反应Si + 4HF === SiF4 ↑ + 2H2 ↑集成电路太阳能电池变压器芯片4.应用:
良好的半导体、计算机芯片、太阳能电池
