2024届高考化学复习专题课件★★综合试卷(一) 课件(共68张PPT)
文档属性
| 名称 | 2024届高考化学复习专题课件★★综合试卷(一) 课件(共68张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 1.6MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-11-21 09:02:10 | ||
图片预览










文档简介
(共68张PPT)
模块综合试卷(一)
(满分:100分)
2024届高考化学复习专题课件★★
1
2
3
4
5
6
7
8
9
1.下列关于热化学方程式的叙述正确的是
A.已知C(石墨,s)===C(金刚石,s) ΔH>0,则金刚石比石墨稳定
B.已知2H2(g)+O2(g)===2H2O(g) ΔH=-483.6 kJ·mol -1,则H2的燃烧热
为241.8 kJ·mol-1
C.S(g)+O2(g)===SO2(g) ΔH1;S(s)+O2(g)===SO2(g) ΔH2,则ΔH1<ΔH2
D.在稀溶液中:H+(aq)+OH-(aq)===H2O(l) ΔH=-57.3 kJ·mol-1,若
将0.5 mol·L-1的稀 H2SO4与1 mol·L-1的NaOH溶液等体积混合,放出的
热量等于57.3 kJ
10
11
12
13
14
15
选择题
16
17
18
19
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
选择题
C(石墨,s)===C(金刚石,s) ΔH>0,则金刚石的能量大,稳定性小于石墨,故A错误;
H2O(g)→H2O(l)放热,所以1 mol H2完全燃烧生成液态水时放热大于241.8 kJ,即H2的燃烧热大于241.8 kJ·mol-1,故B错误;
S(s)→S(g)吸热,等量的S(s)和S(g)完全燃烧,S(g)放热多,由于放热ΔH为负,所以ΔH1<ΔH2,故C正确;
酸碱溶液体积未知,所以放出的热量不确定,故D错误。
16
17
18
19
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
选择题
16
17
18
19
2.下列实验事实不能证明醋酸是弱电解质的是
A.相同pH的醋酸溶液和盐酸分别与同样颗粒大小的锌反应时,产生H2的
起始速率相等
B.常温下,测得0.1 mol·L-1醋酸溶液的pH=4
C.常温下,将pH=1的醋酸溶液稀释1 000倍,测得pH<4
D.在相同条件下,醋酸溶液的导电性比盐酸的弱
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
选择题
16
17
18
19
强、弱电解质的本质区别是看能否完全电离;若完全电离则为强电解质;若部分电离则为弱电解质。
选项 内容指向·联系分析 结论
A pH相同,说明两溶液中的c(H+)相同,与同样的锌粒反应时产生H2的起始速率相同,无法证明醋酸是否完全电离 不能证明
B 若为强酸,常温下0.1 mol·L-1的一元酸,pH=1;而醋酸溶液的pH=4,证明醋酸未完全电离,是弱电解质 能证明
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
选择题
16
17
18
19
C 若为强酸,常温下pH=1的一元酸稀释1 000倍后,溶液的pH=4;而pH=1的醋酸溶液稀释1 000倍后pH<4,证明醋酸在稀释过程中可以继续电离,溶液中存在醋酸分子,醋酸未完全电离 能证明
D 相同条件下,CH3COOH溶液的导电性比盐酸弱,证明其溶液中离子浓度小,即醋酸未完全电离 能证明
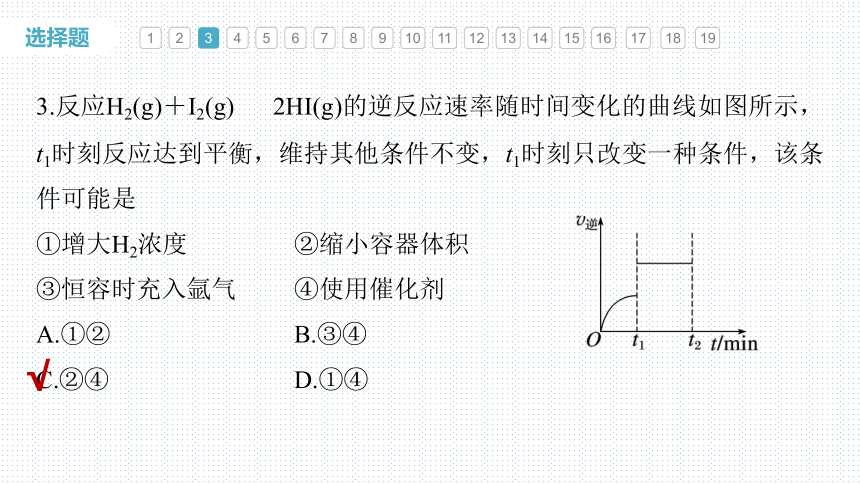
3.反应H2(g)+I2(g) 2HI(g)的逆反应速率随时间变化的曲线如图所示,t1时刻反应达到平衡,维持其他条件不变,t1时刻只改变一种条件,该条件可能是
①增大H2浓度 ②缩小容器体积
③恒容时充入氩气 ④使用催化剂
A.①② B.③④
C.②④ D.①④
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
选择题
16
17
18
19
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
选择题
16
17
18
19
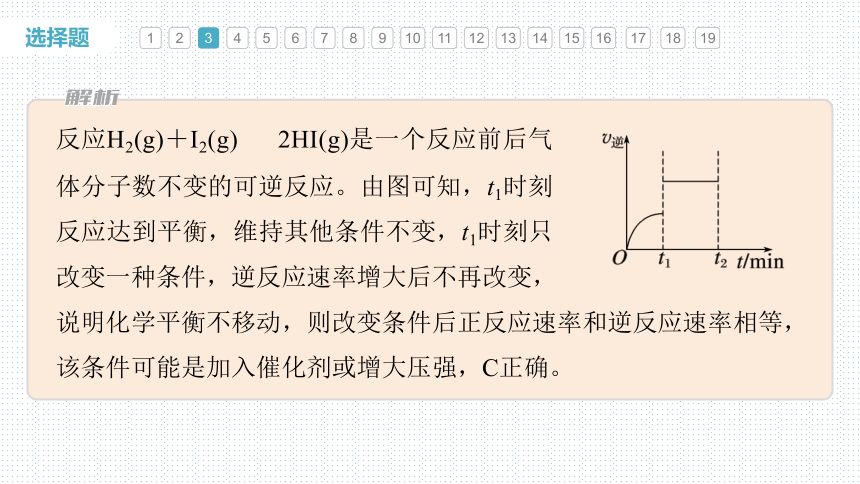
反应H2(g)+I2(g) 2HI(g)是一个反应前后气体分子数不变的可逆反应。由图可知,t1时刻反应达到平衡,维持其他条件不变,t1时刻只改变一种条件,逆反应速率增大后不再改变,
说明化学平衡不移动,则改变条件后正反应速率和逆反应速率相等,该条件可能是加入催化剂或增大压强,C正确。
4.下列说法正确的是
A.洗涤油污常用热的碳酸钠溶液
B.用加热的方法可以除去KCl溶液中的Fe3+
C.配制FeSO4溶液时,将FeSO4固体溶于稀盐酸中,然后稀释至所需浓度
D.将AlCl3溶液和Na2SO3溶液分别加热蒸干、灼烧后,所得固体为Al2O3
和Na2SO3
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
选择题
16
17
18
19
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
选择题
16
17
18
19
碳酸钠溶液显碱性,加热可以促进碳酸根离子的水解,使溶液碱性增强,A正确;
加热会促进Fe3+的水解,生成氢氧化铁沉淀,但是还要经过滤才能得到氯化钾溶液,B错误;
配制FeSO4溶液时,将FeSO4固体溶于稀盐酸中会引入杂质氯离子,C错误;
Na2SO3溶液加热蒸干、灼烧时,要考虑空气中的氧气将其氧化,所以最终得到Na2SO4固体,D错误。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
选择题
16
17
18
19
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
选择题
水的电离被抑制,溶液呈酸性或碱性,碱性条件下,Al3+、Fe3+生成沉淀,故A错误;
c(H+)>c(OH-),溶液呈酸性,这几种离子之间不反应且和氢离子不反应,所以能大量共存,故B正确;
无色溶液中不含有色离子, 呈紫色,故C错误;
能和Al反应放出H2的溶液为弱氧化性酸或强碱溶液,强酸性条件下硝酸和Al反应生成氮氧化物而不是氢气,强碱性条件下,Mg2+、Cu2+生成氢氧化物沉淀而不能大量共存,故D错误。
16
17
18
19
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
选择题
16
17
18
19
6.在100 mL某一元弱酸的溶液中,以0.50 mol·L-1氢氧化钠溶液滴定得到滴定曲线如图所示。
下列叙述正确的是
A.该弱酸在滴定前的浓度是0.15 mol·L-1
B.该弱酸稀释10倍后pH为4
C.为求滴定终点,最合适的指示剂是酚酞
D.为求滴定终点,最合适的指示剂是甲基橙
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
选择题
由图可知开始时,弱酸的pH=3,用NaOH滴定该弱酸溶液达到终点时pH范围在7~11,变色范围最合适的指示剂是酚酞,消耗NaOH的体积是20 mL,该
滴定前该弱酸的pH=3,弱酸在稀释过程中会继续电离,该弱酸稀释10倍后,pH小于4,故B错误。
16
17
18
19
7.下列叙述正确的是
A.稀醋酸中加入少量醋酸钠能增大醋酸的电离程度
B.25 ℃时,等体积等浓度的硝酸与氨水混合后,溶液的pH=7
C.25 ℃时,0.1 mol·L-1的硫化氢溶液比等浓度的硫化钠溶液的导电能力弱
D.0.1 mol AgCl和0.1 mol AgI混合后加入1 L水中,所得溶液中c(Cl-)=c(I-)
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
选择题
16
17
18
19
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
选择题
稀醋酸中加入少量醋酸钠,使溶液中的c(CH3COO-)增大,抑制醋酸的电离,A项错误;
二者完全反应生成NH4NO3, 发生水解,溶液呈酸性,pH<7,B项错误;
H2S部分电离,而Na2S完全电离,在等浓度的两种溶液中,Na2S溶液中的离子浓度较大,溶液的导电能力强,C项正确;
0.1 mol AgCl和0.1 mol AgI混合后加入1 L水中,达到沉淀溶解平衡,因为AgCl的溶解度大于AgI,溶液中c(Cl-)>c(I-),D项错误。
16
17
18
19
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
选择题
8.氮及其化合物的转化过程如图所示,其中图2为反应①过程中能量变化的曲线图。
16
17
18
19
下列分析合理的是
A.图2中c曲线是加入催化剂a时的能量变化曲线
B.反应①的热化学方程式为N2(g)+3H2(g) 2NH3(g) ΔH=-92 kJ·mol-1
C.在反应②中,若有1.25 mol电子发生转移,则参加反应的NH3的体积为5.6 L
D.催化剂a、b能提高反应①、②的化学反应速率和平衡转化率
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
选择题
16
17
18
19
A项,催化剂的反应机理是降低活化能,所以d曲线是加入催化剂的能量变化曲线;
C项,不知是否在标准状况下,气体体积不能准确计算;
D项,催化剂能提高反应速率,但不能影响平衡转化率。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
选择题
A.图甲中ω1>1
B.若在恒容绝热装置中进行上述反应,达
到平衡时,装置内的气体压强将不变
C.温度T1、ω=2, Cl2的转化率约为33.3%
D.图乙中,曲线A表示正反应的平衡常数
16
17
18
19
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
选择题
16
17
18
19
ω增大,可认为CH2==CHCH3不变,增加Cl2的量,平衡向右移动,CH2==CHCH3的转化率增大,则φ减小,由上述分析可知:ω2>ω1,则ω1<1;
该反应在反应前后气体分子数不变,根据图甲升高
温度丙烯的体积分数增大,即升高温度平衡逆向移动,正反应放热,在恒容绝热装置中进行题述反应,体系内温度升高,达到平衡时,装置内的气体压强将增大;
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
选择题
16
17
18
19
由图乙可知,T1时平衡常数为1,设起始时CH2==CHCH3和Cl2的物质的量分别为a mol和2a mol,达到平衡时转化的Cl2的物质的量为x mol,根据三段式进行计算:
CH2==CHCH3(g)+Cl2(g) CH2==CHCH2Cl(g)+HCl(g)
起始/mol a 2a 0 0
转化/mol x x x x
平衡/mol a-x 2a-x x x
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
选择题
16
17
18
19
正反应是放热反应,故温度升高,正反应的平衡常数减小,故图乙中,曲线A表示逆反应的平衡常数。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
选择题
16
17
18
19
10.下列说法不正确的是
A.Mg(OH)2固体在溶液中存在平衡:Mg(OH)2(s) Mg2+(aq)+2OH-(aq),
该固体可溶于NH4Cl溶液
B.向ZnS沉淀上滴加CuSO4溶液,沉淀变为黑色,可推知同温下Ksp(ZnS)
C.向AgCl悬浊液中滴加Na2S溶液,白色沉淀变成黑色,反应的离子方程
式为2AgCl(s)+S2-(aq) Ag2S(s)+2Cl-(aq)
D.向2 mL浓度均为1.2 mol·L-1的KCl、KI混合溶液中滴加1~2滴0.01 mol·
L-1的AgNO3溶液,振荡沉淀呈黄色,说明Ksp(AgCl)>Ksp(AgI)
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
选择题
16
17
18
19
11.下图是利用原电池原理提取碘的两个实验装置,下列说法正确的是
A.两个装置中,石墨Ⅰ和石墨Ⅱ均作负极
B.碘元素在装置①中被还原,在装置②中被氧化
C.装置①中MnO2的电极反应式为MnO2+2H2O+2e-===Mn2++4OH-
D.装置①、②中反应分别生成等量的I2时,导线上通过的电子数之比为1∶5
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
选择题
16
17
18
19
①中石墨Ⅰ区的NaI生成I2是失电子的过程,故石墨Ⅰ作负极,②中石墨Ⅱ区的NaIO3生成I2是得电子的过程,故石墨Ⅱ作正极,故A错误;
①中碘元素的化合价升高,被氧化,②中碘元素的化合价降低,被还原,故B错误;
MnO2在酸性溶液中,不可能生成OH-,故C错误;
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
选择题
16
17
18
19
反应①中碘元素的变化关系式为2I-~I2~2e-,②中碘元素的变化关系式为2 ~I2~10e-,则反应①、②中生成等量的I2时导线上通过的电子数之比为1∶5,故D正确。
A.电源正极为A,电解过程中有气体放出
B.电解时H+从质子交换膜左侧向右侧移动
C.电解过程中,右侧电解液pH保持不变
D.电解池一侧生成5.6 g N2,另一侧溶液质
量减少18 g
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
选择题
16
17
18
19
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
选择题
A项,根据题意,与B极相连的电极反应式为2
+12H++10e-===N2↑+6H2O,作电解池的阴极,故B为负极,则A为正极,溶液中的OH-放电生成O2,正确;
B项,电解时,左侧阳极室OH-发生反应,剩余H+,故H+从质子交换膜左侧向右侧移动,正确;
D项,电解池一侧生成5.6 g N2,转移的电子的物质的量为2 mol,故另一侧发生反应的水的物质的量为1 mol,溶液质量减少18 g,正确。
16
17
18
19
13.(2022·北京,13)利用下图装置进行铁上电镀铜的实验探究。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
选择题
16
17
18
19
装置示意图 序号 电解质溶液 实验现象
① 0.1 mol·L-1 CuSO4+少量H2SO4 阴极表面有无色气体,一段时间后阴极表面有红色固体,气体减少。经检验电解液中有Fe2+
② 0.1 mol·L-1 CuSO4+过量氨水 阴极表面未观察到气体,一段时间后阴极表面有致密红色固体。经检验电解液中无Fe元素
下列说法不正确的是
A.①中气体减少,推测是由于溶液中c(H+)减少,且Cu覆盖铁电极,阻
碍H+与铁接触
B.①中检测到Fe2+,推测可能发生反应:Fe+2H+===Fe2++H2↑、Fe
+Cu2+===Fe2++Cu
C.随阴极析出Cu,推测②中溶液c(Cu2+)减少,Cu2++4NH3 [Cu(NH3)4]2+
平衡逆移
D.②中Cu2+生成[Cu(NH3)4]2+,使得c(Cu2+)比①中溶液的小,Cu缓慢析
出,镀层更致密
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
选择题
16
17
18
19
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
选择题
16
17
18
19
由实验现象可知,实验①中,铁作电镀池的阴极,铁会先与溶液中的氢离子、铜离子反应生成亚铁离子、氢气和铜,一段时间后,铜离子在阴极得到电子发生还原反应生成铜;
实验②中,铜离子与过量氨水反应生成四氨合铜离子,四氨合铜离子在阴极得到电子缓慢发生还原反应生成铜,在铁表面得到比实验①更致密的镀层。由分析可知,实验①中,铁会先与溶液中的氢离子、铜离子反应,当溶液中氢离子浓度减小,放电生成的铜覆盖在铁电极上,阻碍氢离子与铁接触,导致产生的气体减少,故A正确;
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
选择题
16
17
18
19
由分析可知,实验①中,铁作电镀池的阴极,铁会先与溶液中的氢离子、铜离子反应生成亚铁离子、氢气和铜,可能发生的反应为Fe+2H+===Fe2++H2↑、Fe+Cu2+===Fe2++Cu,故B正确;
由分析可知,四氨合铜离子在阴极得到电子缓慢发生还原反应生成铜,随阴极析出铜,四氨合铜离子浓度减小,Cu2++4NH3 [Cu(NH3)4]2+平衡向正反应方向移动,故C错误。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
选择题
16
17
18
19
14.在容积一定的密闭容器中,置入一定量的NO(g)和足量C(s),发生反应:C(s)+2NO(g) CO2(g)+N2(g),平衡状态时NO(g)的物质的量浓度c(NO)与温度T的关系如图所示。则下列说法正确的是
A.该反应的ΔH>0
B.若该反应在T1、T2 ℃时的平衡常数分别为K1、K2,
则K1C.在T2 ℃时,若反应体系处于状态D,则此时一定有v正D.在T3 ℃时,若混合气体的密度不再变化,则可以判断反应达到平衡状态
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
选择题
由图像可知,T1K2,A、B项不正确;
T2 ℃时D点表示c(NO)>c(NO)平衡,因此由D点→
B点需降低c(NO),即平衡向右移动,所以D点对应体系中v正>v逆,C项不正确;
由于C为固体,故容积不变时,反应后气体质量增大,混合气体的密度增大,当密度不再变化时,可以判断反应达到平衡状态,D项正确。
16
17
18
19
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
选择题
15.常温下,将HCl气体通入1 L 浓度均为0.1 mol·L-1的NaA和NaB的混合溶液中,混合溶液的pH与离子浓度变化的关系如图所示(忽略溶液体积的变化)。下列叙述不正确的是
A.Ka(HB)的数量级为10-9
B.酸性的强弱顺序为HCl>HA>HB
C.当通入0.1 mol HCl气体时c(B-)>c(A-)
D.当混合溶液呈中性时:c(Na+)=c(Cl-)
+c(A-)+c(B-)
16
17
18
19
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
选择题
16
17
18
19
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
选择题
16
17
18
19
即Ka(HB)<Ka(HA),所以酸性:HA>HB,向NaA和NaB的混合溶液中通入HCl后,溶液中存在HA、HB,则说明HCl的酸性强于HA和HB,所以酸性强弱顺序为HCl>HA>HB,B正确;
原溶液中NaA和NaB均为0.1 mol,根据强酸制
弱酸原理,通入0.1 mol HCl,H+先与B-反应,反应后溶液中溶质为0.1 mol NaA、0.1 mol NaCl、0.1 mol HB,NaA完全电离,微弱水解,而HB部分电离,所以溶液中c(B-)<c(A-),C错误;
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
选择题
16
17
18
19
由电荷守恒知混合溶液中c(Na+)+c(H+)=c(Cl-)+c(A-)+c(B-)+c(OH-),当溶液呈中性时,c(H+)=c(OH-),所以有c(Na+)=c(Cl-)+c(A-)+c(B-),D正确。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
非选择题
16
17
18
19
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
非选择题
16
17
18
19
①第一步反应是_________(填“放热”或“吸热”)反应,判断依据是__________________________________________。
②1 mol (aq)全部被氧化成 (aq)的热化学方程式是______________
________________________________________________。
放热
ΔH<0(或反应物的总能量大于生成物的总能量)
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
非选择题
16
17
18
19
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
非选择题
(2)已知:2CO(g)+O2(g)===2CO2(g) ΔH=-566 kJ·mol-1 ①
Na2O2(s)+CO2(g)===Na2CO3(s)+ O2(g) ΔH=-226 kJ·mol-1 ②
则CO(g)与Na2O2(s)反应放出509 kJ热量时,电子转移的数目为_________
____________。
16
17
18
19
2NA (或
1.204×1024)
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
非选择题
16
17
18
19
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
非选择题
(3)已知H2(g)+Br2(l)===2HBr(g) ΔH=-72 kJ·mol-1,蒸发1 mol Br2(l)需要吸收的能量为30 kJ,其他相关数据如下表:
16
17
18
19
则表中a=_______。
369
物质 H2(g) Br2(g) HBr(g)
1 mol分子中的化学键断裂时需要吸收的能量/kJ 436 200 a
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
非选择题
16
17
18
19
由题中热化学方程式及蒸发1 mol Br2(l)吸热30 kJ可得:H2(g)+Br2(g)
===2HBr(g) ΔH=-102 kJ·mol-1,则436+200-2a=-102,a=369。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
非选择题
17.(14分)N2O和CO是常见的环境污染气体。
(1)对于反应N2O(g)+CO(g) CO2(g)+N2(g)来说,Fe+可作为此反应的催化剂。其总反应分两步进行:第一步为Fe++N2O FeO++N2;则第二步为__________________________(写方程式)。
已知第二步反应几乎不影响总反应达到平衡所用的时间,由此推知,第一步反应的活化能________(填“大于”“小于”或“等于”)第二步反应的活化能。
16
17
18
19
大于
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
非选择题
16
17
18
19
总反应分两步进行,根据催化剂定义,第一步:Fe++N2O FeO++N2,第二步反应中,中间产物(FeO+)氧化CO生成CO2,本身被还原成Fe+,FeO++CO Fe++CO2;第二步反应对总反应速率没有影响,说明第一步是慢反应,控制总反应速率,则第一步反应的活化能大于第二步反应的活化能。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
非选择题
(2)在四个不同容积的恒容密闭容器中按图甲充入相应的气体,发生反应:2N2O(g) 2N2(g)+O2(g),容器Ⅰ、Ⅱ、Ⅲ中N2O的平衡转化率如图乙所示:
16
17
18
19
①该反应的ΔH____(填“>”或“<”)0。
>
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
非选择题
16
17
18
19
升高温度,N2O的平衡转化率升高,反应向正反应方向进行,则正反应为吸热反应,ΔH>0。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
非选择题
②若容器Ⅰ的体积为2 L,反应在370 ℃下进行,20 s后达到平衡,则0~20 s内容器Ⅰ中用O2表示的反应速率为___________________。B点对应的平衡常数K=________(结果保留两位有效数字)。
16
17
18
19
0.000 5 mol·L-1·s-1
0.004 4
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
非选择题
16
17
18
19
2N2O(g) 2N2(g)+O2(g)
初/(mol·L-1) 0.05 0 0
变/(mol·L-1) 0.02 0.02 0.01
平/(mol·L-1) 0.03 0.02 0.01
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
非选择题
③图中A、C、D三点容器内气体密度由大到小的顺序是 __________。
16
17
18
19
D>C>A
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
非选择题
16
17
18
19
容器内混合气体密度为ρ= ,反应前后质量守恒,m不变,只需比较容器体积即可,从A→C→D,三点起始量一样,随着温度升高,由于正反应为吸热反应,温度升高有助于反应进行,导致转化率增大,
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
非选择题
16
17
18
19
现要使三点的转化率一致,所以需要加压,相当于缩小容器体积,即VA>VC>VD,所以ρA<ρC<ρD,即图中A、C、D三点容器内气体密度大小关系:D>C>A。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
非选择题
④若容器Ⅳ体积为1 L,反应在370 ℃下进行,则起始时反应__________
______(填“向正反应方向”“向逆反应方向”或“不”)进行。
16
17
18
19
方向
向逆反应
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
非选择题
16
17
18
19
容器Ⅳ体积为1 L,370 ℃时,
2N2O(g) 2N2(g)+O2(g)
起始/(mol·L-1) 0.06 0.06 0.04
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
非选择题
18.(12分)纳米级Cu2O由于具有优良的催化性能而受到关注,采用肼(N2H4)燃料电池为电源,用离子交换膜控制电解液中的c(OH-)制备纳米Cu2O,其装置如图甲、乙。
16
17
18
19
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
非选择题
(1)题述装置中D电极应连接肼燃料电池的______(填“A”或“B”)极,该电解池中离子交换膜为______(填“阴”或“阳”)离子交换膜。
16
17
18
19
B
阴
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
非选择题
16
17
18
19
燃料电池正极通氧化剂,负极通燃料,即A极为负极,B极为正极。图乙为电解池装置,电解的目的为制备Cu2O,则D极作阳极,接电池正极(B极),铜被氧化;阳极反应式为2Cu-2e-+2OH-===Cu2O+H2O,反应消耗OH-,采用阴离子交换膜使OH-向阳极移动。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
非选择题
(2)该电解池的阳极反应式为_____
__________________________,肼燃料电池中A极发生的电极反应为______________________________。
16
17
18
19
2e-+2OH-===Cu2O+H2O
N2H4-4e-+4OH-===N2+4H2O
2Cu-
A极为负极,N2H4失电子转化为N2,故电极反应式为N2H4-4e-+4OH-===N2+4H2O。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
非选择题
(3)当反应生成14.4 g Cu2O时,至少需要肼______ mol。
16
17
18
19
0.05
根据电极反应可得关系式4e-~2Cu2O~N2H4,
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
非选择题
19.(15分)(1)电解法也可除去水中的氨氮,实验室用石墨电极电解一定浓度的(NH4)2SO4与NaCl的酸性混合溶液来进行模拟。
①电解时,阳极的电极反应式为____________________。
16
17
18
19
2Cl--2e-===Cl2↑
电解过程中溶液初始Cl-浓度和pH对氨氮去除速率与能耗(处理一定量氨氮消耗的电能)的影响关系如图1和图2所示。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
非选择题
16
17
18
19
阳极失电子发生氧化反应,故电极反应式为2Cl--2e-===Cl2↑。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
非选择题
②图1中当Cl-浓度较低时、图2中当初始pH达到12时,氨氮去除速率低而能耗高的原因可能是__________________________________________;而当Cl-浓度较高时,测得溶液中的 浓度也较高,可能的原因是__________________________________________________________。
16
17
18
19
阳极可能是OH-放电,产生大量氧气,消耗电能
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
非选择题
③图2中,pH为6时处理效果最佳,当pH过低时,处理效果不佳的原因可能是____________________________________。
16
17
18
19
pH太低时,产生的Cl2会从溶液中逸出
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
非选择题
(2)通过调节溶液pH,在弱碱性条件下,用漂白粉溶液也可将废水中的CN-转化为碳酸盐和N2而除去。写出该反应的离子方程式:__________
_____________________________________________________。
16
17
18
19
2CN-+
5ClO-+2OH-+2Ca2+===2CaCO3↓+N2↑+5Cl-+H2O
漂白粉的有效成分是Ca(ClO)2,因为漂白粉溶液也可将废水中的CN-转化为碳酸盐和N2而除去,故离子方程式为2CN-+5ClO-+2OH-+2Ca2+===2CaCO3↓+N2↑+5Cl-+H2O。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
非选择题
(3)废水中的重金属离子通常用沉淀法除去。已知Ksp(NiS)=1.1×10-21,Ksp(CuS)=1.3×10-36,国家规定的排放标准:镍低于1.1×10-5 mol·L-1,铜低于7.8×10-5 mol·L-1。则需要控制溶液中S2-的浓度不低于________mol·L-1。
16
17
18
19
10-16
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
非选择题
16
17
18
19
模块综合试卷(一)
(满分:100分)
2024届高考化学复习专题课件★★
1
2
3
4
5
6
7
8
9
1.下列关于热化学方程式的叙述正确的是
A.已知C(石墨,s)===C(金刚石,s) ΔH>0,则金刚石比石墨稳定
B.已知2H2(g)+O2(g)===2H2O(g) ΔH=-483.6 kJ·mol -1,则H2的燃烧热
为241.8 kJ·mol-1
C.S(g)+O2(g)===SO2(g) ΔH1;S(s)+O2(g)===SO2(g) ΔH2,则ΔH1<ΔH2
D.在稀溶液中:H+(aq)+OH-(aq)===H2O(l) ΔH=-57.3 kJ·mol-1,若
将0.5 mol·L-1的稀 H2SO4与1 mol·L-1的NaOH溶液等体积混合,放出的
热量等于57.3 kJ
10
11
12
13
14
15
选择题
16
17
18
19
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
选择题
C(石墨,s)===C(金刚石,s) ΔH>0,则金刚石的能量大,稳定性小于石墨,故A错误;
H2O(g)→H2O(l)放热,所以1 mol H2完全燃烧生成液态水时放热大于241.8 kJ,即H2的燃烧热大于241.8 kJ·mol-1,故B错误;
S(s)→S(g)吸热,等量的S(s)和S(g)完全燃烧,S(g)放热多,由于放热ΔH为负,所以ΔH1<ΔH2,故C正确;
酸碱溶液体积未知,所以放出的热量不确定,故D错误。
16
17
18
19
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
选择题
16
17
18
19
2.下列实验事实不能证明醋酸是弱电解质的是
A.相同pH的醋酸溶液和盐酸分别与同样颗粒大小的锌反应时,产生H2的
起始速率相等
B.常温下,测得0.1 mol·L-1醋酸溶液的pH=4
C.常温下,将pH=1的醋酸溶液稀释1 000倍,测得pH<4
D.在相同条件下,醋酸溶液的导电性比盐酸的弱
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
选择题
16
17
18
19
强、弱电解质的本质区别是看能否完全电离;若完全电离则为强电解质;若部分电离则为弱电解质。
选项 内容指向·联系分析 结论
A pH相同,说明两溶液中的c(H+)相同,与同样的锌粒反应时产生H2的起始速率相同,无法证明醋酸是否完全电离 不能证明
B 若为强酸,常温下0.1 mol·L-1的一元酸,pH=1;而醋酸溶液的pH=4,证明醋酸未完全电离,是弱电解质 能证明
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
选择题
16
17
18
19
C 若为强酸,常温下pH=1的一元酸稀释1 000倍后,溶液的pH=4;而pH=1的醋酸溶液稀释1 000倍后pH<4,证明醋酸在稀释过程中可以继续电离,溶液中存在醋酸分子,醋酸未完全电离 能证明
D 相同条件下,CH3COOH溶液的导电性比盐酸弱,证明其溶液中离子浓度小,即醋酸未完全电离 能证明
3.反应H2(g)+I2(g) 2HI(g)的逆反应速率随时间变化的曲线如图所示,t1时刻反应达到平衡,维持其他条件不变,t1时刻只改变一种条件,该条件可能是
①增大H2浓度 ②缩小容器体积
③恒容时充入氩气 ④使用催化剂
A.①② B.③④
C.②④ D.①④
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
选择题
16
17
18
19
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
选择题
16
17
18
19
反应H2(g)+I2(g) 2HI(g)是一个反应前后气体分子数不变的可逆反应。由图可知,t1时刻反应达到平衡,维持其他条件不变,t1时刻只改变一种条件,逆反应速率增大后不再改变,
说明化学平衡不移动,则改变条件后正反应速率和逆反应速率相等,该条件可能是加入催化剂或增大压强,C正确。
4.下列说法正确的是
A.洗涤油污常用热的碳酸钠溶液
B.用加热的方法可以除去KCl溶液中的Fe3+
C.配制FeSO4溶液时,将FeSO4固体溶于稀盐酸中,然后稀释至所需浓度
D.将AlCl3溶液和Na2SO3溶液分别加热蒸干、灼烧后,所得固体为Al2O3
和Na2SO3
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
选择题
16
17
18
19
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
选择题
16
17
18
19
碳酸钠溶液显碱性,加热可以促进碳酸根离子的水解,使溶液碱性增强,A正确;
加热会促进Fe3+的水解,生成氢氧化铁沉淀,但是还要经过滤才能得到氯化钾溶液,B错误;
配制FeSO4溶液时,将FeSO4固体溶于稀盐酸中会引入杂质氯离子,C错误;
Na2SO3溶液加热蒸干、灼烧时,要考虑空气中的氧气将其氧化,所以最终得到Na2SO4固体,D错误。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
选择题
16
17
18
19
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
选择题
水的电离被抑制,溶液呈酸性或碱性,碱性条件下,Al3+、Fe3+生成沉淀,故A错误;
c(H+)>c(OH-),溶液呈酸性,这几种离子之间不反应且和氢离子不反应,所以能大量共存,故B正确;
无色溶液中不含有色离子, 呈紫色,故C错误;
能和Al反应放出H2的溶液为弱氧化性酸或强碱溶液,强酸性条件下硝酸和Al反应生成氮氧化物而不是氢气,强碱性条件下,Mg2+、Cu2+生成氢氧化物沉淀而不能大量共存,故D错误。
16
17
18
19
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
选择题
16
17
18
19
6.在100 mL某一元弱酸的溶液中,以0.50 mol·L-1氢氧化钠溶液滴定得到滴定曲线如图所示。
下列叙述正确的是
A.该弱酸在滴定前的浓度是0.15 mol·L-1
B.该弱酸稀释10倍后pH为4
C.为求滴定终点,最合适的指示剂是酚酞
D.为求滴定终点,最合适的指示剂是甲基橙
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
选择题
由图可知开始时,弱酸的pH=3,用NaOH滴定该弱酸溶液达到终点时pH范围在7~11,变色范围最合适的指示剂是酚酞,消耗NaOH的体积是20 mL,该
滴定前该弱酸的pH=3,弱酸在稀释过程中会继续电离,该弱酸稀释10倍后,pH小于4,故B错误。
16
17
18
19
7.下列叙述正确的是
A.稀醋酸中加入少量醋酸钠能增大醋酸的电离程度
B.25 ℃时,等体积等浓度的硝酸与氨水混合后,溶液的pH=7
C.25 ℃时,0.1 mol·L-1的硫化氢溶液比等浓度的硫化钠溶液的导电能力弱
D.0.1 mol AgCl和0.1 mol AgI混合后加入1 L水中,所得溶液中c(Cl-)=c(I-)
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
选择题
16
17
18
19
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
选择题
稀醋酸中加入少量醋酸钠,使溶液中的c(CH3COO-)增大,抑制醋酸的电离,A项错误;
二者完全反应生成NH4NO3, 发生水解,溶液呈酸性,pH<7,B项错误;
H2S部分电离,而Na2S完全电离,在等浓度的两种溶液中,Na2S溶液中的离子浓度较大,溶液的导电能力强,C项正确;
0.1 mol AgCl和0.1 mol AgI混合后加入1 L水中,达到沉淀溶解平衡,因为AgCl的溶解度大于AgI,溶液中c(Cl-)>c(I-),D项错误。
16
17
18
19
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
选择题
8.氮及其化合物的转化过程如图所示,其中图2为反应①过程中能量变化的曲线图。
16
17
18
19
下列分析合理的是
A.图2中c曲线是加入催化剂a时的能量变化曲线
B.反应①的热化学方程式为N2(g)+3H2(g) 2NH3(g) ΔH=-92 kJ·mol-1
C.在反应②中,若有1.25 mol电子发生转移,则参加反应的NH3的体积为5.6 L
D.催化剂a、b能提高反应①、②的化学反应速率和平衡转化率
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
选择题
16
17
18
19
A项,催化剂的反应机理是降低活化能,所以d曲线是加入催化剂的能量变化曲线;
C项,不知是否在标准状况下,气体体积不能准确计算;
D项,催化剂能提高反应速率,但不能影响平衡转化率。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
选择题
A.图甲中ω1>1
B.若在恒容绝热装置中进行上述反应,达
到平衡时,装置内的气体压强将不变
C.温度T1、ω=2, Cl2的转化率约为33.3%
D.图乙中,曲线A表示正反应的平衡常数
16
17
18
19
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
选择题
16
17
18
19
ω增大,可认为CH2==CHCH3不变,增加Cl2的量,平衡向右移动,CH2==CHCH3的转化率增大,则φ减小,由上述分析可知:ω2>ω1,则ω1<1;
该反应在反应前后气体分子数不变,根据图甲升高
温度丙烯的体积分数增大,即升高温度平衡逆向移动,正反应放热,在恒容绝热装置中进行题述反应,体系内温度升高,达到平衡时,装置内的气体压强将增大;
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
选择题
16
17
18
19
由图乙可知,T1时平衡常数为1,设起始时CH2==CHCH3和Cl2的物质的量分别为a mol和2a mol,达到平衡时转化的Cl2的物质的量为x mol,根据三段式进行计算:
CH2==CHCH3(g)+Cl2(g) CH2==CHCH2Cl(g)+HCl(g)
起始/mol a 2a 0 0
转化/mol x x x x
平衡/mol a-x 2a-x x x
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
选择题
16
17
18
19
正反应是放热反应,故温度升高,正反应的平衡常数减小,故图乙中,曲线A表示逆反应的平衡常数。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
选择题
16
17
18
19
10.下列说法不正确的是
A.Mg(OH)2固体在溶液中存在平衡:Mg(OH)2(s) Mg2+(aq)+2OH-(aq),
该固体可溶于NH4Cl溶液
B.向ZnS沉淀上滴加CuSO4溶液,沉淀变为黑色,可推知同温下Ksp(ZnS)
式为2AgCl(s)+S2-(aq) Ag2S(s)+2Cl-(aq)
D.向2 mL浓度均为1.2 mol·L-1的KCl、KI混合溶液中滴加1~2滴0.01 mol·
L-1的AgNO3溶液,振荡沉淀呈黄色,说明Ksp(AgCl)>Ksp(AgI)
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
选择题
16
17
18
19
11.下图是利用原电池原理提取碘的两个实验装置,下列说法正确的是
A.两个装置中,石墨Ⅰ和石墨Ⅱ均作负极
B.碘元素在装置①中被还原,在装置②中被氧化
C.装置①中MnO2的电极反应式为MnO2+2H2O+2e-===Mn2++4OH-
D.装置①、②中反应分别生成等量的I2时,导线上通过的电子数之比为1∶5
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
选择题
16
17
18
19
①中石墨Ⅰ区的NaI生成I2是失电子的过程,故石墨Ⅰ作负极,②中石墨Ⅱ区的NaIO3生成I2是得电子的过程,故石墨Ⅱ作正极,故A错误;
①中碘元素的化合价升高,被氧化,②中碘元素的化合价降低,被还原,故B错误;
MnO2在酸性溶液中,不可能生成OH-,故C错误;
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
选择题
16
17
18
19
反应①中碘元素的变化关系式为2I-~I2~2e-,②中碘元素的变化关系式为2 ~I2~10e-,则反应①、②中生成等量的I2时导线上通过的电子数之比为1∶5,故D正确。
A.电源正极为A,电解过程中有气体放出
B.电解时H+从质子交换膜左侧向右侧移动
C.电解过程中,右侧电解液pH保持不变
D.电解池一侧生成5.6 g N2,另一侧溶液质
量减少18 g
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
选择题
16
17
18
19
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
选择题
A项,根据题意,与B极相连的电极反应式为2
+12H++10e-===N2↑+6H2O,作电解池的阴极,故B为负极,则A为正极,溶液中的OH-放电生成O2,正确;
B项,电解时,左侧阳极室OH-发生反应,剩余H+,故H+从质子交换膜左侧向右侧移动,正确;
D项,电解池一侧生成5.6 g N2,转移的电子的物质的量为2 mol,故另一侧发生反应的水的物质的量为1 mol,溶液质量减少18 g,正确。
16
17
18
19
13.(2022·北京,13)利用下图装置进行铁上电镀铜的实验探究。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
选择题
16
17
18
19
装置示意图 序号 电解质溶液 实验现象
① 0.1 mol·L-1 CuSO4+少量H2SO4 阴极表面有无色气体,一段时间后阴极表面有红色固体,气体减少。经检验电解液中有Fe2+
② 0.1 mol·L-1 CuSO4+过量氨水 阴极表面未观察到气体,一段时间后阴极表面有致密红色固体。经检验电解液中无Fe元素
下列说法不正确的是
A.①中气体减少,推测是由于溶液中c(H+)减少,且Cu覆盖铁电极,阻
碍H+与铁接触
B.①中检测到Fe2+,推测可能发生反应:Fe+2H+===Fe2++H2↑、Fe
+Cu2+===Fe2++Cu
C.随阴极析出Cu,推测②中溶液c(Cu2+)减少,Cu2++4NH3 [Cu(NH3)4]2+
平衡逆移
D.②中Cu2+生成[Cu(NH3)4]2+,使得c(Cu2+)比①中溶液的小,Cu缓慢析
出,镀层更致密
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
选择题
16
17
18
19
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
选择题
16
17
18
19
由实验现象可知,实验①中,铁作电镀池的阴极,铁会先与溶液中的氢离子、铜离子反应生成亚铁离子、氢气和铜,一段时间后,铜离子在阴极得到电子发生还原反应生成铜;
实验②中,铜离子与过量氨水反应生成四氨合铜离子,四氨合铜离子在阴极得到电子缓慢发生还原反应生成铜,在铁表面得到比实验①更致密的镀层。由分析可知,实验①中,铁会先与溶液中的氢离子、铜离子反应,当溶液中氢离子浓度减小,放电生成的铜覆盖在铁电极上,阻碍氢离子与铁接触,导致产生的气体减少,故A正确;
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
选择题
16
17
18
19
由分析可知,实验①中,铁作电镀池的阴极,铁会先与溶液中的氢离子、铜离子反应生成亚铁离子、氢气和铜,可能发生的反应为Fe+2H+===Fe2++H2↑、Fe+Cu2+===Fe2++Cu,故B正确;
由分析可知,四氨合铜离子在阴极得到电子缓慢发生还原反应生成铜,随阴极析出铜,四氨合铜离子浓度减小,Cu2++4NH3 [Cu(NH3)4]2+平衡向正反应方向移动,故C错误。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
选择题
16
17
18
19
14.在容积一定的密闭容器中,置入一定量的NO(g)和足量C(s),发生反应:C(s)+2NO(g) CO2(g)+N2(g),平衡状态时NO(g)的物质的量浓度c(NO)与温度T的关系如图所示。则下列说法正确的是
A.该反应的ΔH>0
B.若该反应在T1、T2 ℃时的平衡常数分别为K1、K2,
则K1
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
选择题
由图像可知,T1
T2 ℃时D点表示c(NO)>c(NO)平衡,因此由D点→
B点需降低c(NO),即平衡向右移动,所以D点对应体系中v正>v逆,C项不正确;
由于C为固体,故容积不变时,反应后气体质量增大,混合气体的密度增大,当密度不再变化时,可以判断反应达到平衡状态,D项正确。
16
17
18
19
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
选择题
15.常温下,将HCl气体通入1 L 浓度均为0.1 mol·L-1的NaA和NaB的混合溶液中,混合溶液的pH与离子浓度变化的关系如图所示(忽略溶液体积的变化)。下列叙述不正确的是
A.Ka(HB)的数量级为10-9
B.酸性的强弱顺序为HCl>HA>HB
C.当通入0.1 mol HCl气体时c(B-)>c(A-)
D.当混合溶液呈中性时:c(Na+)=c(Cl-)
+c(A-)+c(B-)
16
17
18
19
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
选择题
16
17
18
19
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
选择题
16
17
18
19
即Ka(HB)<Ka(HA),所以酸性:HA>HB,向NaA和NaB的混合溶液中通入HCl后,溶液中存在HA、HB,则说明HCl的酸性强于HA和HB,所以酸性强弱顺序为HCl>HA>HB,B正确;
原溶液中NaA和NaB均为0.1 mol,根据强酸制
弱酸原理,通入0.1 mol HCl,H+先与B-反应,反应后溶液中溶质为0.1 mol NaA、0.1 mol NaCl、0.1 mol HB,NaA完全电离,微弱水解,而HB部分电离,所以溶液中c(B-)<c(A-),C错误;
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
选择题
16
17
18
19
由电荷守恒知混合溶液中c(Na+)+c(H+)=c(Cl-)+c(A-)+c(B-)+c(OH-),当溶液呈中性时,c(H+)=c(OH-),所以有c(Na+)=c(Cl-)+c(A-)+c(B-),D正确。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
非选择题
16
17
18
19
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
非选择题
16
17
18
19
①第一步反应是_________(填“放热”或“吸热”)反应,判断依据是__________________________________________。
②1 mol (aq)全部被氧化成 (aq)的热化学方程式是______________
________________________________________________。
放热
ΔH<0(或反应物的总能量大于生成物的总能量)
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
非选择题
16
17
18
19
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
非选择题
(2)已知:2CO(g)+O2(g)===2CO2(g) ΔH=-566 kJ·mol-1 ①
Na2O2(s)+CO2(g)===Na2CO3(s)+ O2(g) ΔH=-226 kJ·mol-1 ②
则CO(g)与Na2O2(s)反应放出509 kJ热量时,电子转移的数目为_________
____________。
16
17
18
19
2NA (或
1.204×1024)
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
非选择题
16
17
18
19
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
非选择题
(3)已知H2(g)+Br2(l)===2HBr(g) ΔH=-72 kJ·mol-1,蒸发1 mol Br2(l)需要吸收的能量为30 kJ,其他相关数据如下表:
16
17
18
19
则表中a=_______。
369
物质 H2(g) Br2(g) HBr(g)
1 mol分子中的化学键断裂时需要吸收的能量/kJ 436 200 a
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
非选择题
16
17
18
19
由题中热化学方程式及蒸发1 mol Br2(l)吸热30 kJ可得:H2(g)+Br2(g)
===2HBr(g) ΔH=-102 kJ·mol-1,则436+200-2a=-102,a=369。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
非选择题
17.(14分)N2O和CO是常见的环境污染气体。
(1)对于反应N2O(g)+CO(g) CO2(g)+N2(g)来说,Fe+可作为此反应的催化剂。其总反应分两步进行:第一步为Fe++N2O FeO++N2;则第二步为__________________________(写方程式)。
已知第二步反应几乎不影响总反应达到平衡所用的时间,由此推知,第一步反应的活化能________(填“大于”“小于”或“等于”)第二步反应的活化能。
16
17
18
19
大于
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
非选择题
16
17
18
19
总反应分两步进行,根据催化剂定义,第一步:Fe++N2O FeO++N2,第二步反应中,中间产物(FeO+)氧化CO生成CO2,本身被还原成Fe+,FeO++CO Fe++CO2;第二步反应对总反应速率没有影响,说明第一步是慢反应,控制总反应速率,则第一步反应的活化能大于第二步反应的活化能。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
非选择题
(2)在四个不同容积的恒容密闭容器中按图甲充入相应的气体,发生反应:2N2O(g) 2N2(g)+O2(g),容器Ⅰ、Ⅱ、Ⅲ中N2O的平衡转化率如图乙所示:
16
17
18
19
①该反应的ΔH____(填“>”或“<”)0。
>
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
非选择题
16
17
18
19
升高温度,N2O的平衡转化率升高,反应向正反应方向进行,则正反应为吸热反应,ΔH>0。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
非选择题
②若容器Ⅰ的体积为2 L,反应在370 ℃下进行,20 s后达到平衡,则0~20 s内容器Ⅰ中用O2表示的反应速率为___________________。B点对应的平衡常数K=________(结果保留两位有效数字)。
16
17
18
19
0.000 5 mol·L-1·s-1
0.004 4
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
非选择题
16
17
18
19
2N2O(g) 2N2(g)+O2(g)
初/(mol·L-1) 0.05 0 0
变/(mol·L-1) 0.02 0.02 0.01
平/(mol·L-1) 0.03 0.02 0.01
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
非选择题
③图中A、C、D三点容器内气体密度由大到小的顺序是 __________。
16
17
18
19
D>C>A
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
非选择题
16
17
18
19
容器内混合气体密度为ρ= ,反应前后质量守恒,m不变,只需比较容器体积即可,从A→C→D,三点起始量一样,随着温度升高,由于正反应为吸热反应,温度升高有助于反应进行,导致转化率增大,
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
非选择题
16
17
18
19
现要使三点的转化率一致,所以需要加压,相当于缩小容器体积,即VA>VC>VD,所以ρA<ρC<ρD,即图中A、C、D三点容器内气体密度大小关系:D>C>A。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
非选择题
④若容器Ⅳ体积为1 L,反应在370 ℃下进行,则起始时反应__________
______(填“向正反应方向”“向逆反应方向”或“不”)进行。
16
17
18
19
方向
向逆反应
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
非选择题
16
17
18
19
容器Ⅳ体积为1 L,370 ℃时,
2N2O(g) 2N2(g)+O2(g)
起始/(mol·L-1) 0.06 0.06 0.04
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
非选择题
18.(12分)纳米级Cu2O由于具有优良的催化性能而受到关注,采用肼(N2H4)燃料电池为电源,用离子交换膜控制电解液中的c(OH-)制备纳米Cu2O,其装置如图甲、乙。
16
17
18
19
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
非选择题
(1)题述装置中D电极应连接肼燃料电池的______(填“A”或“B”)极,该电解池中离子交换膜为______(填“阴”或“阳”)离子交换膜。
16
17
18
19
B
阴
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
非选择题
16
17
18
19
燃料电池正极通氧化剂,负极通燃料,即A极为负极,B极为正极。图乙为电解池装置,电解的目的为制备Cu2O,则D极作阳极,接电池正极(B极),铜被氧化;阳极反应式为2Cu-2e-+2OH-===Cu2O+H2O,反应消耗OH-,采用阴离子交换膜使OH-向阳极移动。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
非选择题
(2)该电解池的阳极反应式为_____
__________________________,肼燃料电池中A极发生的电极反应为______________________________。
16
17
18
19
2e-+2OH-===Cu2O+H2O
N2H4-4e-+4OH-===N2+4H2O
2Cu-
A极为负极,N2H4失电子转化为N2,故电极反应式为N2H4-4e-+4OH-===N2+4H2O。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
非选择题
(3)当反应生成14.4 g Cu2O时,至少需要肼______ mol。
16
17
18
19
0.05
根据电极反应可得关系式4e-~2Cu2O~N2H4,
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
非选择题
19.(15分)(1)电解法也可除去水中的氨氮,实验室用石墨电极电解一定浓度的(NH4)2SO4与NaCl的酸性混合溶液来进行模拟。
①电解时,阳极的电极反应式为____________________。
16
17
18
19
2Cl--2e-===Cl2↑
电解过程中溶液初始Cl-浓度和pH对氨氮去除速率与能耗(处理一定量氨氮消耗的电能)的影响关系如图1和图2所示。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
非选择题
16
17
18
19
阳极失电子发生氧化反应,故电极反应式为2Cl--2e-===Cl2↑。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
非选择题
②图1中当Cl-浓度较低时、图2中当初始pH达到12时,氨氮去除速率低而能耗高的原因可能是__________________________________________;而当Cl-浓度较高时,测得溶液中的 浓度也较高,可能的原因是__________________________________________________________。
16
17
18
19
阳极可能是OH-放电,产生大量氧气,消耗电能
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
非选择题
③图2中,pH为6时处理效果最佳,当pH过低时,处理效果不佳的原因可能是____________________________________。
16
17
18
19
pH太低时,产生的Cl2会从溶液中逸出
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
非选择题
(2)通过调节溶液pH,在弱碱性条件下,用漂白粉溶液也可将废水中的CN-转化为碳酸盐和N2而除去。写出该反应的离子方程式:__________
_____________________________________________________。
16
17
18
19
2CN-+
5ClO-+2OH-+2Ca2+===2CaCO3↓+N2↑+5Cl-+H2O
漂白粉的有效成分是Ca(ClO)2,因为漂白粉溶液也可将废水中的CN-转化为碳酸盐和N2而除去,故离子方程式为2CN-+5ClO-+2OH-+2Ca2+===2CaCO3↓+N2↑+5Cl-+H2O。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
非选择题
(3)废水中的重金属离子通常用沉淀法除去。已知Ksp(NiS)=1.1×10-21,Ksp(CuS)=1.3×10-36,国家规定的排放标准:镍低于1.1×10-5 mol·L-1,铜低于7.8×10-5 mol·L-1。则需要控制溶液中S2-的浓度不低于________mol·L-1。
16
17
18
19
10-16
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
非选择题
16
17
18
19
同课章节目录
