第三章 铁 金属材料 章末复习 课件(共23张PPT) 2023-2024学年高一上学期化学人教版(2019)必修1
文档属性
| 名称 | 第三章 铁 金属材料 章末复习 课件(共23张PPT) 2023-2024学年高一上学期化学人教版(2019)必修1 |  | |
| 格式 | pptx | ||
| 文件大小 | 1.5MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-11-21 10:56:09 | ||
图片预览







文档简介
(共23张PPT)
第三章 铁 金属材料
章末复习
1.能从“价—类”角度认识铁、铝及其化合物的性质(重点)。
2.铁、金属材料在工艺流程中的应用(难点)。
学习目标
目标一 铁、铝及其化合物
目标二 铁、金属材料在化学工艺流程中的应用
内容索引
铁、铝及其化合物
一
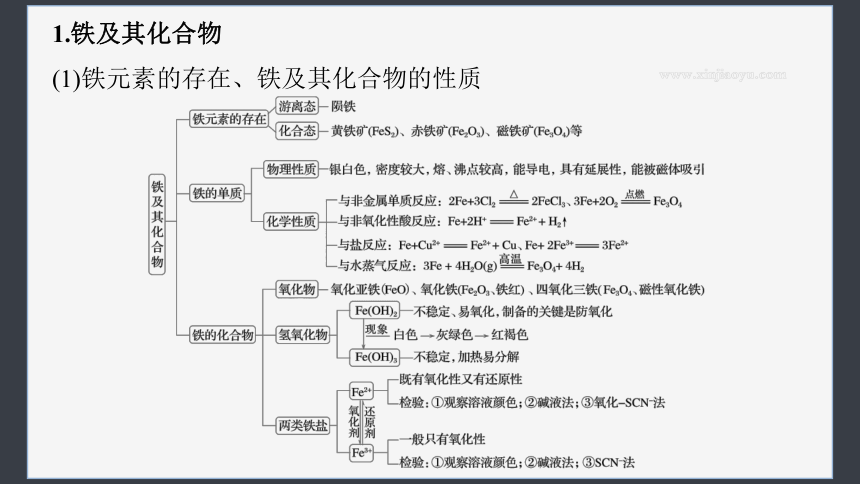
1.铁及其化合物
(1)铁元素的存在、铁及其化合物的性质
(2)铁离子、亚铁离子的鉴别、转化和除杂
Fe3+ Fe2+
鉴别 ①棕黄色 ②加NaOH,红褐色沉淀 ③加KSCN,红色溶液 ①浅绿色
②加NaOH,沉淀颜色变化:白色→灰绿色→红褐色
③加KSCN无明显变化,加H2O2后变红
转化 Fe3+ Fe2+
除杂(括号内为杂质) Fe3+(Fe2+):加Cl2、H2O2等 Fe2+(Fe3+):加入Fe粉
2.铝及其化合物
3.合金
金属材料包括纯金属和它们的合金。合金具有许多优良的物理、化学或机械性能,可以通过添加合金元素的种类、含量和生成合金的条件等加以调节。近年来,为满足某些尖端技术发展的需要,人们又设计和合成了许多新型合金。
应用体验
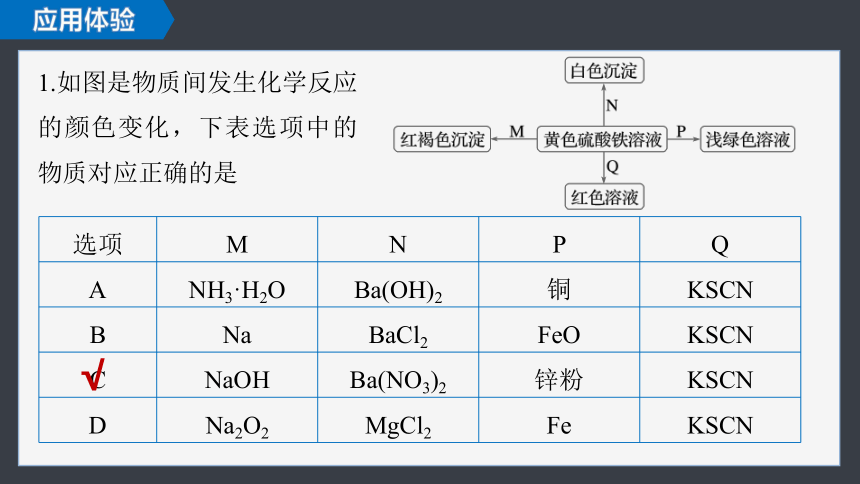
1.如图是物质间发生化学反应的颜色变化,下表选项中的物质对应正确的是
选项 M N P Q
A NH3·H2O Ba(OH)2 铜 KSCN
B Na BaCl2 FeO KSCN
C NaOH Ba(NO3)2 锌粉 KSCN
D Na2O2 MgCl2 Fe KSCN
√
Ba(OH)2与Fe2(SO4)3反应得到的是Fe(OH)3与BaSO4的混合物,沉淀不是白色的,A项错误;
FeO不能还原Fe3+,B项错误;
MgCl2与Fe2(SO4)3不反应,D项错误。
应用体验
2.下列说法不正确的是
A.向盛有FeCl3溶液的试管中加过量铁粉,充分振荡后加1滴KSCN溶液,
实验现象为棕黄色逐渐消失,加KSCN后溶液颜色不变
B.将废铁屑加入FeCl2溶液中,可用于除去工业废气中的Cl2
C.向X溶液中滴加几滴新制氯水,振荡,再加入少量KSCN溶液,溶液
变为红色,说明X溶液中一定含有Fe2+
D.酸性硫酸亚铁溶液在空气中被氧化:4Fe2++O2+4H+===4Fe3++2H2O
√
向FeCl3溶液中加入过量铁粉,发生反应:2Fe3++Fe===3Fe2+,溶液棕黄色逐渐消失,加入KSCN溶液后,溶液颜色不发生变化,A项正确;
将废铁屑加入FeCl2溶液中,可用于除去工业废气中的Cl2,发生反应:2FeCl2+Cl2===2FeCl3、2FeCl3+Fe===3FeCl2,B项正确;
题述实验操作和现象不能得出X溶液中一定含有Fe2+的结论,应先加KSCN溶液,若无明显现象,可判断溶液中不存在Fe3+,然后加新制氯水,若溶液变为红色,则可说明X溶液中一定含有Fe2+,C项错误;
在酸性条件下,Fe2+可以被O2氧化为Fe3+,离子方程式为4Fe2++O2+4H+===4Fe3++2H2O,D项正确。
应用体验
3.镁铝合金质优体轻,又不易锈蚀,大量用于航空工业、造船工业、日用化工等领域。下列关于镁铝合金性质的叙述不正确的是
A.此合金的熔点比镁和铝的熔点都低
B.此合金能全部溶解于足量稀盐酸中
C.此合金能全部溶解于足量氢氧化钠溶液中
D.此合金的硬度比镁和铝的硬度都大
√
合金的熔点一般比各成分金属的熔点低,A正确;
镁铝合金的主要成分是镁和铝,Mg和Al均能与稀盐酸反应,则合金能全部溶解于足量稀盐酸中,B正确;
铝能与氢氧化钠溶液反应但镁不能,镁铝合金不能全部溶解于足量氢氧化钠溶液中,C错误;
合金的硬度一般比各成分金属的硬度大,D正确。
返回
铁、金属材料在化学工艺流程中的应用
二
1.工艺流程图的结构
箭头:箭头进入的是投料(即反应物)、出去的是生成物(包括主产物和副产物)。
三线:出线和进线均表示物料流向或操作流程,可逆线表示物质循环使用。
规律:①主线主产品;②分支副产品;③回头为循环。
2.工艺流程中常见的操作
常见的操作 目的或方法
原料处理 粉碎(研磨) 将块状或颗粒状物质粉碎,增大反应物接触面积,加快反应速率,提高原料利用率
浸取 向固体中加入适当溶剂或溶液,使其中可溶性的物质溶解,包括水浸、酸浸、碱浸;固体发生反应或溶解得到金属离子,不溶物通过过滤除去
灼烧(煅烧) 使固体在高温下氧化、分解等
除杂转化 加入氧化剂 如加入绿色氧化剂H2O2将Fe2+氧化转化为Fe3+。绿色氧化剂H2O2的优点:不引入新杂质,对环境无污染
物质分离 过滤、蒸发等常规操作
3.分离提纯
(1)过滤:分离沉淀和溶液,若防止某物质降温时会大量析出,采用趁热过滤等方法。
(2)沉淀的洗涤
①沉淀的洗涤:向过滤器中加入蒸馏水至浸没沉淀,待水自然流下后,重复以上操作2~3次。
②洗涤沉淀的试剂及洗涤的目的:
水洗——除去表面可溶性杂质。
冰水洗——洗去沉淀表面的杂质离子;减少沉淀溶解损耗。
乙醇洗——洗去沉淀表面的杂质离子;减少沉淀溶解损耗;使沉淀快速干燥。
③判断沉淀是否洗涤干净:取最后一次洗涤滤液,滴加试剂,若无沉淀产生,证明已洗涤干净,反之未洗涤干净。
(3)结晶:分离可溶性的溶质,根据溶质溶解性的特点选择合适的结晶方式。
①蒸发结晶:适用于溶解度受温度影响不大,且受热不易分解的可溶性物质的析出。
②蒸发浓缩、冷却结晶:适用于杂质的溶解度随温度变化不大的物质的分离提纯,如除去KNO3中的少量NaCl;受热易分解的物质如结晶水合物等。
③蒸发结晶、趁热过滤:适用于杂质的溶解度随温度变化较大的物质的分离提纯,可减少杂质晶体的析出,如除去NaCl中的少量KNO3。趁热过滤时漏斗要预热或用带加热装置的漏斗过滤。
应用体验
某废旧金属材料中主要含Fe、Cu、Al、Fe2O3、FeO、Al2O3、CuO等,现利用下列工艺流程回收部分金属及金属化合物:
已知:绿矾为FeSO4·7H2O。
下列说法错误的是
A.焙烧过程中金属单质转
化成了对应的氧化物
B.操作Ⅰ使用到的玻璃仪器有玻璃棒、小烧杯和漏斗
C.酸浸2发生的反应为Fe+Cu2+===Fe2++Cu
D.操作Ⅲ的方法是蒸发浓缩、冷却结晶
√
Fe、Cu、Al在焙烧过程中会生成对应的氧化物,故A正确;
操作Ⅰ是过滤,使用到的玻璃仪器有玻璃棒、小烧杯和漏斗,故B正确;
酸浸2是Fe、Cu混合物中Fe和硫酸反应:Fe+2H+===Fe2++H2↑,故C错误;
操作Ⅲ是滤液Ⅱ变为绿矾,其方法是蒸发浓缩、冷却结晶,故D正确。
返回
第三章 铁 金属材料
章末复习
1.能从“价—类”角度认识铁、铝及其化合物的性质(重点)。
2.铁、金属材料在工艺流程中的应用(难点)。
学习目标
目标一 铁、铝及其化合物
目标二 铁、金属材料在化学工艺流程中的应用
内容索引
铁、铝及其化合物
一
1.铁及其化合物
(1)铁元素的存在、铁及其化合物的性质
(2)铁离子、亚铁离子的鉴别、转化和除杂
Fe3+ Fe2+
鉴别 ①棕黄色 ②加NaOH,红褐色沉淀 ③加KSCN,红色溶液 ①浅绿色
②加NaOH,沉淀颜色变化:白色→灰绿色→红褐色
③加KSCN无明显变化,加H2O2后变红
转化 Fe3+ Fe2+
除杂(括号内为杂质) Fe3+(Fe2+):加Cl2、H2O2等 Fe2+(Fe3+):加入Fe粉
2.铝及其化合物
3.合金
金属材料包括纯金属和它们的合金。合金具有许多优良的物理、化学或机械性能,可以通过添加合金元素的种类、含量和生成合金的条件等加以调节。近年来,为满足某些尖端技术发展的需要,人们又设计和合成了许多新型合金。
应用体验
1.如图是物质间发生化学反应的颜色变化,下表选项中的物质对应正确的是
选项 M N P Q
A NH3·H2O Ba(OH)2 铜 KSCN
B Na BaCl2 FeO KSCN
C NaOH Ba(NO3)2 锌粉 KSCN
D Na2O2 MgCl2 Fe KSCN
√
Ba(OH)2与Fe2(SO4)3反应得到的是Fe(OH)3与BaSO4的混合物,沉淀不是白色的,A项错误;
FeO不能还原Fe3+,B项错误;
MgCl2与Fe2(SO4)3不反应,D项错误。
应用体验
2.下列说法不正确的是
A.向盛有FeCl3溶液的试管中加过量铁粉,充分振荡后加1滴KSCN溶液,
实验现象为棕黄色逐渐消失,加KSCN后溶液颜色不变
B.将废铁屑加入FeCl2溶液中,可用于除去工业废气中的Cl2
C.向X溶液中滴加几滴新制氯水,振荡,再加入少量KSCN溶液,溶液
变为红色,说明X溶液中一定含有Fe2+
D.酸性硫酸亚铁溶液在空气中被氧化:4Fe2++O2+4H+===4Fe3++2H2O
√
向FeCl3溶液中加入过量铁粉,发生反应:2Fe3++Fe===3Fe2+,溶液棕黄色逐渐消失,加入KSCN溶液后,溶液颜色不发生变化,A项正确;
将废铁屑加入FeCl2溶液中,可用于除去工业废气中的Cl2,发生反应:2FeCl2+Cl2===2FeCl3、2FeCl3+Fe===3FeCl2,B项正确;
题述实验操作和现象不能得出X溶液中一定含有Fe2+的结论,应先加KSCN溶液,若无明显现象,可判断溶液中不存在Fe3+,然后加新制氯水,若溶液变为红色,则可说明X溶液中一定含有Fe2+,C项错误;
在酸性条件下,Fe2+可以被O2氧化为Fe3+,离子方程式为4Fe2++O2+4H+===4Fe3++2H2O,D项正确。
应用体验
3.镁铝合金质优体轻,又不易锈蚀,大量用于航空工业、造船工业、日用化工等领域。下列关于镁铝合金性质的叙述不正确的是
A.此合金的熔点比镁和铝的熔点都低
B.此合金能全部溶解于足量稀盐酸中
C.此合金能全部溶解于足量氢氧化钠溶液中
D.此合金的硬度比镁和铝的硬度都大
√
合金的熔点一般比各成分金属的熔点低,A正确;
镁铝合金的主要成分是镁和铝,Mg和Al均能与稀盐酸反应,则合金能全部溶解于足量稀盐酸中,B正确;
铝能与氢氧化钠溶液反应但镁不能,镁铝合金不能全部溶解于足量氢氧化钠溶液中,C错误;
合金的硬度一般比各成分金属的硬度大,D正确。
返回
铁、金属材料在化学工艺流程中的应用
二
1.工艺流程图的结构
箭头:箭头进入的是投料(即反应物)、出去的是生成物(包括主产物和副产物)。
三线:出线和进线均表示物料流向或操作流程,可逆线表示物质循环使用。
规律:①主线主产品;②分支副产品;③回头为循环。
2.工艺流程中常见的操作
常见的操作 目的或方法
原料处理 粉碎(研磨) 将块状或颗粒状物质粉碎,增大反应物接触面积,加快反应速率,提高原料利用率
浸取 向固体中加入适当溶剂或溶液,使其中可溶性的物质溶解,包括水浸、酸浸、碱浸;固体发生反应或溶解得到金属离子,不溶物通过过滤除去
灼烧(煅烧) 使固体在高温下氧化、分解等
除杂转化 加入氧化剂 如加入绿色氧化剂H2O2将Fe2+氧化转化为Fe3+。绿色氧化剂H2O2的优点:不引入新杂质,对环境无污染
物质分离 过滤、蒸发等常规操作
3.分离提纯
(1)过滤:分离沉淀和溶液,若防止某物质降温时会大量析出,采用趁热过滤等方法。
(2)沉淀的洗涤
①沉淀的洗涤:向过滤器中加入蒸馏水至浸没沉淀,待水自然流下后,重复以上操作2~3次。
②洗涤沉淀的试剂及洗涤的目的:
水洗——除去表面可溶性杂质。
冰水洗——洗去沉淀表面的杂质离子;减少沉淀溶解损耗。
乙醇洗——洗去沉淀表面的杂质离子;减少沉淀溶解损耗;使沉淀快速干燥。
③判断沉淀是否洗涤干净:取最后一次洗涤滤液,滴加试剂,若无沉淀产生,证明已洗涤干净,反之未洗涤干净。
(3)结晶:分离可溶性的溶质,根据溶质溶解性的特点选择合适的结晶方式。
①蒸发结晶:适用于溶解度受温度影响不大,且受热不易分解的可溶性物质的析出。
②蒸发浓缩、冷却结晶:适用于杂质的溶解度随温度变化不大的物质的分离提纯,如除去KNO3中的少量NaCl;受热易分解的物质如结晶水合物等。
③蒸发结晶、趁热过滤:适用于杂质的溶解度随温度变化较大的物质的分离提纯,可减少杂质晶体的析出,如除去NaCl中的少量KNO3。趁热过滤时漏斗要预热或用带加热装置的漏斗过滤。
应用体验
某废旧金属材料中主要含Fe、Cu、Al、Fe2O3、FeO、Al2O3、CuO等,现利用下列工艺流程回收部分金属及金属化合物:
已知:绿矾为FeSO4·7H2O。
下列说法错误的是
A.焙烧过程中金属单质转
化成了对应的氧化物
B.操作Ⅰ使用到的玻璃仪器有玻璃棒、小烧杯和漏斗
C.酸浸2发生的反应为Fe+Cu2+===Fe2++Cu
D.操作Ⅲ的方法是蒸发浓缩、冷却结晶
√
Fe、Cu、Al在焙烧过程中会生成对应的氧化物,故A正确;
操作Ⅰ是过滤,使用到的玻璃仪器有玻璃棒、小烧杯和漏斗,故B正确;
酸浸2是Fe、Cu混合物中Fe和硫酸反应:Fe+2H+===Fe2++H2↑,故C错误;
操作Ⅲ是滤液Ⅱ变为绿矾,其方法是蒸发浓缩、冷却结晶,故D正确。
返回
