4.1.1 原子结构 课件(共27张PPT) 2023-2024学年高一上学期化学人教版(2019)必修1
文档属性
| 名称 | 4.1.1 原子结构 课件(共27张PPT) 2023-2024学年高一上学期化学人教版(2019)必修1 |  | |
| 格式 | pptx | ||
| 文件大小 | 11.0MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-11-21 11:27:27 | ||
图片预览







文档简介
(共27张PPT)
第一节 原子结构与元素周期表
第1课时 原子结构
第四章 物质结构 元素周期律
[学习目标]
1.了解原子的表示方法,掌握有关质量数、质子数、中子数、电子数
的相关计算 (重点)。
2.能从微观角度认识原子的构成,掌握原子核外电子排布规律,能画
出1~20号元素的原子结构示意图(重点)。
3.能根据原子的结构特征确定元素(难点)。
导入新课
原子结构模型的演变历程
道尔顿模型(1803年):
坚实的、不可再分实心球
汤姆孙原子模型(1904年):
平均分布着正电荷的粒子,镶嵌着许多电子,中和了正电荷,从而形成中性原子。
卢瑟福原子模型(1911年):
中心有一个带正电荷的核,电子在它的周围沿着不同轨道运转,就像行星环绕太阳运转一样。
玻尔原子模型(1913年):
电子在原子核外空间的一定轨道上绕核做高速圆周运动。
电子云模型
电子云模型
现代物质结构学说
一、原子结构
1.构成原子的微粒及其性质
原子
原子核
质子:相对质量近似为1,带1个单位正电荷
中子:相对质量近似为1,不带电
核外电子:带1个单位负电荷,质量很小(可忽略不计)
质子
电子
中子
参考数据:
①1个核外电子的质量:9.10×10-31 kg
②1个质子的质量:1.6726231 × 10-27 kg
③1个中子的质量:1.6749286 ×10-27 kg
2.质量数
(1)概念:如果忽略电子的质量,将原子核内所有质子和中子的相对质量取近似
整数值相加,所得的数值。常用A表示。
(2)构成原子的粒子间的两个关系
①质量数(A)=质子数(Z)+中子数(N)。
②质子数=核电荷数=核外电子数。
原子的质量数是否就是原子的相对原子质量?请举例说明。
不一定。S的质量数为32,而硫原子的相对原子质量为32.06,两者数值上相近但不相等。
思考交流
一、原子结构
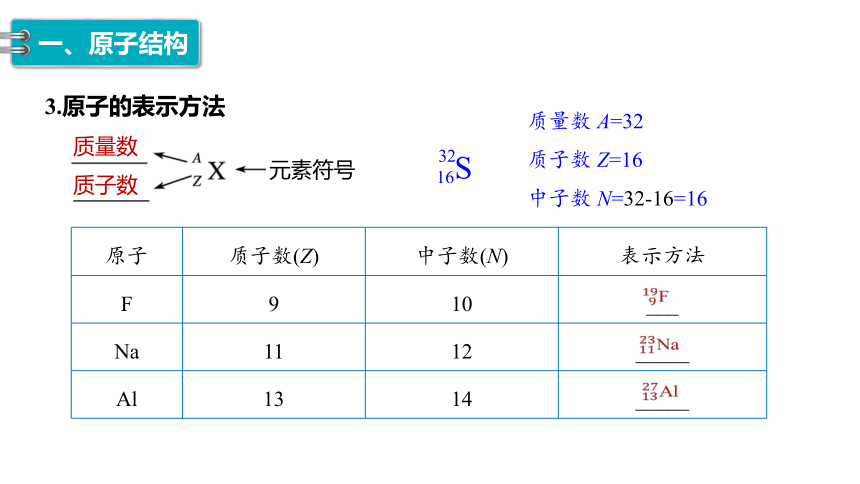
3.原子的表示方法
质量数
质子数
S
16
32
质量数 A=32
质子数 Z=16
中子数 N=32-16=16
原子 质子数(Z) 中子数(N) 表示方法
F 9 10 ___
Na 11 12 _____
Al 13 14 _____
一、原子结构
F
Na
Al
元素符号
思考交流
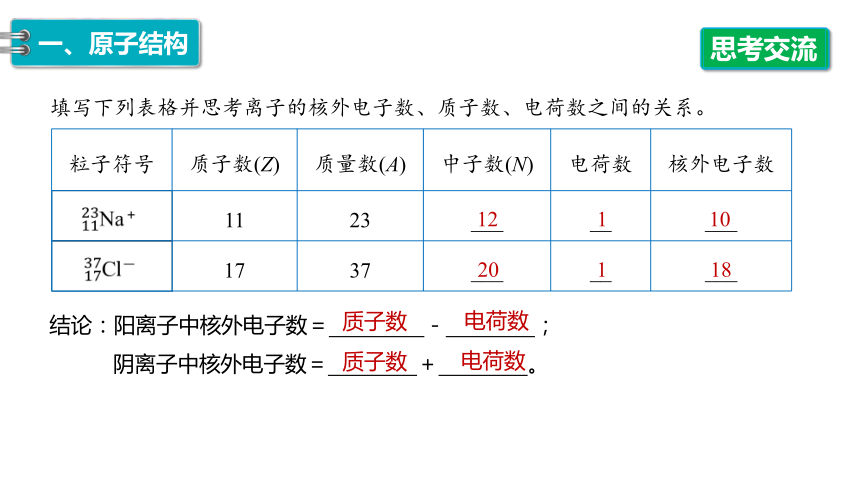
填写下列表格并思考离子的核外电子数、质子数、电荷数之间的关系。
粒子符号 质子数(Z) 质量数(A) 中子数(N) 电荷数 核外电子数
11 23 ___ __ ___
17 37 ___ __ ___
结论:阳离子中核外电子数= - ;
阴离子中核外电子数= + 。
12
1
10
20
1
18
质子数
电荷数
质子数
电荷数
一、原子结构
应用体验
1.判断正误
(1)原子呈电中性是因为中子不带电
(2)质子数和中子数决定原子的质量
(3)微粒中的质子数与核外电子数一定相等
(4)某种氯原子的中子数是18,则其质量数是35,核外电子数是17
(5)质量数为28的硅原子可以表示为
×
√
×
√
√
一、原子结构
应用体验
2.(2023·石家庄高一检测)高铁动车车厢禁止吸烟,高铁装有的离子式烟雾传感器具有稳定性好、灵敏度高的特点,其主体是一个放有镅()放射源的电离室。下列关于的说法正确的是
A.核外电子数为95 B.质子数为146
C.质量数为146 D.中子数为95
3.一种中子数为9的氧原子的质量数为____,核外电子数为____,其二价氧离子的质量数为____,核外电子数为____。
17
8
17
10
一、原子结构
√
95
241
146
(1)一个信息丰富的符号解读
A——质量数
Z——核电荷数或质子数
n——离子所带的电荷数
b——化学式中原子的个数
(2)粒子中的数量关系
①分子或原子:质子数=核外电子数
②阳离子Xn+:质子数=核外电子数+n
③阴离子Xn-:质子数=核外电子数-n
S
16
32
2-
O
2
Mg
2+
一、原子结构
归纳总结
二、原子核外电子排布
根据数据分析电子运动的特征:
①速度:炮弹 2 km/s,人造卫星 7.8 km/s,宇宙飞船 11 km/s,氢核外电子2.2×108 m/s;
②乒乓球半径:4×10-2 m;原子半径:约10-10 m。
问题导入
电子质量小;运动空间小;运动速度快。
电子在原子核外是如何运动的?多电子的原子呢?有没有什么规律呢?
绕核运动,
1.电子层
(1)概念:在含有多个电子的原子里,电子分别在能量不同的区域内运动。
我们把不同的区域简化为不连续的壳层,也称作电子层。
(2)不同电子层的表示及能量关系
各电子层 由内到外 电子层数 1 2 3 4 5 6 7
字母代号 K L M N O P Q
离核远近 由近到远
能量高低 由低到高
二、原子核外电子排布
思考讨论
下表是稀有气体元素原子的电子层排布,从中你能发现什么规律?
1. 当K层为最外层时,最多能容纳的电子数是多少?除了K层,其他各层为最外层时,最多能容纳的电子数是多少?
2. 次外层最多容纳的电子数是多少?
3. 你能归纳出第n层最多能容纳的电子数吗?
4. 根据归纳的规律,用原子结构示意图表示核电荷数为1~20号元素原子的核外电子排布。
二、原子核外电子排布
2.电子分层排布
(1)能量最低原理
核外电子总是优先排布在能量最低的电子层里,然后再由里往外排布在能量逐步升高的电子层里,即按K→L→M→N……顺序排列。
(2)电子层最多容纳的电子数
①第n层最多容纳2n2个电子。
如K、L、M、N层最多容纳的电子数分别为2、8、18、32。
②最外层电子数目最多不能超过8个(K层为最外层时不能超过2个)。
③次外层最多能容纳的电子数不超过18个。
二、原子核外电子排布
3.核外电子排布的表示方法
原子(或离子)结构示意图
二、原子核外电子排布
粒子符号
原子核
质子数(或核电荷数)
电子层
该电子层上的电子数
+11
2 8 1
Na
应用举例
画出下列原子或离子的结构示意图
①S: ,S2-: ; ②Ca: ,Ca2+: 。
二、原子核外电子排布
思考交流
1. M层最多可容纳18个电子,为什么钾原子的核外电子排布不是 ?
原子核外电子排布每层最多容纳2n2个电子,故M层最多可容纳18个电子,但M层作为最外层时,最多不超过8个电子。
二、原子核外电子排布
思考交流
2.在1~20号元素的原子中:
(1)最外层电子数与次外层电子数相等的原子有 。
(2)最外层电子数是次外层电子数2倍的原子有 ,3倍的原子有 。
(3)次外层电子数是最外层电子数2倍的原子有 。
(4)电子层数与最外层电子数相等的原子有 。
Be、Ar
C
O
Li、Si
H、Be、Al
二、原子核外电子排布
4.常见的10e-和18e-微粒
(1)常见的10e-微粒
F-、O2-、N3-、OH-
HF、H2O、NH3、CH4
Na+、Mg2+、Al3+、、H3O+
(2)常见的18e-微粒
H2S
F2
K+、Ca2+
二、原子核外电子排布
某同学在画某种元素的一种单核微粒的结构示意图时,忘记在圆圈内标出质子数,请你根据核外电子排布,推测可能的微粒符号。
可能为中性原子Ne,
也可能为阳离子Na+、Mg2+、Al3+,
也可能为阴离子F-、O2-、N3-。
思考讨论
二、原子核外电子排布
应用体验
1.判断正误
(1)在多电子原子里,电子的能量不完全相同
(2)M层为最外层时,最多容纳18个电子
(3)原子的次外层电子数都是8
(4)Mg的原子结构示意图是
(5)最外层电子数小于4的原子必定是金属元素的原子
×
√
×
×
×
二、原子核外电子排布
应用体验
2.下列说法正确的是
A.某单核微粒的核外电子排布如图所示,则该微粒一定是氩原子
B.最外层只有1个电子的元素一定是金属元素
C.与H3O+具有相同的质子数和电子数
D.最外层电子数是次外层电子数2倍的元素的原子容易失去电子成为阳离子
√
二、原子核外电子排布
H元素不是金属元素
C元素,C原子既不容易失电子也不容易得电子
该微粒可能为中性原子,也可能是阴离子或阳离子
应用体验
3.下列微粒中:①12Mg2+ ② ③Cl- ④O2-,核外电子总数相同的是
A.②③④ B.①②④
C.①②③ D.①②③④
√
二、原子核外电子排布
10
10
10
18
自我测试
1.(2023·石家庄二中高一检测)下列关于电子排布的说法正确的是
A.氧离子(O2-)的核电荷数与最外层电子数相等
B.在多电子的原子中,能量高的电子通常在离核近的区域内运动
C.核外电子总是先排在能量高的电子层上
D.对于简单离子来说,最外层电子数一定为2或8
√
8
8
远
低
如H+最外层没有电子
自我测试
2.太空探索器常用制成的核电池提供动力,该钚原子的中子数与核外电子数之差为
A.238 B.144 C.94 D.50
√
3.与Na+具有相同电子数和质子数的微粒是
A.OH- B.H2O
C.CH4 D.
√
238-94=144
94
10 11
电子数:10,质子数:9
电子数:10,质子数:10
电子数:10,质子数:10
电子数:10,质子数:11
自我测试
4.根据下列叙述,写出元素名称并画出原子结构示意图。
信息 元素 名称 原子结构
示意图
A元素原子最外层电子数是次外层电子数的1.5倍
B元素+1价离子B+的电子层排布与Ne相同
C元素原子次外层电子数是最外层电子数的
硼
钠
氧
本节内容结束
第一节 原子结构与元素周期表
第1课时 原子结构
第四章 物质结构 元素周期律
[学习目标]
1.了解原子的表示方法,掌握有关质量数、质子数、中子数、电子数
的相关计算 (重点)。
2.能从微观角度认识原子的构成,掌握原子核外电子排布规律,能画
出1~20号元素的原子结构示意图(重点)。
3.能根据原子的结构特征确定元素(难点)。
导入新课
原子结构模型的演变历程
道尔顿模型(1803年):
坚实的、不可再分实心球
汤姆孙原子模型(1904年):
平均分布着正电荷的粒子,镶嵌着许多电子,中和了正电荷,从而形成中性原子。
卢瑟福原子模型(1911年):
中心有一个带正电荷的核,电子在它的周围沿着不同轨道运转,就像行星环绕太阳运转一样。
玻尔原子模型(1913年):
电子在原子核外空间的一定轨道上绕核做高速圆周运动。
电子云模型
电子云模型
现代物质结构学说
一、原子结构
1.构成原子的微粒及其性质
原子
原子核
质子:相对质量近似为1,带1个单位正电荷
中子:相对质量近似为1,不带电
核外电子:带1个单位负电荷,质量很小(可忽略不计)
质子
电子
中子
参考数据:
①1个核外电子的质量:9.10×10-31 kg
②1个质子的质量:1.6726231 × 10-27 kg
③1个中子的质量:1.6749286 ×10-27 kg
2.质量数
(1)概念:如果忽略电子的质量,将原子核内所有质子和中子的相对质量取近似
整数值相加,所得的数值。常用A表示。
(2)构成原子的粒子间的两个关系
①质量数(A)=质子数(Z)+中子数(N)。
②质子数=核电荷数=核外电子数。
原子的质量数是否就是原子的相对原子质量?请举例说明。
不一定。S的质量数为32,而硫原子的相对原子质量为32.06,两者数值上相近但不相等。
思考交流
一、原子结构
3.原子的表示方法
质量数
质子数
S
16
32
质量数 A=32
质子数 Z=16
中子数 N=32-16=16
原子 质子数(Z) 中子数(N) 表示方法
F 9 10 ___
Na 11 12 _____
Al 13 14 _____
一、原子结构
F
Na
Al
元素符号
思考交流
填写下列表格并思考离子的核外电子数、质子数、电荷数之间的关系。
粒子符号 质子数(Z) 质量数(A) 中子数(N) 电荷数 核外电子数
11 23 ___ __ ___
17 37 ___ __ ___
结论:阳离子中核外电子数= - ;
阴离子中核外电子数= + 。
12
1
10
20
1
18
质子数
电荷数
质子数
电荷数
一、原子结构
应用体验
1.判断正误
(1)原子呈电中性是因为中子不带电
(2)质子数和中子数决定原子的质量
(3)微粒中的质子数与核外电子数一定相等
(4)某种氯原子的中子数是18,则其质量数是35,核外电子数是17
(5)质量数为28的硅原子可以表示为
×
√
×
√
√
一、原子结构
应用体验
2.(2023·石家庄高一检测)高铁动车车厢禁止吸烟,高铁装有的离子式烟雾传感器具有稳定性好、灵敏度高的特点,其主体是一个放有镅()放射源的电离室。下列关于的说法正确的是
A.核外电子数为95 B.质子数为146
C.质量数为146 D.中子数为95
3.一种中子数为9的氧原子的质量数为____,核外电子数为____,其二价氧离子的质量数为____,核外电子数为____。
17
8
17
10
一、原子结构
√
95
241
146
(1)一个信息丰富的符号解读
A——质量数
Z——核电荷数或质子数
n——离子所带的电荷数
b——化学式中原子的个数
(2)粒子中的数量关系
①分子或原子:质子数=核外电子数
②阳离子Xn+:质子数=核外电子数+n
③阴离子Xn-:质子数=核外电子数-n
S
16
32
2-
O
2
Mg
2+
一、原子结构
归纳总结
二、原子核外电子排布
根据数据分析电子运动的特征:
①速度:炮弹 2 km/s,人造卫星 7.8 km/s,宇宙飞船 11 km/s,氢核外电子2.2×108 m/s;
②乒乓球半径:4×10-2 m;原子半径:约10-10 m。
问题导入
电子质量小;运动空间小;运动速度快。
电子在原子核外是如何运动的?多电子的原子呢?有没有什么规律呢?
绕核运动,
1.电子层
(1)概念:在含有多个电子的原子里,电子分别在能量不同的区域内运动。
我们把不同的区域简化为不连续的壳层,也称作电子层。
(2)不同电子层的表示及能量关系
各电子层 由内到外 电子层数 1 2 3 4 5 6 7
字母代号 K L M N O P Q
离核远近 由近到远
能量高低 由低到高
二、原子核外电子排布
思考讨论
下表是稀有气体元素原子的电子层排布,从中你能发现什么规律?
1. 当K层为最外层时,最多能容纳的电子数是多少?除了K层,其他各层为最外层时,最多能容纳的电子数是多少?
2. 次外层最多容纳的电子数是多少?
3. 你能归纳出第n层最多能容纳的电子数吗?
4. 根据归纳的规律,用原子结构示意图表示核电荷数为1~20号元素原子的核外电子排布。
二、原子核外电子排布
2.电子分层排布
(1)能量最低原理
核外电子总是优先排布在能量最低的电子层里,然后再由里往外排布在能量逐步升高的电子层里,即按K→L→M→N……顺序排列。
(2)电子层最多容纳的电子数
①第n层最多容纳2n2个电子。
如K、L、M、N层最多容纳的电子数分别为2、8、18、32。
②最外层电子数目最多不能超过8个(K层为最外层时不能超过2个)。
③次外层最多能容纳的电子数不超过18个。
二、原子核外电子排布
3.核外电子排布的表示方法
原子(或离子)结构示意图
二、原子核外电子排布
粒子符号
原子核
质子数(或核电荷数)
电子层
该电子层上的电子数
+11
2 8 1
Na
应用举例
画出下列原子或离子的结构示意图
①S: ,S2-: ; ②Ca: ,Ca2+: 。
二、原子核外电子排布
思考交流
1. M层最多可容纳18个电子,为什么钾原子的核外电子排布不是 ?
原子核外电子排布每层最多容纳2n2个电子,故M层最多可容纳18个电子,但M层作为最外层时,最多不超过8个电子。
二、原子核外电子排布
思考交流
2.在1~20号元素的原子中:
(1)最外层电子数与次外层电子数相等的原子有 。
(2)最外层电子数是次外层电子数2倍的原子有 ,3倍的原子有 。
(3)次外层电子数是最外层电子数2倍的原子有 。
(4)电子层数与最外层电子数相等的原子有 。
Be、Ar
C
O
Li、Si
H、Be、Al
二、原子核外电子排布
4.常见的10e-和18e-微粒
(1)常见的10e-微粒
F-、O2-、N3-、OH-
HF、H2O、NH3、CH4
Na+、Mg2+、Al3+、、H3O+
(2)常见的18e-微粒
H2S
F2
K+、Ca2+
二、原子核外电子排布
某同学在画某种元素的一种单核微粒的结构示意图时,忘记在圆圈内标出质子数,请你根据核外电子排布,推测可能的微粒符号。
可能为中性原子Ne,
也可能为阳离子Na+、Mg2+、Al3+,
也可能为阴离子F-、O2-、N3-。
思考讨论
二、原子核外电子排布
应用体验
1.判断正误
(1)在多电子原子里,电子的能量不完全相同
(2)M层为最外层时,最多容纳18个电子
(3)原子的次外层电子数都是8
(4)Mg的原子结构示意图是
(5)最外层电子数小于4的原子必定是金属元素的原子
×
√
×
×
×
二、原子核外电子排布
应用体验
2.下列说法正确的是
A.某单核微粒的核外电子排布如图所示,则该微粒一定是氩原子
B.最外层只有1个电子的元素一定是金属元素
C.与H3O+具有相同的质子数和电子数
D.最外层电子数是次外层电子数2倍的元素的原子容易失去电子成为阳离子
√
二、原子核外电子排布
H元素不是金属元素
C元素,C原子既不容易失电子也不容易得电子
该微粒可能为中性原子,也可能是阴离子或阳离子
应用体验
3.下列微粒中:①12Mg2+ ② ③Cl- ④O2-,核外电子总数相同的是
A.②③④ B.①②④
C.①②③ D.①②③④
√
二、原子核外电子排布
10
10
10
18
自我测试
1.(2023·石家庄二中高一检测)下列关于电子排布的说法正确的是
A.氧离子(O2-)的核电荷数与最外层电子数相等
B.在多电子的原子中,能量高的电子通常在离核近的区域内运动
C.核外电子总是先排在能量高的电子层上
D.对于简单离子来说,最外层电子数一定为2或8
√
8
8
远
低
如H+最外层没有电子
自我测试
2.太空探索器常用制成的核电池提供动力,该钚原子的中子数与核外电子数之差为
A.238 B.144 C.94 D.50
√
3.与Na+具有相同电子数和质子数的微粒是
A.OH- B.H2O
C.CH4 D.
√
238-94=144
94
10 11
电子数:10,质子数:9
电子数:10,质子数:10
电子数:10,质子数:10
电子数:10,质子数:11
自我测试
4.根据下列叙述,写出元素名称并画出原子结构示意图。
信息 元素 名称 原子结构
示意图
A元素原子最外层电子数是次外层电子数的1.5倍
B元素+1价离子B+的电子层排布与Ne相同
C元素原子次外层电子数是最外层电子数的
硼
钠
氧
本节内容结束
