4.3.1 离子键 课件 (共21张PPT)2023-2024学年高一上学期化学人教版(2019)必修1
文档属性
| 名称 | 4.3.1 离子键 课件 (共21张PPT)2023-2024学年高一上学期化学人教版(2019)必修1 |

|
|
| 格式 | pptx | ||
| 文件大小 | 9.2MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-11-21 11:28:01 | ||
图片预览






文档简介
(共21张PPT)
第三节 化学键
第1课时 离子键
第四章 物质结构 元素周期律
[学习目标]
1.通过氯化钠的形成过程,认识离子键的形成,了解离子键和离子化
合物的概念,会判断离子化合物(重点)。
2.会用电子式表示常见离子化合物的形成过程,促进“宏观辨识与微
观探析”化学核心素养的发展(难点)。
导入新课
118种元素组成的物质千万种,什么作用使这些元素的原子结合在一起的呢?
一、离子键与离子化合物
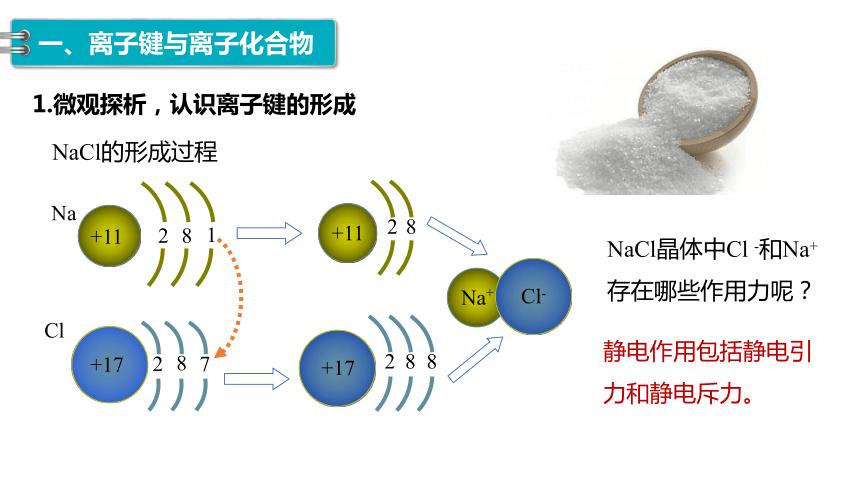
1.微观探析,认识离子键的形成
Na
+11
8
1
2
Cl
+17
8
7
2
+11
8
2
+17
8
8
2
Na+
Cl-
NaCl的形成过程
NaCl晶体中Cl -和Na+
存在哪些作用力呢?
静电作用包括静电引力和静电斥力。
(1)定义:带相反电荷离子之间的相互作用
Na+
Cl-
2. 离子键
(2)成键要素
成键微粒:阳离子和阴离子
成键本质:静电作用(包括静电引力和静电斥力)
成键元素:一般是活泼金属和活泼非金属
(3)成键过程
一、离子键与离子化合物
3.离子化合物
(1)定义:由离子键构成的化合物。
判断下列哪些物质是离子化合物?(填“是”或“不是”)
①KBr______;②HCl______;③NH4Cl ______;
④NaOH______;⑤KNO3______;⑥Na2O______。
思考讨论
是
不是
是
是
是
是
(2)与物质类别的关系
强碱:NaOH、KOH等
大多数盐:NaCl、K2SO4、NH4Cl等
活泼金属氧化物:Na2O、CaO等
一、离子键与离子化合物
(1)并不是所有的金属与非金属化合都能形成离子键。
如AlCl3中不存在离子键。
(2)非金属元素间也可形成离子键。
如NH4Cl中与Cl-间的就是离子键。
(3)离子化合物中一定含有离子键,含离子键的化合物一定是离子化合物。
一、离子键与离子化合物
归纳总结
1.判断正误
(1)阴、阳离子之间的静电吸引形成离子键。
(2)金属元素与非金属元素形成的化合物一定为离子化合物。
(3)离子化合物中一定含有金属元素。
(4)所有氧化物均为离子化合物。
(5)第ⅠA族元素与第ⅦA族元素形成的化合物一定是离子化合物。
(6)离子化合物中一定含有阴离子和阳离子,所以离子化合物一定能导电。
×
×
×
×
×
×
应用体验
一、离子键与离子化合物
应用体验
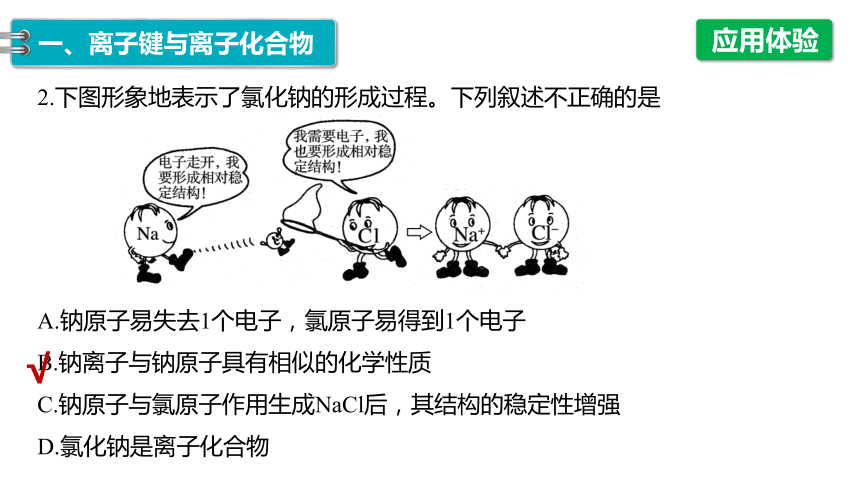
2.下图形象地表示了氯化钠的形成过程。下列叙述不正确的是
A.钠原子易失去1个电子,氯原子易得到1个电子
B.钠离子与钠原子具有相似的化学性质
C.钠原子与氯原子作用生成NaCl后,其结构的稳定性增强
D.氯化钠是离子化合物
√
一、离子键与离子化合物
应用体验
3.(2023·广东高一学业考试)含离子键的氧化物是
A.MgO B.HClO C.NO D.KOH
√
4.下列哪一组元素的原子间容易形成离子键
元素 a b c d e f g
M层电子数 1 2 3 4 5 6 7
A.a和c B.a和f C.d和g D.c和g
√
一、离子键与离子化合物
原子
阳离子
阴离子
化合物
1.定义
(1)概念:在元素符号周围用“·”或“×”来表示原子的最外层电子(价电子)的式子。
(2)常见粒子的电子式
Na
Mg
N
O
F
Al
C
Na+
Mg2+
Ca2+
H+
[ Cl ]-
[ S ]2-
[ Br ]-
[ O ]2-
[H N H]+
H
H
[ O H]-
[ O
O ]2-
Na+
[ Cl ]-
[ Cl ]-
Mg2+
[ Cl ]-
Mg2+
[ O ]2-
Na+
[ O H]-
注意电子平均分布
简单阳离子即离子符号
注意离子不可合并
二、电子式
有的同学将MgO的电子式写为 ,这样书写是否正确并说明原因?
问题讨论
二、电子式
不正确。MgO为离子化合物,应写为 ,阴离子的电子式必须加[ ],并指明电荷数。
2.用电子式表示离子化合物的形成过程
有的同学用电子式表示化合物Na2S的形成过程为
2Na+S == ,这样书写是否正确并说明原因?
问题讨论
二、电子式
不正确。应书写为 ,且形成过程不用“===”,应用“ ”。
二、电子式
书写电子式的注意事项
(1)一个“·”或“×”代表一个电子,原子的电子式中“·”或“×”的个数即表示原子的
最外层电子数。
(2)化合物形成之前同一原子的电子式不能既用“×”又用“·”表示。
(3)“[ ]”在所有的阴离子、复杂的阳离子中出现。
(4)在化合物中,如果有多个阴、阳离子,阴、阳离子必须是间隔的,即不能将两个阴离子或两个阳离子写在一起,如CaCl2要写成 ,不能写成 ,也不能写成 。
(5)用电子式表示化合物形成过程时,由于不是化学方程式,不能用“===”,应用“ ”。“ ”前是原子的电子式,“ ”后是化合物的电子式。
归纳总结
1.判断正误
(1)O:
(2)Al3+:
(3)Na2O:
(4)KCl的形成过程:
(5)Mg3N2的形成过程:3Mg×+
×
×
×
×
×
应用体验
二、电子式
应用体验
2.下列化学用语正确的是
A.钠离子的电子式:
B.Cl-的结构示意图:
C.质量数为35的核素氯:
D.NaCl的形成过程:
√
二、电子式
应用体验
3.用电子式表示下列离子化合物的形成过程:
BaCl2:________________________________________;
MgS:________________________;
K2O:__________________________。
二、电子式
自我测试
1.(2023·湖南株洲高一期末)下列物质中,含有离子键的是
A.KCl B.H2O C.CH4 D.Cl2
√
活泼金属与活泼非金属元素间易通过得失电子形成离子键
自我测试
2.(2023·大连高一学业考试)元素周期律和周期表体现了对元素的科学分类方法,以及结构决定性质的化学观念。其重要意义还在于它从自然科学方面有力地论证了事物变化中量变引起质变的规律性,揭示出复杂的表象中蕴含着规律等科学观念。下表列出了①~⑨ 9种短周期元素在周期表中的位置。请回答下列问题:
周期 族 ⅠA ⅡA ⅢA ⅣA ⅤA ⅥA ⅦA 0
1 ①
2 ② ③ ④ ⑤
3 ⑥ ⑦ ⑧ ⑨
下列各组元素形成的常见化合物中含有离子键的是
A.①和④ B.②和④ C.①和⑨ D.⑥和⑨
√
Na2S
自我测试
3.(2023·安徽宣城高一期末)北京理工大学科研团队在《Science》上发表有关钙钛矿(主要成分为CaTiO3)太阳能电池的论文。下列关于CaTiO3的叙述错误的是
A.属于电解质 B.属于氧化物
C.含有离子键 D.组成元素只有一种位于短周期
√
4.1个M原子失去2个电子转移到2个Y原子中去,形成离子化合物Z。下列说法正确的是
A.Z可表示为MY2 B.Z可表示为M2Y
C.Z的电子式可表示为 D.M形成+1价阳离子
√
本节内容结束
第三节 化学键
第1课时 离子键
第四章 物质结构 元素周期律
[学习目标]
1.通过氯化钠的形成过程,认识离子键的形成,了解离子键和离子化
合物的概念,会判断离子化合物(重点)。
2.会用电子式表示常见离子化合物的形成过程,促进“宏观辨识与微
观探析”化学核心素养的发展(难点)。
导入新课
118种元素组成的物质千万种,什么作用使这些元素的原子结合在一起的呢?
一、离子键与离子化合物
1.微观探析,认识离子键的形成
Na
+11
8
1
2
Cl
+17
8
7
2
+11
8
2
+17
8
8
2
Na+
Cl-
NaCl的形成过程
NaCl晶体中Cl -和Na+
存在哪些作用力呢?
静电作用包括静电引力和静电斥力。
(1)定义:带相反电荷离子之间的相互作用
Na+
Cl-
2. 离子键
(2)成键要素
成键微粒:阳离子和阴离子
成键本质:静电作用(包括静电引力和静电斥力)
成键元素:一般是活泼金属和活泼非金属
(3)成键过程
一、离子键与离子化合物
3.离子化合物
(1)定义:由离子键构成的化合物。
判断下列哪些物质是离子化合物?(填“是”或“不是”)
①KBr______;②HCl______;③NH4Cl ______;
④NaOH______;⑤KNO3______;⑥Na2O______。
思考讨论
是
不是
是
是
是
是
(2)与物质类别的关系
强碱:NaOH、KOH等
大多数盐:NaCl、K2SO4、NH4Cl等
活泼金属氧化物:Na2O、CaO等
一、离子键与离子化合物
(1)并不是所有的金属与非金属化合都能形成离子键。
如AlCl3中不存在离子键。
(2)非金属元素间也可形成离子键。
如NH4Cl中与Cl-间的就是离子键。
(3)离子化合物中一定含有离子键,含离子键的化合物一定是离子化合物。
一、离子键与离子化合物
归纳总结
1.判断正误
(1)阴、阳离子之间的静电吸引形成离子键。
(2)金属元素与非金属元素形成的化合物一定为离子化合物。
(3)离子化合物中一定含有金属元素。
(4)所有氧化物均为离子化合物。
(5)第ⅠA族元素与第ⅦA族元素形成的化合物一定是离子化合物。
(6)离子化合物中一定含有阴离子和阳离子,所以离子化合物一定能导电。
×
×
×
×
×
×
应用体验
一、离子键与离子化合物
应用体验
2.下图形象地表示了氯化钠的形成过程。下列叙述不正确的是
A.钠原子易失去1个电子,氯原子易得到1个电子
B.钠离子与钠原子具有相似的化学性质
C.钠原子与氯原子作用生成NaCl后,其结构的稳定性增强
D.氯化钠是离子化合物
√
一、离子键与离子化合物
应用体验
3.(2023·广东高一学业考试)含离子键的氧化物是
A.MgO B.HClO C.NO D.KOH
√
4.下列哪一组元素的原子间容易形成离子键
元素 a b c d e f g
M层电子数 1 2 3 4 5 6 7
A.a和c B.a和f C.d和g D.c和g
√
一、离子键与离子化合物
原子
阳离子
阴离子
化合物
1.定义
(1)概念:在元素符号周围用“·”或“×”来表示原子的最外层电子(价电子)的式子。
(2)常见粒子的电子式
Na
Mg
N
O
F
Al
C
Na+
Mg2+
Ca2+
H+
[ Cl ]-
[ S ]2-
[ Br ]-
[ O ]2-
[H N H]+
H
H
[ O H]-
[ O
O ]2-
Na+
[ Cl ]-
[ Cl ]-
Mg2+
[ Cl ]-
Mg2+
[ O ]2-
Na+
[ O H]-
注意电子平均分布
简单阳离子即离子符号
注意离子不可合并
二、电子式
有的同学将MgO的电子式写为 ,这样书写是否正确并说明原因?
问题讨论
二、电子式
不正确。MgO为离子化合物,应写为 ,阴离子的电子式必须加[ ],并指明电荷数。
2.用电子式表示离子化合物的形成过程
有的同学用电子式表示化合物Na2S的形成过程为
2Na+S == ,这样书写是否正确并说明原因?
问题讨论
二、电子式
不正确。应书写为 ,且形成过程不用“===”,应用“ ”。
二、电子式
书写电子式的注意事项
(1)一个“·”或“×”代表一个电子,原子的电子式中“·”或“×”的个数即表示原子的
最外层电子数。
(2)化合物形成之前同一原子的电子式不能既用“×”又用“·”表示。
(3)“[ ]”在所有的阴离子、复杂的阳离子中出现。
(4)在化合物中,如果有多个阴、阳离子,阴、阳离子必须是间隔的,即不能将两个阴离子或两个阳离子写在一起,如CaCl2要写成 ,不能写成 ,也不能写成 。
(5)用电子式表示化合物形成过程时,由于不是化学方程式,不能用“===”,应用“ ”。“ ”前是原子的电子式,“ ”后是化合物的电子式。
归纳总结
1.判断正误
(1)O:
(2)Al3+:
(3)Na2O:
(4)KCl的形成过程:
(5)Mg3N2的形成过程:3Mg×+
×
×
×
×
×
应用体验
二、电子式
应用体验
2.下列化学用语正确的是
A.钠离子的电子式:
B.Cl-的结构示意图:
C.质量数为35的核素氯:
D.NaCl的形成过程:
√
二、电子式
应用体验
3.用电子式表示下列离子化合物的形成过程:
BaCl2:________________________________________;
MgS:________________________;
K2O:__________________________。
二、电子式
自我测试
1.(2023·湖南株洲高一期末)下列物质中,含有离子键的是
A.KCl B.H2O C.CH4 D.Cl2
√
活泼金属与活泼非金属元素间易通过得失电子形成离子键
自我测试
2.(2023·大连高一学业考试)元素周期律和周期表体现了对元素的科学分类方法,以及结构决定性质的化学观念。其重要意义还在于它从自然科学方面有力地论证了事物变化中量变引起质变的规律性,揭示出复杂的表象中蕴含着规律等科学观念。下表列出了①~⑨ 9种短周期元素在周期表中的位置。请回答下列问题:
周期 族 ⅠA ⅡA ⅢA ⅣA ⅤA ⅥA ⅦA 0
1 ①
2 ② ③ ④ ⑤
3 ⑥ ⑦ ⑧ ⑨
下列各组元素形成的常见化合物中含有离子键的是
A.①和④ B.②和④ C.①和⑨ D.⑥和⑨
√
Na2S
自我测试
3.(2023·安徽宣城高一期末)北京理工大学科研团队在《Science》上发表有关钙钛矿(主要成分为CaTiO3)太阳能电池的论文。下列关于CaTiO3的叙述错误的是
A.属于电解质 B.属于氧化物
C.含有离子键 D.组成元素只有一种位于短周期
√
4.1个M原子失去2个电子转移到2个Y原子中去,形成离子化合物Z。下列说法正确的是
A.Z可表示为MY2 B.Z可表示为M2Y
C.Z的电子式可表示为 D.M形成+1价阳离子
√
本节内容结束
