4.1.2 元素周期表 核素 课件(共28张PPT) 2023-2024学年高一上学期化学人教版(2019)必修1
文档属性
| 名称 | 4.1.2 元素周期表 核素 课件(共28张PPT) 2023-2024学年高一上学期化学人教版(2019)必修1 |  | |
| 格式 | pptx | ||
| 文件大小 | 12.1MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-11-21 11:30:59 | ||
图片预览







文档简介
(共28张PPT)
第一节 原子结构与元素周期表
第2课时 元素周期表 核素
第四章 物质结构 元素周期律
[学习目标]
1.了解元素周期表的发展历程及现行元素周期表的结构。
2.能从原子结构角度理解元素周期表的编排原则,能进行元素在周期表
中位置与原子结构之间的相互推导(重、难点)。
3.知道元素、核素、同位素、的含义,并能比较它们的不同(难点)。
导入新课
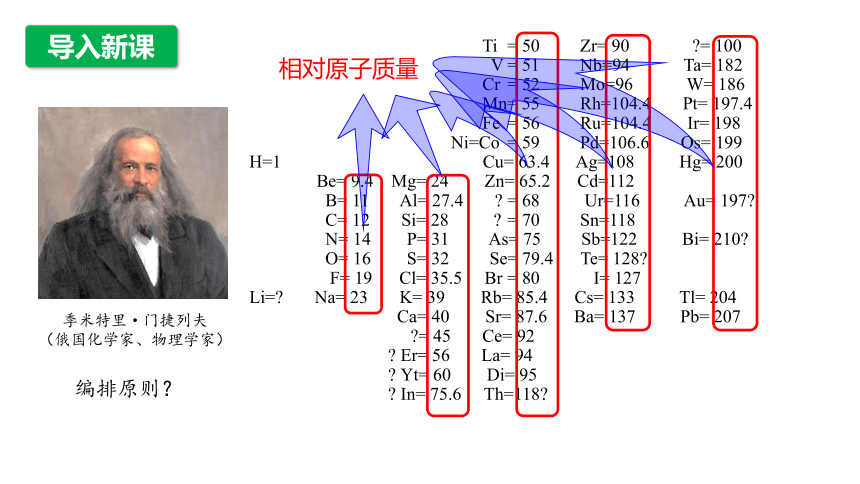
1869年第一张元素周期表
季米特里·门捷列夫
(俄国化学家、物理学家)
编排原则?
导入新课
季米特里·门捷列夫
(俄国化学家、物理学家)
Ti = 50 Zr= 90 = 100
V = 51 Nb=94 Ta= 182
Cr = 52 Mo=96 W= 186
Mn= 55 Rh=104.4 Pt= 197.4
Fe = 56 Ru=104.4 Ir= 198
Ni=Co = 59 Pd=106.6 Os= 199
H=1 Cu= 63.4 Ag=108 Hg= 200
Be= 9.4 Mg= 24 Zn= 65.2 Cd=112
B= 11 Al= 27.4 = 68 Ur=116 Au= 197
C= 12 Si= 28 = 70 Sn=118
N= 14 P= 31 As= 75 Sb=122 Bi= 210
O= 16 S= 32 Se= 79.4 Te= 128
F= 19 Cl= 35.5 Br = 80 I= 127
Li= Na= 23 K= 39 Rb= 85.4 Cs= 133 Tl= 204
Ca= 40 Sr= 87.6 Ba= 137 Pb= 207
= 45 Ce= 92
Er= 56 La= 94
Yt= 60 Di= 95
In= 75.6 Th=118
相对原子质量
编排原则?
导入新课
季米特里·门捷列夫
(俄国化学家、物理学家)
1871年,门捷列夫根据周期表大胆地预言了三种未知元素性质,当时称之为亚硼、亚铝、亚硅,它们的性质分别类似于硼、铝、硅。
1875年,法国布瓦博德朗发现了一种新元素,命名为“镓”,它是门捷列夫五年前预言的元素亚铝。镓的发现是科学预言获得第一次成功的验证。
1886年法国文克勒发现了锗,它就是门捷列夫预言的亚硅。又一次预言成功。文克勒以十分敬佩的心情,写信给门捷列夫:“我通知您,您天才的研究又获得新的胜利,我向您致以崇高的敬意”。
导入新课
季米特里·门捷列夫
(俄国化学家、物理学家)
一、元素周期表的编排原则与结构
1.元素周期表的发展历程
元 素 周 期 表
诞生
1869年,俄国化学家门捷列夫制出
编制
意义
演变
现行
将元素按照相对原子质量由小到大依次排列,将化学性质相似的元素放在一个纵行
揭示了化学元素及其化合物间的联系和规律性
为未知元素留下的空位先后被填满
排序依据由相对原子质量改为原子的核电荷数
2.原子序数及其与原子结构的关系
原子序数:按照元素在周期表中的顺序给元素编号
原子序数与原子结构的关系:原子序数=质子数=核外电子数=核电荷数
一、元素周期表的编排原则与结构
3.元素周期表的编排原则
横行(7个)——元素电子层数相同,原子序数从左到右依次递增
纵列(18个)——元素原子最外层电子数相同,自上而下电子层数依次递增
……………周期
……族
7个周期
16个族 (18个纵行)
第Ⅷ族
8、9、10三个纵行
一、元素周期表的编排原则与结构
4.元素周期表的结构
(1)周期的划分
短周期
长周期
2
8
8
18
18
32
32
短周期
长周期
第一周期
第二周期
第三周期
第四周期
第五周期
第六周期
第七周期
周期
2 种
8 种
8 种
32 种
18 种
18 种
32 种
注意:元素的周期序数=电子层数。
一、元素周期表的编排原则与结构
在现行元素周期表中第四、五、六、七周期均有18列,为什么第四、五周期各有18种元素,而第六、七周期各有32种元素?
第六周期中的镧系有15种元素;第七周期中的锕系有15种元素,比第四、五周期多出14种元素。
思考交流
一、元素周期表的编排原则与结构
4.元素周期表的结构
(2)族的分类
主族:短周期和长周期元素共同构成
表示ⅠA 、ⅡA ……ⅦA,7个
副族:完全由长周期元素构成
表示ⅠB 、ⅡB ……ⅦB和第Ⅷ族(3个纵行),8个
0 族:第18纵列,最外层电子数8 (He除外) 1个
七A七B和0族
3个纵行第Ⅷ族
一、元素周期表的编排原则与结构
ⅠA、ⅡA ⅢA、ⅣA、ⅤA、ⅥA、ⅦA、0族
ⅢB、ⅣB、ⅤB、ⅥB、ⅦB、Ⅷ、ⅠB、ⅡB
思考交流
1. 在周期表中第Ⅷ族元素包含8、9、10三个纵列,而其他族只有一个纵列,故第Ⅷ族元素种类最多,这种判断对吗?
2. 同周期的第ⅡA、ⅢA族元素的原子序数差一定为“1”吗?
一、元素周期表的编排原则与结构
错误
32种
1
11
25
不一定
4.元素周期表的结构
(3)常见族的元素的别称
族 别称
第ⅠA族(除氢外) 碱金属元素
第ⅦA族 卤族元素
0族 稀有气体元素
碳族
氮族
氧族
卤族
一、元素周期表的编排原则与结构
5.元素周期表中方格里的符号的意义
原子序数
相对原子质量
元素符号
元素名称
知识拓展
一、元素周期表的编排原则与结构
U
铀
5f36d17s2
238.0
元素符号,红色指放射性元素
价层电子排布,括号指可能的电子排布
相对原子质量(加括号的数据为该放射性元素半衰期最长同位素的质量数)
原子序数
元素名称注*的是人造元素
应用体验
1.判断正误
(1)一个横行即是一个周期,一个纵列即是一个族
(2)每一周期都是碱金属元素开始,稀有气体元素结束
(3)同族元素的最外层电子数一定等于族序数
(4)长周期中第ⅡA族与第ⅢA族之间隔着10个纵列
(5)长周期的元素没有主族,只有副族、0族
(6)第ⅠA族中元素均为金属元素,又称碱金属元素
×
√
×
×
×
×
一、元素周期表的编排原则与结构
应用体验
2.(2023·长沙高一检测)下列说法正确的是
A.某短周期元素最外层有2个电子,则其一定是金属元素
B.主族元素的单原子阳离子一定具有稀有气体的电子层结构(H+除外)
C.元素周期表有7个主族、8个副族和1个0族,副族均由长周期元素组成
D.主族元素在周期表中的位置只取决于该元素的电子层数
√
一、元素周期表的编排原则与结构
如He,稀有气体
短周期主族元素
电子层数(周期数)、最外层电子数(族序数)
1.元素周期表的结构
2.原子序数的定量关系
(1)同周期,第ⅡA族元素与第ⅢA族元素原子序数差可能为1、11、25。
(2)同族,相邻周期元素原子序数差:第ⅠA族~第ⅡA族:上一周期元素种数;
第ⅢA族~0族:下一周期元素种数。
如Na与K原子序数相差8,Cl与Br原子序数相差18。
一、元素周期表的编排原则与结构
归纳总结
二、核素、同位素
H
1
1
2
3
氢
1.0079
周期表中有118种元素,是不是就只有118种原子呢?试分析下列三种原子结构的异同?它们是不是同一种元素?
问题导入
请填写三种氢原子的原子符号:
氢元素的原子核 原子名称 原子符号
质子数(Z) 中子数(N)
1 0 氕
1 1 氘
1 2 氚
X
A
Z
质子数相同而中子数不同,它们是同一种元素。
或D
或T
1.概念辨析
(1)元素:具有相同质子数(核电荷数)的一类原子的总称。
(2)核素:具有一定数目质子和一定数目中子的一种原子。
(3)同位素:质子数相同而中子数不同的同一元素的不同原子互称为同位素
(即同一元素的不同核素)。
氕 氘 氚
二、核素、同位素
思考交流
(1)O2和O3互为同位素吗?H2O和D2O互为同位素吗?
O2和O3不互为同位素,因为O2和O3互为同素异形体,不是原子;
H2O和D2O不互为同位素,因为H2O和D2O是分子。
(2)填写下列空白:
同位素 同素异形体
本质
范畴
特性
质子数相同、中子数不同的核素
同种元素组成的不同单质
原子
单质
化学性质几乎相同,物理性质不同
组成元素相同,性质不同
二、核素、同位素
2.同位素的应用
(1)14C在考古中推断文物的年代;
(2)2H、3H制造氢弹的原料;
(3)235U核反应堆的燃料;
(4)12C相对原子质量的标准原子
(5)放射性同位素释放的射线可用于育种、治疗恶性肿瘤等。
二、核素、同位素
1.判断正误
(1)任何原子都由质子、中子、电子构成
(2)23Na和23Mg互为同位素
(3)同位素原子的化学性质几乎相同,物理性质略有差异
(4)原子的种类大于元素的种类
(5) 和为同一元素的不同微粒
(6)16O、1H、2H、3H四种核素可构成4种水分子
(7)核聚变如+―→+,因为有新微粒生成,所以该变化是化学变化
×
√
×
√
√
×
×
应用体验
二、核素、同位素
应用体验
√
二、核素、同位素
2.金属钛对人体无毒且能与肌肉和骨骼生长在一起,有“生物金属”之称。下列有关和的说法正确的是
A.和的质量数不同,属于两种元素
B. 和的质子数相同,互称同位素
C. 和的质子数相同,是同一种核素
D. 和核外电子数相同,中子数不同,互称为同素异形体
自我测试
1.某元素的离子结构示意图为 ,该元素在周期表中的位置是
A.第五周期0族
B.第六周期第ⅠB族
C.第五周期第ⅦA族
D.第六周期第ⅠA族
√
核电荷数为55,核外电子总数为54,很明显是失1个电子形成阳离子结构,故其原子最外层是1个电子,可推出是第六周期第ⅠA族元素
自我测试
√
2.(2023·山东临沂高一期末)核能利用有利于早日实现“碳达峰、碳中和”。核裂变的原理为+―→++3,下列说法错误的是
A. 与互为同素异形体
B. 的中子数为143
C. 核外电子数为56
D.Kr在周期表中的位置为第四周期0族
同位素
自我测试
3.(2023·广东阳江高一期末)A、B、C、D为短周期元素,在周期表中的相对位置如图所示,A、C两元素的原子核外电子数之和等于B元素原子的质子数。
(1)写出A元素的名称:_____。
(2)B位于周期表中第_____周期第_____族。
(3)C的原子结构示意图为__________。
(4)D的单质与水反应的化学方程式为________________________。
氮
三
ⅥA
Cl2+H2O HCl+HClO
+9
2 7
x-1
x+1
x-8
x=8
O
N
F
S
Cl
本节内容结束
第一节 原子结构与元素周期表
第2课时 元素周期表 核素
第四章 物质结构 元素周期律
[学习目标]
1.了解元素周期表的发展历程及现行元素周期表的结构。
2.能从原子结构角度理解元素周期表的编排原则,能进行元素在周期表
中位置与原子结构之间的相互推导(重、难点)。
3.知道元素、核素、同位素、的含义,并能比较它们的不同(难点)。
导入新课
1869年第一张元素周期表
季米特里·门捷列夫
(俄国化学家、物理学家)
编排原则?
导入新课
季米特里·门捷列夫
(俄国化学家、物理学家)
Ti = 50 Zr= 90 = 100
V = 51 Nb=94 Ta= 182
Cr = 52 Mo=96 W= 186
Mn= 55 Rh=104.4 Pt= 197.4
Fe = 56 Ru=104.4 Ir= 198
Ni=Co = 59 Pd=106.6 Os= 199
H=1 Cu= 63.4 Ag=108 Hg= 200
Be= 9.4 Mg= 24 Zn= 65.2 Cd=112
B= 11 Al= 27.4 = 68 Ur=116 Au= 197
C= 12 Si= 28 = 70 Sn=118
N= 14 P= 31 As= 75 Sb=122 Bi= 210
O= 16 S= 32 Se= 79.4 Te= 128
F= 19 Cl= 35.5 Br = 80 I= 127
Li= Na= 23 K= 39 Rb= 85.4 Cs= 133 Tl= 204
Ca= 40 Sr= 87.6 Ba= 137 Pb= 207
= 45 Ce= 92
Er= 56 La= 94
Yt= 60 Di= 95
In= 75.6 Th=118
相对原子质量
编排原则?
导入新课
季米特里·门捷列夫
(俄国化学家、物理学家)
1871年,门捷列夫根据周期表大胆地预言了三种未知元素性质,当时称之为亚硼、亚铝、亚硅,它们的性质分别类似于硼、铝、硅。
1875年,法国布瓦博德朗发现了一种新元素,命名为“镓”,它是门捷列夫五年前预言的元素亚铝。镓的发现是科学预言获得第一次成功的验证。
1886年法国文克勒发现了锗,它就是门捷列夫预言的亚硅。又一次预言成功。文克勒以十分敬佩的心情,写信给门捷列夫:“我通知您,您天才的研究又获得新的胜利,我向您致以崇高的敬意”。
导入新课
季米特里·门捷列夫
(俄国化学家、物理学家)
一、元素周期表的编排原则与结构
1.元素周期表的发展历程
元 素 周 期 表
诞生
1869年,俄国化学家门捷列夫制出
编制
意义
演变
现行
将元素按照相对原子质量由小到大依次排列,将化学性质相似的元素放在一个纵行
揭示了化学元素及其化合物间的联系和规律性
为未知元素留下的空位先后被填满
排序依据由相对原子质量改为原子的核电荷数
2.原子序数及其与原子结构的关系
原子序数:按照元素在周期表中的顺序给元素编号
原子序数与原子结构的关系:原子序数=质子数=核外电子数=核电荷数
一、元素周期表的编排原则与结构
3.元素周期表的编排原则
横行(7个)——元素电子层数相同,原子序数从左到右依次递增
纵列(18个)——元素原子最外层电子数相同,自上而下电子层数依次递增
……………周期
……族
7个周期
16个族 (18个纵行)
第Ⅷ族
8、9、10三个纵行
一、元素周期表的编排原则与结构
4.元素周期表的结构
(1)周期的划分
短周期
长周期
2
8
8
18
18
32
32
短周期
长周期
第一周期
第二周期
第三周期
第四周期
第五周期
第六周期
第七周期
周期
2 种
8 种
8 种
32 种
18 种
18 种
32 种
注意:元素的周期序数=电子层数。
一、元素周期表的编排原则与结构
在现行元素周期表中第四、五、六、七周期均有18列,为什么第四、五周期各有18种元素,而第六、七周期各有32种元素?
第六周期中的镧系有15种元素;第七周期中的锕系有15种元素,比第四、五周期多出14种元素。
思考交流
一、元素周期表的编排原则与结构
4.元素周期表的结构
(2)族的分类
主族:短周期和长周期元素共同构成
表示ⅠA 、ⅡA ……ⅦA,7个
副族:完全由长周期元素构成
表示ⅠB 、ⅡB ……ⅦB和第Ⅷ族(3个纵行),8个
0 族:第18纵列,最外层电子数8 (He除外) 1个
七A七B和0族
3个纵行第Ⅷ族
一、元素周期表的编排原则与结构
ⅠA、ⅡA ⅢA、ⅣA、ⅤA、ⅥA、ⅦA、0族
ⅢB、ⅣB、ⅤB、ⅥB、ⅦB、Ⅷ、ⅠB、ⅡB
思考交流
1. 在周期表中第Ⅷ族元素包含8、9、10三个纵列,而其他族只有一个纵列,故第Ⅷ族元素种类最多,这种判断对吗?
2. 同周期的第ⅡA、ⅢA族元素的原子序数差一定为“1”吗?
一、元素周期表的编排原则与结构
错误
32种
1
11
25
不一定
4.元素周期表的结构
(3)常见族的元素的别称
族 别称
第ⅠA族(除氢外) 碱金属元素
第ⅦA族 卤族元素
0族 稀有气体元素
碳族
氮族
氧族
卤族
一、元素周期表的编排原则与结构
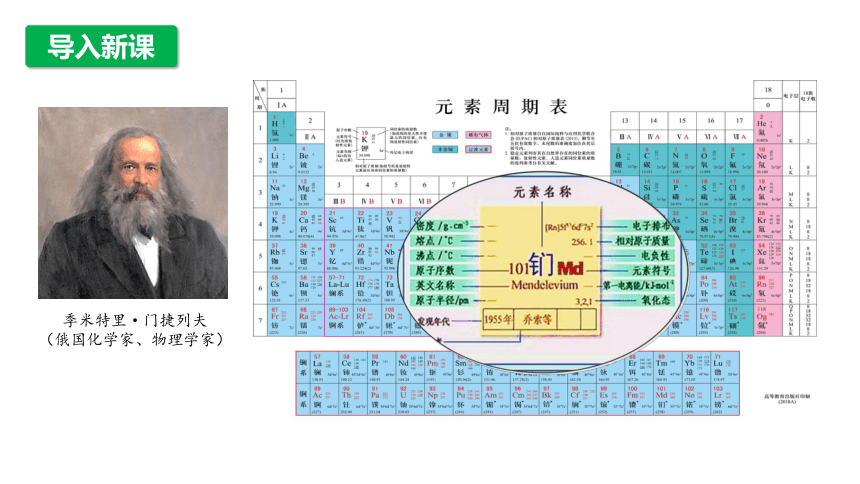
5.元素周期表中方格里的符号的意义
原子序数
相对原子质量
元素符号
元素名称
知识拓展
一、元素周期表的编排原则与结构
U
铀
5f36d17s2
238.0
元素符号,红色指放射性元素
价层电子排布,括号指可能的电子排布
相对原子质量(加括号的数据为该放射性元素半衰期最长同位素的质量数)
原子序数
元素名称注*的是人造元素
应用体验
1.判断正误
(1)一个横行即是一个周期,一个纵列即是一个族
(2)每一周期都是碱金属元素开始,稀有气体元素结束
(3)同族元素的最外层电子数一定等于族序数
(4)长周期中第ⅡA族与第ⅢA族之间隔着10个纵列
(5)长周期的元素没有主族,只有副族、0族
(6)第ⅠA族中元素均为金属元素,又称碱金属元素
×
√
×
×
×
×
一、元素周期表的编排原则与结构
应用体验
2.(2023·长沙高一检测)下列说法正确的是
A.某短周期元素最外层有2个电子,则其一定是金属元素
B.主族元素的单原子阳离子一定具有稀有气体的电子层结构(H+除外)
C.元素周期表有7个主族、8个副族和1个0族,副族均由长周期元素组成
D.主族元素在周期表中的位置只取决于该元素的电子层数
√
一、元素周期表的编排原则与结构
如He,稀有气体
短周期主族元素
电子层数(周期数)、最外层电子数(族序数)
1.元素周期表的结构
2.原子序数的定量关系
(1)同周期,第ⅡA族元素与第ⅢA族元素原子序数差可能为1、11、25。
(2)同族,相邻周期元素原子序数差:第ⅠA族~第ⅡA族:上一周期元素种数;
第ⅢA族~0族:下一周期元素种数。
如Na与K原子序数相差8,Cl与Br原子序数相差18。
一、元素周期表的编排原则与结构
归纳总结
二、核素、同位素
H
1
1
2
3
氢
1.0079
周期表中有118种元素,是不是就只有118种原子呢?试分析下列三种原子结构的异同?它们是不是同一种元素?
问题导入
请填写三种氢原子的原子符号:
氢元素的原子核 原子名称 原子符号
质子数(Z) 中子数(N)
1 0 氕
1 1 氘
1 2 氚
X
A
Z
质子数相同而中子数不同,它们是同一种元素。
或D
或T
1.概念辨析
(1)元素:具有相同质子数(核电荷数)的一类原子的总称。
(2)核素:具有一定数目质子和一定数目中子的一种原子。
(3)同位素:质子数相同而中子数不同的同一元素的不同原子互称为同位素
(即同一元素的不同核素)。
氕 氘 氚
二、核素、同位素
思考交流
(1)O2和O3互为同位素吗?H2O和D2O互为同位素吗?
O2和O3不互为同位素,因为O2和O3互为同素异形体,不是原子;
H2O和D2O不互为同位素,因为H2O和D2O是分子。
(2)填写下列空白:
同位素 同素异形体
本质
范畴
特性
质子数相同、中子数不同的核素
同种元素组成的不同单质
原子
单质
化学性质几乎相同,物理性质不同
组成元素相同,性质不同
二、核素、同位素
2.同位素的应用
(1)14C在考古中推断文物的年代;
(2)2H、3H制造氢弹的原料;
(3)235U核反应堆的燃料;
(4)12C相对原子质量的标准原子
(5)放射性同位素释放的射线可用于育种、治疗恶性肿瘤等。
二、核素、同位素
1.判断正误
(1)任何原子都由质子、中子、电子构成
(2)23Na和23Mg互为同位素
(3)同位素原子的化学性质几乎相同,物理性质略有差异
(4)原子的种类大于元素的种类
(5) 和为同一元素的不同微粒
(6)16O、1H、2H、3H四种核素可构成4种水分子
(7)核聚变如+―→+,因为有新微粒生成,所以该变化是化学变化
×
√
×
√
√
×
×
应用体验
二、核素、同位素
应用体验
√
二、核素、同位素
2.金属钛对人体无毒且能与肌肉和骨骼生长在一起,有“生物金属”之称。下列有关和的说法正确的是
A.和的质量数不同,属于两种元素
B. 和的质子数相同,互称同位素
C. 和的质子数相同,是同一种核素
D. 和核外电子数相同,中子数不同,互称为同素异形体
自我测试
1.某元素的离子结构示意图为 ,该元素在周期表中的位置是
A.第五周期0族
B.第六周期第ⅠB族
C.第五周期第ⅦA族
D.第六周期第ⅠA族
√
核电荷数为55,核外电子总数为54,很明显是失1个电子形成阳离子结构,故其原子最外层是1个电子,可推出是第六周期第ⅠA族元素
自我测试
√
2.(2023·山东临沂高一期末)核能利用有利于早日实现“碳达峰、碳中和”。核裂变的原理为+―→++3,下列说法错误的是
A. 与互为同素异形体
B. 的中子数为143
C. 核外电子数为56
D.Kr在周期表中的位置为第四周期0族
同位素
自我测试
3.(2023·广东阳江高一期末)A、B、C、D为短周期元素,在周期表中的相对位置如图所示,A、C两元素的原子核外电子数之和等于B元素原子的质子数。
(1)写出A元素的名称:_____。
(2)B位于周期表中第_____周期第_____族。
(3)C的原子结构示意图为__________。
(4)D的单质与水反应的化学方程式为________________________。
氮
三
ⅥA
Cl2+H2O HCl+HClO
+9
2 7
x-1
x+1
x-8
x=8
O
N
F
S
Cl
本节内容结束
