3.1.2 铁盐和亚铁盐 课件(共25张PPT) 2023-2024学年高一上学期化学人教版(2019)必修1
文档属性
| 名称 | 3.1.2 铁盐和亚铁盐 课件(共25张PPT) 2023-2024学年高一上学期化学人教版(2019)必修1 |

|
|
| 格式 | pptx | ||
| 文件大小 | 107.3MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-11-21 00:00:00 | ||
图片预览







文档简介
(共25张PPT)
第一节 铁及其化合物
第2课时 铁盐和亚铁盐
第三章 铁 金属材料
[学习目标]
1.依据化合价理论,结合实验探究,掌握Fe、Fe2+、Fe3+相互转化的
途径,强化变化观念(重点)。
2.通过实验探究学会Fe2+、Fe3+的检验方法,培养证据推理意识,提
升实验探究能力与创新意识(难点)。
导入新课
你知道为什么人体需要补铁吗?如何补铁?
铁是人体必需的微量元素中含量最多的一种,缺铁性贫血为仅次于结核病的全球患病率最高、耗资最大的公共卫生问题。
铁元素常见价态
亚铁盐:FeSO4、FeCl2等
铁盐:Fe2(SO4)3、FeCl3等
常见的铁盐有哪些?
+2价
+3价
如何检验?
一、铁盐、亚铁盐的性质与检验
探究:FeCl3溶液中滴加KSCN溶液;FeCl2溶液中滴加KSCN溶液。
现象:
解释:
应用:
变红色
Fe3++3SCN-===Fe(SCN)3(红色)
利用KSCN溶液检验Fe3+的存在
不变色
实验探究
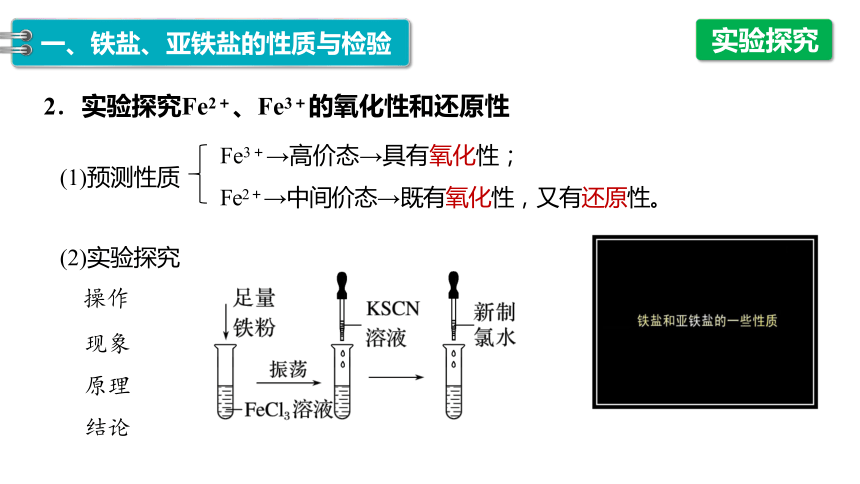
1.实验探究Fe2+、Fe3+与KSCN溶液的反应
(1)预测性质
实验探究
Fe3+→高价态→具有氧化性;
Fe2+→中间价态→既有氧化性,又有还原性。
(2)实验探究
操作
现象
原理
结论
一、铁盐、亚铁盐的性质与检验
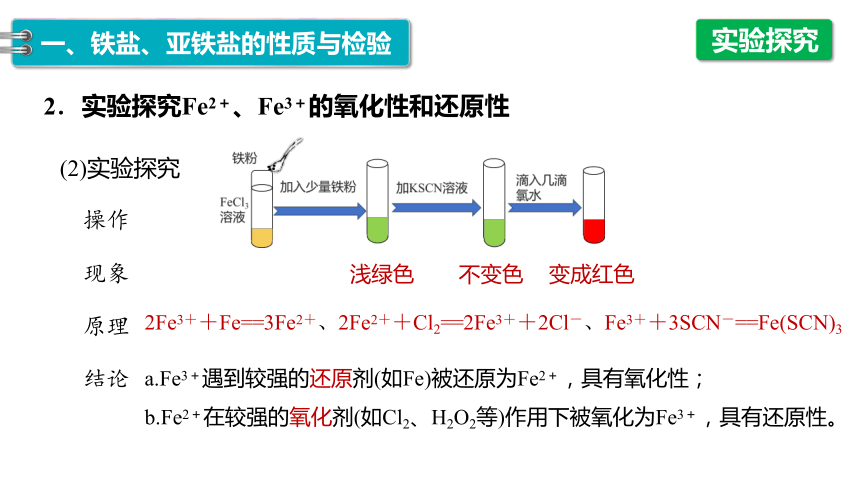
2.实验探究Fe2+、Fe3+的氧化性和还原性
实验探究
现象
原理
结论
浅绿色 不变色 变成红色
2Fe3++Fe==3Fe2+、2Fe2++Cl2==2Fe3++2Cl-、Fe3++3SCN-==Fe(SCN)3
a.Fe3+遇到较强的还原剂(如Fe)被还原为Fe2+,具有氧化性;
b.Fe2+在较强的氧化剂(如Cl2、H2O2等)作用下被氧化为Fe3+,具有还原性。
一、铁盐、亚铁盐的性质与检验
2.实验探究Fe2+、Fe3+的氧化性和还原性
(2)实验探究
操作
应用示例
写出下列反应的离子方程式:
Fe2++Zn===Fe+Zn2+
2Fe2++Cl2===2Fe3++2Cl-
2Fe3++Fe===3Fe2+
2Fe3++Cu===2Fe2++Cu2+
2Fe3++2I-===I2+2Fe2+
一、铁盐、亚铁盐的性质与检验
思考交流
(1)实验室中久置的硫酸亚铁溶液会变黄的原因是_______________________
_______________________。
(2)请设计实验检验在空气中放置的硫酸亚铁溶液已部分变质:___________
______________________________________________________________________________________________________________________________________________________________。
(3)如何通过实验证明Fe3O4中含有+2价铁?
溶液中的亚铁离子被空气
中的氧气氧化为Fe3+
分别取久置的硫酸亚铁溶液于两支试管中,一支试管中滴加KSCN溶液,溶液变红,证明溶液中有Fe3+;另一支试管中滴加酸性高锰酸钾溶液,紫红色褪去,证明溶液中有Fe2+
取Fe3O4少许于试管中,加入稀H2SO4溶解,再向其中加入几滴酸性KMnO4溶液,若紫色褪去,证明Fe3O4中含Fe2+。
一、铁盐、亚铁盐的性质与检验
溶液中Fe2+、Fe3+的检验方法
(1)溶液中只含Fe2+或Fe3+中的一种
a. 观察颜色: 溶液呈棕黄色→Fe3+ 溶液呈浅绿色→ Fe2+
b. 加碱液:
产生红褐色沉淀→Fe3+
产生白色沉淀,迅速变为灰绿色,最后变成红褐色→ Fe2+
c. KSCN溶液:
溶液呈红色→Fe3+
一、铁盐、亚铁盐的性质与检验
氯水
溶液不变红 溶液变红→ Fe2+
归纳总结
(2)含Fe2+和Fe3+的混合溶液
①Fe2+的检验
a. 通常向溶液中滴加适量酸性KMnO4溶液,溶液紫红色褪去,说明含有Fe2+(注意:Cl-等还原性的离子对Fe2+的检验有干扰)。
b. 向溶液中加入K3[Fe(CN)6]溶液,产生蓝色沉淀,说明含有Fe2+。
②Fe3+的检验
向溶液中滴加KSCN溶液,现象为溶液变红。
一、铁盐、亚铁盐的性质与检验
溶液中Fe2+、Fe3+的检验方法
归纳总结
1.判断正误
(1)金属阳离子只有氧化性
(2)向FeCl3溶液中滴加适量的KSCN溶液,出现红色沉淀
(3)向某溶液中先滴加氯水,后滴加KSCN溶液,溶液变红色,则原溶液中有Fe3+
(4)向MCl2溶液中加入酸性KMnO4溶液,溶液褪色,则M2+为Fe2+
(5)向含有Fe2+的溶液中,滴加几滴H2O2溶液后溶液变成红色,说明溶液中一定有SCN-
×
×
×
√
×
应用体验
一、铁盐、亚铁盐的性质与检验
应用体验
2.现欲探究铁及其化合物的氧化性或还原性,可供选用的试剂有铁粉、FeCl3溶液、FeCl2溶液、氯水、H2O2溶液、锌片。下列叙述不正确的是
A.在FeCl2溶液中加入锌片,溶液逐渐由浅绿色变为无色
B.向FeCl2溶液中滴加氯水,溶液变为棕黄色,则Fe2+具有还原性
C.向FeCl2溶液中滴加少量酸化的H2O2溶液,溶液变为棕黄色,并产生
大量无色气体
D.向FeCl3溶液中加入足量铁粉,溶液由棕黄色变为浅绿色,则Fe具有
还原性
√
一、铁盐、亚铁盐的性质与检验
2Fe2++H2O2+2H+===2Fe3++2H2O
二、Fe、Fe2+、Fe3+的转化关系及应用
(1)
0
Fe
还原性
弱氧化剂
Fe2+
强氧化剂
Fe3+
写出下列反应方程式(能写离子方程式的写离子方程式):
①Fe与S:_______________________;②Fe与Fe3+: _______________________ ;
③Fe与Cu2+: ____________________;④Fe与H2O:_________________________;
⑤Fe与Cl2:_____________________。
Fe+S===FeS
△
2Fe+3Cl2===2FeCl3
△
Fe+2Fe3+===3Fe2+
Fe+Cu2+===Cu+Fe2+
3Fe+4H2O(g)====Fe3O4+4H2
高温
1.Fe、 Fe2+、Fe3+的转化关系
(2) Fe2+既有氧化性又有还原性
写出下列反应方程式(能写离子方程式的写离子方程式):
①Fe2+与Cl2: ;②Fe2+与Zn: ;
③FeO与CO:______________________。
2Fe2++Cl2===2Fe3++2Cl-
(3)Fe3+具有氧化性,可被还原为Fe2+或Fe
写出下列反应方程式(能写离子方程式的写离子方程式):
①Fe3+与Cu: ;
②Fe2O3与CO:__________________________。
FeO+CO====Fe+CO2
高温
Fe2O3+3CO====2Fe+3CO2
高温
2Fe3++Cu===2Fe2++Cu2+
二、Fe、Fe2+、Fe3+的转化关系及应用
1.Fe、 Fe2+、Fe3+的转化关系
Zn+Fe2+===Zn2++Fe
(1)含Fe2+、Fe3+的分离、除杂方法
主要物质 杂质 除杂方法
Fe2+ Fe3+
FeCl3 FeCl2
Fe2+ Cu2+
问题思考
二、Fe、Fe2+、Fe3+的转化关系及应用
2.转化关系的应用
加过量铁粉后过滤
加氯水或通入Cl2
加过量铁粉后过滤
问题思考
①Fe2+、Fe3+与OH-因反应生成沉淀而不能大量共存。
②Fe3+与S2-、I-、HS-、S,Fe2+与ClO-、Mn(H+)在溶液中因发生氧化还原反应而不能大量共存。
③Fe3+与SCN-发生反应生成难电离的Fe(SCN)3,不能大量共存。
二、Fe、Fe2+、Fe3+的转化关系及应用
2.转化关系的应用
(2)离子的共存问题
二、Fe、Fe2+、Fe3+的转化关系及应用
2.转化关系的应用
(3)利用覆铜板制作图案
①实验原理:
利用FeCl3溶液作为“腐蚀液”,将覆铜板上不需要的铜腐蚀。
②实验操作:取一小块覆铜板,用油性笔在覆铜板上画上设计好的图案,然后浸入盛有FeCl3溶液的小烧杯中。过一段时间后,取出覆铜板并用水清洗干净。
③实验现象:
用油性笔画出的图案处不被腐蚀,洗净后板上留下设计的图案。
④实验结论:
⑤反应方程式:
二、Fe、Fe2+、Fe3+的转化关系及应用
2.转化关系的应用
(3)利用覆铜板制作图案
铜可被FeCl3溶液腐蚀
2FeCl3+Cu===2FeCl2+CuCl2
(2Fe3++Cu===2Fe2++Cu2+)
思考交流
使用后的腐蚀液中含有哪些物质?如何处理腐蚀液回收得到Cu和FeCl3
使用后的腐蚀液中含有CuCl2、FeCl2、FeCl3
回收流程如下图:
二、Fe、Fe2+、Fe3+的转化关系及应用
自我测试
1.下列离子的检验方法合理的是
A.向某溶液中滴入KSCN溶液呈红色,说明原溶液中不含Fe2+
B.向某溶液中通入Cl2,然后再加入KSCN溶液变红色,说明原溶液中含有Fe2+
C.向某溶液中加入KSCN溶液呈红色,说明原溶液中含有Fe3+
D.向某溶液中加入NaOH溶液得白色沉淀,又观察到沉淀颜色逐渐变为红褐色,
说明原溶液中含有Fe2+,不含有Mg2+
√
证明存在Fe3+,但无法确定Fe2+是否存在
不能确定原溶液是只存在Fe2+,还是只存在Fe3+或Fe2+、Fe3+均含有
若含Fe2+的溶液中含有其他能与碱生成白色沉淀的离子时,也出现同样的现象
自我测试
2.(2022·湖南岳阳市教科院高一检测)下列除去杂质(括号中的物质为杂质)的方法正确的是
A.Fe(OH)3[Fe(OH)2]:灼烧
B.FeCl2溶液(FeCl3):通入适量Cl2
C.FeCl3溶液(CuCl2):加入足量的Fe粉,过滤
D.Cl2(HCl):通过饱和食盐水洗气后干燥
√
混合物在空气中灼烧得到Fe2O3
氯化铁和铁粉反应生成氯化亚铁
HCl极易溶于水,可以被饱和食盐水吸收
自我测试
3.某化学兴趣小组利用铁粉、锌粉、0.1 mol·L-1 FeCl3溶液、0.1 mol·L-1 FeCl2溶液、KSCN溶液和新制氯水来探究Fe2+、Fe3+的氧化性、还原性,并利用实验结论解决一些问题。
(1)用上述所给物质写出体现Fe2+具有还原性的化学方程式:________________________________。
2FeCl2+Cl2===2FeCl3
自我测试
3.某化学兴趣小组利用铁粉、锌粉、0.1 mol·L-1 FeCl3溶液、0.1 mol·L-1 FeCl2溶液、KSCN溶液和新制氯水来探究Fe2+、Fe3+的氧化性、还原性,并利用实验结论解决一些问题。
(2)设计实验方案,完成下列表格。
探究内容 实验方案 实验现象
探究Fe3+具有氧化性 取少量0.1 mol·L-1 FeCl3溶液,向溶液中加入足量铁粉,再加入少量KSCN溶液 加入铁粉后,溶液颜色变为________;加入KSCN溶液后,溶液_______
浅绿色
不变红
自我测试
3.某化学兴趣小组利用铁粉、锌粉、0.1 mol·L-1 FeCl3溶液、0.1 mol·L-1 FeCl2溶液、KSCN溶液和新制氯水来探究Fe2+、Fe3+的氧化性、还原性,并利用实验结论解决一些问题。
(3)该兴趣小组为探究“Fe2+具有氧化性”,提出向FeCl2溶液中加入锌粉,该反应的离子方程式为____________________________。
Fe2++Zn===Zn2++Fe
本节内容结束
第一节 铁及其化合物
第2课时 铁盐和亚铁盐
第三章 铁 金属材料
[学习目标]
1.依据化合价理论,结合实验探究,掌握Fe、Fe2+、Fe3+相互转化的
途径,强化变化观念(重点)。
2.通过实验探究学会Fe2+、Fe3+的检验方法,培养证据推理意识,提
升实验探究能力与创新意识(难点)。
导入新课
你知道为什么人体需要补铁吗?如何补铁?
铁是人体必需的微量元素中含量最多的一种,缺铁性贫血为仅次于结核病的全球患病率最高、耗资最大的公共卫生问题。
铁元素常见价态
亚铁盐:FeSO4、FeCl2等
铁盐:Fe2(SO4)3、FeCl3等
常见的铁盐有哪些?
+2价
+3价
如何检验?
一、铁盐、亚铁盐的性质与检验
探究:FeCl3溶液中滴加KSCN溶液;FeCl2溶液中滴加KSCN溶液。
现象:
解释:
应用:
变红色
Fe3++3SCN-===Fe(SCN)3(红色)
利用KSCN溶液检验Fe3+的存在
不变色
实验探究
1.实验探究Fe2+、Fe3+与KSCN溶液的反应
(1)预测性质
实验探究
Fe3+→高价态→具有氧化性;
Fe2+→中间价态→既有氧化性,又有还原性。
(2)实验探究
操作
现象
原理
结论
一、铁盐、亚铁盐的性质与检验
2.实验探究Fe2+、Fe3+的氧化性和还原性
实验探究
现象
原理
结论
浅绿色 不变色 变成红色
2Fe3++Fe==3Fe2+、2Fe2++Cl2==2Fe3++2Cl-、Fe3++3SCN-==Fe(SCN)3
a.Fe3+遇到较强的还原剂(如Fe)被还原为Fe2+,具有氧化性;
b.Fe2+在较强的氧化剂(如Cl2、H2O2等)作用下被氧化为Fe3+,具有还原性。
一、铁盐、亚铁盐的性质与检验
2.实验探究Fe2+、Fe3+的氧化性和还原性
(2)实验探究
操作
应用示例
写出下列反应的离子方程式:
Fe2++Zn===Fe+Zn2+
2Fe2++Cl2===2Fe3++2Cl-
2Fe3++Fe===3Fe2+
2Fe3++Cu===2Fe2++Cu2+
2Fe3++2I-===I2+2Fe2+
一、铁盐、亚铁盐的性质与检验
思考交流
(1)实验室中久置的硫酸亚铁溶液会变黄的原因是_______________________
_______________________。
(2)请设计实验检验在空气中放置的硫酸亚铁溶液已部分变质:___________
______________________________________________________________________________________________________________________________________________________________。
(3)如何通过实验证明Fe3O4中含有+2价铁?
溶液中的亚铁离子被空气
中的氧气氧化为Fe3+
分别取久置的硫酸亚铁溶液于两支试管中,一支试管中滴加KSCN溶液,溶液变红,证明溶液中有Fe3+;另一支试管中滴加酸性高锰酸钾溶液,紫红色褪去,证明溶液中有Fe2+
取Fe3O4少许于试管中,加入稀H2SO4溶解,再向其中加入几滴酸性KMnO4溶液,若紫色褪去,证明Fe3O4中含Fe2+。
一、铁盐、亚铁盐的性质与检验
溶液中Fe2+、Fe3+的检验方法
(1)溶液中只含Fe2+或Fe3+中的一种
a. 观察颜色: 溶液呈棕黄色→Fe3+ 溶液呈浅绿色→ Fe2+
b. 加碱液:
产生红褐色沉淀→Fe3+
产生白色沉淀,迅速变为灰绿色,最后变成红褐色→ Fe2+
c. KSCN溶液:
溶液呈红色→Fe3+
一、铁盐、亚铁盐的性质与检验
氯水
溶液不变红 溶液变红→ Fe2+
归纳总结
(2)含Fe2+和Fe3+的混合溶液
①Fe2+的检验
a. 通常向溶液中滴加适量酸性KMnO4溶液,溶液紫红色褪去,说明含有Fe2+(注意:Cl-等还原性的离子对Fe2+的检验有干扰)。
b. 向溶液中加入K3[Fe(CN)6]溶液,产生蓝色沉淀,说明含有Fe2+。
②Fe3+的检验
向溶液中滴加KSCN溶液,现象为溶液变红。
一、铁盐、亚铁盐的性质与检验
溶液中Fe2+、Fe3+的检验方法
归纳总结
1.判断正误
(1)金属阳离子只有氧化性
(2)向FeCl3溶液中滴加适量的KSCN溶液,出现红色沉淀
(3)向某溶液中先滴加氯水,后滴加KSCN溶液,溶液变红色,则原溶液中有Fe3+
(4)向MCl2溶液中加入酸性KMnO4溶液,溶液褪色,则M2+为Fe2+
(5)向含有Fe2+的溶液中,滴加几滴H2O2溶液后溶液变成红色,说明溶液中一定有SCN-
×
×
×
√
×
应用体验
一、铁盐、亚铁盐的性质与检验
应用体验
2.现欲探究铁及其化合物的氧化性或还原性,可供选用的试剂有铁粉、FeCl3溶液、FeCl2溶液、氯水、H2O2溶液、锌片。下列叙述不正确的是
A.在FeCl2溶液中加入锌片,溶液逐渐由浅绿色变为无色
B.向FeCl2溶液中滴加氯水,溶液变为棕黄色,则Fe2+具有还原性
C.向FeCl2溶液中滴加少量酸化的H2O2溶液,溶液变为棕黄色,并产生
大量无色气体
D.向FeCl3溶液中加入足量铁粉,溶液由棕黄色变为浅绿色,则Fe具有
还原性
√
一、铁盐、亚铁盐的性质与检验
2Fe2++H2O2+2H+===2Fe3++2H2O
二、Fe、Fe2+、Fe3+的转化关系及应用
(1)
0
Fe
还原性
弱氧化剂
Fe2+
强氧化剂
Fe3+
写出下列反应方程式(能写离子方程式的写离子方程式):
①Fe与S:_______________________;②Fe与Fe3+: _______________________ ;
③Fe与Cu2+: ____________________;④Fe与H2O:_________________________;
⑤Fe与Cl2:_____________________。
Fe+S===FeS
△
2Fe+3Cl2===2FeCl3
△
Fe+2Fe3+===3Fe2+
Fe+Cu2+===Cu+Fe2+
3Fe+4H2O(g)====Fe3O4+4H2
高温
1.Fe、 Fe2+、Fe3+的转化关系
(2) Fe2+既有氧化性又有还原性
写出下列反应方程式(能写离子方程式的写离子方程式):
①Fe2+与Cl2: ;②Fe2+与Zn: ;
③FeO与CO:______________________。
2Fe2++Cl2===2Fe3++2Cl-
(3)Fe3+具有氧化性,可被还原为Fe2+或Fe
写出下列反应方程式(能写离子方程式的写离子方程式):
①Fe3+与Cu: ;
②Fe2O3与CO:__________________________。
FeO+CO====Fe+CO2
高温
Fe2O3+3CO====2Fe+3CO2
高温
2Fe3++Cu===2Fe2++Cu2+
二、Fe、Fe2+、Fe3+的转化关系及应用
1.Fe、 Fe2+、Fe3+的转化关系
Zn+Fe2+===Zn2++Fe
(1)含Fe2+、Fe3+的分离、除杂方法
主要物质 杂质 除杂方法
Fe2+ Fe3+
FeCl3 FeCl2
Fe2+ Cu2+
问题思考
二、Fe、Fe2+、Fe3+的转化关系及应用
2.转化关系的应用
加过量铁粉后过滤
加氯水或通入Cl2
加过量铁粉后过滤
问题思考
①Fe2+、Fe3+与OH-因反应生成沉淀而不能大量共存。
②Fe3+与S2-、I-、HS-、S,Fe2+与ClO-、Mn(H+)在溶液中因发生氧化还原反应而不能大量共存。
③Fe3+与SCN-发生反应生成难电离的Fe(SCN)3,不能大量共存。
二、Fe、Fe2+、Fe3+的转化关系及应用
2.转化关系的应用
(2)离子的共存问题
二、Fe、Fe2+、Fe3+的转化关系及应用
2.转化关系的应用
(3)利用覆铜板制作图案
①实验原理:
利用FeCl3溶液作为“腐蚀液”,将覆铜板上不需要的铜腐蚀。
②实验操作:取一小块覆铜板,用油性笔在覆铜板上画上设计好的图案,然后浸入盛有FeCl3溶液的小烧杯中。过一段时间后,取出覆铜板并用水清洗干净。
③实验现象:
用油性笔画出的图案处不被腐蚀,洗净后板上留下设计的图案。
④实验结论:
⑤反应方程式:
二、Fe、Fe2+、Fe3+的转化关系及应用
2.转化关系的应用
(3)利用覆铜板制作图案
铜可被FeCl3溶液腐蚀
2FeCl3+Cu===2FeCl2+CuCl2
(2Fe3++Cu===2Fe2++Cu2+)
思考交流
使用后的腐蚀液中含有哪些物质?如何处理腐蚀液回收得到Cu和FeCl3
使用后的腐蚀液中含有CuCl2、FeCl2、FeCl3
回收流程如下图:
二、Fe、Fe2+、Fe3+的转化关系及应用
自我测试
1.下列离子的检验方法合理的是
A.向某溶液中滴入KSCN溶液呈红色,说明原溶液中不含Fe2+
B.向某溶液中通入Cl2,然后再加入KSCN溶液变红色,说明原溶液中含有Fe2+
C.向某溶液中加入KSCN溶液呈红色,说明原溶液中含有Fe3+
D.向某溶液中加入NaOH溶液得白色沉淀,又观察到沉淀颜色逐渐变为红褐色,
说明原溶液中含有Fe2+,不含有Mg2+
√
证明存在Fe3+,但无法确定Fe2+是否存在
不能确定原溶液是只存在Fe2+,还是只存在Fe3+或Fe2+、Fe3+均含有
若含Fe2+的溶液中含有其他能与碱生成白色沉淀的离子时,也出现同样的现象
自我测试
2.(2022·湖南岳阳市教科院高一检测)下列除去杂质(括号中的物质为杂质)的方法正确的是
A.Fe(OH)3[Fe(OH)2]:灼烧
B.FeCl2溶液(FeCl3):通入适量Cl2
C.FeCl3溶液(CuCl2):加入足量的Fe粉,过滤
D.Cl2(HCl):通过饱和食盐水洗气后干燥
√
混合物在空气中灼烧得到Fe2O3
氯化铁和铁粉反应生成氯化亚铁
HCl极易溶于水,可以被饱和食盐水吸收
自我测试
3.某化学兴趣小组利用铁粉、锌粉、0.1 mol·L-1 FeCl3溶液、0.1 mol·L-1 FeCl2溶液、KSCN溶液和新制氯水来探究Fe2+、Fe3+的氧化性、还原性,并利用实验结论解决一些问题。
(1)用上述所给物质写出体现Fe2+具有还原性的化学方程式:________________________________。
2FeCl2+Cl2===2FeCl3
自我测试
3.某化学兴趣小组利用铁粉、锌粉、0.1 mol·L-1 FeCl3溶液、0.1 mol·L-1 FeCl2溶液、KSCN溶液和新制氯水来探究Fe2+、Fe3+的氧化性、还原性,并利用实验结论解决一些问题。
(2)设计实验方案,完成下列表格。
探究内容 实验方案 实验现象
探究Fe3+具有氧化性 取少量0.1 mol·L-1 FeCl3溶液,向溶液中加入足量铁粉,再加入少量KSCN溶液 加入铁粉后,溶液颜色变为________;加入KSCN溶液后,溶液_______
浅绿色
不变红
自我测试
3.某化学兴趣小组利用铁粉、锌粉、0.1 mol·L-1 FeCl3溶液、0.1 mol·L-1 FeCl2溶液、KSCN溶液和新制氯水来探究Fe2+、Fe3+的氧化性、还原性,并利用实验结论解决一些问题。
(3)该兴趣小组为探究“Fe2+具有氧化性”,提出向FeCl2溶液中加入锌粉,该反应的离子方程式为____________________________。
Fe2++Zn===Zn2++Fe
本节内容结束
