1.1 化学反应的热效应 同步练习 (含解析)2023-2024学年高二上学期化学鲁科版(2019)选择性必修1
文档属性
| 名称 | 1.1 化学反应的热效应 同步练习 (含解析)2023-2024学年高二上学期化学鲁科版(2019)选择性必修1 |

|
|
| 格式 | docx | ||
| 文件大小 | 685.9KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-11-21 11:34:15 | ||
图片预览



文档简介
1.1 化学反应的热效应 同步练习
一、单选题
1.能源可划分为一次能源和二次能源,直接从自然界取得的能源称为一级能源,一次能源经过加工、转换得到的能源成为二次能源。下列能源中属于一次能源的是( )
A.氢能 B.电能 C.核能 D.水煤气
2.已知:反应 。现分别取50mL 0.50mol/L醋酸溶液与50mL 0.55mo/L NaOH溶液进行反应,用如图实验装置测定该反应的反应热,下列说法错误的是( )
A.小烧杯和大烧杯的杯口应相平
B.使用环形玻璃搅拌棒是为了使反应更充分
C.为了让反应充分进行,NaOH分三次倒入
D.该实验测得的反应热
3.二十一世纪以来,人类一直致力于新能源的开发与利用。下列属于新能源的是( )
A.煤炭 B.天然气 C.氢气 D.石油
4.石油是一种重要能源,人类正面临着石油短缺、油价上涨的困惑.以下解决能源问题的方法不当的是( )
A.用木材作燃料 B.用乙醇替代汽油
C.开发风能 D.开发地热
5.中国研究人员研制出一种新型复合光催化剂,利用太阳光在催化剂表面实现高效分解水,主要过程如下图所示。下列说法错误的是( )
A.整个过程实现了光能向化学能的转换
B.过程II有O-O单键生成并放出能量
C.过程III发生的化学反应为: 2H2O2=2H2O+O2
D.整个过程的总反应方程式为: 2H2O→H2+O2
6.下列四组热化学方程式,△H1>△H2的是( )
①C(s)+O2(g)=CO2(g) △H1 C(s)+ O2(g)=CO(g) △H2
②S(s)+O2(g)=SO2(g) △H1 S(g)+O2(g)=SO2(g) △H2
③CaCO3(s)=CaO(s)+CO2(g) △H1 CaO(s)+H2O(l)=Ca(OH)2(s) △H2
④HCl+NaOH=NaCl+H2O △H1 HCl+NH3·H2O=NH4Cl+H2O △H2
A.①③ B.①④ C.②③ D.②④
7.已知通过乙醇制取氢气有如下两条路线:
a.CH3CH2OH(g)+H2O(g)=4H2(g)+2CO(g) △H=+255.6kJ mol-1
B.CH3CH2OH(g)+1/2O2(g)=3H2(g)+2CO(g) △H=+13.8kJ mol-1
则下列说法错误的是( )
A.降低温度,可提高b路线中乙醇的转化率
B.从能量消耗的角度来看,b路线制氢更加有利
C.乙醇可通过淀粉等生物原料发酵制得,属于可再生资源
D.由a、b知:2H2(g)+O2(g)=2H2O(g) △H=-483.6kJ mol-1
8.在298K和100kPa压力下,已知金刚石和石墨的熵、燃烧热和密度分别为:
物质 S(J k-1 mol-1) △H(kJ mol-1) ρ(kg m-3)
C(石墨) 5.7 -393.51 2260
C(金刚石) 2.4 -395.40 3513
此条件下,对于反应C(石墨)→C(金刚石),下列说法正确的是( )
A.该反应的△H<0,ΔS<0
B.金刚石比石墨稳定
C.由公式ΔG=△H-TΔS可知,该反应在任何条件下都能自发进行
D.超高压条件下,石墨有可能变为金刚石
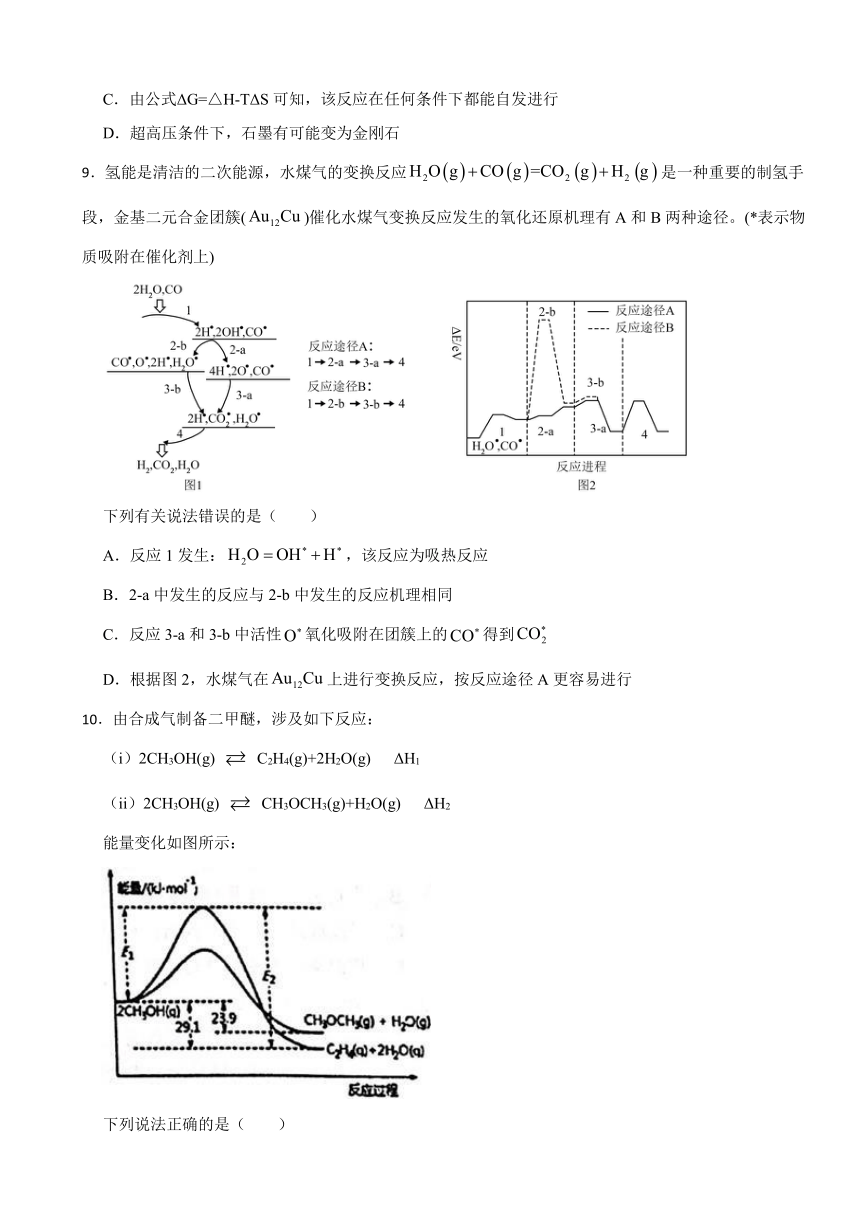
9.氢能是清洁的二次能源,水煤气的变换反应是一种重要的制氢手段,金基二元合金团簇()催化水煤气变换反应发生的氧化还原机理有A和B两种途径。(*表示物质吸附在催化剂上)
下列有关说法错误的是( )
A.反应1发生:,该反应为吸热反应
B.2-a中发生的反应与2-b中发生的反应机理相同
C.反应3-a和3-b中活性氧化吸附在团簇上的得到
D.根据图2,水煤气在上进行变换反应,按反应途径A更容易进行
10.由合成气制备二甲醚,涉及如下反应:
(i)2CH3OH(g) C2H4(g)+2H2O(g) ΔH1
(ii)2CH3OH(g) CH3OCH3(g)+H2O(g) ΔH2
能量变化如图所示:
下列说法正确的是( )
A.ΔH1<ΔH2
B.反应(ii)为吸热反应
C.C2H4(g)+H2O(g) CH3OCH3(g) ΔH=-5.2kJ·mol-1
D.若在容器中加入催化剂,则E2-E1将变小
11.已知在25℃、101kPa下,1gC8H18(辛烷)燃烧生成二氧化碳和液态水时放出48.40kJ热量.表示上述反应的热化学方程式正确的是( )
A.C8H18(1)+ O2(g)═8CO2(g)+9H2O(g)△H=﹣48.40kJ mol﹣1
B.C8H18(1)+ O2(g)═8CO2(g)+9H2O(1)△H=﹣5518kJ mol﹣1
C.C8H18(1)+ O2(g)═8CO2(g)+9H2O(1)△H=+5518kJ mol﹣1
D.C8H18(1)+ O2(g)═8CO2(g)+9H2O(1)△H=﹣48.40kJ mol﹣1
12.25℃、 下,碳、氡气、甲烷和葡萄糖(C6H12O6)的燃烧热依次是 、 、 、 ,则下列热化学方程式正确的是( )
A.
B.
C.
D.
13.下列与化学反应原理相关的叙述错误的是()
A.放热反应中生成物总能量一定低于反应物总能量
B.放热反应的反应速率总是大于吸热反应的反应速率
C.盖斯定律实质上是能量守恒定律的体现
D.电离平衡、水解平衡和沉淀溶解平衡均为动态平衡
14.已知下列反应的热化学方程式为:( )
①CH3COOH(l)+2O2(g)=2CO2(g)+2H2O(l) ΔH1=-870.3 kJ·mol-1
②C(s)+O2(g)=CO2(g) ΔH2=-393.5 kJ·mol-1
③H2(g)+1/2O2(g)=H2O(l) ΔH3=-285.8 kJ·mol-1
则反应2C(s)+2H2(g)+O2(g)=CH3COOH(l)的ΔH(单位为kJ·mol-1)为:
A.-488.3 B.-191 C.-476.8 D.-1 549.6
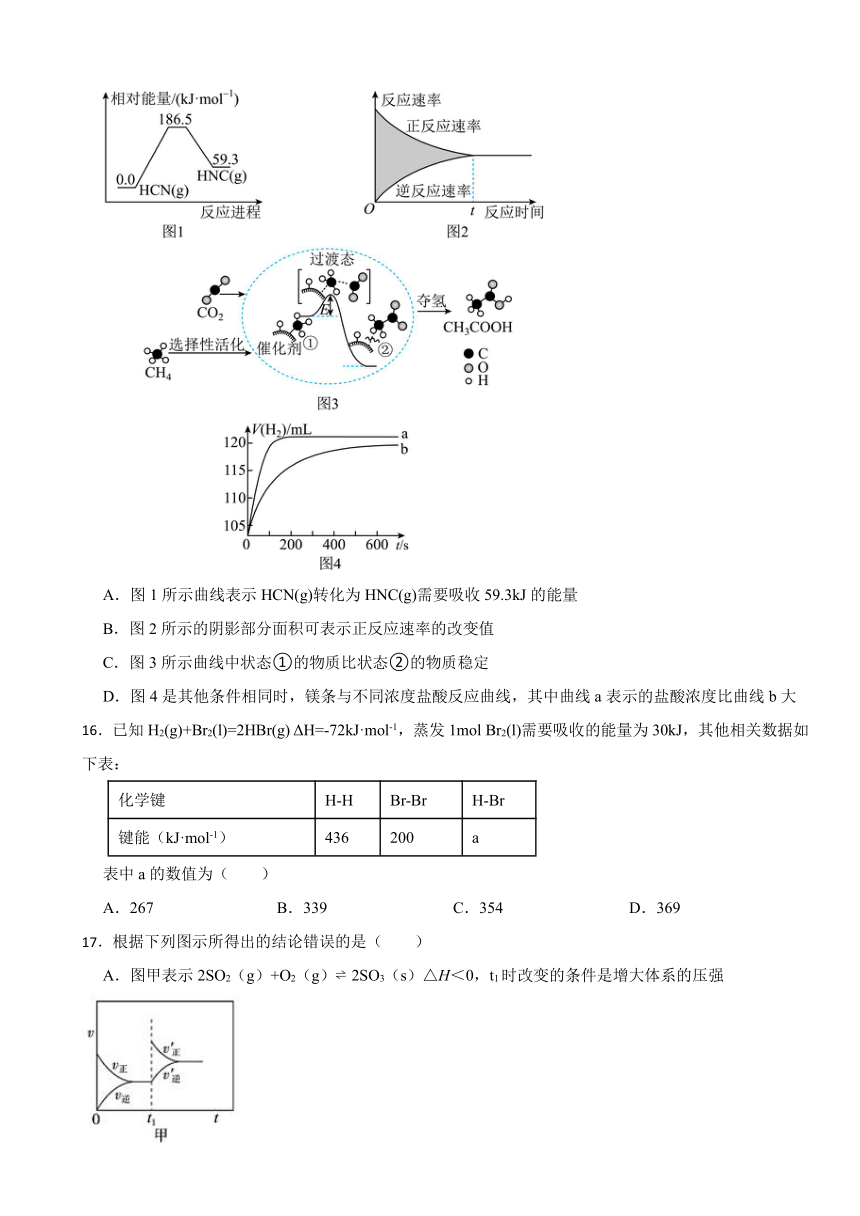
15.下列图示与对应的叙述正确的是( )
A.图1所示曲线表示HCN(g)转化为HNC(g)需要吸收59.3kJ的能量
B.图2所示的阴影部分面积可表示正反应速率的改变值
C.图3所示曲线中状态①的物质比状态②的物质稳定
D.图4是其他条件相同时,镁条与不同浓度盐酸反应曲线,其中曲线a表示的盐酸浓度比曲线b大
16.已知H2(g)+Br2(l)=2HBr(g) ΔH=-72kJ·mol-1,蒸发1mol Br2(l)需要吸收的能量为30kJ,其他相关数据如下表:
化学键 H-H Br-Br H-Br
键能(kJ·mol-1) 436 200 a
表中a的数值为( )
A.267 B.339 C.354 D.369
17.根据下列图示所得出的结论错误的是( )
A.图甲表示2SO2(g)+O2(g) 2SO3(s)△H<0,t1时改变的条件是增大体系的压强
B.图乙NaCl溶液浓度过高铁腐蚀速率降低,说明NaCl浓度越大溶液中O2的浓度越小
C.图丙说明石墨转化为金刚石的反应的△H>0
D.图丁是一定条件下发生反应:4NH3+4NO+O2 4N2+6H2O,此过程△H<0
18.已知:①4NH3(g)+5O2(g)=4NO(g)+6H2O(g)△H1=-akJ·mol-1
②4NH3(g)+3O2(g)=2N2(g)+6H2O(g)△H2=-bkJ·mol-1
③H2(g)+1/2O2(g)=H2O(g)△H3=-ckJ·mol-1
④H2(g)+1/2O2(g)=H2O(l)△H4=-dkJ·mol-1
下列叙述正确的是( )
A.由上述热化学方程式可知△H3<△H4
B.H2的燃烧热为dkJ·mol-1
C.4NH3(g)+4O2(g)=2NO(g)+N2(g)+6H2O(g)△H=(-a-b)kJ·mol-1
D.4NH3(g) 2N2(g)+6H2(g)△H=(6d-b)kJ·mol-1
二、综合题
19.联氨()又称肼,是一种应用广泛的化工原料,常用作火箭和燃料电池的燃料。回答下列问题:
(1)已知:①
②
③
写出常温下燃烧生成氮气和液态水的热化学方程式 。
已知部分键能数据如下:
化学键
键能/ 942 500 154 462
则断裂中键所需的能量是 kJ。
(2)工业上一种制备联氨的方法为,若制备,转移电子的物质的量为 mol。
(3)一种联氨燃料电池的工作原理如图所示。放电一段时间,电解质溶液的pH (填“增大”、“减小”或“不变”),负极反应式为 ,若电池工作时消耗,则消耗氧气的体积为 L(标准状况)。
20.汽车尾气中排放的NxOy和CO,科学家寻找高效催化剂实现大气污染物转化:
2CO(g)+2NO(g) N2(g)+2CO2(g)△H1
(1)已知:CO的燃烧热△H2=﹣283kJ moL﹣1.几种化学键的键能数据如下:
化学键 N≡N键 O=O键 N O键
键能kJ/ mol﹣1 945 498 630
已知:N2(g)+O2(g)=2NO(g)△H3,则:△H1= .
(2)CO与空气在KOH溶液中构成燃料电池(石墨为电极),若放电后电解质溶液中离子浓度大小顺序为
c(K+)>c(HCO3﹣)>c(OH﹣)>c(H+)>c(CO32﹣),则负极的反应式为 ;
(3)在一定温度下,向2L的密闭容器中充入4.0molNO2和4.0molCO,在催化剂作用下发生反应
4CO(g)+2NO2(g) N2(g)+4CO2(g)△H<0,相关数据如下:
0min 5min 10min 15min 20min
c(NO2) 2.0 1.7 1.56 1.5 1.5
c(N2) 0 0.15 0.22 0.25 0.25
①5~10min,用CO的浓度变化表示的反应速率为:
②能说明上述反应达到平衡状态的是
A.2n正(NO2)=n逆(N2) B.混合气体的平均相对分子质量不变
C.气体密度不变D.容器内气体压强不变
③20min时,向容器中加入1.0molNO2和1.0molCO,在t1时刻再次达到平衡时,NO2的转化率比原平衡时 (填“变大”、“变小”或“不变”).
④计算此温度下的化学平衡常数K=
⑤在上述平衡的基础上,在时间t2、t3时改变反应的某一条件,反应速率的变化如图所示,则在t3时刻改变的反应条件是: ;在时间15﹣20,t1﹣t2,t2﹣t3,t4﹣t5时的平衡常数分别为K1、K2、K3、K4,请比较各平衡常数的大小关系: .
21.参考如图,按要求回答下列问题:
(1)甲醇质子交换膜燃料电池将甲醇蒸气转化为氢气的一种原理是CH3OH(g)和H2O反应生成CO2和H2.若在反应体系中加入催化剂,反应速率增大,正反应活化能 a的变化是 (填“增大”、“减小”、“不变”),反应热△H的变化是 (填“增大”、“减小”、“不变”).请写出CH3OH(g)和H2O(g)反应的热化学方程式 .
(2)甲醇质子交换膜燃料电池中将甲醇蒸气转化为氢气的另一种反应原理是:
CH3OH(g)+ O2(g) CO2(g)+2H2(g)△H=﹣c kJ/mol
又知H2O(g) H2O(l)△H=﹣d kJ/mol.
则甲醇燃烧热的热化学方程式为 .
22.拆开1molHH键,1molNH键,1molN≡N键分别需要吸收的能量为436kJ、391kJ、946kJ,求:
(1)1molN2生成NH3放出的热量 。
(2)1molH2生成NH3放出的热量(不考虑可逆反应) 。
23.
(1)Ⅰ.同温同压下,H2(g)+Cl2(g)=2HCl(g),在光照和点燃条件下的ΔH(化学计量数相同)分别为ΔH1、ΔH2,则ΔH1 ΔH2。
(2)Ⅱ.肼(N2H4)可作为火箭发动机的燃料。
肼(N2H4)与氧化剂N2O4(l)反应生成N2和水蒸气。已知:
①N2(g)+2O2(g)=N2O4(l) ΔH1=-195 kJ·mol-1
②N2H4(l)+O2(g)=N2(g)+2H2O(g) ΔH2=-534 kJ·mol-1
试计算1 mol肼(l)与N2O4(l)完全反应生成N2和水蒸气时放出的热量为 ,写出肼(l)和N2O4(l)反应的热化学方程式: 。
(3)有关肼化学反应的能量变化如图所示,已知断裂1 mol化学键所需的能量(kJ):
N≡N为942、O=O为500、N—N为154,则断裂1 mol N—H键所需的能量是 kJ。
答案解析部分
1.【答案】C
【解析】【解答】A.氢能无法直接从自然界中获取,不属于一次能源,A不符合题意;
B.电能不能直接从自然界中获取,不属于一次能源,B不符合题意;
C.核能能够直接从自然界中获取,属于一次能源,C符合题意;
D.水煤气的主要成分是CO和H2,不能直接从自然界获取,不属于一次能源,D不符合题意;
故答案为:C
【分析】根据一次能源和二次能源的定义进行分析。
2.【答案】C
【解析】【解答】A.两烧杯的杯口应该平齐,便于塑料板密封防止热量散失,A项不符合题意;
B.使用环形玻璃搅拌棒搅拌使物质充分混合反应刚充分,B项不符合题意;
C.为了防止热量散失,应快速将NaOH倒入且一次性倒入,C项符合题意;
D.醋酸电离吸热,所以消耗一部分能量,ΔH> 57.3kJ/mol,D项不符合题意;
故答案为:C。
【分析】中和热测定的实验中要注意, 小烧杯和大烧杯的杯口应相平,两烧杯之间应填充满岁泡沫塑料,倾倒溶液的时候应一次性倒入,且使用环形玻璃搅拌棒进行搅拌混合。
3.【答案】C
【解析】【解答】新能源包括太阳能、核能、风能、氢能等;而煤、石油、天然气是化石燃料,属于常规能源,
故答案为C。
【分析】注意化石燃料燃烧后产生大量的二氧化碳,不属于新能源。
4.【答案】A
【解析】【解答】解:石油虽然是﹣种重要能源,但是毕竟石油是不可再生的能源,人类正面临着石油短缺、油价上涨的等等困惑.所以寻求新能源是当务之急.所以目前综合利用太阳能、风能、地热等新能源,乙醇属于生物质能,是可再生资源,不仅可以弥补能源的危机,而且发展前景非常大.但是乱砍伐树木,不仅导致水土流失,而且破坏生态环境,温室效应加急等等,弊大于利,此法不妥.故只有选项A不妥.
故选A.
【分析】解决能源问题有两条出路:一是要把现有的能源利用好,提高利用率;二是要积极开发新能源,寻找替代能源.特别是提高太阳能的利用率,开发新能源核能.
5.【答案】C
【解析】【解答】A.由图可知,太阳能使水分解,则实现了光能向化学能的转化,故A不符合题意;
B.过程II中生成氢气、过氧化氢,形成化学键,过程Ⅱ放出能量并生成了O O键,故B不符合题意;
C.由图可知,过程Ⅲ发生的反应为过氧化氢分解生成氢气和氧气的反应,H2O2═H2+O2,故C符合题意;
D.总反应为水分解生成氢气和氧气,则总反应2H2O→2H2+O2,故D不符合题意。
故答案为:C。
【分析】A.由图可知,该过程实现了光能向化学能的转化;
B.过程Ⅱ形成了过氧化氢,形成化学键放出热量;
D.该过程的总反应为水分解生成氢气和氧气。
6.【答案】C
【解析】【解答】①中碳完全燃烧放热多,放热越多,△H越小,即△H1<△H2;②中气态硫燃烧放热多,放热越多,△H越小,即△H1>△H2;③中碳酸钙分解吸热,氧化钙与水反应放热,则△H1>△H2;④中由于弱电解质电离吸热,所以盐酸和强碱反应放热多,放热越多,△H越小,即△H1<△H2;
故答案为:C。
【分析】①根据放热反应反应进行的越完全,放热越多,△H越小;②根据固体物质转化为气态物质,需要吸热解答;③根据吸热反应,放热反应解答;④根据弱电解质的电离需要吸热,中和反应,强酸强碱反应放热多解答;
7.【答案】A
【解析】【解答】A.降低温度,平衡向逆反应(放热反应)方向移动,将降低b路线中乙醇的转化率,符合题意
B.对比可看出,制取等量的氢气,b路线消耗的能量远大于a路线,不符合题意
D.由盖斯定律可知:2(②-①)得到:2 H2(g)+O2(g)="=2" H2O(g)△H=-483.6KJ. mol-1,不符合题意
故答案为:A
【分析】A.b反应是吸热反应,升高温度平衡向正反应方向移动;
B.b反应吸收的能量低于a反应吸收的能量;
C.淀粉水解得到葡萄糖,然后得到乙醇;
D.根据盖斯定律进行分析。
8.【答案】D
【解析】【解答】A.利用盖斯定律,C(石墨)→C(金刚石) △H=-393.51 kJ mol-1-(-395.40kJ mol-1)=1.89 kJ mol-1>0,ΔS=2.4 J k-1 mol-1-5.7 J k-1 mol-1=-3.3 J k-1 mol-1<0,A不符合题意 ;
B.物质具有的能量越低,该物质越稳定,反应C(石墨)→C(金刚石) △H>0,属于吸热反应,石墨的能量较低更稳定,B不符合题意 ;
C.ΔG=△H-TΔS=1.89 kJ mol-1-298K×(-3.3 J k-1 mol-1)×10-3kJ/J=2.8734 kJ mol-1,通常不能自发进行,C不符合题意 ;
D.反应C(石墨)→C(金刚石)是体积减小的反应,超高压条件下,石墨有可能变为金刚石,D符合题意 ;
故答案为:D
【分析】A.①C(石墨)+O2(g)=CO2(g) △H=-393.51 kJ mol-1;
②C(金刚石)+O2(g)=CO2(g) △H=-395.40kJ mol-1。
利用盖斯定律,C(石墨)→C(金刚石) △H=-393.51 kJ mol-1-(-395.40kJ mol-1)=1.89 kJ mol-1>0,ΔS=2.4 J k-1 mol-1-5.7 J k-1 mol-1=-3.3 J k-1 mol-1<0 ;
B.物质具有的能量越低,该物质越稳定;
C.ΔG=△H-TΔS>0,通常不能自发进行;
D.反应C(石墨)→C(金刚石)是体积减小的反应,超高压条件下,石墨有可能变为金刚石。
9.【答案】B
【解析】【解答】A.根据图示,反应1发生,生成物总能量大于反应物总能量,该反应为吸热反应,故A不符合题意;
B.途径A,2-a中发生反应:,途径B,反应2-b中发生反应:,故B符合题意;
C.根据图示,反应3-a和3-b中活性氧化吸附在团簇上的得到,故C不符合题意;
D.途径A中反应2-a的活化能比途径B中反应2-b的活化能低,按反应途径A更容易进行,故D不符合题意;
故答案为:B。
【分析】A.根据图像,反应生成物总能量大于反应物总能量判断;
B.依据反应物和产物的化学式分析;
C.根据图像,利用已知“*表示物质吸附在催化剂上”分析;
D.依据反应的活化能越高,反应速率越慢,反应进行的程度越小分析。
10.【答案】A
【解析】【解答】A. 根据图像数据可知,ΔH1=-29.1kJ·mol-1,ΔH2=-23.9kJ·mol-1,则ΔH1<ΔH2,A符合题意;
B.从图像数据可看出,ΔH2<0,即反应(ii)为放热反应,B不符合题意;
C. 根据盖斯定律可知,反应(ii)-反应(i)可得反应C2H4(g)+H2O(g) CH3OCH3(g),则ΔH=ΔH2-ΔH1 = -23.9kJ·mol-1-(-29.1kJ·mol-1)=+5.2kJ·mol-1,C不符合题意;
D. 若在容器中加入催化剂,降低了反应的活化能,但不会改变反应焓变,则E2-E1的差值不变,D不符合题意;
故答案为:A
【分析】A、由能量图确定反应热的大小;
B、由能量图像可知,ΔH2<0;
C、根据盖斯定律计算目标反应的反应热;
D、催化剂可降低反应所需的活化能,但不改变反应热;
11.【答案】B
【解析】【解答】解:由25℃,101kPa下,1gC8H18(辛烷)燃烧生成二氧化碳和液态水时放出48.40kJ热量,
则1molC8H18燃烧生成二氧化碳和液态水时放出热量为48.40kJ×114=5518kJ,
标明物质的聚集状态,该反应为放热反应,则
热化学反应方程式为C8H18(l)+ O2(g)═8CO2(g)+9H2O(l)△H=﹣5518kJ/mol,
故选:B.
【分析】1gC8H18(辛烷)燃烧生成二氧化碳和液态水时放出48.40kJ热量,则1mol1gC8H18燃烧生成二氧化碳和液态水时放出热量为48.40kJ×114=5518kJ,以此来解答.
12.【答案】C
【解析】【解答】燃烧热指1mol可燃物完全燃烧生成稳定的化合物所放出的热量;
A.C完全燃烧的稳定氧化物是CO2(g),故A不符合题意;
B.H2完全燃烧的稳定氧化物是液态H2O,且该反应是放热反应,焓变值为负值,故B不符合题意;
C.由C的燃烧热可得热化学方程式: ①,由H2的燃烧热可得: ②、由CH4的燃烧热可得: ③,由盖斯定律①+2×②-③可得: ,故C符合题意;
D.葡萄糖不是1mol可燃物反应产生的能量,故D不符合题意;
故答案为:C。
【分析】依据燃烧热指1mol可燃物完全燃烧生成稳定的化合物所放出的热量,判断反应的正误。
13.【答案】B
【解析】【解答】影响反应速率的根本原因是反应物的性质,同时也受外界条件的影响,例如温度、浓度、压强等,但与反应是放热反应还是吸热反应无关,B符合题意。
故答案为:B
【分析】放热反应和吸热反应和反应速率没有必然联系。
14.【答案】A
【解析】【解答】将②×2+③×2-①可得2C(s)+2H2(g)+O2(g)═CH3COOH(l),
则△H=2×(-393.5kJ/mol)+2×(-285.8kJ/mol)-(-870.3kJ/mol)=-488.3kJ/mol
故答案为:A。
【分析】利用盖斯定律,将②×2+③×2-①可得热化学方程式2C(s)+2H2(g)+O2(g)═CH3COOH(l),以此计算反应热可得答案。
15.【答案】D
【解析】【解答】A.利用焓变=生成物总能量-反应物总能量;图1所示曲线表示1molHCN(g)转化为1molHNC(g)需要吸收59.3kJ的能量,若不知道反应物的物质的量,则无法计算,A错误;
B.依据,图2所示的阴影部分面积表示物质的量浓度的改变值,B错误;
C.物质的能量越低,越稳定,由图3可知,所示曲线中状态①的物质能量高,状态②的物质的能量低,故状态②的物质稳定,C错误;
D.依据图4信息,其他条件相同时,盐酸的浓度越大,反应速率越快,反应需要的时间越短,镁条与不同浓度盐酸反应曲线,其中曲线a表示的盐酸浓度比曲线b大,D正确;
故选D。
【分析】A.利用焓变=生成物总能量-反应物总能量;
B.依据分析;
C.物质的能量越低,越稳定;
D.依据其他条件相同时,盐酸的浓度越大,反应速率越快。
16.【答案】D
【解析】【解答】蒸发1mol 液溴变Br2(g)需要吸收的能量为30kJ,根据ΔH=反应物的总键能-生成物的总键能=436+30+200-2×a = -72,解得a=369,
故答案为:D。
【分析】计算反应热有两种方式:1.键能:反应物的总键能-生成物的总键能。2.总能量:生成物的总能量-反应物的总能量。计算时要分清能量类型。
17.【答案】A
【解析】【解答】A. 根据图象,t1时刻v逆瞬间不变,v正瞬间增大,则是增大反应物浓度,故A符合题意;
B. O2的含量影响碳钢在NaCl溶液中的腐蚀速率,根据图象,腐蚀速率先增大,增大到最大后减小,说明在NaCl浓度较高时溶液中O2的浓度减少,正极反应减慢导致腐蚀速率降低,故B不符合题意;
C. 石墨能量低于金刚石能量,所以石墨转化为金刚石的反应的△H>0,故C不符合题意;
D. 图丁是一定条件下发生反应:4NH3+4NO+O2 4N2+6H2O,根据图像,以先拐先平数值大为原则,则T1>T2,升高温度,NO的体积浓度增大,平衡逆向移动,则正反应为放热反应,△H<0,故D不符合题意;
故答案为:A。
【分析】A.根据图示,增大压强应该都增大,不会出现v逆瞬间不变,因此是表示的增加反应物的浓度
B.根据即可得出,氯化钠溶液的浓度对钢铁的腐蚀其到促进作用
C.焓变=生成物的能量-反应物的能量即可判断
D.根据达到平衡的时间长短即可判断温度大小,温度越高,时间越短
18.【答案】B
【解析】【解答】解:A.气态水到液态水继续放热,所以d>c,则△H3>△H4,A不符合题意;
B.燃烧热应生成稳定氧化物,应该是液态水,燃烧热为d kJ/mol,B符合题意;
C.根据盖斯定律(①+②)/2得到:4NH3(g)+4O2(g)=2NO(g)+N2(g)+6H2O(g)△H=(-a-b)/2 kJ·mol-1,C不符合题意;
D.根据盖斯定律可知(②-③×6)即得到4NH3(g) 2N2(g)+6H2(g)△H=(6c-b) kJ·mol-1,D不符合题意。
故答案为:B。
【分析】热量大小比较看数值,放热吸热看符号,焓变大小比较全包括;燃烧热的含义在恒压下1摩尔纯物质燃烧产生稳定氧化物释放的能量,氢气的产物应是液态水。
19.【答案】(1) ;356.75
(2)
(3)减小;;22.4
【解析】【解答】(1)根据盖斯定律(①-②+4x③) 得N2H4(l)+O2 (g)=N2(g) + 2H2O (l) △H=0.5×(-1038-204-44x 4)kJ/mol-709kJ.mol-l
则N2H4(l)的燃烧热的热化学方程式为 N2H4(l)+O2(g)=N2(g)+2H2O(l) △H = -709kJ.mol-l
设N2H4中N-H键的键能为xkJ/mol,N2H4(l) + O2(g)=N2(g) + 2H2O (l)
△H =反应物总键能一生成物总键能= (4x+154+500-942-4x462)k/mol=-709k/mol,x=356.75,
故答案为: 356.75;
(2)n(N2H4)=40000g/32g/mol=1250mol,该反应中N元素化合价由-3价转化为-2价,则生成1molN2H4转移电子的物质的量为1mol x 2x[(-2) -(-3)] = 2mol,据此计算制备40kgN2H4转移电子的物质的量为1250molx2=2500mol,
故答案为:2500;
(3)根据图知,N2H4失电子和OH-反应生成N2,消耗OH-导致溶液碱性减弱,溶液的pH值减小,负极反应式为N2H4 +4OH - 4e = N2↑+4H2O,正极反应式为O2 + 2H2O + 4e = 4OH ,
n(N2H)=32g/32g/mol =1mol,根据负极反应式知,消耗1molN2H4 ,失去4mol电子,则正极上消耗1molO2,标况下氧气的体积= 1mol x 22.4L/mol = 22.4L,
故答案为:减小;N2H4 +4OH - 4e = N2↑+4H2O;22.4。
【分析】根据盖斯定律,焓变=反应物总键能一生成物总键能,分析溶液中pH的变化时,就看溶液中OH-和H+的量,标况下氧气的体积= 物质的量x 22.4L/mol。
20.【答案】(1)﹣749kJ moL﹣1
(2)2CO﹣2e﹣+3OH﹣=HCO3﹣+H2O
(3)0.056mol/(L.min);BD;变大;0.11;降低温度;K1=K2=K3<K4
【解析】【解答】解:(1)焓变=反应物键能总和﹣生成物键能总和,则反应①N2(g)+O2(g)=2NO(g)△H3=945kJ/mol+498kJ/mol﹣630kJ/mol×2=+183 kJ moL﹣1,CO的燃烧热△H2=﹣283kJ moL﹣1,即2CO(g)+O2(g)=2CO2(g)△H=﹣566kJ/mol ②,②﹣①得到2CO(g)+2NO(g) N2(g)+2CO2(g),所以2CO(g)+2NO(g) N2(g)+2CO2(g),△H1=﹣566kJ/mol﹣183 kJ moL﹣1=﹣749kJ moL﹣1,
故答案为:﹣749kJ moL﹣1;(2)CO与空气在KOH溶液中构成燃料电池中,负极上CO发生失电子的氧化反应,根据离子浓度大小关系,得到电极反应式为;2CO﹣2e﹣+3OH﹣=HCO3﹣+H2O,故答案为:2CO﹣2e﹣+3OH﹣=HCO3﹣+H2O;(3)①根据速率之比等于对应物质的化学计量数之比,v(CO)=4v(N2)=4× =0.056mol/(L.min),故答案为:0.056mol/(L.min);②A.2n正(NO2)=n逆(N2),速率之比不等于计量数之比,故错误;
B.混合气体的平均相对分子质量不变,说明气体的物质的量不变,反应达平衡状态,故正确;
C.气体密度一直不变,故错误;
D.容器内气体压强不变,反应达平衡状态,故正确;故选:BD;
③20min时,向容器中加入1.0molNO2和1.0molCO,相当于增大压强,平衡向正反应方向移动,所以二氧化氮的转化率变大,故答案为:变大;
④
4CO(g)+ 2NO2(g) N2(g)+ 4CO2(g)
初起浓度: 2 2 0 0
变化浓度: 1 0.5 0.25 1
平衡浓度: 1 1.5 0.25 1
所以K= =0.11,故答案为:0.11;
⑤t3时刻反应速率都减小,平衡正向移动,而正反应是放热反应,所以降低温度;平衡常数是温度的函数,正反应是放热反应,温度升高K值减小,其中15﹣20是增大压强,t1﹣t2是使用催化剂,t2﹣t3时降低温度,t4﹣t5时温度不变,所以K1、K2、K3、K4的大小关系为:降低温度;K1=K2=K3<K4.
【分析】(1)化学反应焓变=反应物键能总和﹣生成物键能总和计算,CO的燃烧热△H2=﹣283kJ moL﹣1,即2CO(g)+O2(g)=2CO2(g)△H=﹣566kJ/mol,根据表中数据以及盖斯定律来计算;(2)CO与空气在KOH溶液中构成燃料电池中,负极上CO发生失电子的氧化反应,根据离子存在形式确定电极反应;(3)①根据速率之比等于对应物质的化学计量数之比,v(CO)=4v(N2),由此分析解答;②达平衡状态时各组分的浓度不随时间的改变而改变;③20min时,向容器中加入1.0molNO2和1.0molCO,相当于增大压强,平衡向正反应方向移动;④化学平衡常数K等于平衡时生成物浓度幂之积比上反应物浓度幂之积;⑤t3时刻反应速率都减小,平衡正向移动,而正反应是放热反应,所以降低温度;平衡常数是温度的函数,正反应是放热反应,温度升高K值减小.
21.【答案】(1)减小;不变;CH3OH(g)+H2O(g)=CO2(g)+3H2(g)△H=+(a﹣b)kJ/mol
(2)CH3OH(g)+ O2(g)=CO2(g)+2H2O(l)△H=(2a﹣2b+3c+2d)kJ/mol
【解析】【解答】解:(1)催化剂降低反应的活化能,加快反应速率,即a减小,但催化剂不能改变活化能,即反应热△H不变,反应能量图中生成物的总能量大于反应物的总能量,则为吸热反应,由图可知,1mol 甲醇和1mol 水蒸气反应生成CO2和氢气吸收的热量为(a﹣b)kJ,反应热化学方程式为:CH3OH(g)+H2O(g)=CO2(g)+3H2(g)△H=+(a﹣b)kJ/mol;故答案为:减小; 不变;CH3OH(g)+H2O(g)=CO2(g)+3H2(g)△H=+(a﹣b)kJ/mol;(2)已知:①CH3OH(g)+ O2(g)=CO2(g)+2H2(g)△H=c kJ/mol,
②H2O(g)=H2O(l)△H=d kJ/mol,③CH3OH(g)+H2O(g)=CO2(g)+3H2(g)△H=+(a﹣b)kJ/mol;根据盖斯定律①×3﹣2×(③﹣②)可得:CH3OH(g)+ O2(g)=CO2(g)+2H2O(l)△H=(2a﹣2b+3c+2d)kJ/mol;故答案为:CH3OH(g)+ O2(g)=CO2(g)+2H2O(l)△H=(2a﹣2b+3c+2d)kJ/mol.
【分析】(1)催化剂降低反应的活化能,加快反应速率,即a减小,但催化剂不能改变活化能,即反应热△H不变.根据图象可知反应热=akJ/mol﹣bkJ/mol,所以CH3OH(g)和H2O(g)反应的热化学方程式为CH3OH(g)+H2O(g)=CO2(g)+3H2(g)△H=+(a﹣b)kJ/mol;(2)已知:①CH3OH(g)+ O2(g)=CO2(g)+2H2(g)△H=c kJ/mol,②H2O(g)=H2O(l)△H=d kJ/mol,③CH3OH(g)+H2O(g)=CO2(g)+3H2(g)△H=+(a﹣b)kJ/mol;根据盖斯定律①×3﹣2×(③﹣②)可得.
22.【答案】(1)92kJ
(2)30.67kJ
【解析】【解答】(1)反应热等于断键吸收的能量和形成化学键所放出的能量的差值,则1molN2生成NH3放出的热量=2×3×391kJ-3×436kJ-946kJ=92kJ;
(2)根据以上分析可知1molH2生成NH3放出的热量=92kJ÷3=30.67kJ。
【分析】此题考查焓变与键能之间的关系,根据反应物键能减去生成物的键能之和进行计算。
23.【答案】(1)=
(2)436.5 kJ;2N2H4(l)+N2O4(l)=3N2(g)+4H2O(g) ΔH=-873 kJ·mol-1
(3)391
【解析】【解答】(1)反应热与反应物的总能量和生成物的总能量,与反应条件无关,则光照和点燃条件的△H相同;
故答案为:=;
(2)已知:①N2(g)+2O2(g)=N2O4(l) ΔH1=-195 kJ·mol-1
②N2H4(l)+O2(g)=N2(g)+2H2O(g) ΔH2=-534 kJ·mol-1
②×2-①得:2N2H4(l)+N2O4(l)=3N2(g)+4H2O(g) ΔH=-873 kJ·mol-1,有热化学方程式可知消耗2mol的N2H4(l)放出873KJ的热量,故1 mol肼(l)与N2O4(l)完全反应生成N2和水蒸气时放出的热量为436.5 kJ,
故答案为:436.5 kJ;2N2H4(l)+N2O4(l)=3N2(g)+4H2O(g) ΔH=-873 kJ·mol-1
(3)根据图中内容,可以看出N2H4(g)+O2(g)=2N(g)+4H(g)+2O(g),△H3=2752kJ/mol 534kJ/mol=2218kJ/mol,化学反应的焓变等于产物的能量与反应物能量的差值,旧键断裂吸收能量,新键生成释放能量,设断裂1molN H键所需的能量为K,旧键断裂吸收的能量:154+4K+500=2218,解得K=391,
故答案为:391。
【分析】(1)反应热与反应物的总能量和生成物的总能量有关,与反应条件无关;
(2)根据盖斯定律进行热化学方程式的加减求解即可;
(3)依据化学反应的焓变等于产物的能量与反应物能量的差值,旧键断裂吸收能量,新键生成释放能量求解即可。
一、单选题
1.能源可划分为一次能源和二次能源,直接从自然界取得的能源称为一级能源,一次能源经过加工、转换得到的能源成为二次能源。下列能源中属于一次能源的是( )
A.氢能 B.电能 C.核能 D.水煤气
2.已知:反应 。现分别取50mL 0.50mol/L醋酸溶液与50mL 0.55mo/L NaOH溶液进行反应,用如图实验装置测定该反应的反应热,下列说法错误的是( )
A.小烧杯和大烧杯的杯口应相平
B.使用环形玻璃搅拌棒是为了使反应更充分
C.为了让反应充分进行,NaOH分三次倒入
D.该实验测得的反应热
3.二十一世纪以来,人类一直致力于新能源的开发与利用。下列属于新能源的是( )
A.煤炭 B.天然气 C.氢气 D.石油
4.石油是一种重要能源,人类正面临着石油短缺、油价上涨的困惑.以下解决能源问题的方法不当的是( )
A.用木材作燃料 B.用乙醇替代汽油
C.开发风能 D.开发地热
5.中国研究人员研制出一种新型复合光催化剂,利用太阳光在催化剂表面实现高效分解水,主要过程如下图所示。下列说法错误的是( )
A.整个过程实现了光能向化学能的转换
B.过程II有O-O单键生成并放出能量
C.过程III发生的化学反应为: 2H2O2=2H2O+O2
D.整个过程的总反应方程式为: 2H2O→H2+O2
6.下列四组热化学方程式,△H1>△H2的是( )
①C(s)+O2(g)=CO2(g) △H1 C(s)+ O2(g)=CO(g) △H2
②S(s)+O2(g)=SO2(g) △H1 S(g)+O2(g)=SO2(g) △H2
③CaCO3(s)=CaO(s)+CO2(g) △H1 CaO(s)+H2O(l)=Ca(OH)2(s) △H2
④HCl+NaOH=NaCl+H2O △H1 HCl+NH3·H2O=NH4Cl+H2O △H2
A.①③ B.①④ C.②③ D.②④
7.已知通过乙醇制取氢气有如下两条路线:
a.CH3CH2OH(g)+H2O(g)=4H2(g)+2CO(g) △H=+255.6kJ mol-1
B.CH3CH2OH(g)+1/2O2(g)=3H2(g)+2CO(g) △H=+13.8kJ mol-1
则下列说法错误的是( )
A.降低温度,可提高b路线中乙醇的转化率
B.从能量消耗的角度来看,b路线制氢更加有利
C.乙醇可通过淀粉等生物原料发酵制得,属于可再生资源
D.由a、b知:2H2(g)+O2(g)=2H2O(g) △H=-483.6kJ mol-1
8.在298K和100kPa压力下,已知金刚石和石墨的熵、燃烧热和密度分别为:
物质 S(J k-1 mol-1) △H(kJ mol-1) ρ(kg m-3)
C(石墨) 5.7 -393.51 2260
C(金刚石) 2.4 -395.40 3513
此条件下,对于反应C(石墨)→C(金刚石),下列说法正确的是( )
A.该反应的△H<0,ΔS<0
B.金刚石比石墨稳定
C.由公式ΔG=△H-TΔS可知,该反应在任何条件下都能自发进行
D.超高压条件下,石墨有可能变为金刚石
9.氢能是清洁的二次能源,水煤气的变换反应是一种重要的制氢手段,金基二元合金团簇()催化水煤气变换反应发生的氧化还原机理有A和B两种途径。(*表示物质吸附在催化剂上)
下列有关说法错误的是( )
A.反应1发生:,该反应为吸热反应
B.2-a中发生的反应与2-b中发生的反应机理相同
C.反应3-a和3-b中活性氧化吸附在团簇上的得到
D.根据图2,水煤气在上进行变换反应,按反应途径A更容易进行
10.由合成气制备二甲醚,涉及如下反应:
(i)2CH3OH(g) C2H4(g)+2H2O(g) ΔH1
(ii)2CH3OH(g) CH3OCH3(g)+H2O(g) ΔH2
能量变化如图所示:
下列说法正确的是( )
A.ΔH1<ΔH2
B.反应(ii)为吸热反应
C.C2H4(g)+H2O(g) CH3OCH3(g) ΔH=-5.2kJ·mol-1
D.若在容器中加入催化剂,则E2-E1将变小
11.已知在25℃、101kPa下,1gC8H18(辛烷)燃烧生成二氧化碳和液态水时放出48.40kJ热量.表示上述反应的热化学方程式正确的是( )
A.C8H18(1)+ O2(g)═8CO2(g)+9H2O(g)△H=﹣48.40kJ mol﹣1
B.C8H18(1)+ O2(g)═8CO2(g)+9H2O(1)△H=﹣5518kJ mol﹣1
C.C8H18(1)+ O2(g)═8CO2(g)+9H2O(1)△H=+5518kJ mol﹣1
D.C8H18(1)+ O2(g)═8CO2(g)+9H2O(1)△H=﹣48.40kJ mol﹣1
12.25℃、 下,碳、氡气、甲烷和葡萄糖(C6H12O6)的燃烧热依次是 、 、 、 ,则下列热化学方程式正确的是( )
A.
B.
C.
D.
13.下列与化学反应原理相关的叙述错误的是()
A.放热反应中生成物总能量一定低于反应物总能量
B.放热反应的反应速率总是大于吸热反应的反应速率
C.盖斯定律实质上是能量守恒定律的体现
D.电离平衡、水解平衡和沉淀溶解平衡均为动态平衡
14.已知下列反应的热化学方程式为:( )
①CH3COOH(l)+2O2(g)=2CO2(g)+2H2O(l) ΔH1=-870.3 kJ·mol-1
②C(s)+O2(g)=CO2(g) ΔH2=-393.5 kJ·mol-1
③H2(g)+1/2O2(g)=H2O(l) ΔH3=-285.8 kJ·mol-1
则反应2C(s)+2H2(g)+O2(g)=CH3COOH(l)的ΔH(单位为kJ·mol-1)为:
A.-488.3 B.-191 C.-476.8 D.-1 549.6
15.下列图示与对应的叙述正确的是( )
A.图1所示曲线表示HCN(g)转化为HNC(g)需要吸收59.3kJ的能量
B.图2所示的阴影部分面积可表示正反应速率的改变值
C.图3所示曲线中状态①的物质比状态②的物质稳定
D.图4是其他条件相同时,镁条与不同浓度盐酸反应曲线,其中曲线a表示的盐酸浓度比曲线b大
16.已知H2(g)+Br2(l)=2HBr(g) ΔH=-72kJ·mol-1,蒸发1mol Br2(l)需要吸收的能量为30kJ,其他相关数据如下表:
化学键 H-H Br-Br H-Br
键能(kJ·mol-1) 436 200 a
表中a的数值为( )
A.267 B.339 C.354 D.369
17.根据下列图示所得出的结论错误的是( )
A.图甲表示2SO2(g)+O2(g) 2SO3(s)△H<0,t1时改变的条件是增大体系的压强
B.图乙NaCl溶液浓度过高铁腐蚀速率降低,说明NaCl浓度越大溶液中O2的浓度越小
C.图丙说明石墨转化为金刚石的反应的△H>0
D.图丁是一定条件下发生反应:4NH3+4NO+O2 4N2+6H2O,此过程△H<0
18.已知:①4NH3(g)+5O2(g)=4NO(g)+6H2O(g)△H1=-akJ·mol-1
②4NH3(g)+3O2(g)=2N2(g)+6H2O(g)△H2=-bkJ·mol-1
③H2(g)+1/2O2(g)=H2O(g)△H3=-ckJ·mol-1
④H2(g)+1/2O2(g)=H2O(l)△H4=-dkJ·mol-1
下列叙述正确的是( )
A.由上述热化学方程式可知△H3<△H4
B.H2的燃烧热为dkJ·mol-1
C.4NH3(g)+4O2(g)=2NO(g)+N2(g)+6H2O(g)△H=(-a-b)kJ·mol-1
D.4NH3(g) 2N2(g)+6H2(g)△H=(6d-b)kJ·mol-1
二、综合题
19.联氨()又称肼,是一种应用广泛的化工原料,常用作火箭和燃料电池的燃料。回答下列问题:
(1)已知:①
②
③
写出常温下燃烧生成氮气和液态水的热化学方程式 。
已知部分键能数据如下:
化学键
键能/ 942 500 154 462
则断裂中键所需的能量是 kJ。
(2)工业上一种制备联氨的方法为,若制备,转移电子的物质的量为 mol。
(3)一种联氨燃料电池的工作原理如图所示。放电一段时间,电解质溶液的pH (填“增大”、“减小”或“不变”),负极反应式为 ,若电池工作时消耗,则消耗氧气的体积为 L(标准状况)。
20.汽车尾气中排放的NxOy和CO,科学家寻找高效催化剂实现大气污染物转化:
2CO(g)+2NO(g) N2(g)+2CO2(g)△H1
(1)已知:CO的燃烧热△H2=﹣283kJ moL﹣1.几种化学键的键能数据如下:
化学键 N≡N键 O=O键 N O键
键能kJ/ mol﹣1 945 498 630
已知:N2(g)+O2(g)=2NO(g)△H3,则:△H1= .
(2)CO与空气在KOH溶液中构成燃料电池(石墨为电极),若放电后电解质溶液中离子浓度大小顺序为
c(K+)>c(HCO3﹣)>c(OH﹣)>c(H+)>c(CO32﹣),则负极的反应式为 ;
(3)在一定温度下,向2L的密闭容器中充入4.0molNO2和4.0molCO,在催化剂作用下发生反应
4CO(g)+2NO2(g) N2(g)+4CO2(g)△H<0,相关数据如下:
0min 5min 10min 15min 20min
c(NO2) 2.0 1.7 1.56 1.5 1.5
c(N2) 0 0.15 0.22 0.25 0.25
①5~10min,用CO的浓度变化表示的反应速率为:
②能说明上述反应达到平衡状态的是
A.2n正(NO2)=n逆(N2) B.混合气体的平均相对分子质量不变
C.气体密度不变D.容器内气体压强不变
③20min时,向容器中加入1.0molNO2和1.0molCO,在t1时刻再次达到平衡时,NO2的转化率比原平衡时 (填“变大”、“变小”或“不变”).
④计算此温度下的化学平衡常数K=
⑤在上述平衡的基础上,在时间t2、t3时改变反应的某一条件,反应速率的变化如图所示,则在t3时刻改变的反应条件是: ;在时间15﹣20,t1﹣t2,t2﹣t3,t4﹣t5时的平衡常数分别为K1、K2、K3、K4,请比较各平衡常数的大小关系: .
21.参考如图,按要求回答下列问题:
(1)甲醇质子交换膜燃料电池将甲醇蒸气转化为氢气的一种原理是CH3OH(g)和H2O反应生成CO2和H2.若在反应体系中加入催化剂,反应速率增大,正反应活化能 a的变化是 (填“增大”、“减小”、“不变”),反应热△H的变化是 (填“增大”、“减小”、“不变”).请写出CH3OH(g)和H2O(g)反应的热化学方程式 .
(2)甲醇质子交换膜燃料电池中将甲醇蒸气转化为氢气的另一种反应原理是:
CH3OH(g)+ O2(g) CO2(g)+2H2(g)△H=﹣c kJ/mol
又知H2O(g) H2O(l)△H=﹣d kJ/mol.
则甲醇燃烧热的热化学方程式为 .
22.拆开1molHH键,1molNH键,1molN≡N键分别需要吸收的能量为436kJ、391kJ、946kJ,求:
(1)1molN2生成NH3放出的热量 。
(2)1molH2生成NH3放出的热量(不考虑可逆反应) 。
23.
(1)Ⅰ.同温同压下,H2(g)+Cl2(g)=2HCl(g),在光照和点燃条件下的ΔH(化学计量数相同)分别为ΔH1、ΔH2,则ΔH1 ΔH2。
(2)Ⅱ.肼(N2H4)可作为火箭发动机的燃料。
肼(N2H4)与氧化剂N2O4(l)反应生成N2和水蒸气。已知:
①N2(g)+2O2(g)=N2O4(l) ΔH1=-195 kJ·mol-1
②N2H4(l)+O2(g)=N2(g)+2H2O(g) ΔH2=-534 kJ·mol-1
试计算1 mol肼(l)与N2O4(l)完全反应生成N2和水蒸气时放出的热量为 ,写出肼(l)和N2O4(l)反应的热化学方程式: 。
(3)有关肼化学反应的能量变化如图所示,已知断裂1 mol化学键所需的能量(kJ):
N≡N为942、O=O为500、N—N为154,则断裂1 mol N—H键所需的能量是 kJ。
答案解析部分
1.【答案】C
【解析】【解答】A.氢能无法直接从自然界中获取,不属于一次能源,A不符合题意;
B.电能不能直接从自然界中获取,不属于一次能源,B不符合题意;
C.核能能够直接从自然界中获取,属于一次能源,C符合题意;
D.水煤气的主要成分是CO和H2,不能直接从自然界获取,不属于一次能源,D不符合题意;
故答案为:C
【分析】根据一次能源和二次能源的定义进行分析。
2.【答案】C
【解析】【解答】A.两烧杯的杯口应该平齐,便于塑料板密封防止热量散失,A项不符合题意;
B.使用环形玻璃搅拌棒搅拌使物质充分混合反应刚充分,B项不符合题意;
C.为了防止热量散失,应快速将NaOH倒入且一次性倒入,C项符合题意;
D.醋酸电离吸热,所以消耗一部分能量,ΔH> 57.3kJ/mol,D项不符合题意;
故答案为:C。
【分析】中和热测定的实验中要注意, 小烧杯和大烧杯的杯口应相平,两烧杯之间应填充满岁泡沫塑料,倾倒溶液的时候应一次性倒入,且使用环形玻璃搅拌棒进行搅拌混合。
3.【答案】C
【解析】【解答】新能源包括太阳能、核能、风能、氢能等;而煤、石油、天然气是化石燃料,属于常规能源,
故答案为C。
【分析】注意化石燃料燃烧后产生大量的二氧化碳,不属于新能源。
4.【答案】A
【解析】【解答】解:石油虽然是﹣种重要能源,但是毕竟石油是不可再生的能源,人类正面临着石油短缺、油价上涨的等等困惑.所以寻求新能源是当务之急.所以目前综合利用太阳能、风能、地热等新能源,乙醇属于生物质能,是可再生资源,不仅可以弥补能源的危机,而且发展前景非常大.但是乱砍伐树木,不仅导致水土流失,而且破坏生态环境,温室效应加急等等,弊大于利,此法不妥.故只有选项A不妥.
故选A.
【分析】解决能源问题有两条出路:一是要把现有的能源利用好,提高利用率;二是要积极开发新能源,寻找替代能源.特别是提高太阳能的利用率,开发新能源核能.
5.【答案】C
【解析】【解答】A.由图可知,太阳能使水分解,则实现了光能向化学能的转化,故A不符合题意;
B.过程II中生成氢气、过氧化氢,形成化学键,过程Ⅱ放出能量并生成了O O键,故B不符合题意;
C.由图可知,过程Ⅲ发生的反应为过氧化氢分解生成氢气和氧气的反应,H2O2═H2+O2,故C符合题意;
D.总反应为水分解生成氢气和氧气,则总反应2H2O→2H2+O2,故D不符合题意。
故答案为:C。
【分析】A.由图可知,该过程实现了光能向化学能的转化;
B.过程Ⅱ形成了过氧化氢,形成化学键放出热量;
D.该过程的总反应为水分解生成氢气和氧气。
6.【答案】C
【解析】【解答】①中碳完全燃烧放热多,放热越多,△H越小,即△H1<△H2;②中气态硫燃烧放热多,放热越多,△H越小,即△H1>△H2;③中碳酸钙分解吸热,氧化钙与水反应放热,则△H1>△H2;④中由于弱电解质电离吸热,所以盐酸和强碱反应放热多,放热越多,△H越小,即△H1<△H2;
故答案为:C。
【分析】①根据放热反应反应进行的越完全,放热越多,△H越小;②根据固体物质转化为气态物质,需要吸热解答;③根据吸热反应,放热反应解答;④根据弱电解质的电离需要吸热,中和反应,强酸强碱反应放热多解答;
7.【答案】A
【解析】【解答】A.降低温度,平衡向逆反应(放热反应)方向移动,将降低b路线中乙醇的转化率,符合题意
B.对比可看出,制取等量的氢气,b路线消耗的能量远大于a路线,不符合题意
D.由盖斯定律可知:2(②-①)得到:2 H2(g)+O2(g)="=2" H2O(g)△H=-483.6KJ. mol-1,不符合题意
故答案为:A
【分析】A.b反应是吸热反应,升高温度平衡向正反应方向移动;
B.b反应吸收的能量低于a反应吸收的能量;
C.淀粉水解得到葡萄糖,然后得到乙醇;
D.根据盖斯定律进行分析。
8.【答案】D
【解析】【解答】A.利用盖斯定律,C(石墨)→C(金刚石) △H=-393.51 kJ mol-1-(-395.40kJ mol-1)=1.89 kJ mol-1>0,ΔS=2.4 J k-1 mol-1-5.7 J k-1 mol-1=-3.3 J k-1 mol-1<0,A不符合题意 ;
B.物质具有的能量越低,该物质越稳定,反应C(石墨)→C(金刚石) △H>0,属于吸热反应,石墨的能量较低更稳定,B不符合题意 ;
C.ΔG=△H-TΔS=1.89 kJ mol-1-298K×(-3.3 J k-1 mol-1)×10-3kJ/J=2.8734 kJ mol-1,通常不能自发进行,C不符合题意 ;
D.反应C(石墨)→C(金刚石)是体积减小的反应,超高压条件下,石墨有可能变为金刚石,D符合题意 ;
故答案为:D
【分析】A.①C(石墨)+O2(g)=CO2(g) △H=-393.51 kJ mol-1;
②C(金刚石)+O2(g)=CO2(g) △H=-395.40kJ mol-1。
利用盖斯定律,C(石墨)→C(金刚石) △H=-393.51 kJ mol-1-(-395.40kJ mol-1)=1.89 kJ mol-1>0,ΔS=2.4 J k-1 mol-1-5.7 J k-1 mol-1=-3.3 J k-1 mol-1<0 ;
B.物质具有的能量越低,该物质越稳定;
C.ΔG=△H-TΔS>0,通常不能自发进行;
D.反应C(石墨)→C(金刚石)是体积减小的反应,超高压条件下,石墨有可能变为金刚石。
9.【答案】B
【解析】【解答】A.根据图示,反应1发生,生成物总能量大于反应物总能量,该反应为吸热反应,故A不符合题意;
B.途径A,2-a中发生反应:,途径B,反应2-b中发生反应:,故B符合题意;
C.根据图示,反应3-a和3-b中活性氧化吸附在团簇上的得到,故C不符合题意;
D.途径A中反应2-a的活化能比途径B中反应2-b的活化能低,按反应途径A更容易进行,故D不符合题意;
故答案为:B。
【分析】A.根据图像,反应生成物总能量大于反应物总能量判断;
B.依据反应物和产物的化学式分析;
C.根据图像,利用已知“*表示物质吸附在催化剂上”分析;
D.依据反应的活化能越高,反应速率越慢,反应进行的程度越小分析。
10.【答案】A
【解析】【解答】A. 根据图像数据可知,ΔH1=-29.1kJ·mol-1,ΔH2=-23.9kJ·mol-1,则ΔH1<ΔH2,A符合题意;
B.从图像数据可看出,ΔH2<0,即反应(ii)为放热反应,B不符合题意;
C. 根据盖斯定律可知,反应(ii)-反应(i)可得反应C2H4(g)+H2O(g) CH3OCH3(g),则ΔH=ΔH2-ΔH1 = -23.9kJ·mol-1-(-29.1kJ·mol-1)=+5.2kJ·mol-1,C不符合题意;
D. 若在容器中加入催化剂,降低了反应的活化能,但不会改变反应焓变,则E2-E1的差值不变,D不符合题意;
故答案为:A
【分析】A、由能量图确定反应热的大小;
B、由能量图像可知,ΔH2<0;
C、根据盖斯定律计算目标反应的反应热;
D、催化剂可降低反应所需的活化能,但不改变反应热;
11.【答案】B
【解析】【解答】解:由25℃,101kPa下,1gC8H18(辛烷)燃烧生成二氧化碳和液态水时放出48.40kJ热量,
则1molC8H18燃烧生成二氧化碳和液态水时放出热量为48.40kJ×114=5518kJ,
标明物质的聚集状态,该反应为放热反应,则
热化学反应方程式为C8H18(l)+ O2(g)═8CO2(g)+9H2O(l)△H=﹣5518kJ/mol,
故选:B.
【分析】1gC8H18(辛烷)燃烧生成二氧化碳和液态水时放出48.40kJ热量,则1mol1gC8H18燃烧生成二氧化碳和液态水时放出热量为48.40kJ×114=5518kJ,以此来解答.
12.【答案】C
【解析】【解答】燃烧热指1mol可燃物完全燃烧生成稳定的化合物所放出的热量;
A.C完全燃烧的稳定氧化物是CO2(g),故A不符合题意;
B.H2完全燃烧的稳定氧化物是液态H2O,且该反应是放热反应,焓变值为负值,故B不符合题意;
C.由C的燃烧热可得热化学方程式: ①,由H2的燃烧热可得: ②、由CH4的燃烧热可得: ③,由盖斯定律①+2×②-③可得: ,故C符合题意;
D.葡萄糖不是1mol可燃物反应产生的能量,故D不符合题意;
故答案为:C。
【分析】依据燃烧热指1mol可燃物完全燃烧生成稳定的化合物所放出的热量,判断反应的正误。
13.【答案】B
【解析】【解答】影响反应速率的根本原因是反应物的性质,同时也受外界条件的影响,例如温度、浓度、压强等,但与反应是放热反应还是吸热反应无关,B符合题意。
故答案为:B
【分析】放热反应和吸热反应和反应速率没有必然联系。
14.【答案】A
【解析】【解答】将②×2+③×2-①可得2C(s)+2H2(g)+O2(g)═CH3COOH(l),
则△H=2×(-393.5kJ/mol)+2×(-285.8kJ/mol)-(-870.3kJ/mol)=-488.3kJ/mol
故答案为:A。
【分析】利用盖斯定律,将②×2+③×2-①可得热化学方程式2C(s)+2H2(g)+O2(g)═CH3COOH(l),以此计算反应热可得答案。
15.【答案】D
【解析】【解答】A.利用焓变=生成物总能量-反应物总能量;图1所示曲线表示1molHCN(g)转化为1molHNC(g)需要吸收59.3kJ的能量,若不知道反应物的物质的量,则无法计算,A错误;
B.依据,图2所示的阴影部分面积表示物质的量浓度的改变值,B错误;
C.物质的能量越低,越稳定,由图3可知,所示曲线中状态①的物质能量高,状态②的物质的能量低,故状态②的物质稳定,C错误;
D.依据图4信息,其他条件相同时,盐酸的浓度越大,反应速率越快,反应需要的时间越短,镁条与不同浓度盐酸反应曲线,其中曲线a表示的盐酸浓度比曲线b大,D正确;
故选D。
【分析】A.利用焓变=生成物总能量-反应物总能量;
B.依据分析;
C.物质的能量越低,越稳定;
D.依据其他条件相同时,盐酸的浓度越大,反应速率越快。
16.【答案】D
【解析】【解答】蒸发1mol 液溴变Br2(g)需要吸收的能量为30kJ,根据ΔH=反应物的总键能-生成物的总键能=436+30+200-2×a = -72,解得a=369,
故答案为:D。
【分析】计算反应热有两种方式:1.键能:反应物的总键能-生成物的总键能。2.总能量:生成物的总能量-反应物的总能量。计算时要分清能量类型。
17.【答案】A
【解析】【解答】A. 根据图象,t1时刻v逆瞬间不变,v正瞬间增大,则是增大反应物浓度,故A符合题意;
B. O2的含量影响碳钢在NaCl溶液中的腐蚀速率,根据图象,腐蚀速率先增大,增大到最大后减小,说明在NaCl浓度较高时溶液中O2的浓度减少,正极反应减慢导致腐蚀速率降低,故B不符合题意;
C. 石墨能量低于金刚石能量,所以石墨转化为金刚石的反应的△H>0,故C不符合题意;
D. 图丁是一定条件下发生反应:4NH3+4NO+O2 4N2+6H2O,根据图像,以先拐先平数值大为原则,则T1>T2,升高温度,NO的体积浓度增大,平衡逆向移动,则正反应为放热反应,△H<0,故D不符合题意;
故答案为:A。
【分析】A.根据图示,增大压强应该都增大,不会出现v逆瞬间不变,因此是表示的增加反应物的浓度
B.根据即可得出,氯化钠溶液的浓度对钢铁的腐蚀其到促进作用
C.焓变=生成物的能量-反应物的能量即可判断
D.根据达到平衡的时间长短即可判断温度大小,温度越高,时间越短
18.【答案】B
【解析】【解答】解:A.气态水到液态水继续放热,所以d>c,则△H3>△H4,A不符合题意;
B.燃烧热应生成稳定氧化物,应该是液态水,燃烧热为d kJ/mol,B符合题意;
C.根据盖斯定律(①+②)/2得到:4NH3(g)+4O2(g)=2NO(g)+N2(g)+6H2O(g)△H=(-a-b)/2 kJ·mol-1,C不符合题意;
D.根据盖斯定律可知(②-③×6)即得到4NH3(g) 2N2(g)+6H2(g)△H=(6c-b) kJ·mol-1,D不符合题意。
故答案为:B。
【分析】热量大小比较看数值,放热吸热看符号,焓变大小比较全包括;燃烧热的含义在恒压下1摩尔纯物质燃烧产生稳定氧化物释放的能量,氢气的产物应是液态水。
19.【答案】(1) ;356.75
(2)
(3)减小;;22.4
【解析】【解答】(1)根据盖斯定律(①-②+4x③) 得N2H4(l)+O2 (g)=N2(g) + 2H2O (l) △H=0.5×(-1038-204-44x 4)kJ/mol-709kJ.mol-l
则N2H4(l)的燃烧热的热化学方程式为 N2H4(l)+O2(g)=N2(g)+2H2O(l) △H = -709kJ.mol-l
设N2H4中N-H键的键能为xkJ/mol,N2H4(l) + O2(g)=N2(g) + 2H2O (l)
△H =反应物总键能一生成物总键能= (4x+154+500-942-4x462)k/mol=-709k/mol,x=356.75,
故答案为: 356.75;
(2)n(N2H4)=40000g/32g/mol=1250mol,该反应中N元素化合价由-3价转化为-2价,则生成1molN2H4转移电子的物质的量为1mol x 2x[(-2) -(-3)] = 2mol,据此计算制备40kgN2H4转移电子的物质的量为1250molx2=2500mol,
故答案为:2500;
(3)根据图知,N2H4失电子和OH-反应生成N2,消耗OH-导致溶液碱性减弱,溶液的pH值减小,负极反应式为N2H4 +4OH - 4e = N2↑+4H2O,正极反应式为O2 + 2H2O + 4e = 4OH ,
n(N2H)=32g/32g/mol =1mol,根据负极反应式知,消耗1molN2H4 ,失去4mol电子,则正极上消耗1molO2,标况下氧气的体积= 1mol x 22.4L/mol = 22.4L,
故答案为:减小;N2H4 +4OH - 4e = N2↑+4H2O;22.4。
【分析】根据盖斯定律,焓变=反应物总键能一生成物总键能,分析溶液中pH的变化时,就看溶液中OH-和H+的量,标况下氧气的体积= 物质的量x 22.4L/mol。
20.【答案】(1)﹣749kJ moL﹣1
(2)2CO﹣2e﹣+3OH﹣=HCO3﹣+H2O
(3)0.056mol/(L.min);BD;变大;0.11;降低温度;K1=K2=K3<K4
【解析】【解答】解:(1)焓变=反应物键能总和﹣生成物键能总和,则反应①N2(g)+O2(g)=2NO(g)△H3=945kJ/mol+498kJ/mol﹣630kJ/mol×2=+183 kJ moL﹣1,CO的燃烧热△H2=﹣283kJ moL﹣1,即2CO(g)+O2(g)=2CO2(g)△H=﹣566kJ/mol ②,②﹣①得到2CO(g)+2NO(g) N2(g)+2CO2(g),所以2CO(g)+2NO(g) N2(g)+2CO2(g),△H1=﹣566kJ/mol﹣183 kJ moL﹣1=﹣749kJ moL﹣1,
故答案为:﹣749kJ moL﹣1;(2)CO与空气在KOH溶液中构成燃料电池中,负极上CO发生失电子的氧化反应,根据离子浓度大小关系,得到电极反应式为;2CO﹣2e﹣+3OH﹣=HCO3﹣+H2O,故答案为:2CO﹣2e﹣+3OH﹣=HCO3﹣+H2O;(3)①根据速率之比等于对应物质的化学计量数之比,v(CO)=4v(N2)=4× =0.056mol/(L.min),故答案为:0.056mol/(L.min);②A.2n正(NO2)=n逆(N2),速率之比不等于计量数之比,故错误;
B.混合气体的平均相对分子质量不变,说明气体的物质的量不变,反应达平衡状态,故正确;
C.气体密度一直不变,故错误;
D.容器内气体压强不变,反应达平衡状态,故正确;故选:BD;
③20min时,向容器中加入1.0molNO2和1.0molCO,相当于增大压强,平衡向正反应方向移动,所以二氧化氮的转化率变大,故答案为:变大;
④
4CO(g)+ 2NO2(g) N2(g)+ 4CO2(g)
初起浓度: 2 2 0 0
变化浓度: 1 0.5 0.25 1
平衡浓度: 1 1.5 0.25 1
所以K= =0.11,故答案为:0.11;
⑤t3时刻反应速率都减小,平衡正向移动,而正反应是放热反应,所以降低温度;平衡常数是温度的函数,正反应是放热反应,温度升高K值减小,其中15﹣20是增大压强,t1﹣t2是使用催化剂,t2﹣t3时降低温度,t4﹣t5时温度不变,所以K1、K2、K3、K4的大小关系为:降低温度;K1=K2=K3<K4.
【分析】(1)化学反应焓变=反应物键能总和﹣生成物键能总和计算,CO的燃烧热△H2=﹣283kJ moL﹣1,即2CO(g)+O2(g)=2CO2(g)△H=﹣566kJ/mol,根据表中数据以及盖斯定律来计算;(2)CO与空气在KOH溶液中构成燃料电池中,负极上CO发生失电子的氧化反应,根据离子存在形式确定电极反应;(3)①根据速率之比等于对应物质的化学计量数之比,v(CO)=4v(N2),由此分析解答;②达平衡状态时各组分的浓度不随时间的改变而改变;③20min时,向容器中加入1.0molNO2和1.0molCO,相当于增大压强,平衡向正反应方向移动;④化学平衡常数K等于平衡时生成物浓度幂之积比上反应物浓度幂之积;⑤t3时刻反应速率都减小,平衡正向移动,而正反应是放热反应,所以降低温度;平衡常数是温度的函数,正反应是放热反应,温度升高K值减小.
21.【答案】(1)减小;不变;CH3OH(g)+H2O(g)=CO2(g)+3H2(g)△H=+(a﹣b)kJ/mol
(2)CH3OH(g)+ O2(g)=CO2(g)+2H2O(l)△H=(2a﹣2b+3c+2d)kJ/mol
【解析】【解答】解:(1)催化剂降低反应的活化能,加快反应速率,即a减小,但催化剂不能改变活化能,即反应热△H不变,反应能量图中生成物的总能量大于反应物的总能量,则为吸热反应,由图可知,1mol 甲醇和1mol 水蒸气反应生成CO2和氢气吸收的热量为(a﹣b)kJ,反应热化学方程式为:CH3OH(g)+H2O(g)=CO2(g)+3H2(g)△H=+(a﹣b)kJ/mol;故答案为:减小; 不变;CH3OH(g)+H2O(g)=CO2(g)+3H2(g)△H=+(a﹣b)kJ/mol;(2)已知:①CH3OH(g)+ O2(g)=CO2(g)+2H2(g)△H=c kJ/mol,
②H2O(g)=H2O(l)△H=d kJ/mol,③CH3OH(g)+H2O(g)=CO2(g)+3H2(g)△H=+(a﹣b)kJ/mol;根据盖斯定律①×3﹣2×(③﹣②)可得:CH3OH(g)+ O2(g)=CO2(g)+2H2O(l)△H=(2a﹣2b+3c+2d)kJ/mol;故答案为:CH3OH(g)+ O2(g)=CO2(g)+2H2O(l)△H=(2a﹣2b+3c+2d)kJ/mol.
【分析】(1)催化剂降低反应的活化能,加快反应速率,即a减小,但催化剂不能改变活化能,即反应热△H不变.根据图象可知反应热=akJ/mol﹣bkJ/mol,所以CH3OH(g)和H2O(g)反应的热化学方程式为CH3OH(g)+H2O(g)=CO2(g)+3H2(g)△H=+(a﹣b)kJ/mol;(2)已知:①CH3OH(g)+ O2(g)=CO2(g)+2H2(g)△H=c kJ/mol,②H2O(g)=H2O(l)△H=d kJ/mol,③CH3OH(g)+H2O(g)=CO2(g)+3H2(g)△H=+(a﹣b)kJ/mol;根据盖斯定律①×3﹣2×(③﹣②)可得.
22.【答案】(1)92kJ
(2)30.67kJ
【解析】【解答】(1)反应热等于断键吸收的能量和形成化学键所放出的能量的差值,则1molN2生成NH3放出的热量=2×3×391kJ-3×436kJ-946kJ=92kJ;
(2)根据以上分析可知1molH2生成NH3放出的热量=92kJ÷3=30.67kJ。
【分析】此题考查焓变与键能之间的关系,根据反应物键能减去生成物的键能之和进行计算。
23.【答案】(1)=
(2)436.5 kJ;2N2H4(l)+N2O4(l)=3N2(g)+4H2O(g) ΔH=-873 kJ·mol-1
(3)391
【解析】【解答】(1)反应热与反应物的总能量和生成物的总能量,与反应条件无关,则光照和点燃条件的△H相同;
故答案为:=;
(2)已知:①N2(g)+2O2(g)=N2O4(l) ΔH1=-195 kJ·mol-1
②N2H4(l)+O2(g)=N2(g)+2H2O(g) ΔH2=-534 kJ·mol-1
②×2-①得:2N2H4(l)+N2O4(l)=3N2(g)+4H2O(g) ΔH=-873 kJ·mol-1,有热化学方程式可知消耗2mol的N2H4(l)放出873KJ的热量,故1 mol肼(l)与N2O4(l)完全反应生成N2和水蒸气时放出的热量为436.5 kJ,
故答案为:436.5 kJ;2N2H4(l)+N2O4(l)=3N2(g)+4H2O(g) ΔH=-873 kJ·mol-1
(3)根据图中内容,可以看出N2H4(g)+O2(g)=2N(g)+4H(g)+2O(g),△H3=2752kJ/mol 534kJ/mol=2218kJ/mol,化学反应的焓变等于产物的能量与反应物能量的差值,旧键断裂吸收能量,新键生成释放能量,设断裂1molN H键所需的能量为K,旧键断裂吸收的能量:154+4K+500=2218,解得K=391,
故答案为:391。
【分析】(1)反应热与反应物的总能量和生成物的总能量有关,与反应条件无关;
(2)根据盖斯定律进行热化学方程式的加减求解即可;
(3)依据化学反应的焓变等于产物的能量与反应物能量的差值,旧键断裂吸收能量,新键生成释放能量求解即可。
同课章节目录
- 第1章 化学反应与能量转化
- 第1节 化学反应的热效应
- 第2节 化学能转化为电能——电池
- 第3节 电能转化为化学能——电解
- 第4节 金属的腐蚀与防护
- 微项目 设计载人航天器用化学电池与氧气再生方案——化学反应中能量及物质的转化利用
- 第2章 化学反应的方向、 限度与速率
- 第1节 化学反应的方向
- 第2节 化学反应的限度
- 第3节 化学反应的速率
- 第4节 化学反应条件的优化——工业合成氨
- 微项目 探讨如何利用工业废气中的二氧化碳合成甲醇——化学反应选择与反应条件优化
- 第3章 物质在水溶液中的行为
- 第1节 水与水溶液
- 第2节 弱电解质的电离 盐类的水解
- 第3节 沉淀溶解平衡
- 第4节 离子反应
- 微项目 揭秘索尔维制碱法和侯氏制碱法——化学平衡思想的创造性应用
