3.3.2 氨的转化 课件(共24张PPT) 2023-2024学年高一化学鲁科版(2029)必修第一册
文档属性
| 名称 | 3.3.2 氨的转化 课件(共24张PPT) 2023-2024学年高一化学鲁科版(2029)必修第一册 |  | |
| 格式 | pptx | ||
| 文件大小 | 717.4KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-11-21 13:54:18 | ||
图片预览







文档简介
(共24张PPT)
第3章 物质的性质与转化
第3节 氮的循环
第2课时 氨的转化
2.氨的转化与生成
氨是无色、有刺激性气味的气体;在标准状况下,密度比空气小,为 0.771 g·L-1;极易溶于水且能快速溶解,常温、常压下1体积水能溶解约 700 体积氨气。
氨是氮循环中的重要物质,在人类的生产和生活中有着广泛的应用。氨易液化,液氨汽化时要吸收大量的热,因此氨可用作制冷剂。氨是氮肥工业和硝酸工业的重要原料。化学氮肥主要包括铵态氮肥(主要成分头NH )、硝态氮肥(主要成分为 NO ) 和有机态肥——尿素[CO(NH2)2]。
氨元素是植物体内氨基酸和蛋白质必需的组成元素,也是叶绿素的组成成分之一,因此施用氮肥能够促进作物生长,并提高作物中蛋白质的含量。
玉米植株缺氮时,叶绿素含量下降,叶片黄化
缺氮的玉米植株
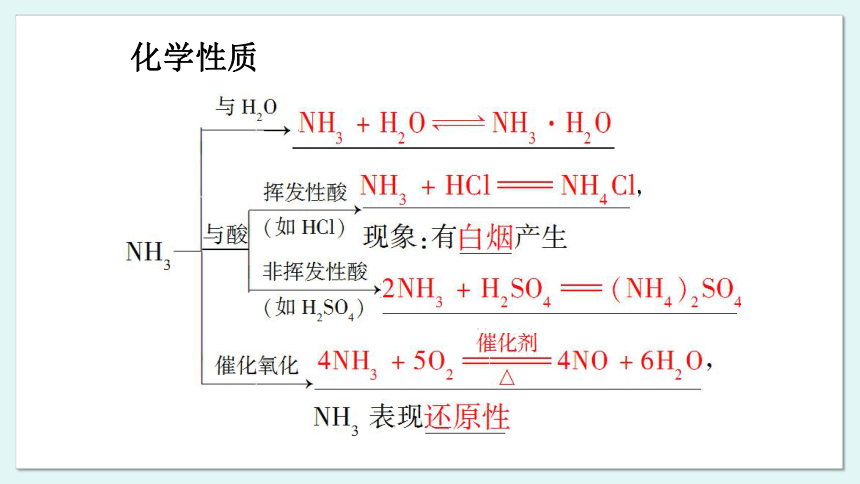
化学性质
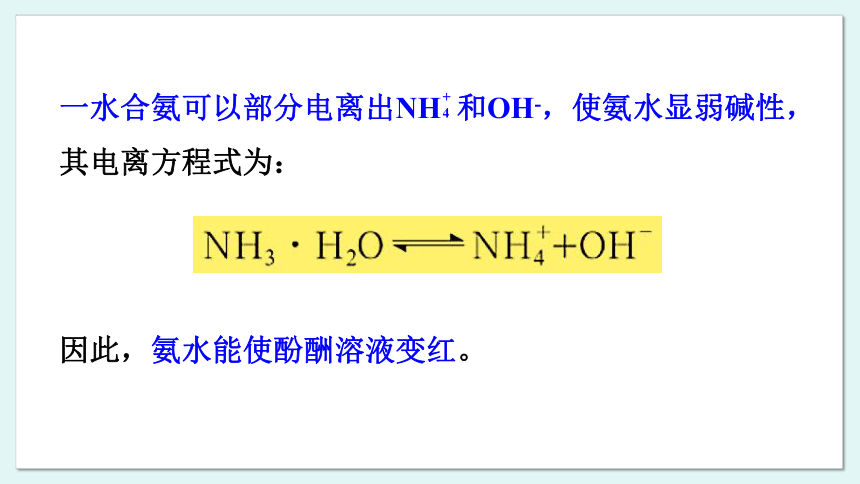
氨溶于水时能与水发生反应生成一水合氨(NH3·H2O),氨水显弱碱性。氨不仅能与水发生反应,还能与酸发生反应生成铵盐,如与盐酸(或氯化氢)反应生成氯化铵(NH4CI)。利用这些性质可以把氨气转化为氨水、铵盐。在这类转化中,氮元素的化合价没有改变,实现的是物质类别的转化。
一水合氨可以部分电离出NH 和OH-,使氨水显弱碱性,其电离方程式为:
因此,氨水能使酚酬溶液变红。
氨溶于水
氨的喷泉实验
氨与氯化氢的反应
氨中氮元素的化合价为最低价,因此氨具有还原性,能与具有氧化性的物质发生反应。工业上利用氨在催化剂(如铂、铑等 ) 存在的情况下与氧气的反应来制备生产硝酸所需要的一氧化氮。
实验表明,通过加热碳酸氢铵、氯化铵等盐能够产生氨气。
铵盐与碱溶液共热也可以产生氨气,实验室里常用这种方法检验溶液中的铵离子。
在实验室里常用氯化铵与氢氧化钙反应制取少量氨气,用向下排空气法收集氨气,并用湿润的红色石蕊试纸检验氨气是否收集满。
加热碳酸氢铵固体
氯化铵固体与NaOH溶液的反应
实验室制取氨气并检验氨气是否收集满
氨气的实验室制法
1.反应原理: 。
2.验满方法
(1)使湿润的红色石蕊试纸 。
(2)蘸有浓盐酸的玻璃棒靠近试管口时 。
3.收集方法: 。
向下排空气法
立即变蓝
产生大量白烟
由于铵盐具有受热易分解的性质,在储存铵态氮肥时,应密封包装并放在阴凉通风处;施肥时,应将其埋在土中以保持肥效。铵盐能与碱发生反应,因此铵态氮肥不能与碱性物质如草木灰等混合施用。
铵盐的性质
氯化铵受热分解成气体,该气体又能生成固体氯化铵,该过程属于升华吗?
提示:不属于。升华是物理变化,氯化铵分解生成氨气和氯化氢气体,氯化氢和氨气生成氯化铵属于化学反应。
铵态氮肥为什么不能与草木灰混用?
提示:草木灰的主要成分为K2CO3,其水溶液呈碱性,铵盐能与碱反应生成氨气逸出,从而降低肥效。
实验室制备气体的原理决定气体发生装置的类型,常见气体发生装置类型:
装置基本类型 固- 固反应物(加热) 固 -液反应物(不加热) 固 -液反应物(加热)
装置示意图
身边的化学
尿素和复合化肥
工业上常用氨和二氧化碳在一定条件下合成尿素。尿素是一种白色晶体,它的含氮量高达 46.65%,是目前含氮量最高的氮肥。尿素施入土壤后,在微生物的作用下与水缓慢反应产生氨,因此尿素的肥效比较持久。作为一种中性肥料,尿素适用于各种土壤和作物。尿素易保存,使用方便,对土壤的破坏作用小,是目前使用量较大的一种化学氮肥。
复合化肥是一类优质、高效的化肥,目前使用较多的主要是含氮和磷的复合化肥,如磷酸二氢铵(NH4H2PO4)和磷酸氢二[(NH4)HPO4]等。这类化肥具有养分含量高、无关成分少等优点。
科学合理地施用氮肥
合理地施用氮肥是实现农作物高产、稳产的一项重要措施,但是不合理地施用氮肥会导致环境污染。农田径流带入地表水体中过量的含有氮元素的物质会污染水资源:大量施用氮肥会导致大气中二氧化氮含量增多,长期施用氮肥特别是铵态氮肥会使土壤酸化,导致土壤板结。在提倡科学施肥的同时,还要改良化学肥料的生产工艺,改善氮肥的品种,向生产高效、多功能、生态环保的新型肥料方向发展。
完成课后相关练习
谢谢观看
谢谢观看
第3章 物质的性质与转化
第3节 氮的循环
第2课时 氨的转化
2.氨的转化与生成
氨是无色、有刺激性气味的气体;在标准状况下,密度比空气小,为 0.771 g·L-1;极易溶于水且能快速溶解,常温、常压下1体积水能溶解约 700 体积氨气。
氨是氮循环中的重要物质,在人类的生产和生活中有着广泛的应用。氨易液化,液氨汽化时要吸收大量的热,因此氨可用作制冷剂。氨是氮肥工业和硝酸工业的重要原料。化学氮肥主要包括铵态氮肥(主要成分头NH )、硝态氮肥(主要成分为 NO ) 和有机态肥——尿素[CO(NH2)2]。
氨元素是植物体内氨基酸和蛋白质必需的组成元素,也是叶绿素的组成成分之一,因此施用氮肥能够促进作物生长,并提高作物中蛋白质的含量。
玉米植株缺氮时,叶绿素含量下降,叶片黄化
缺氮的玉米植株
化学性质
氨溶于水时能与水发生反应生成一水合氨(NH3·H2O),氨水显弱碱性。氨不仅能与水发生反应,还能与酸发生反应生成铵盐,如与盐酸(或氯化氢)反应生成氯化铵(NH4CI)。利用这些性质可以把氨气转化为氨水、铵盐。在这类转化中,氮元素的化合价没有改变,实现的是物质类别的转化。
一水合氨可以部分电离出NH 和OH-,使氨水显弱碱性,其电离方程式为:
因此,氨水能使酚酬溶液变红。
氨溶于水
氨的喷泉实验
氨与氯化氢的反应
氨中氮元素的化合价为最低价,因此氨具有还原性,能与具有氧化性的物质发生反应。工业上利用氨在催化剂(如铂、铑等 ) 存在的情况下与氧气的反应来制备生产硝酸所需要的一氧化氮。
实验表明,通过加热碳酸氢铵、氯化铵等盐能够产生氨气。
铵盐与碱溶液共热也可以产生氨气,实验室里常用这种方法检验溶液中的铵离子。
在实验室里常用氯化铵与氢氧化钙反应制取少量氨气,用向下排空气法收集氨气,并用湿润的红色石蕊试纸检验氨气是否收集满。
加热碳酸氢铵固体
氯化铵固体与NaOH溶液的反应
实验室制取氨气并检验氨气是否收集满
氨气的实验室制法
1.反应原理: 。
2.验满方法
(1)使湿润的红色石蕊试纸 。
(2)蘸有浓盐酸的玻璃棒靠近试管口时 。
3.收集方法: 。
向下排空气法
立即变蓝
产生大量白烟
由于铵盐具有受热易分解的性质,在储存铵态氮肥时,应密封包装并放在阴凉通风处;施肥时,应将其埋在土中以保持肥效。铵盐能与碱发生反应,因此铵态氮肥不能与碱性物质如草木灰等混合施用。
铵盐的性质
氯化铵受热分解成气体,该气体又能生成固体氯化铵,该过程属于升华吗?
提示:不属于。升华是物理变化,氯化铵分解生成氨气和氯化氢气体,氯化氢和氨气生成氯化铵属于化学反应。
铵态氮肥为什么不能与草木灰混用?
提示:草木灰的主要成分为K2CO3,其水溶液呈碱性,铵盐能与碱反应生成氨气逸出,从而降低肥效。
实验室制备气体的原理决定气体发生装置的类型,常见气体发生装置类型:
装置基本类型 固- 固反应物(加热) 固 -液反应物(不加热) 固 -液反应物(加热)
装置示意图
身边的化学
尿素和复合化肥
工业上常用氨和二氧化碳在一定条件下合成尿素。尿素是一种白色晶体,它的含氮量高达 46.65%,是目前含氮量最高的氮肥。尿素施入土壤后,在微生物的作用下与水缓慢反应产生氨,因此尿素的肥效比较持久。作为一种中性肥料,尿素适用于各种土壤和作物。尿素易保存,使用方便,对土壤的破坏作用小,是目前使用量较大的一种化学氮肥。
复合化肥是一类优质、高效的化肥,目前使用较多的主要是含氮和磷的复合化肥,如磷酸二氢铵(NH4H2PO4)和磷酸氢二[(NH4)HPO4]等。这类化肥具有养分含量高、无关成分少等优点。
科学合理地施用氮肥
合理地施用氮肥是实现农作物高产、稳产的一项重要措施,但是不合理地施用氮肥会导致环境污染。农田径流带入地表水体中过量的含有氮元素的物质会污染水资源:大量施用氮肥会导致大气中二氧化氮含量增多,长期施用氮肥特别是铵态氮肥会使土壤酸化,导致土壤板结。在提倡科学施肥的同时,还要改良化学肥料的生产工艺,改善氮肥的品种,向生产高效、多功能、生态环保的新型肥料方向发展。
完成课后相关练习
谢谢观看
谢谢观看
