2.3.2 氧化剂和还原剂 氧化还原反应的应用 课件(共29张PPT) 2023-2024学年高一化学鲁科版(2029)必修第一册
文档属性
| 名称 | 2.3.2 氧化剂和还原剂 氧化还原反应的应用 课件(共29张PPT) 2023-2024学年高一化学鲁科版(2029)必修第一册 |

|
|
| 格式 | pptx | ||
| 文件大小 | 486.6KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-11-21 00:00:00 | ||
图片预览








文档简介
(共29张PPT)
第2章 元素与物质世界
第3节 氧化还原反应
第2课时 氧化剂和还原剂
氧化还原反应的应用
二、氧化剂和还原剂
在氧化还原反应中,所含某种(或某些)元素化合价降低的反应物称为氧化剂,所含某种(或某些)元素化合价升高的反应物称为还原剂。氧化剂具有氧化性,在氧化还原反应中被还原,发生还原反应;还原剂具有还原性,在氧化还原反应中被氧化,发生氧化反应。
在氢气与氧化铜的反应中,氧化铜中的铜元素化合价降低,氧化铜是氧化剂;氢气中的氢元素化合价升高,氢气是还原剂。
氧化还原反应为我们认识和研究物质增添了新的视角——从氧化性、还原性的角度认识和研究物质的性质。当某物质所含元素处于较高价态时,元素有降低价态的趋势,该物质可能具有氧化性;当某物质所含元素处于较低价态时,元素有升高价态的趋势,该物质可能具有还原性。
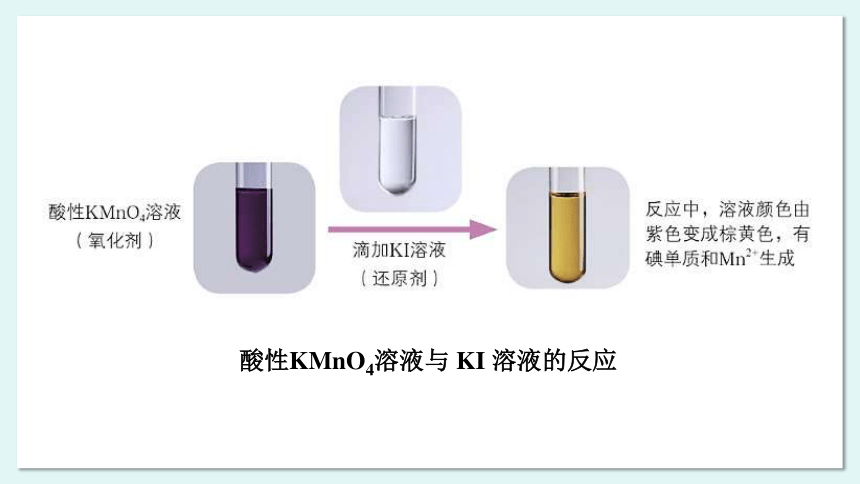
例如,高锰酸钾中的锰元素为 +7 价,为锰元素的最高价态,高锰酸钾具有氧化性;碘化钾中的碘元素为 -1 价,为碘元素的最低价态,碘化钾具有还原性。实验表明,酸性 KMnO4溶液与 KI 溶液能够发生氧化还原反应。在反应中元素的化合价降低,高锰酸钾做氧化剂;碘元素的化合价升高,碘化钾做还原剂。
酸性KMnO4溶液与 KI 溶液的反应
在中学化学里,常见的氧化剂有氧气、氯气等活泼的非金属单质,硝酸、浓硫酸等含有较高价态元素的含氧酸,以及高锰酸钾、氯酸钾、氯化铁等含有较高价态元素的盐;常见的还原剂有活泼的金属单质,碳单质、氢气等非金属单质,以及一些含有较低价态元素的氧化物(如一氧化碳、二氧化硫等)和盐(如碘化钾、亚硫酸钠、硫酸亚铁等)。
三、氧化还原反应的应用
1.研究物质的性质
我们可以利用氧化还原反应,通过分析物质所含元素化合价的升降趋势,研究物质的还原性或氧化性。
氧化性、还原性与价态的关系
元素处于最低价态时,只有 ;元素处于中间价态时既有 又有 ,但一般情况下主要表现某一方面的性质;元素处于最高价态时,只有 。
氧化性
还原性
氧化性
还原性
H2O2的氧化性和还原性探究
①预测
H2O2中的氧元素的化合价为-1价,是氧元素的中间价态,由此可推测H2O2既有氧化性又有还原性。
②实验方案
证明H2O2具有还原性,需加入 剂,如 。
证明H2O2具有氧化性,需加入 剂,如 。
氧化
还原
实验内容 实验现象 结论
滴入酸性KMnO4溶液,有 产生,酸性 KMnO4溶液紫红色褪去 H2O2被氧化为 ,表现 性
向H2O2中滴加KI溶液,溶液变 色,再滴加淀粉溶液,溶液变 。 H2O2可氧化KI生成 ,H2O2表现 性
③实验步骤、现象和结论
气泡
蓝
还原
黄
氧化
方法导引
研究物质氧化性或还原性的思路
1.根据物质所含元素化合价升高或降低的可能性,预测物质可能具有还原性或氧化性。若所含某元素的化合价有升高的趋势,说明该物质可能具有还原性;反之,若所含某元素的化合价有降低的趋势,说明该物质可能具有氧化性。
2.如果预测某物质具有氧化性,就需要寻找具有还原性的另一物质,通过实验检验两者能否发生氧化还原反应,以验证预测是否正确。相应地,如果预测某物质具有还原性,就需要寻找具有氧化性的另一物质,通过实验来验证预测是否正确。
物质的氧化性或还原性的强弱是由物质得失电子的能力决定的。借助氧化还原反应可以比较不同物质氧化性或还原性的强弱。环境条件也会影响物质氧化性或还原性的强弱。例如,我们常使用酸性条件下的 KMnO4溶液做氧化剂(实际上是其中的 MnO 参与氧化还原反应),就是因为大部分含氧酸的酸根离子做氧化剂时,溶液的酸性越强,含氧酸根离子的氧化性就越强。
2.实现物质转化与获得能量
人们可以利用氧化还原反应实现物质的转化。以金属的冶炼为例,热还原法、金属置换法、电解法等都是常见的方法。热还原法是以碳、一氧化碳等物质作为还原剂,在加热条件下将金属氧化物还原为金属单质,如用一氧化碳还原铁的氧化物得到金属铁。金属置换法是利用置换反应,以活泼金属为还原剂,将目标金属从其盐溶液中还原出来,如用铁从CuSO4溶液中置换出铜。电解法则是利用外加电源提供电子,使金属元素的化合价降低从而获得金属单质,如电解氧化铝制备金属铝。
无论是哪种冶炼方法,其本质都是利用氧化还原反应中的电子转移,使被还原的化合物中的金属元素的化合价从正价降低至 0 价,生成金属单质。
氧化还原反应不仅是人们获得物质的重要方式,也是人们获得能量的重要途径。例如,人们可以利用可燃物作为还原剂,选择合适的氧化剂与之发生氧化还原反应获得热能;另外,人们还可以利用氧化还原反应获得电能。
氧化还原反应在人类的生产和生活中无处不在。运用好氧化还原反应规律,可以丰富物质转化、能量转化的途径,获取生产活动的更高社会效益,促进人类社会的可持续发展。
迁移·应用
瑞典化学家舍勒是最早发现氯气的人。他在研究软锰矿矿石(主要成分是二氧化锰)时,把浓盐酸和软锰矿矿石混合加热,意外地得到了氯气。至今,实验室中还用这种方法制取氯气。
实验室制取氯气的装置示意图
浓盐酸
还原性和酸性
吸收Cl2的反应原理
化学方程式: 。
离子方程式: 。
氧化剂: ,还原剂: 。
易错提醒
(1)实验室制备Cl2注意事项
①必须用浓盐酸,MnO2与稀盐酸不反应。
②为了减少制得的Cl2中HCl的含量,所以加热温度不宜过高,减少HCl的挥发。
③实验结束后,先使反应停止并排出装置中残留的Cl2,再拆卸装置,避免污染空气。
④尾气吸收时,不能用澄清石灰水吸收Cl2,因为溶液中c(OH-)浓度小,吸收不完全。
(2) MnO2与浓盐酸反应特点
①浓盐酸中,部分Cl-的化合价升高,4 mol HCl参加反应,被氧化的Cl-为2 mol。
②随着反应的进行盐酸浓度变小,故MnO2足量时,盐酸不能完全反应,反应后溶液为盐酸和MnCl2的混合液。
化学与技术
利用氧化还原反应制备物质和获得能量的实例
金属钛具有许多优异的性能,是航空、军工、电力等领域的必需材料。金红石[主要成分为二氧化钛(TiO2)] 是地壳中矿石中的一种。目前大规模生产钛的方法是:第一步,让金红石、碳单质在高温下与氯气反应,制得四氯化钛(TiCl4);第二步,在氩气氛围中加热,使金属镁与四氯化钛反应制得金属钛。
钛合金广泛应用于飞机制造业
硅单质有很多重要的用途。硅元素在自然界中不以单质形式存在,主要以二氧化硅(SiO2)的形式存在。用碳单质还原二氧化硅可以制得粗硅,使粗硅与氯气反应生成四氯化硅(SiCl4),净化后再用氢气还原四氯化硅,可以制得比较纯净的硅单质。
燃料电池是很有发展前景的一种新型电源,其原理是:利用氢气、天然气等燃料做电池负极反应物,发生氧化反应;利用空气中的氧气做电池正极反应物,发生还原反应;连接外电路时,电子从负极移向正极形成电流。
完成课后相关练习
谢谢观看
谢谢观看
第2章 元素与物质世界
第3节 氧化还原反应
第2课时 氧化剂和还原剂
氧化还原反应的应用
二、氧化剂和还原剂
在氧化还原反应中,所含某种(或某些)元素化合价降低的反应物称为氧化剂,所含某种(或某些)元素化合价升高的反应物称为还原剂。氧化剂具有氧化性,在氧化还原反应中被还原,发生还原反应;还原剂具有还原性,在氧化还原反应中被氧化,发生氧化反应。
在氢气与氧化铜的反应中,氧化铜中的铜元素化合价降低,氧化铜是氧化剂;氢气中的氢元素化合价升高,氢气是还原剂。
氧化还原反应为我们认识和研究物质增添了新的视角——从氧化性、还原性的角度认识和研究物质的性质。当某物质所含元素处于较高价态时,元素有降低价态的趋势,该物质可能具有氧化性;当某物质所含元素处于较低价态时,元素有升高价态的趋势,该物质可能具有还原性。
例如,高锰酸钾中的锰元素为 +7 价,为锰元素的最高价态,高锰酸钾具有氧化性;碘化钾中的碘元素为 -1 价,为碘元素的最低价态,碘化钾具有还原性。实验表明,酸性 KMnO4溶液与 KI 溶液能够发生氧化还原反应。在反应中元素的化合价降低,高锰酸钾做氧化剂;碘元素的化合价升高,碘化钾做还原剂。
酸性KMnO4溶液与 KI 溶液的反应
在中学化学里,常见的氧化剂有氧气、氯气等活泼的非金属单质,硝酸、浓硫酸等含有较高价态元素的含氧酸,以及高锰酸钾、氯酸钾、氯化铁等含有较高价态元素的盐;常见的还原剂有活泼的金属单质,碳单质、氢气等非金属单质,以及一些含有较低价态元素的氧化物(如一氧化碳、二氧化硫等)和盐(如碘化钾、亚硫酸钠、硫酸亚铁等)。
三、氧化还原反应的应用
1.研究物质的性质
我们可以利用氧化还原反应,通过分析物质所含元素化合价的升降趋势,研究物质的还原性或氧化性。
氧化性、还原性与价态的关系
元素处于最低价态时,只有 ;元素处于中间价态时既有 又有 ,但一般情况下主要表现某一方面的性质;元素处于最高价态时,只有 。
氧化性
还原性
氧化性
还原性
H2O2的氧化性和还原性探究
①预测
H2O2中的氧元素的化合价为-1价,是氧元素的中间价态,由此可推测H2O2既有氧化性又有还原性。
②实验方案
证明H2O2具有还原性,需加入 剂,如 。
证明H2O2具有氧化性,需加入 剂,如 。
氧化
还原
实验内容 实验现象 结论
滴入酸性KMnO4溶液,有 产生,酸性 KMnO4溶液紫红色褪去 H2O2被氧化为 ,表现 性
向H2O2中滴加KI溶液,溶液变 色,再滴加淀粉溶液,溶液变 。 H2O2可氧化KI生成 ,H2O2表现 性
③实验步骤、现象和结论
气泡
蓝
还原
黄
氧化
方法导引
研究物质氧化性或还原性的思路
1.根据物质所含元素化合价升高或降低的可能性,预测物质可能具有还原性或氧化性。若所含某元素的化合价有升高的趋势,说明该物质可能具有还原性;反之,若所含某元素的化合价有降低的趋势,说明该物质可能具有氧化性。
2.如果预测某物质具有氧化性,就需要寻找具有还原性的另一物质,通过实验检验两者能否发生氧化还原反应,以验证预测是否正确。相应地,如果预测某物质具有还原性,就需要寻找具有氧化性的另一物质,通过实验来验证预测是否正确。
物质的氧化性或还原性的强弱是由物质得失电子的能力决定的。借助氧化还原反应可以比较不同物质氧化性或还原性的强弱。环境条件也会影响物质氧化性或还原性的强弱。例如,我们常使用酸性条件下的 KMnO4溶液做氧化剂(实际上是其中的 MnO 参与氧化还原反应),就是因为大部分含氧酸的酸根离子做氧化剂时,溶液的酸性越强,含氧酸根离子的氧化性就越强。
2.实现物质转化与获得能量
人们可以利用氧化还原反应实现物质的转化。以金属的冶炼为例,热还原法、金属置换法、电解法等都是常见的方法。热还原法是以碳、一氧化碳等物质作为还原剂,在加热条件下将金属氧化物还原为金属单质,如用一氧化碳还原铁的氧化物得到金属铁。金属置换法是利用置换反应,以活泼金属为还原剂,将目标金属从其盐溶液中还原出来,如用铁从CuSO4溶液中置换出铜。电解法则是利用外加电源提供电子,使金属元素的化合价降低从而获得金属单质,如电解氧化铝制备金属铝。
无论是哪种冶炼方法,其本质都是利用氧化还原反应中的电子转移,使被还原的化合物中的金属元素的化合价从正价降低至 0 价,生成金属单质。
氧化还原反应不仅是人们获得物质的重要方式,也是人们获得能量的重要途径。例如,人们可以利用可燃物作为还原剂,选择合适的氧化剂与之发生氧化还原反应获得热能;另外,人们还可以利用氧化还原反应获得电能。
氧化还原反应在人类的生产和生活中无处不在。运用好氧化还原反应规律,可以丰富物质转化、能量转化的途径,获取生产活动的更高社会效益,促进人类社会的可持续发展。
迁移·应用
瑞典化学家舍勒是最早发现氯气的人。他在研究软锰矿矿石(主要成分是二氧化锰)时,把浓盐酸和软锰矿矿石混合加热,意外地得到了氯气。至今,实验室中还用这种方法制取氯气。
实验室制取氯气的装置示意图
浓盐酸
还原性和酸性
吸收Cl2的反应原理
化学方程式: 。
离子方程式: 。
氧化剂: ,还原剂: 。
易错提醒
(1)实验室制备Cl2注意事项
①必须用浓盐酸,MnO2与稀盐酸不反应。
②为了减少制得的Cl2中HCl的含量,所以加热温度不宜过高,减少HCl的挥发。
③实验结束后,先使反应停止并排出装置中残留的Cl2,再拆卸装置,避免污染空气。
④尾气吸收时,不能用澄清石灰水吸收Cl2,因为溶液中c(OH-)浓度小,吸收不完全。
(2) MnO2与浓盐酸反应特点
①浓盐酸中,部分Cl-的化合价升高,4 mol HCl参加反应,被氧化的Cl-为2 mol。
②随着反应的进行盐酸浓度变小,故MnO2足量时,盐酸不能完全反应,反应后溶液为盐酸和MnCl2的混合液。
化学与技术
利用氧化还原反应制备物质和获得能量的实例
金属钛具有许多优异的性能,是航空、军工、电力等领域的必需材料。金红石[主要成分为二氧化钛(TiO2)] 是地壳中矿石中的一种。目前大规模生产钛的方法是:第一步,让金红石、碳单质在高温下与氯气反应,制得四氯化钛(TiCl4);第二步,在氩气氛围中加热,使金属镁与四氯化钛反应制得金属钛。
钛合金广泛应用于飞机制造业
硅单质有很多重要的用途。硅元素在自然界中不以单质形式存在,主要以二氧化硅(SiO2)的形式存在。用碳单质还原二氧化硅可以制得粗硅,使粗硅与氯气反应生成四氯化硅(SiCl4),净化后再用氢气还原四氯化硅,可以制得比较纯净的硅单质。
燃料电池是很有发展前景的一种新型电源,其原理是:利用氢气、天然气等燃料做电池负极反应物,发生氧化反应;利用空气中的氧气做电池正极反应物,发生还原反应;连接外电路时,电子从负极移向正极形成电流。
完成课后相关练习
谢谢观看
谢谢观看
