2.1.2 一种重要的混合物——胶体 课件(共21张PPT) 2023-2024学年高一化学鲁科版(2029)必修第一册
文档属性
| 名称 | 2.1.2 一种重要的混合物——胶体 课件(共21张PPT) 2023-2024学年高一化学鲁科版(2029)必修第一册 |  | |
| 格式 | pptx | ||
| 文件大小 | 856.4KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-11-21 14:28:38 | ||
图片预览








文档简介
(共21张PPT)
第2章 元素与物质世界
第1节 元素与物质分类
第2课时 一种重要的混合物——胶体
联想·质疑
不知你是否有过这样的经历:清晨当太阳升起时,漫步在茂密的森林里,会看到一缕缕阳光穿过枝叶间隙铺洒在地面上。你知道为什么会产生这美丽的景象吗
阳光穿过茂密枝叶间隙的景象
溶液、悬浊液与乳浊液都是由一种(或几种)物质(分散质)分散到另一种物质(分散剂)里形成的分散系。溶液中的分散质微粒是直径小于 1 nm (10-9 m的分子或离子,使溶液这种分散系表现出透明、均一、稳定的宏观特征;而悬浊液、乳浊液中的分散质微粒是分子的集合体或离子的集合体(分别呈固态或液态),其微粒直径大于100 nm,使悬浊液或乳浊液这种分散系表现出浑浊、不稳定等宏观特征。还有一种分散系,其分散质的微粒直径介于 1~100 nm,这种分散系称为胶体。
一种重要的混合物——胶体
KNO3溶液(左) 与泥土悬浊液(右)
氢氧化铁胶体(左)与碘化银胶体(右)
胶体具有不同于溶液和浊液的独特性质。
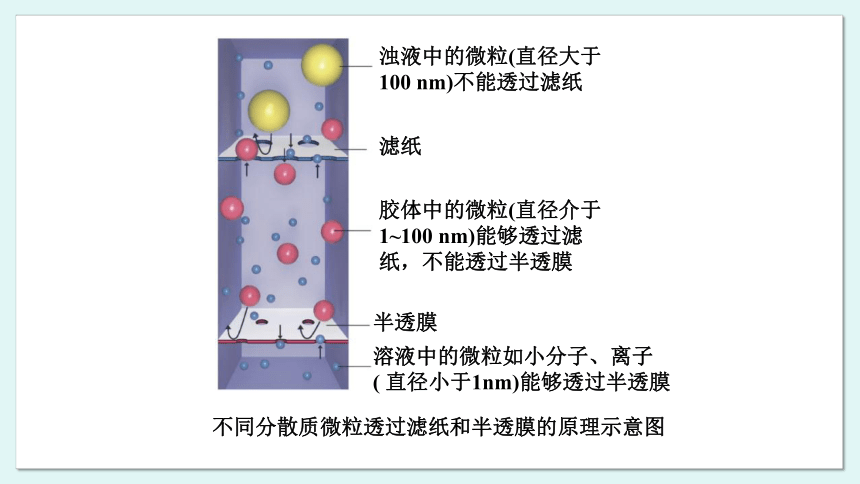
胶体的分散质微粒比溶液的大,能够透过滤纸,但不能透过半透膜(如动物肠衣、鸡蛋壳膜、羊皮纸、胶棉薄膜、玻璃纸等 )。半透膜具有比滤纸更细小的孔隙,只有小分子、离子能够透过,因此可以利用半透膜分离胶体中的杂质分子或离子。这种提纯、精制胶体的方法称为渗析。
浊液中的微粒(直径大于100 nm)不能透过滤纸
滤纸
胶体中的微粒(直径介于1~100 nm)能够透过滤纸,不能透过半透膜
半透膜
溶液中的微粒如小分子、离子( 直径小于1nm)能够透过半透膜
不同分散质微粒透过滤纸和半透膜的原理示意图
胶体的分离和提纯
1.胶体与浊液分离:用 的方法,胶体的分散质微粒可以通过滤纸。
2.胶体与溶液分离:用 的方法,胶体的分散质微粒不能通过半透膜,而小分子、离子能够通过半透膜。
渗析
过滤
当可见光束通过胶体时,在入射光侧面口观察到光亮的“通路”,这种现象称为丁达尔现象或丁达尔效应。丁达尔现象是胶体中分散质微粒对可见光(波长为400~700 nm)散射而形成的,可用于实验室鉴别一种分散系属于胶体还是属于溶液。
实际上,丁达尔现象对我们来说并不陌生。例如,清晨在密林中看到的一缕缕光束、阳光透过墙上的小孔在较暗房间里形成的一道道光柱等,都属于丁达尔现象。其实,云、雾、烟也都是胶体只是这些胶体的分散剂是空气,分散质微粒是微小的液滴或固体颗粒。
利用丁达尔现象鉴别胶体与溶液
胶体在自然界中广泛存在,人类的生产、生活以及人体的生命活动都与胶体有着密切的关系。例如,在水的净化过程中,向水中加入可以形成胶体的无害物质,利用胶体分散质具有巨大的比表面积(单位质量的微粒具有的表面积)的性质,形成较强的吸附能力,吸附水中的色素、悬浮固体等以达到净水的目的。
电泳
胶体的分散质具有巨大的比表面积,能吸附带有某种电荷的离子,从而形成带电微粒。有些胶体的分散质微粒吸附带有正电荷的离子,有些则吸附带有负电荷的离子。这些带电微粒在外电场的作用下会发生定向移动。
例如,氢氧化铁胶体的分散质微粒带有正电荷,在通电的情况下会向与直流电源负极相连的一极移动,这种现象称为电泳。电泳具有很高的实用价值,如电泳电镀就是利用电泳将油漆、乳胶、橡胶等微粒均匀地沉积在镀件上的。
氢氧化铁胶体的电泳现象
聚 沉
把酸、碱、盐等物质加入胶体中时,它们溶解产生的阳离子或阴离子所带电荷与胶体的分散质微粒所带电荷中和,会使胶体的分散质微粒聚集成较大的微粒,在重力作用下沉淀析出。这种胶体形成沉淀析出的现象称为聚沉。加热或搅拌也可能引起胶体的聚沉。胶体的聚沉在生产和生活中有着重要的应用,如向豆浆(一种胶体 )中加入硫酸钙使蛋白质等聚沉可制成可口的豆腐。
氢氧化铁胶体的聚沉
分散系 溶液 胶体 浊液
分散质 微粒 单个小分 子或离子 高分子或 多分子集 合体 巨大数目的
分子集合体
分散质 微粒直径 小于1 nm 1~100 nm 大于
100 nm
溶液、 胶体、浊液三类分散系的比较
性 质 外观 均一、透明 多数均一、透明 不均一、
不透明
稳定性 稳定 较稳定 不稳定
能否透过 滤纸 能 能 不能
能否透过 半透膜 能 不能 不能
操作 过滤 渗析
分离 物质 胶体和悬浊液 胶体和溶液
使用 仪器 铁架台(带铁圈)、烧杯、玻璃棒、漏斗、滤纸 烧杯、玻璃棒、半透膜
胶体与悬浊液、胶体与溶液的分离
操作 要领 一贴:滤纸紧贴漏斗内壁 二低:①滤纸边缘要低于漏斗边缘;②液面要低于滤纸边缘 三靠:①烧杯嘴紧靠倾斜的玻璃棒;②玻璃棒下端靠在三层滤纸处;③漏斗的下端紧靠接收器内壁 ①半透膜不能破损,且袋口要扎紧;②半透膜浸入的水要及时更换
原理 悬浊液中的分散质微粒不能透过滤纸,而胶体分散质微粒可以透过滤纸 胶体分散质微粒不能透过半透膜,溶液中的溶质微粒能透过半透膜
完成课后相关练习
谢谢观看
谢谢观看
第2章 元素与物质世界
第1节 元素与物质分类
第2课时 一种重要的混合物——胶体
联想·质疑
不知你是否有过这样的经历:清晨当太阳升起时,漫步在茂密的森林里,会看到一缕缕阳光穿过枝叶间隙铺洒在地面上。你知道为什么会产生这美丽的景象吗
阳光穿过茂密枝叶间隙的景象
溶液、悬浊液与乳浊液都是由一种(或几种)物质(分散质)分散到另一种物质(分散剂)里形成的分散系。溶液中的分散质微粒是直径小于 1 nm (10-9 m的分子或离子,使溶液这种分散系表现出透明、均一、稳定的宏观特征;而悬浊液、乳浊液中的分散质微粒是分子的集合体或离子的集合体(分别呈固态或液态),其微粒直径大于100 nm,使悬浊液或乳浊液这种分散系表现出浑浊、不稳定等宏观特征。还有一种分散系,其分散质的微粒直径介于 1~100 nm,这种分散系称为胶体。
一种重要的混合物——胶体
KNO3溶液(左) 与泥土悬浊液(右)
氢氧化铁胶体(左)与碘化银胶体(右)
胶体具有不同于溶液和浊液的独特性质。
胶体的分散质微粒比溶液的大,能够透过滤纸,但不能透过半透膜(如动物肠衣、鸡蛋壳膜、羊皮纸、胶棉薄膜、玻璃纸等 )。半透膜具有比滤纸更细小的孔隙,只有小分子、离子能够透过,因此可以利用半透膜分离胶体中的杂质分子或离子。这种提纯、精制胶体的方法称为渗析。
浊液中的微粒(直径大于100 nm)不能透过滤纸
滤纸
胶体中的微粒(直径介于1~100 nm)能够透过滤纸,不能透过半透膜
半透膜
溶液中的微粒如小分子、离子( 直径小于1nm)能够透过半透膜
不同分散质微粒透过滤纸和半透膜的原理示意图
胶体的分离和提纯
1.胶体与浊液分离:用 的方法,胶体的分散质微粒可以通过滤纸。
2.胶体与溶液分离:用 的方法,胶体的分散质微粒不能通过半透膜,而小分子、离子能够通过半透膜。
渗析
过滤
当可见光束通过胶体时,在入射光侧面口观察到光亮的“通路”,这种现象称为丁达尔现象或丁达尔效应。丁达尔现象是胶体中分散质微粒对可见光(波长为400~700 nm)散射而形成的,可用于实验室鉴别一种分散系属于胶体还是属于溶液。
实际上,丁达尔现象对我们来说并不陌生。例如,清晨在密林中看到的一缕缕光束、阳光透过墙上的小孔在较暗房间里形成的一道道光柱等,都属于丁达尔现象。其实,云、雾、烟也都是胶体只是这些胶体的分散剂是空气,分散质微粒是微小的液滴或固体颗粒。
利用丁达尔现象鉴别胶体与溶液
胶体在自然界中广泛存在,人类的生产、生活以及人体的生命活动都与胶体有着密切的关系。例如,在水的净化过程中,向水中加入可以形成胶体的无害物质,利用胶体分散质具有巨大的比表面积(单位质量的微粒具有的表面积)的性质,形成较强的吸附能力,吸附水中的色素、悬浮固体等以达到净水的目的。
电泳
胶体的分散质具有巨大的比表面积,能吸附带有某种电荷的离子,从而形成带电微粒。有些胶体的分散质微粒吸附带有正电荷的离子,有些则吸附带有负电荷的离子。这些带电微粒在外电场的作用下会发生定向移动。
例如,氢氧化铁胶体的分散质微粒带有正电荷,在通电的情况下会向与直流电源负极相连的一极移动,这种现象称为电泳。电泳具有很高的实用价值,如电泳电镀就是利用电泳将油漆、乳胶、橡胶等微粒均匀地沉积在镀件上的。
氢氧化铁胶体的电泳现象
聚 沉
把酸、碱、盐等物质加入胶体中时,它们溶解产生的阳离子或阴离子所带电荷与胶体的分散质微粒所带电荷中和,会使胶体的分散质微粒聚集成较大的微粒,在重力作用下沉淀析出。这种胶体形成沉淀析出的现象称为聚沉。加热或搅拌也可能引起胶体的聚沉。胶体的聚沉在生产和生活中有着重要的应用,如向豆浆(一种胶体 )中加入硫酸钙使蛋白质等聚沉可制成可口的豆腐。
氢氧化铁胶体的聚沉
分散系 溶液 胶体 浊液
分散质 微粒 单个小分 子或离子 高分子或 多分子集 合体 巨大数目的
分子集合体
分散质 微粒直径 小于1 nm 1~100 nm 大于
100 nm
溶液、 胶体、浊液三类分散系的比较
性 质 外观 均一、透明 多数均一、透明 不均一、
不透明
稳定性 稳定 较稳定 不稳定
能否透过 滤纸 能 能 不能
能否透过 半透膜 能 不能 不能
操作 过滤 渗析
分离 物质 胶体和悬浊液 胶体和溶液
使用 仪器 铁架台(带铁圈)、烧杯、玻璃棒、漏斗、滤纸 烧杯、玻璃棒、半透膜
胶体与悬浊液、胶体与溶液的分离
操作 要领 一贴:滤纸紧贴漏斗内壁 二低:①滤纸边缘要低于漏斗边缘;②液面要低于滤纸边缘 三靠:①烧杯嘴紧靠倾斜的玻璃棒;②玻璃棒下端靠在三层滤纸处;③漏斗的下端紧靠接收器内壁 ①半透膜不能破损,且袋口要扎紧;②半透膜浸入的水要及时更换
原理 悬浊液中的分散质微粒不能透过滤纸,而胶体分散质微粒可以透过滤纸 胶体分散质微粒不能透过半透膜,溶液中的溶质微粒能透过半透膜
完成课后相关练习
谢谢观看
谢谢观看
