3.2.1 自然界中的硫 二氧化硫 课件(共29张PPT)2023-2024学年高一化学鲁科版(2029)必修第一册
文档属性
| 名称 | 3.2.1 自然界中的硫 二氧化硫 课件(共29张PPT)2023-2024学年高一化学鲁科版(2029)必修第一册 |  | |
| 格式 | pptx | ||
| 文件大小 | 1.3MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-11-21 15:20:03 | ||
图片预览







文档简介
(共29张PPT)
第3章 物质的性质与转化
第2节 硫的转化
第1课时 自然界中的硫 二氧化硫
硫是重要的非金属元素,也是人类最早认识的化学元素之一。在古代,硫单质及含硫化合物就常常被炼丹家所使用。硫单质还是我国古代四大发明之——黑火药的主要成分。硫及其化合物在现代生产和生活中仍发挥着重要的作用。
火山喷发时的景象
火山喷发时熔岩喷涌、浓烟滚滚,不仅释放出巨大的能量,而且产生了许多含有硫元素的气体,在火山口还有硫单质出现。这是自然界中硫单质及含硫化合物的来源之一。
一、自然界中的硫
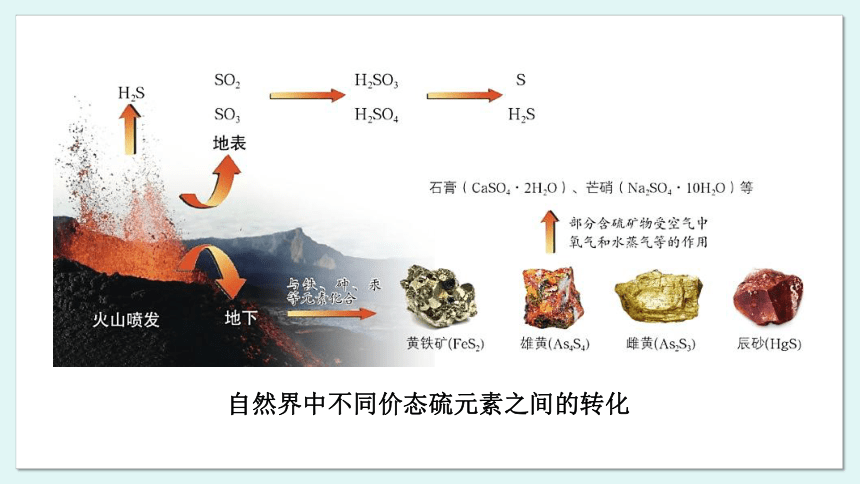
1.自然界中不同价态硫元素之间的转化
硫元素广泛存在于自然界中。海洋、大气和地壳中乃至动植物体内,都含有硫元素。
地层深处蕴藏着大量含有硫元素的物质。火山喷发时,部分硫元素转化成硫化氢气体,部分硫元素转化成二氧化硫和三氧化硫气体。二氧化硫在大气中存在的时间比较短,当有氧气、水蒸气、阳光等存在时,二氧化硫会被氧化成三氧化硫。二氧化硫和三氧化硫溶于水,分别生成亚硫酸和硫酸。一些微生物会把部分亚硫酸和硫酸转化成硫单质或硫化氢。
火山喷发时,熔融态的含有硫元素的物质与含有铁、砷、汞等元素的物质反应形成矿物。暴露于地球表面的多种含硫矿物,受到空气中氧气和水蒸气等的作用,转化成新的物质,如石膏、芒硝等。
自然界中不同价态硫元素之间的转化
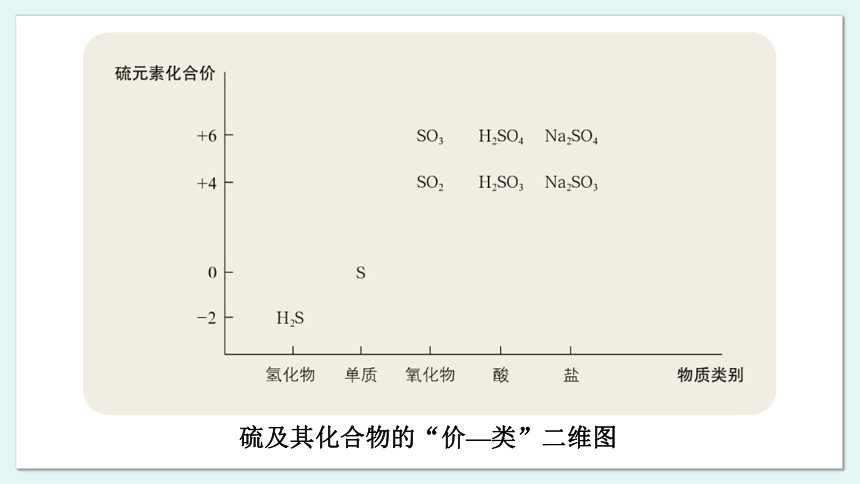
自然界中有丰富的含有硫元素的物质,如硫化氢、硫单质、二氧化硫、三氧化硫、亚硫酸、硫酸、硫酸钠等。从物质类别角度分析,硫及其化合物包括氢化物、单质、氧化物、酸、盐等;从硫元素的化合价角度分析,包括分别含有 -2、0、+4 和 +6 价硫元素的物质,如下图所示。硫及其化合物之间可以相互转化。
硫及其化合物的“价—类”二维图
2.认识硫单质
硫单质,俗称硫黄。通常状况下,它是一种黄色或淡黄色的固体;很脆,易研成粉末;不溶于水,微溶于酒精,易溶于二硫化碳(CS2);熔点和沸点都不高。
硫单质的性质
[实验 1] 取少量硫粉放入试管中,观察它的颜色、状态;在酒精灯上加热,观察发生的现象。
硫的熔化
[实验 2]把研细的硫粉和铁粉按照一定比例混合均匀,放在石棉网上堆成条状或如图所示的形状。用灼热的玻璃棒触及一端,当混合物呈红热状态时移开玻璃棒,观察发生的现象。
硫粉与铁粉的反应
[实验3] 取少量硫粉放入燃烧匙中,将燃烧匙放在酒精灯上加热至硫粉熔化并燃烧后,迅速伸入盛满氧气的集气瓶(底部有少量水)中,观察发生的现象。
硫在氧气中燃烧
硫元素的两种同素异形体
由硫元素组成的单质有多种,如正交硫和单斜硫。由同一种元素组成的性质不同的几种单质,叫作该元素的同素异形体。同素异形体之间的性质差异,主要表现在物理性质上。正交硫和单斜硫是常见的硫元素的同素异形体。
硫单质能与金属铁反应生成硫化亚铁 (FeS),体现了硫单质的氧化性;能与氧气反应生成二氧化硫,体现了硫单质的还原性。
硫黄主要用于制造硫酸、化肥、火柴及杀虫剂等。
二、实验室里研究不同价态硫元素之间的转化
探究不同价态硫元素之间相互转化的思路
探究不同价态硫元素之间的相互转化,实际上是探究含有不同价态硫元素的物质之间的相互转化。
首先,要选择含有不同价态硫元素的物质,如含 +4 价硫元素的物质可以选择二氧化硫或亚硫酸钠。
其次,实现不同价态硫元素之间的相互转化,依据的是氧化还原理论,需要寻找合适的氧化剂或还原剂。
再次,提供表明相应转化实际发生的证据。
含有不同价态硫元素的物质之间转化时,所发生的反应属于氧化还原反应。
当硫元素处于中间价态时,含有这种价态硫元素的物质(如硫黄、二氧化硫、亚硫酸钠),既具有氧化性又具有还原性;当硫元素处于最高价态时,含有这种价态硫元素的物质(如三氧化硫、浓硫酸),只具有氧化性;当硫元素处于最低价态时,含有这种价态硫元素的物质(如硫化氢、硫化钠),只具有还原性。
二氧化硫是一种无色、有刺激性气味的有毒气体,易溶于水。二氧化硫在催化剂和加热的条件下能被氧气氧化,体现了二氧化硫的还原性;二氧化硫能与硫化氢(或硫化钠)反应,则体现了二氧化硫的氧化性及硫化氢(或硫化钠)的还原性。
二氧化硫与 H2S 溶液的反应
在相同条件下能同时向正、反两个方向进行的反应称为可逆反应。二氧化硫与氧气的反应以及前面学过的氯气与水的反应都属于可逆反应。在可逆反应的化学方程式中用 代替 。
二氧化硫除了具有氧化性和还原性外,还具有酸性氧化物的一般性质,如与水反应生成亚硫酸、与 NaOH 溶液反应生成亚硫酸钠和水。
二氧化硫具有漂白性,能使品红等有色物质褪色。但是,用二氧化硫漂白过的有色物质,在一定条件下会恢复原来的颜色。
二氧化硫使品红溶液褪色
二氧化硫是一种食品添加剂。我国《食品安全国家标准 食品添加剂使用标准》规定了二氧化硫作为漂白剂、防腐剂、抗氧化剂的使用范围、使用限量和残留量。
SO2 CO2
物 理 性 质 气味 有刺激性气味 无味
毒性 有毒 无毒
溶解性 易溶 能溶
SO2和CO2性质的比较
方法规律
CO2、SO2的鉴别
(1)利用SO2的刺激性气味,用闻气味鉴别。
(2)利用SO2的漂白性,用品红溶液鉴别。
(3)利用SO2的还原性,用酸性高锰酸钾溶液、溴水或氯水、硝酸酸化的硝酸钡、氯化铁溶液等鉴别。
类型 原理 特点 举例 适用对象
氧 化 型 漂白剂本身是强氧化剂,可将有色物质氧化,使有色物质失去原有的颜色 不可逆 HClO、 Ca(ClO)2、 Na2O2、 H2O2等 主要适用于漂白纺织品
漂白原理分类比较
加 合 型 漂白剂与有机色质结合生成新的无色物质,使有机色质失去原有的颜色 可逆 SO2或 H2SO3 常用于漂白纸张、纺织品等
吸 附 型 有些固体物质疏松多孔,具有较大的表面积,可以吸附有色物质而使之失去原有的颜色 部分吸附剂可 重复使用 活性炭 吸附色素、一些有毒气体或微粒
完成课后相关练习
谢谢观看
谢谢观看
第3章 物质的性质与转化
第2节 硫的转化
第1课时 自然界中的硫 二氧化硫
硫是重要的非金属元素,也是人类最早认识的化学元素之一。在古代,硫单质及含硫化合物就常常被炼丹家所使用。硫单质还是我国古代四大发明之——黑火药的主要成分。硫及其化合物在现代生产和生活中仍发挥着重要的作用。
火山喷发时的景象
火山喷发时熔岩喷涌、浓烟滚滚,不仅释放出巨大的能量,而且产生了许多含有硫元素的气体,在火山口还有硫单质出现。这是自然界中硫单质及含硫化合物的来源之一。
一、自然界中的硫
1.自然界中不同价态硫元素之间的转化
硫元素广泛存在于自然界中。海洋、大气和地壳中乃至动植物体内,都含有硫元素。
地层深处蕴藏着大量含有硫元素的物质。火山喷发时,部分硫元素转化成硫化氢气体,部分硫元素转化成二氧化硫和三氧化硫气体。二氧化硫在大气中存在的时间比较短,当有氧气、水蒸气、阳光等存在时,二氧化硫会被氧化成三氧化硫。二氧化硫和三氧化硫溶于水,分别生成亚硫酸和硫酸。一些微生物会把部分亚硫酸和硫酸转化成硫单质或硫化氢。
火山喷发时,熔融态的含有硫元素的物质与含有铁、砷、汞等元素的物质反应形成矿物。暴露于地球表面的多种含硫矿物,受到空气中氧气和水蒸气等的作用,转化成新的物质,如石膏、芒硝等。
自然界中不同价态硫元素之间的转化
自然界中有丰富的含有硫元素的物质,如硫化氢、硫单质、二氧化硫、三氧化硫、亚硫酸、硫酸、硫酸钠等。从物质类别角度分析,硫及其化合物包括氢化物、单质、氧化物、酸、盐等;从硫元素的化合价角度分析,包括分别含有 -2、0、+4 和 +6 价硫元素的物质,如下图所示。硫及其化合物之间可以相互转化。
硫及其化合物的“价—类”二维图
2.认识硫单质
硫单质,俗称硫黄。通常状况下,它是一种黄色或淡黄色的固体;很脆,易研成粉末;不溶于水,微溶于酒精,易溶于二硫化碳(CS2);熔点和沸点都不高。
硫单质的性质
[实验 1] 取少量硫粉放入试管中,观察它的颜色、状态;在酒精灯上加热,观察发生的现象。
硫的熔化
[实验 2]把研细的硫粉和铁粉按照一定比例混合均匀,放在石棉网上堆成条状或如图所示的形状。用灼热的玻璃棒触及一端,当混合物呈红热状态时移开玻璃棒,观察发生的现象。
硫粉与铁粉的反应
[实验3] 取少量硫粉放入燃烧匙中,将燃烧匙放在酒精灯上加热至硫粉熔化并燃烧后,迅速伸入盛满氧气的集气瓶(底部有少量水)中,观察发生的现象。
硫在氧气中燃烧
硫元素的两种同素异形体
由硫元素组成的单质有多种,如正交硫和单斜硫。由同一种元素组成的性质不同的几种单质,叫作该元素的同素异形体。同素异形体之间的性质差异,主要表现在物理性质上。正交硫和单斜硫是常见的硫元素的同素异形体。
硫单质能与金属铁反应生成硫化亚铁 (FeS),体现了硫单质的氧化性;能与氧气反应生成二氧化硫,体现了硫单质的还原性。
硫黄主要用于制造硫酸、化肥、火柴及杀虫剂等。
二、实验室里研究不同价态硫元素之间的转化
探究不同价态硫元素之间相互转化的思路
探究不同价态硫元素之间的相互转化,实际上是探究含有不同价态硫元素的物质之间的相互转化。
首先,要选择含有不同价态硫元素的物质,如含 +4 价硫元素的物质可以选择二氧化硫或亚硫酸钠。
其次,实现不同价态硫元素之间的相互转化,依据的是氧化还原理论,需要寻找合适的氧化剂或还原剂。
再次,提供表明相应转化实际发生的证据。
含有不同价态硫元素的物质之间转化时,所发生的反应属于氧化还原反应。
当硫元素处于中间价态时,含有这种价态硫元素的物质(如硫黄、二氧化硫、亚硫酸钠),既具有氧化性又具有还原性;当硫元素处于最高价态时,含有这种价态硫元素的物质(如三氧化硫、浓硫酸),只具有氧化性;当硫元素处于最低价态时,含有这种价态硫元素的物质(如硫化氢、硫化钠),只具有还原性。
二氧化硫是一种无色、有刺激性气味的有毒气体,易溶于水。二氧化硫在催化剂和加热的条件下能被氧气氧化,体现了二氧化硫的还原性;二氧化硫能与硫化氢(或硫化钠)反应,则体现了二氧化硫的氧化性及硫化氢(或硫化钠)的还原性。
二氧化硫与 H2S 溶液的反应
在相同条件下能同时向正、反两个方向进行的反应称为可逆反应。二氧化硫与氧气的反应以及前面学过的氯气与水的反应都属于可逆反应。在可逆反应的化学方程式中用 代替 。
二氧化硫除了具有氧化性和还原性外,还具有酸性氧化物的一般性质,如与水反应生成亚硫酸、与 NaOH 溶液反应生成亚硫酸钠和水。
二氧化硫具有漂白性,能使品红等有色物质褪色。但是,用二氧化硫漂白过的有色物质,在一定条件下会恢复原来的颜色。
二氧化硫使品红溶液褪色
二氧化硫是一种食品添加剂。我国《食品安全国家标准 食品添加剂使用标准》规定了二氧化硫作为漂白剂、防腐剂、抗氧化剂的使用范围、使用限量和残留量。
SO2 CO2
物 理 性 质 气味 有刺激性气味 无味
毒性 有毒 无毒
溶解性 易溶 能溶
SO2和CO2性质的比较
方法规律
CO2、SO2的鉴别
(1)利用SO2的刺激性气味,用闻气味鉴别。
(2)利用SO2的漂白性,用品红溶液鉴别。
(3)利用SO2的还原性,用酸性高锰酸钾溶液、溴水或氯水、硝酸酸化的硝酸钡、氯化铁溶液等鉴别。
类型 原理 特点 举例 适用对象
氧 化 型 漂白剂本身是强氧化剂,可将有色物质氧化,使有色物质失去原有的颜色 不可逆 HClO、 Ca(ClO)2、 Na2O2、 H2O2等 主要适用于漂白纺织品
漂白原理分类比较
加 合 型 漂白剂与有机色质结合生成新的无色物质,使有机色质失去原有的颜色 可逆 SO2或 H2SO3 常用于漂白纸张、纺织品等
吸 附 型 有些固体物质疏松多孔,具有较大的表面积,可以吸附有色物质而使之失去原有的颜色 部分吸附剂可 重复使用 活性炭 吸附色素、一些有毒气体或微粒
完成课后相关练习
谢谢观看
谢谢观看
