3.1 铁的多样性 课件(共47张PPT)2023-2024学年高一化学鲁科版(2029)必修第一册
文档属性
| 名称 | 3.1 铁的多样性 课件(共47张PPT)2023-2024学年高一化学鲁科版(2029)必修第一册 |

|
|
| 格式 | pptx | ||
| 文件大小 | 2.3MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-11-21 15:21:42 | ||
图片预览











文档简介
(共47张PPT)
第3章 物质的性质与转化
第1节 铁的多样性
铁元素是重要的金属元素,在地壳中的含量仅次于氧、硅和铝元素。含有铁元素的物质,与人体健康密切相关,在人类的生产和生活中也有着重要应用。
含有铁元素的物质及其应用
铁元素在自然界中有的以游离态存在,如陨铁,更多的则以 +2 价或 +3 价的化合态存在。自然界中含有铁元素的矿石包括黄铁矿、赤铁矿、磁铁矿等。
我们日常生活用品中,也有许多含有铁元素的物质。例如,铁锅的主要成分是铁单质,补铁保健品中含有亚铁盐,粉刷墙壁的红色涂料中含有三氧化二铁,激光打印机的墨粉中含有四氧化三铁……这些含有铁元素的物质的应用与它们的性质密切相关。
一、亚铁盐和铁盐
常见的亚铁盐有硫酸亚铁、氯化亚铁等;常见的铁盐有硫酸铁、氯化铁等。
亚铁盐和铁盐的性质
实验目的
以硫酸亚铁、氯化铁为例,通过实验探究亚铁盐和铁盐的性质。
实验用品
FeSO4溶液,FeCl3溶液,NaOH 溶液,酸性KMnO4溶液,氯水,KSCN(硫氰酸钾) 溶液,KI溶液,淀粉溶液,铁粉,锌片,铜片;
试管,胶头滴管,镊子,药匙。
安全提示
氯水、稀硫酸、酸性KMnO4溶液等具有腐蚀性,取用时应避免沾到皮肤或衣服上;若沾到,请立即用大量清水冲洗。
预测与假设
(1)从物质类别角度:亚铁盐和铁盐都能与 溶液反应生成相应的铁的氢氧化物。
(2)从化合价角度:Fe3+具有较强 ;Fe2+既有 又有 。
还原性
碱
氧化性
氧化性
实验方案
(1)证明Fe2+、Fe3+与OH-能反应,需向亚铁盐、铁盐溶液中滴加碱性试剂,如 。
(2)证明Fe3+具有氧化性,需加入 剂,如 、 、KI溶液。
(3)证明Fe2+具有氧化性,需加入 剂,如锌,证明其具有还原性,需加入 剂,如 、酸性KMnO4等。
氯水
NaOH溶液
还原
铁
铜
还原
氧化
实验内容 实验现象 结论
先生成 沉淀,迅速变成 ,最后变成 沉淀 有关方程式有:
_________________________
_________________________
___________
实验步骤、现象和结论
(1)Fe2+、Fe3+与碱的反应
红褐色
白色
灰绿色
生成 沉淀 离子方程式有:
_______________________
红褐色
实验内容 实验现象 结论
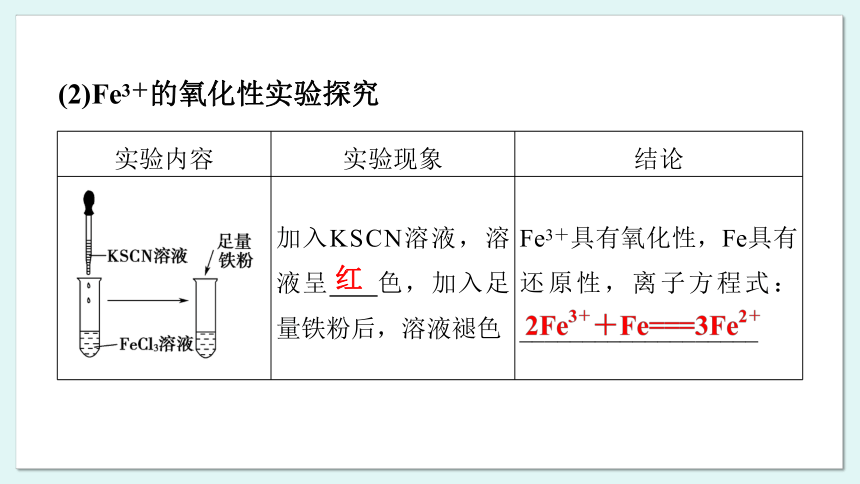
加入KSCN溶液,溶液呈 色,加入足量铁粉后,溶液褪色 Fe3+具有氧化性,Fe具有还原性,离子方程式:___________________
(2)Fe3+的氧化性实验探究
红
加入KSCN溶液,溶液呈 色,加入足量铜片后,溶液红色消失,变为蓝色 Fe3+具有氧化性,离子方程式:___________
__________________
红
实验内容 实验现象 结论
加入KSCN溶液,无明显现象,再滴加氯水溶液呈 色 Fe2+具有还原性,离子方程式:_______________
____________________,
Fe3++3SCN-===Fe(SCN)3
(3)Fe2+的氧化性和还原性实验探究
红
加入FeSO4溶液,酸性KMnO4溶液紫红色褪去,溶液略呈黄色 Fe2+具有还原性,被酸性KMnO4氧化为Fe3+
溶液由 色变为无色 Fe2+具有氧化性,离子方程式:___________
_______________
浅绿
方法导引
研究物质性质的两个基本角度
在研究物质的性质时,可以从物质类别、物质所含核心元素的化合价这两个基本角度预测物质可能具有的性质,并通过实验进行验证。
Fe3+的检验
依据 Fe3+与 SCN- 反应使溶液显红色的性质,可以用 KSCN 溶液检验Fe3+的存在。
FeCl3溶液与 KSCN 溶液的反应
从物质类别的角度看,亚铁盐 (如硫酸亚铁) 和铁盐(如氯化铁) 都属于盐类,都能与碱溶液反应生成相应的铁的氢氧化物。
从化合价的角度看,铁盐因含有 +3 价铁元素而具有氧化性。例如,FeCl3溶液分别与金属铁、铜或 KI溶液反应时,Fe3+皆被还原为 Fe2+。
FeCl3溶液与铁粉的反应
亚铁盐因含有 +2 价铁元素,既具有氧化性,又具有较强的还原性。例如,在 FeSO4溶液与金属锌的反应中,Fe2+被还原为铁单质,体现了亚铁盐的氧化性;在 FeSO4 溶液与氯水、酸性 KMnO4溶液的反应中,Fe2+被氧化为Fe3+ ,体现了亚铁盐的还原性。
FeSO4溶液与氯水的反应
FeSO4溶液与酸性KMnO4溶液的反应
二、铁、铁的氧化物和铁的氢氧化物
铁单质不能与冷水、热水发生反应,但能与水蒸气在高温条件下发生反应生成四氧化三铁和氢气。
铁单质与水蒸气的反应
三氧化二铁粉末与铝粉在高温条件下发生反应生成铁单质和氧化铝,并放出大量热。
利用三氧化二铁粉末与铝粉的反应焊接钢轨
铁单质、铁的氧化物、铁的氢氧化物都分别具有它们所属物质类别的一般性质。
纯净的铁是光亮的银白色金属,密度为 7.86 g·cm-3,熔点为 1538℃。纯铁的抗腐蚀能力很强,具有良好的延展性和导热性,导电性比铜、铝差,能被磁铁吸引。铁单质能与稀盐酸、稀硫酸等发生置换反应,放出氢气;还能与某些盐溶液发生置换反应,生成亚铁盐和其他金属单质。
不反应
方法 方法一 方法二
实验装置
铁与水蒸气的反应:
听到
听到轻微爆鸣声
爆鸣声
氧化亚铁(FeO)是一种黑色粉末,可以用作色素,如应用于瓷器制作中使釉呈绿色;四氧化三铁(Fe3O4)是具有磁性的黑色固体,是一种常用的磁性材料;三氧化二铁(Fe2O3)是一种红棕色粉末,常用作油漆、涂料、油墨的红色颜料。铁的氧化物都不溶于水,也不与水反应。氧化亚铁和三氧化二铁都属于碱性氧化物,它们皆能与稀盐酸或稀硫酸发生反应,生成相应的亚铁盐或铁盐。
氢氧化亚铁是白色固体,难于水;氢氧化铁是红褐色固体,也难溶于水。这两种铁的氢氧化物都能与稀盐酸或稀硫酸发生反应,生成相应的亚铁盐或铁盐。
从铁元素化合价的角度进行分析,可以进一步认识铁单质、铁的氧化物、铁的两种氢氧化物的性质。
铁单质中铁元素的化合价为0价,铁单质具有还原性,能与具有氧化性的物质发生反应。例如,铁单质与稀盐酸或稀硫酸反应,铁的化合价从0价变成 +2 价,体现了铁单质的还原性;在高温条件下,铁单质被水氧化成四氧化三铁,也体现了铁单质的还原性。
三氧化二铁中铁元素的化合价为 +3 价,具有降低的趋势,三氧化二铁表现出氧化性。在三氧化二铁粉末与铝粉的反应中,三氧化二铁就是氧化剂,表现出氧化性。
氧化亚铁、氢氧化亚铁中铁元素的化合价为 +2 价,具有升高的趋势,氧化亚铁、氢氧化亚铁具有还原性。实验表明,氢氧化亚铁很不稳定,容易被氧化。FeSO4溶液与NaOH 溶液反应产生的氢氧化亚铁白色沉淀,在空气中迅速变成灰绿色,最后变成红褐色,这是氢氧化亚铁被空气中的氧气氧化为氢氧化铁的缘故。
FeSO4溶液与 NaOH 溶液反应产生的氢氧化亚铁被空气中的氧气氧化为氢氧化铁
制备 可溶性亚铁盐与碱溶液反应Fe2++2OH-===Fe(OH)2↓ 可溶性铁盐与碱溶液反应Fe3++3OH-===Fe(OH)3↓
转化 在空气中,Fe(OH)2能够迅速地被氧气氧化成Fe(OH)3,现象是___________________________________________,______________________________,化学方程式为 _________________________________________
白色沉淀迅速变成灰绿色
最后变成红褐色
三、铁及其化合物之间的转化关系
铁元素具有多种价态。含有同种价态铁元素的物质之间可以相互转化,含有不同价态铁元素的物质在一定条件下也可以相互转化。
在下图中适当的位置标注含铁物质,完成铁及其化合物的“价—类”二维图,用箭头标明物质之间的转化关系并说明依据。
铁及其化合物之间存在两种转化关系:含有相同价态铁元素的物质之间的转化,可借助复分解反应等实现;含有不同价态铁元素的物质之间的转化,可借助氧化还原反应实现。
活动·探究
补铁剂中铁元素价态的检验
铁元素在人体中起着重要的作用。如果人体缺铁,就会出现贫血症状。轻度缺铁性贫血可用饮食疗法治疗,严重缺铁时则需要服用补铁剂。
补铁口服液是常见的补铁剂,其中除了含铁化合物外,还常添加抗氧化物质( 如维生素 C)、甜味剂、香精等。例如,某补铁口服液 100 mL 含铁元素 20~30 mg、维生素 C 200~300 mg。
实验目的
检验某补铁口服液中铁元素的价态。
实验用品
某补铁口服液,H2SO4溶液,NaOH 溶液,酸性KMnO4溶液,氯水,KSCN 溶液;
试管,胶头滴管。
安全提示
氯水、酸性KMnO4溶液等具有腐蚀性,取用时应避免沾到皮肤或衣服上;若沾到,请立即用大量清水冲洗。
实验步骤 实验现象 实验结论
(1)取少量补铁口服液于试管中,滴入KSCN溶液 a.不变红 _______
b.变红 _______
(2)若出现现象a,向反应后的溶液中滴加氯水 _________ _______
(3)若出现现象b,另取补铁剂滴加酸性KMnO4溶液 紫红色褪去 _______
紫红色不褪去 _______
补铁剂中铁元素价态的检验
溶液变红
利用铁及其化合物之间的转化关系可以解决许多实际问题,如铁及其化合物的制备、亚铁盐溶液的保存等,以满足人们生产活动和日常生活的需要。
身边的化学
铁元素与人体健康
铁元素是人体中含量最高的生命必需微量元素,承担着极其重要的生理功能。血红蛋白分子含有 Fe2+,正是这些 Fe2+ 使血红蛋白分子具有载氧功能,能将肺部吸入的氧气输送到全身各组织,供细胞使用。如果因为某种原因血红蛋白分子中的 Fe2+ 被氧化成 Fe 3+ ,这种血红蛋白分子就会丧失载氧能力,使人体出现缺氧症状。
人体内的铁元素主要来源于食物。动物血、肝脏、骨髓以及蛋黄、菠菜、木耳、葡萄红枣、大豆、芝麻等食物含有丰富的铁元素。研究结果显示,源自食物中的铁元素主要在小肠(尤其是十二指肠)内被吸收,并且人体只能吸收 Fe2+ 。由于维生素 C 具有还原性,可以将 Fe3+ 还原成 Fe2+ ,所以食用维生素 C 含量较高的食物有利于人体对铁元素的吸收。对于健康的成年人来说,合理的膳食完全可以满足人体对铁元素的需求。儿童和孕期妇女因需要摄入较多的铁元素,可额外补充。
完成课后相关练习
谢谢观看
谢谢观看
第3章 物质的性质与转化
第1节 铁的多样性
铁元素是重要的金属元素,在地壳中的含量仅次于氧、硅和铝元素。含有铁元素的物质,与人体健康密切相关,在人类的生产和生活中也有着重要应用。
含有铁元素的物质及其应用
铁元素在自然界中有的以游离态存在,如陨铁,更多的则以 +2 价或 +3 价的化合态存在。自然界中含有铁元素的矿石包括黄铁矿、赤铁矿、磁铁矿等。
我们日常生活用品中,也有许多含有铁元素的物质。例如,铁锅的主要成分是铁单质,补铁保健品中含有亚铁盐,粉刷墙壁的红色涂料中含有三氧化二铁,激光打印机的墨粉中含有四氧化三铁……这些含有铁元素的物质的应用与它们的性质密切相关。
一、亚铁盐和铁盐
常见的亚铁盐有硫酸亚铁、氯化亚铁等;常见的铁盐有硫酸铁、氯化铁等。
亚铁盐和铁盐的性质
实验目的
以硫酸亚铁、氯化铁为例,通过实验探究亚铁盐和铁盐的性质。
实验用品
FeSO4溶液,FeCl3溶液,NaOH 溶液,酸性KMnO4溶液,氯水,KSCN(硫氰酸钾) 溶液,KI溶液,淀粉溶液,铁粉,锌片,铜片;
试管,胶头滴管,镊子,药匙。
安全提示
氯水、稀硫酸、酸性KMnO4溶液等具有腐蚀性,取用时应避免沾到皮肤或衣服上;若沾到,请立即用大量清水冲洗。
预测与假设
(1)从物质类别角度:亚铁盐和铁盐都能与 溶液反应生成相应的铁的氢氧化物。
(2)从化合价角度:Fe3+具有较强 ;Fe2+既有 又有 。
还原性
碱
氧化性
氧化性
实验方案
(1)证明Fe2+、Fe3+与OH-能反应,需向亚铁盐、铁盐溶液中滴加碱性试剂,如 。
(2)证明Fe3+具有氧化性,需加入 剂,如 、 、KI溶液。
(3)证明Fe2+具有氧化性,需加入 剂,如锌,证明其具有还原性,需加入 剂,如 、酸性KMnO4等。
氯水
NaOH溶液
还原
铁
铜
还原
氧化
实验内容 实验现象 结论
先生成 沉淀,迅速变成 ,最后变成 沉淀 有关方程式有:
_________________________
_________________________
___________
实验步骤、现象和结论
(1)Fe2+、Fe3+与碱的反应
红褐色
白色
灰绿色
生成 沉淀 离子方程式有:
_______________________
红褐色
实验内容 实验现象 结论
加入KSCN溶液,溶液呈 色,加入足量铁粉后,溶液褪色 Fe3+具有氧化性,Fe具有还原性,离子方程式:___________________
(2)Fe3+的氧化性实验探究
红
加入KSCN溶液,溶液呈 色,加入足量铜片后,溶液红色消失,变为蓝色 Fe3+具有氧化性,离子方程式:___________
__________________
红
实验内容 实验现象 结论
加入KSCN溶液,无明显现象,再滴加氯水溶液呈 色 Fe2+具有还原性,离子方程式:_______________
____________________,
Fe3++3SCN-===Fe(SCN)3
(3)Fe2+的氧化性和还原性实验探究
红
加入FeSO4溶液,酸性KMnO4溶液紫红色褪去,溶液略呈黄色 Fe2+具有还原性,被酸性KMnO4氧化为Fe3+
溶液由 色变为无色 Fe2+具有氧化性,离子方程式:___________
_______________
浅绿
方法导引
研究物质性质的两个基本角度
在研究物质的性质时,可以从物质类别、物质所含核心元素的化合价这两个基本角度预测物质可能具有的性质,并通过实验进行验证。
Fe3+的检验
依据 Fe3+与 SCN- 反应使溶液显红色的性质,可以用 KSCN 溶液检验Fe3+的存在。
FeCl3溶液与 KSCN 溶液的反应
从物质类别的角度看,亚铁盐 (如硫酸亚铁) 和铁盐(如氯化铁) 都属于盐类,都能与碱溶液反应生成相应的铁的氢氧化物。
从化合价的角度看,铁盐因含有 +3 价铁元素而具有氧化性。例如,FeCl3溶液分别与金属铁、铜或 KI溶液反应时,Fe3+皆被还原为 Fe2+。
FeCl3溶液与铁粉的反应
亚铁盐因含有 +2 价铁元素,既具有氧化性,又具有较强的还原性。例如,在 FeSO4溶液与金属锌的反应中,Fe2+被还原为铁单质,体现了亚铁盐的氧化性;在 FeSO4 溶液与氯水、酸性 KMnO4溶液的反应中,Fe2+被氧化为Fe3+ ,体现了亚铁盐的还原性。
FeSO4溶液与氯水的反应
FeSO4溶液与酸性KMnO4溶液的反应
二、铁、铁的氧化物和铁的氢氧化物
铁单质不能与冷水、热水发生反应,但能与水蒸气在高温条件下发生反应生成四氧化三铁和氢气。
铁单质与水蒸气的反应
三氧化二铁粉末与铝粉在高温条件下发生反应生成铁单质和氧化铝,并放出大量热。
利用三氧化二铁粉末与铝粉的反应焊接钢轨
铁单质、铁的氧化物、铁的氢氧化物都分别具有它们所属物质类别的一般性质。
纯净的铁是光亮的银白色金属,密度为 7.86 g·cm-3,熔点为 1538℃。纯铁的抗腐蚀能力很强,具有良好的延展性和导热性,导电性比铜、铝差,能被磁铁吸引。铁单质能与稀盐酸、稀硫酸等发生置换反应,放出氢气;还能与某些盐溶液发生置换反应,生成亚铁盐和其他金属单质。
不反应
方法 方法一 方法二
实验装置
铁与水蒸气的反应:
听到
听到轻微爆鸣声
爆鸣声
氧化亚铁(FeO)是一种黑色粉末,可以用作色素,如应用于瓷器制作中使釉呈绿色;四氧化三铁(Fe3O4)是具有磁性的黑色固体,是一种常用的磁性材料;三氧化二铁(Fe2O3)是一种红棕色粉末,常用作油漆、涂料、油墨的红色颜料。铁的氧化物都不溶于水,也不与水反应。氧化亚铁和三氧化二铁都属于碱性氧化物,它们皆能与稀盐酸或稀硫酸发生反应,生成相应的亚铁盐或铁盐。
氢氧化亚铁是白色固体,难于水;氢氧化铁是红褐色固体,也难溶于水。这两种铁的氢氧化物都能与稀盐酸或稀硫酸发生反应,生成相应的亚铁盐或铁盐。
从铁元素化合价的角度进行分析,可以进一步认识铁单质、铁的氧化物、铁的两种氢氧化物的性质。
铁单质中铁元素的化合价为0价,铁单质具有还原性,能与具有氧化性的物质发生反应。例如,铁单质与稀盐酸或稀硫酸反应,铁的化合价从0价变成 +2 价,体现了铁单质的还原性;在高温条件下,铁单质被水氧化成四氧化三铁,也体现了铁单质的还原性。
三氧化二铁中铁元素的化合价为 +3 价,具有降低的趋势,三氧化二铁表现出氧化性。在三氧化二铁粉末与铝粉的反应中,三氧化二铁就是氧化剂,表现出氧化性。
氧化亚铁、氢氧化亚铁中铁元素的化合价为 +2 价,具有升高的趋势,氧化亚铁、氢氧化亚铁具有还原性。实验表明,氢氧化亚铁很不稳定,容易被氧化。FeSO4溶液与NaOH 溶液反应产生的氢氧化亚铁白色沉淀,在空气中迅速变成灰绿色,最后变成红褐色,这是氢氧化亚铁被空气中的氧气氧化为氢氧化铁的缘故。
FeSO4溶液与 NaOH 溶液反应产生的氢氧化亚铁被空气中的氧气氧化为氢氧化铁
制备 可溶性亚铁盐与碱溶液反应Fe2++2OH-===Fe(OH)2↓ 可溶性铁盐与碱溶液反应Fe3++3OH-===Fe(OH)3↓
转化 在空气中,Fe(OH)2能够迅速地被氧气氧化成Fe(OH)3,现象是___________________________________________,______________________________,化学方程式为 _________________________________________
白色沉淀迅速变成灰绿色
最后变成红褐色
三、铁及其化合物之间的转化关系
铁元素具有多种价态。含有同种价态铁元素的物质之间可以相互转化,含有不同价态铁元素的物质在一定条件下也可以相互转化。
在下图中适当的位置标注含铁物质,完成铁及其化合物的“价—类”二维图,用箭头标明物质之间的转化关系并说明依据。
铁及其化合物之间存在两种转化关系:含有相同价态铁元素的物质之间的转化,可借助复分解反应等实现;含有不同价态铁元素的物质之间的转化,可借助氧化还原反应实现。
活动·探究
补铁剂中铁元素价态的检验
铁元素在人体中起着重要的作用。如果人体缺铁,就会出现贫血症状。轻度缺铁性贫血可用饮食疗法治疗,严重缺铁时则需要服用补铁剂。
补铁口服液是常见的补铁剂,其中除了含铁化合物外,还常添加抗氧化物质( 如维生素 C)、甜味剂、香精等。例如,某补铁口服液 100 mL 含铁元素 20~30 mg、维生素 C 200~300 mg。
实验目的
检验某补铁口服液中铁元素的价态。
实验用品
某补铁口服液,H2SO4溶液,NaOH 溶液,酸性KMnO4溶液,氯水,KSCN 溶液;
试管,胶头滴管。
安全提示
氯水、酸性KMnO4溶液等具有腐蚀性,取用时应避免沾到皮肤或衣服上;若沾到,请立即用大量清水冲洗。
实验步骤 实验现象 实验结论
(1)取少量补铁口服液于试管中,滴入KSCN溶液 a.不变红 _______
b.变红 _______
(2)若出现现象a,向反应后的溶液中滴加氯水 _________ _______
(3)若出现现象b,另取补铁剂滴加酸性KMnO4溶液 紫红色褪去 _______
紫红色不褪去 _______
补铁剂中铁元素价态的检验
溶液变红
利用铁及其化合物之间的转化关系可以解决许多实际问题,如铁及其化合物的制备、亚铁盐溶液的保存等,以满足人们生产活动和日常生活的需要。
身边的化学
铁元素与人体健康
铁元素是人体中含量最高的生命必需微量元素,承担着极其重要的生理功能。血红蛋白分子含有 Fe2+,正是这些 Fe2+ 使血红蛋白分子具有载氧功能,能将肺部吸入的氧气输送到全身各组织,供细胞使用。如果因为某种原因血红蛋白分子中的 Fe2+ 被氧化成 Fe 3+ ,这种血红蛋白分子就会丧失载氧能力,使人体出现缺氧症状。
人体内的铁元素主要来源于食物。动物血、肝脏、骨髓以及蛋黄、菠菜、木耳、葡萄红枣、大豆、芝麻等食物含有丰富的铁元素。研究结果显示,源自食物中的铁元素主要在小肠(尤其是十二指肠)内被吸收,并且人体只能吸收 Fe2+ 。由于维生素 C 具有还原性,可以将 Fe3+ 还原成 Fe2+ ,所以食用维生素 C 含量较高的食物有利于人体对铁元素的吸收。对于健康的成年人来说,合理的膳食完全可以满足人体对铁元素的需求。儿童和孕期妇女因需要摄入较多的铁元素,可额外补充。
完成课后相关练习
谢谢观看
谢谢观看
