初中科学中考一轮复习专题——金属
图片预览




文档简介
(共15张PPT)
3.金属
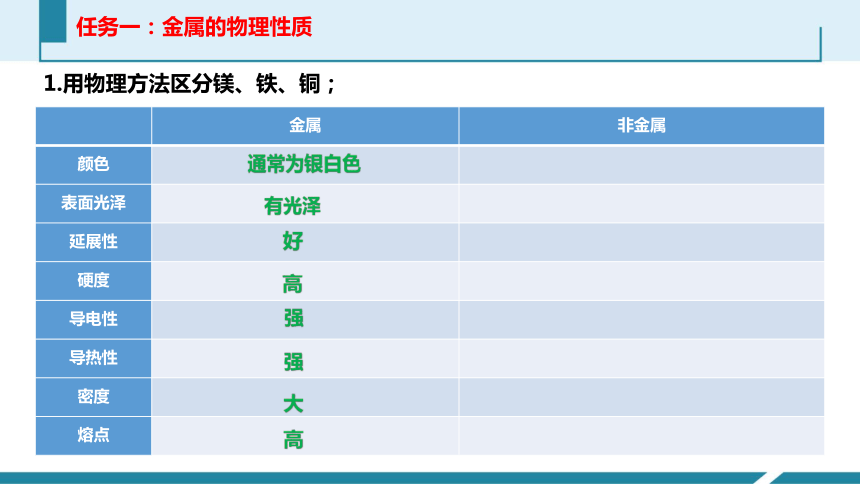
任务一:金属的物理性质
1.用物理方法区分镁、铁、铜;
金属 非金属
颜色
表面光泽
延展性
硬度
导电性
导热性
密度
熔点
通常为银白色
有光泽
好
高
强
强
大
高
1.(宁波)人类的生活和生产都离不开金属材料。下列金属制品中,主要利用金属导热性的是( )
[解析]选D。本题主要考查金属的性质与用途的关系。金属用作雕塑和车模主要是利用其延展性,用作导线是利用其导电性,用作炒锅是利用其导热性。
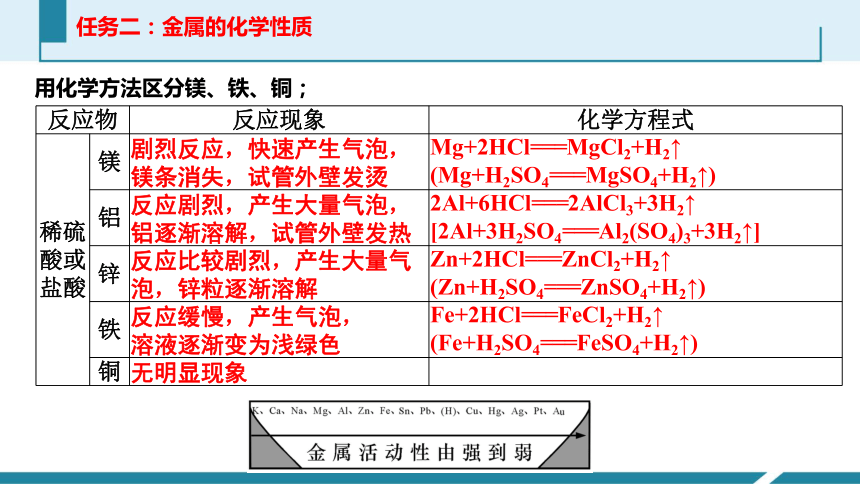
任务二:金属的化学性质
用化学方法区分镁、铁、铜;
反应物 反应现象 化学方程式
稀硫酸或盐酸 镁
铝
锌
铁
铜
(Fe+H2SO4===FeSO4+H2↑)
Fe+2HCl===FeCl2+H2↑
(Zn+H2SO4===ZnSO4+H2↑)
Zn+2HCl===ZnCl2+H2↑
[2Al+3H2SO4===Al2(SO4)3+3H2↑]
2Al+6HCl===2AlCl3+3H2↑
(Mg+H2SO4===MgSO4+H2↑)
Mg+2HCl===MgCl2+H2↑
无明显现象
溶液逐渐变为浅绿色
反应缓慢,产生气泡,
泡,锌粒逐渐溶解
反应比较剧烈,产生大量气
铝逐渐溶解,试管外壁发热
反应剧烈,产生大量气泡,
镁条消失,试管外壁发烫
剧烈反应,快速产生气泡,
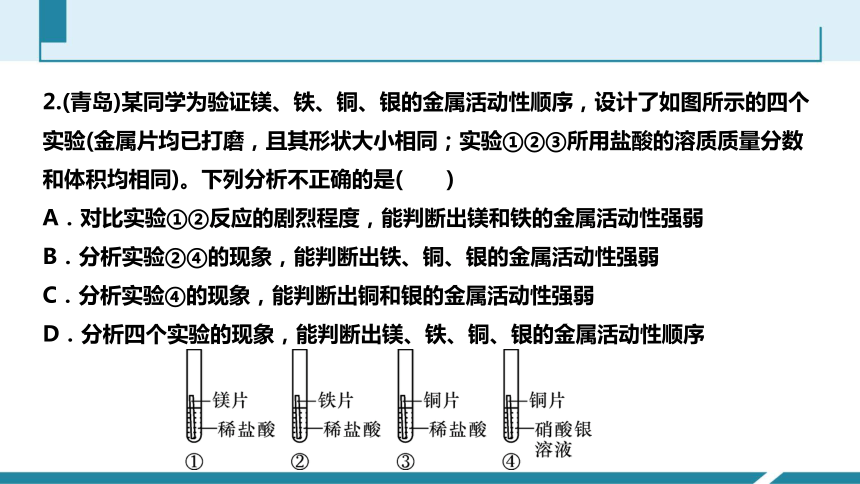
2.(青岛)某同学为验证镁、铁、铜、银的金属活动性顺序,设计了如图所示的四个实验(金属片均已打磨,且其形状大小相同;实验①②③所用盐酸的溶质质量分数和体积均相同)。下列分析不正确的是( )
A.对比实验①②反应的剧烈程度,能判断出镁和铁的金属活动性强弱
B.分析实验②④的现象,能判断出铁、铜、银的金属活动性强弱
C.分析实验④的现象,能判断出铜和银的金属活动性强弱
D.分析四个实验的现象,能判断出镁、铁、铜、银的金属活动性顺序
【答案】B
【解析】
A.镁和铁均属于活泼金属,都能与稀盐酸反应产生氢气,金属的活动性越强,金属与酸反应的越剧烈,产生气泡的速率越快,①中镁片表面产生气泡的速率大于②中铁片表面产生气泡的速率,说明镁比铁活泼;所以可通过对比实验①②反应的剧烈程度,能判断出镁和铁的金属活动性强弱,选项说法正确;
B.②中产生气泡,说明铁在H前面,④中铜片表面覆盖一层银白色物质,且溶液由无色变成蓝色,说明铜能置换出硝酸银中的银,即铜比银活泼,但是两个实验无法比较铁和铜的活动性强弱,选项说法错误;
C.④中铜片表面覆盖一层银白色物质,且溶液由无色变成蓝色,说明铜能置换出硝酸银中的银,即铜比银活泼,选项说法正确;
D.镁和铁均属于活泼金属,都能与稀盐酸反应产生氢气,金属的活动性越强,金属与酸反应的越剧烈,产生气泡的速率越快,①中镁片表面产生气泡的速率大于②中铁片表面产生气泡的速率,说明镁比铁活泼;而实验③中,铜片表面没有变化,说明说明铜的活动性小于镁和铁;④中铜片表面覆盖一层银白色物质,且溶液由无色变成蓝色,说明铜能置换出硝酸银中的银,即铜比银活泼。分析四个实验的现象,能判断出镁、铁、铜、银的金属活动性顺序,选项说法正确。
故选:B。
在金属活动性顺序中,位于氢前面的金属能置换出酸中的氢,位于前面的金属能把排在它后面的金属从其盐溶液中置换出来,据此判断能否发生反应,进而可确定四种金属活动性由强到弱的顺序。
3.(齐齐哈尔)向硝酸铜、硝酸银和硝酸镁的混合溶液中加入一定质量的金属锌,充分反应后过滤,得到滤渣和滤液,以下推断正确的是( )
A.若滤液为蓝色,则滤渣中一定有银和铜
B.若向滤液中加入稀盐酸无白色沉淀生成,则滤渣中一定有银和铜
C.若向滤渣中加入稀盐酸有气泡生成,则滤液中只含有硝酸镁和硝酸锌
D.若反应前加入的金属锌的质量和反应后滤渣的质量相等,则滤渣中一定不含锌和镁
C
任务三:金属防腐
讨论:日常生活中,我们经常见到各种各样的铁制品生锈,造成资源浪费,我们有哪些方法可以防止铁生锈?
金属锈蚀的条件:
1. 要有水分
2. 要有空气
3. 与内部结构有关
金属防护主要有三项措施:
1、保持干燥 、清洁 ,可以防止生锈
2、保护膜法(隔离空气) 如刷油漆、抹油脂等
3、改变金属材料的内部结构制成耐腐蚀的合金,如制成不锈钢等。
4.某同学根据铜绿[Cu2(OH)2CO3]的成分作出猜想:金属铜锈蚀的条件除有氧气和水外,还必须有二氧化碳,为证明“必须有二氧化碳”,需要进行如图所示实验中的( )
A. 甲和乙
B. 甲和丁
C. 乙和丁
D. 丙和丁
【答案】B
【解答】甲试管的铜片与氧气、水和二氧化碳同时接触发生了锈蚀;乙中的铜片与二氧化碳和水接触,没有锈蚀,说明铜的锈蚀与氧气有关;丙中的铜片与二氧化碳和氧气接触,没有锈蚀,说明铜的锈蚀与水有挂;丁中的铜片与氧气和水接触没有锈蚀,说明了铜的锈蚀与二氧化碳有关.由以上分析可知,通过实验甲与丁的对比得出:铜的锈蚀必须有二氧化碳参与.故选B.
【分析】欲验证铜的锈蚀与二氧化碳有关,则需要做一个没有二氧化碳存在的对比实验.
5.下列有关金属的实验操作不能达到实验目的的是( )
D
选项 实验目的 主要实验操作
A 检验Zn粉中是否有Fe粉 取样,加入足量的稀盐酸,观察溶液颜色
B 比较镁和铁的活动性 将镁片、铁片分别在空气中灼烧
C 除去Fe粉中的Zn粉 加入足量的硫酸亚铁溶液,过滤、洗涤、干燥
D 区分铜粉和银粉 取样,加入足量的稀盐酸,观察现象
6.化学兴趣小组举行“颜色接龙”大赛,接龙顺序:红色→黑色→浅绿色→无色→白色。下列选项将接龙颜色搞错的是( )
A.将CO通过灼热的红色四氧化三铁,生成黑色的铁
B.向黑色的铁粉中加入盐酸,生成浅绿色的氯化亚铁溶液
C.向浅绿色的氯化亚铁溶液中加入锌片,生成无色的氯化锌溶液
D.向无色的氯化锌溶液中加入硝酸银溶液,生成白色氯化银沉淀
A
5.化学兴趣小组同学要探究镁、铁、铜三种金属的活动性顺序,设计了如图所示的实验方案:
(1)试管乙中观察到的现象是 _
,反应的化学方程式为 。
(2)同学们经讨论后认为该方案可以优化, 试管的实验是多余的。同学们经讨论得出三种金属的活动性由强到弱的顺序为
> > 。
Cu
Fe
Mg
丙
Fe+CuSO4 ===FeSO4+Cu
为浅绿色
铁表面有红色物质析出,溶液由蓝色变
(3)去掉多余的实验,同学们将另两支试管中反应后的物质倒入同一大烧杯中,一段时间后过滤,得到不溶物和滤液,并对不溶物的成分进行如下探究:
【提出问题】烧杯中不溶物的成分是什么
【实验探究】向过滤得到的不溶物中加稀硫酸:
①若无气泡产生,则不溶物的成分是 ;
②若有气泡产生,则不溶物中一定含有 ,可能含有 。
镁
铜、铁
铜
3.金属
任务一:金属的物理性质
1.用物理方法区分镁、铁、铜;
金属 非金属
颜色
表面光泽
延展性
硬度
导电性
导热性
密度
熔点
通常为银白色
有光泽
好
高
强
强
大
高
1.(宁波)人类的生活和生产都离不开金属材料。下列金属制品中,主要利用金属导热性的是( )
[解析]选D。本题主要考查金属的性质与用途的关系。金属用作雕塑和车模主要是利用其延展性,用作导线是利用其导电性,用作炒锅是利用其导热性。
任务二:金属的化学性质
用化学方法区分镁、铁、铜;
反应物 反应现象 化学方程式
稀硫酸或盐酸 镁
铝
锌
铁
铜
(Fe+H2SO4===FeSO4+H2↑)
Fe+2HCl===FeCl2+H2↑
(Zn+H2SO4===ZnSO4+H2↑)
Zn+2HCl===ZnCl2+H2↑
[2Al+3H2SO4===Al2(SO4)3+3H2↑]
2Al+6HCl===2AlCl3+3H2↑
(Mg+H2SO4===MgSO4+H2↑)
Mg+2HCl===MgCl2+H2↑
无明显现象
溶液逐渐变为浅绿色
反应缓慢,产生气泡,
泡,锌粒逐渐溶解
反应比较剧烈,产生大量气
铝逐渐溶解,试管外壁发热
反应剧烈,产生大量气泡,
镁条消失,试管外壁发烫
剧烈反应,快速产生气泡,
2.(青岛)某同学为验证镁、铁、铜、银的金属活动性顺序,设计了如图所示的四个实验(金属片均已打磨,且其形状大小相同;实验①②③所用盐酸的溶质质量分数和体积均相同)。下列分析不正确的是( )
A.对比实验①②反应的剧烈程度,能判断出镁和铁的金属活动性强弱
B.分析实验②④的现象,能判断出铁、铜、银的金属活动性强弱
C.分析实验④的现象,能判断出铜和银的金属活动性强弱
D.分析四个实验的现象,能判断出镁、铁、铜、银的金属活动性顺序
【答案】B
【解析】
A.镁和铁均属于活泼金属,都能与稀盐酸反应产生氢气,金属的活动性越强,金属与酸反应的越剧烈,产生气泡的速率越快,①中镁片表面产生气泡的速率大于②中铁片表面产生气泡的速率,说明镁比铁活泼;所以可通过对比实验①②反应的剧烈程度,能判断出镁和铁的金属活动性强弱,选项说法正确;
B.②中产生气泡,说明铁在H前面,④中铜片表面覆盖一层银白色物质,且溶液由无色变成蓝色,说明铜能置换出硝酸银中的银,即铜比银活泼,但是两个实验无法比较铁和铜的活动性强弱,选项说法错误;
C.④中铜片表面覆盖一层银白色物质,且溶液由无色变成蓝色,说明铜能置换出硝酸银中的银,即铜比银活泼,选项说法正确;
D.镁和铁均属于活泼金属,都能与稀盐酸反应产生氢气,金属的活动性越强,金属与酸反应的越剧烈,产生气泡的速率越快,①中镁片表面产生气泡的速率大于②中铁片表面产生气泡的速率,说明镁比铁活泼;而实验③中,铜片表面没有变化,说明说明铜的活动性小于镁和铁;④中铜片表面覆盖一层银白色物质,且溶液由无色变成蓝色,说明铜能置换出硝酸银中的银,即铜比银活泼。分析四个实验的现象,能判断出镁、铁、铜、银的金属活动性顺序,选项说法正确。
故选:B。
在金属活动性顺序中,位于氢前面的金属能置换出酸中的氢,位于前面的金属能把排在它后面的金属从其盐溶液中置换出来,据此判断能否发生反应,进而可确定四种金属活动性由强到弱的顺序。
3.(齐齐哈尔)向硝酸铜、硝酸银和硝酸镁的混合溶液中加入一定质量的金属锌,充分反应后过滤,得到滤渣和滤液,以下推断正确的是( )
A.若滤液为蓝色,则滤渣中一定有银和铜
B.若向滤液中加入稀盐酸无白色沉淀生成,则滤渣中一定有银和铜
C.若向滤渣中加入稀盐酸有气泡生成,则滤液中只含有硝酸镁和硝酸锌
D.若反应前加入的金属锌的质量和反应后滤渣的质量相等,则滤渣中一定不含锌和镁
C
任务三:金属防腐
讨论:日常生活中,我们经常见到各种各样的铁制品生锈,造成资源浪费,我们有哪些方法可以防止铁生锈?
金属锈蚀的条件:
1. 要有水分
2. 要有空气
3. 与内部结构有关
金属防护主要有三项措施:
1、保持干燥 、清洁 ,可以防止生锈
2、保护膜法(隔离空气) 如刷油漆、抹油脂等
3、改变金属材料的内部结构制成耐腐蚀的合金,如制成不锈钢等。
4.某同学根据铜绿[Cu2(OH)2CO3]的成分作出猜想:金属铜锈蚀的条件除有氧气和水外,还必须有二氧化碳,为证明“必须有二氧化碳”,需要进行如图所示实验中的( )
A. 甲和乙
B. 甲和丁
C. 乙和丁
D. 丙和丁
【答案】B
【解答】甲试管的铜片与氧气、水和二氧化碳同时接触发生了锈蚀;乙中的铜片与二氧化碳和水接触,没有锈蚀,说明铜的锈蚀与氧气有关;丙中的铜片与二氧化碳和氧气接触,没有锈蚀,说明铜的锈蚀与水有挂;丁中的铜片与氧气和水接触没有锈蚀,说明了铜的锈蚀与二氧化碳有关.由以上分析可知,通过实验甲与丁的对比得出:铜的锈蚀必须有二氧化碳参与.故选B.
【分析】欲验证铜的锈蚀与二氧化碳有关,则需要做一个没有二氧化碳存在的对比实验.
5.下列有关金属的实验操作不能达到实验目的的是( )
D
选项 实验目的 主要实验操作
A 检验Zn粉中是否有Fe粉 取样,加入足量的稀盐酸,观察溶液颜色
B 比较镁和铁的活动性 将镁片、铁片分别在空气中灼烧
C 除去Fe粉中的Zn粉 加入足量的硫酸亚铁溶液,过滤、洗涤、干燥
D 区分铜粉和银粉 取样,加入足量的稀盐酸,观察现象
6.化学兴趣小组举行“颜色接龙”大赛,接龙顺序:红色→黑色→浅绿色→无色→白色。下列选项将接龙颜色搞错的是( )
A.将CO通过灼热的红色四氧化三铁,生成黑色的铁
B.向黑色的铁粉中加入盐酸,生成浅绿色的氯化亚铁溶液
C.向浅绿色的氯化亚铁溶液中加入锌片,生成无色的氯化锌溶液
D.向无色的氯化锌溶液中加入硝酸银溶液,生成白色氯化银沉淀
A
5.化学兴趣小组同学要探究镁、铁、铜三种金属的活动性顺序,设计了如图所示的实验方案:
(1)试管乙中观察到的现象是 _
,反应的化学方程式为 。
(2)同学们经讨论后认为该方案可以优化, 试管的实验是多余的。同学们经讨论得出三种金属的活动性由强到弱的顺序为
> > 。
Cu
Fe
Mg
丙
Fe+CuSO4 ===FeSO4+Cu
为浅绿色
铁表面有红色物质析出,溶液由蓝色变
(3)去掉多余的实验,同学们将另两支试管中反应后的物质倒入同一大烧杯中,一段时间后过滤,得到不溶物和滤液,并对不溶物的成分进行如下探究:
【提出问题】烧杯中不溶物的成分是什么
【实验探究】向过滤得到的不溶物中加稀硫酸:
①若无气泡产生,则不溶物的成分是 ;
②若有气泡产生,则不溶物中一定含有 ,可能含有 。
镁
铜、铁
铜
同课章节目录
