初中科学中考一轮复习专题——常见的碱
图片预览




文档简介
2.常见的碱
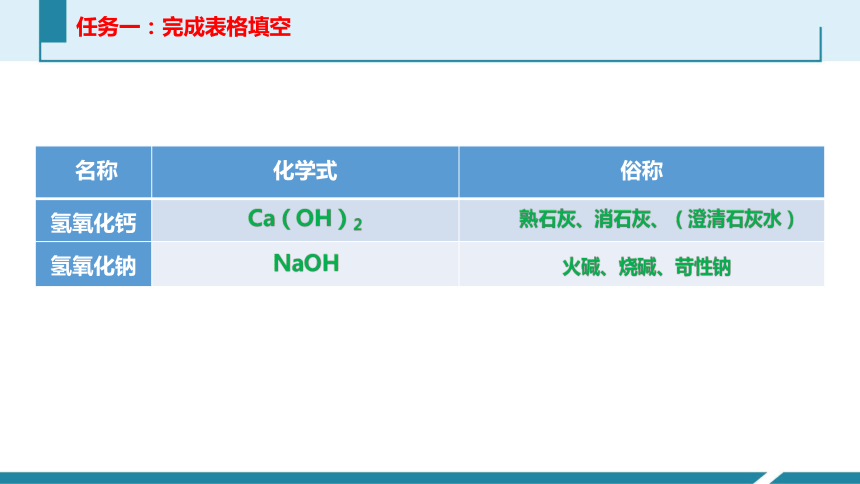
任务一:完成表格填空
{5C22544A-7EE6-4342-B048-85BDC9FD1C3A}?名称
化学式
俗称
氢氧化钙
氢氧化钠
Ca(OH)2
NaOH
熟石灰、消石灰、(澄清石灰水)
火碱、烧碱、苛性钠
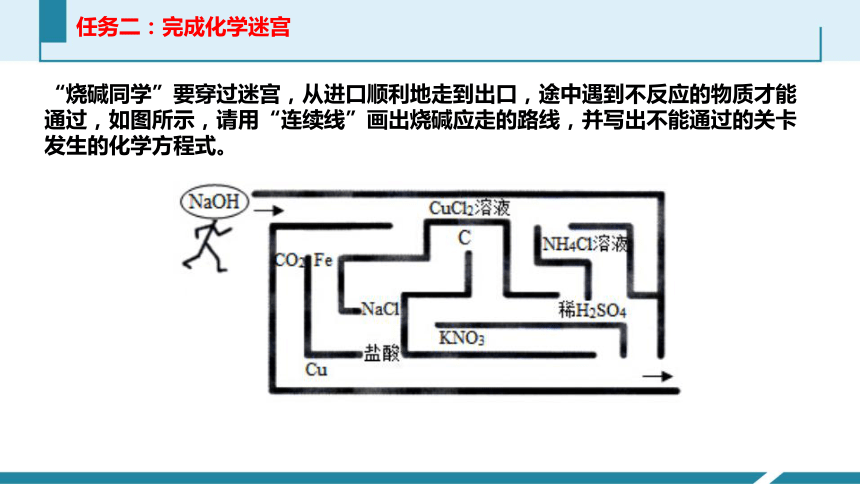
任务二:完成化学迷宫
“烧碱同学”要穿过迷宫,从进口顺利地走到出口,途中遇到不反应的物质才能通过,如图所示,请用“连续线”画出烧碱应走的路线,并写出不能通过的关卡发生的化学方程式。
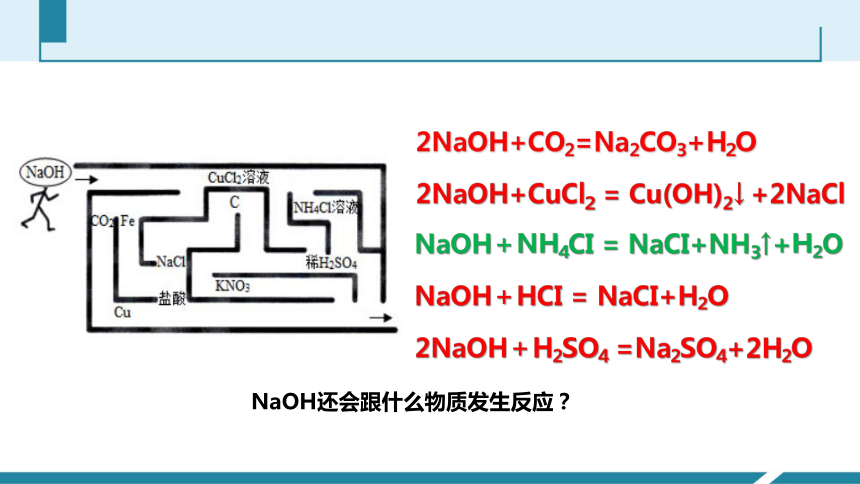
2NaOH+CO2=Na2CO3+H2O
2NaOH+CuCl2 = Cu(OH)2↓ +2NaCl
NaOH+HCI = NaCI+H2O
2NaOH+H2SO4 =Na2SO4+2H2O
NaOH+NH4CI = NaCI+NH3↑+H2O
NaOH还会跟什么物质发生反应?
任务三:碱的通性
1.根据任务二总结碱的化学性质;
2.仿照“金属+酸→盐+氢气”的形式,再次总结碱的化学性质;
(1)碱+酸碱指示剂→有色物质
(2)碱+酸性氧化物→盐+水
(3)碱+酸→盐+水
(4)碱+盐→新碱+新盐
酸性氧化物指CO2、SO2、SO3、氮的氧化物,不包括CO
反应物中的碱和盐都要求为溶液,且满足复分解的条件,该反应才能进行
碱要求形成碱溶液,该反应才能进行
任务四:区分氢氧化钠和氢氧化钙
实验室里有两瓶白色固体,已知分别是氢氧化钠和氢氧化钙固体,但是由于标签模糊,已经分不清楚哪瓶是哪瓶,你有哪些办法区分它们并说明理由呢?
(1)看形状
NaOH
Ca(OH)2
(2)取适量固体,加适量水,固体全部溶解的是NaOH,部分溶解的是Ca(OH)2
氢氧化钠易溶于水,氢氧化钙微溶于水
(4)取适量固体,分别放在两个表面皿中,过一段时间,固体表面变潮湿的是NaOH,无明显现象的是Ca(OH)2
氢氧化钠具有吸水性,在空气中易潮解
(3)取适量固体,加适量水,水温升高更明显的是NaOH
氢氧化钠溶于水会放出大量的热
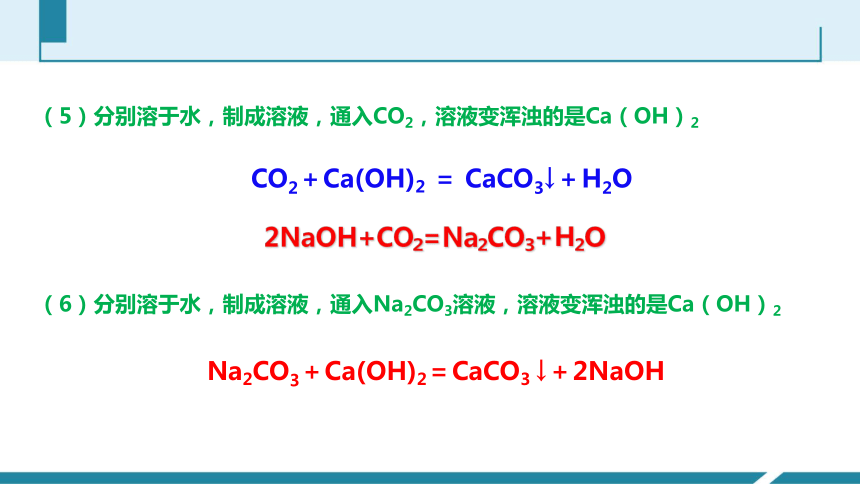
(5)分别溶于水,制成溶液,通入CO2,溶液变浑浊的是Ca(OH)2
2NaOH+CO2=Na2CO3+H2O
CO2+Ca(OH)2 = CaCO3↓+H2O
(6)分别溶于水,制成溶液,通入Na2CO3溶液,溶液变浑浊的是Ca(OH)2
Na2CO3+Ca(OH)2=CaCO3 ↓+2NaOH
1.下列四种物质中,在一定条件下能与其它三种物质发生反应的是( )
A.H2SO4 B.NaOH C.CO2 D.CuCl2
分析:A、根据硫酸不会与氯化铜反应进行分析;
B、根据氢氧化钠会与其余三种物质反应进行分析;
C、根据二氧化碳不会与硫酸反应进行分析;
D、根据氯化铜不会与硫酸反应进行分析.
解答:解:A、硫酸不会与二氧化碳和氯化铜反应,不满足要求,故A错误;
B、氢氧化钠和硫酸反应生成硫酸钠,和二氧化碳反应生成硅酸钠,和氯化铜反应生成氢氧化铜沉淀,满足要求,故B正确;
C、二氧化碳不会与硫酸和氯化铜反应,不满足要求,故C错误;
D、氯化铜不会与硫酸和二氧化碳反应,不满足要求,故D错误;
故选:B.
2.已知氧氧化钾(KOH)可溶于水,其化学性质与氢氧化钠相似.下列对氢氧化钾的化学性质叙述错误的是( )
A. 能使紫色石蕊溶液变红
B. 能使无色酚酞溶液变红
C. 能与稀盐酸反应
D. 能与二氧化碳反应
A
【分析】因为氢氧化钾(KOH)可溶于水,其化学性质与氢氧化钠相似,所以氢氧化钾(KOH)能与二氧化碳反应、能与稀硫酸反应、能使无色酚酞溶液变红、能使紫色石蕊溶液变蓝.
3.如图是氢氧化钠和盐酸反应过程中,溶液pH变化的曲线图。下列有关该实验事实的说法错误的是( )
A. 该实验是将盐酸滴入氢氧化钠溶液中
B. 该实验说明在蒸馏水中加入微量的酸或碱,溶液的pH会发生较大的变化
C. C点时的溶液能使酚酞试液变红
D. A点时的溶液中的溶质有氯化钠和氢氧化钠两种物质
【答案】C
【解析】溶液的pH小于7,溶液呈酸性,pH越小,酸性越强;溶液的pH大于7,溶液呈碱性,pH越大碱性越强;pH等于7,溶液呈中性。A. 由图中信息可知,反应中溶液的pH由大于7逐渐减小至小于7,故该实验是将盐酸滴入氢氧化钠溶液中,正确;B. pH为7的前后溶液的pH变化特显著,说明在蒸馏水中加入微量的酸或碱,溶液的pH会发生较大的变化,正确;C. C点时,酸过量,溶液的溶质是氯化钠和氯化氢,溶液显酸性,不能使酚酞试液变红,错误;D. A点时,酸不足,氢氧化钠有剩余,溶液中的溶质有生成氯化钠和剩余的氢氧化钠两种物质,正确。故选C。
4.为验证 Ba(OH)2的化学性质做如图所示的四个实验:
(1) 实验一中能够观察到的明显现象是 。
(2) 实验二、三验证了 Ba(OH)2能和某些 (填物质类别)发生化学反应。
(3) 实验四中发生反应的化学方程式为 。
(4) 将上述实验后四支试管中的所有物质倒入同一个烧杯,充分混合后过滤,得到白色固体和溶液 A。取一定量溶液 A,加入少量 Ba(OH)2溶液,振荡后只得到无色溶液。综上分析,溶液A 中除酚酞外,一定还含有的溶质是________________________。
【答案】 溶液由无色变红;盐;Ba(OH)2+2HCl=BaCl2+2H2O;NaCl、HCl和MgCl2
【解析】
(1)氢氧化钡是碱性溶液,故能使酚酞溶液由无色变红;
(2)由题可知,实验2、3都是氢氧化钡与盐发生的反应;
(3)实验4是稀盐酸和氢氧化钡反应生成氯化钡和水,反应方程式为Ba(OH)2+2HCl=BaCl2+2H2O;
(4)上述实验后四支试管中的所有物质倒入同一个烧杯,充分混合后过滤,得到白色固体和溶液A,向溶液A中加入氢氧化钡,得到无色溶液,而混合溶液中有酚酞,说明溶液A中一定有稀盐酸与氢氧化钡发生了反应而导致溶液没有变红,溶液A中有稀盐酸,则溶液中一定不可能有氢氧化钡,则一定会与实验3中生成的氢氧化钠反应生成氯化钠,与实验2中的生成的氢氧化镁反应生成氯化镁,加入氢氧化钡后没有沉淀生成,说明溶液A中一定没有硫酸钠,故溶液A一定含有的溶质是NaCl、HCl和MgCl2
5.(嘉兴)复方碳酸氢钠片是一种常用的抗酸剂药物,口服后能迅速中和胃酸,用于缓解胃酸过多引起的胃痛等症状。复方碳酸氢钠片的主要成分是碳酸氢钠(其他成分可溶于水但不参与反应),碳酸氢钠与盐酸反应的化学方程式为:NaHCO3+HCl===NaCl+H2O+CO2↑。
某科学兴趣小组为了测定药片中碳酸氢钠的含量做了以下实验:先将复方碳酸氢钠片制成粉末,取 10 克分多次放入盛有 100 克稀盐酸的烧杯中充分反应。测出加入的粉末质量和反应后的溶液质量,两者质量关系如图所示。
(1)实验后,兴趣小组又往烧杯中加入少量粉末,观察到______________,说明上述实验结束时稀盐酸过量。
(2)计算复方碳酸氢钠片中碳酸氢钠的含量。
(3)计算 10 克粉末与稀盐酸反应后所得氯化钠溶液的溶质质量分数。(计算结果精确到 0.1%)
【考点】有关溶质质量分数的简单计算;根据化学反应方程式的计算.
【专题】溶质质量分数与化学方程式相结合的计算.
【分析】(1)根据质量守恒定律和图象分析、计算生成二氧化碳的质量;
(2)根据碳酸氢钠和盐酸反应生成氯化钠、水和二氧化碳分析回答;
(3)根据二氧化碳的质量及反应的化学方程式可计算碳酸氢钠的含量、生成的氯化钠的质量,再计算复方碳酸氢钠片中碳酸氢钠的含量;
(4)根据溶质质量分数的计算公式计算。
3.常见的盐
任务一:完成表格填空
{5C22544A-7EE6-4342-B048-85BDC9FD1C3A}?名称
化学式
俗称
氯化钠
碳酸钠
碳酸氢钠
碳酸钙
NaCl
Na2CO3
食盐
纯碱、苏打
NaHCO3
CaCO3
小苏打
大理石、石灰石的主要成分
任务二:用化学方程式解决问题
1. 不能用铁桶配制农药波尔多液(含有硫酸铜); 2. 泡沫灭火器的灭火原理(原材料是盐酸和碳酸钠); 3. 工业上用熟石灰和纯碱反应制取烧碱; 4. 硫酸铜溶液和氯化钡溶液反应生成不溶于酸的白色沉淀。
1.Fe+CuSO4=FeSO4+Cu
2.Na2CO3+2HCl=2NaCl+CO2↑+H2O
3.Na2CO3+Ca(OH)2=CaCO3 ↓+2NaOH
4.CuSO4+BaCl2=BaSO4↓+CuCl2
任务三:盐的性质
1.根据任务二总结盐的化学性质;
2.仿照“酸+碱→盐+水”的形式,再次总结碱的化学性质;
(1)盐+金属→新盐+新金属
(2)盐+酸→新盐+新酸
(3)盐+碱→新盐+新碱
(4)盐+盐→新盐1+新盐2
3.在你总结的盐的性质中,说明每一条性质的注意事项;
任务四:复分解反应
1.观察任务二中的四条化学方程式,其中属于复分解反应的有哪些?
2. 总结复分解反应的通式和发生条件;
3.根据总结的复分解反应条件,判断下列物质间是否能发生反应,并简单说明理由;
{5C22544A-7EE6-4342-B048-85BDC9FD1C3A}?
H2SO4
BaCl2
NaOH
Na2CO3
H2SO4
×
BaCl2
×
NaOH
×
Na2CO3
×
任务一:完成表格填空
{5C22544A-7EE6-4342-B048-85BDC9FD1C3A}?名称
化学式
俗称
氢氧化钙
氢氧化钠
Ca(OH)2
NaOH
熟石灰、消石灰、(澄清石灰水)
火碱、烧碱、苛性钠
任务二:完成化学迷宫
“烧碱同学”要穿过迷宫,从进口顺利地走到出口,途中遇到不反应的物质才能通过,如图所示,请用“连续线”画出烧碱应走的路线,并写出不能通过的关卡发生的化学方程式。
2NaOH+CO2=Na2CO3+H2O
2NaOH+CuCl2 = Cu(OH)2↓ +2NaCl
NaOH+HCI = NaCI+H2O
2NaOH+H2SO4 =Na2SO4+2H2O
NaOH+NH4CI = NaCI+NH3↑+H2O
NaOH还会跟什么物质发生反应?
任务三:碱的通性
1.根据任务二总结碱的化学性质;
2.仿照“金属+酸→盐+氢气”的形式,再次总结碱的化学性质;
(1)碱+酸碱指示剂→有色物质
(2)碱+酸性氧化物→盐+水
(3)碱+酸→盐+水
(4)碱+盐→新碱+新盐
酸性氧化物指CO2、SO2、SO3、氮的氧化物,不包括CO
反应物中的碱和盐都要求为溶液,且满足复分解的条件,该反应才能进行
碱要求形成碱溶液,该反应才能进行
任务四:区分氢氧化钠和氢氧化钙
实验室里有两瓶白色固体,已知分别是氢氧化钠和氢氧化钙固体,但是由于标签模糊,已经分不清楚哪瓶是哪瓶,你有哪些办法区分它们并说明理由呢?
(1)看形状
NaOH
Ca(OH)2
(2)取适量固体,加适量水,固体全部溶解的是NaOH,部分溶解的是Ca(OH)2
氢氧化钠易溶于水,氢氧化钙微溶于水
(4)取适量固体,分别放在两个表面皿中,过一段时间,固体表面变潮湿的是NaOH,无明显现象的是Ca(OH)2
氢氧化钠具有吸水性,在空气中易潮解
(3)取适量固体,加适量水,水温升高更明显的是NaOH
氢氧化钠溶于水会放出大量的热
(5)分别溶于水,制成溶液,通入CO2,溶液变浑浊的是Ca(OH)2
2NaOH+CO2=Na2CO3+H2O
CO2+Ca(OH)2 = CaCO3↓+H2O
(6)分别溶于水,制成溶液,通入Na2CO3溶液,溶液变浑浊的是Ca(OH)2
Na2CO3+Ca(OH)2=CaCO3 ↓+2NaOH
1.下列四种物质中,在一定条件下能与其它三种物质发生反应的是( )
A.H2SO4 B.NaOH C.CO2 D.CuCl2
分析:A、根据硫酸不会与氯化铜反应进行分析;
B、根据氢氧化钠会与其余三种物质反应进行分析;
C、根据二氧化碳不会与硫酸反应进行分析;
D、根据氯化铜不会与硫酸反应进行分析.
解答:解:A、硫酸不会与二氧化碳和氯化铜反应,不满足要求,故A错误;
B、氢氧化钠和硫酸反应生成硫酸钠,和二氧化碳反应生成硅酸钠,和氯化铜反应生成氢氧化铜沉淀,满足要求,故B正确;
C、二氧化碳不会与硫酸和氯化铜反应,不满足要求,故C错误;
D、氯化铜不会与硫酸和二氧化碳反应,不满足要求,故D错误;
故选:B.
2.已知氧氧化钾(KOH)可溶于水,其化学性质与氢氧化钠相似.下列对氢氧化钾的化学性质叙述错误的是( )
A. 能使紫色石蕊溶液变红
B. 能使无色酚酞溶液变红
C. 能与稀盐酸反应
D. 能与二氧化碳反应
A
【分析】因为氢氧化钾(KOH)可溶于水,其化学性质与氢氧化钠相似,所以氢氧化钾(KOH)能与二氧化碳反应、能与稀硫酸反应、能使无色酚酞溶液变红、能使紫色石蕊溶液变蓝.
3.如图是氢氧化钠和盐酸反应过程中,溶液pH变化的曲线图。下列有关该实验事实的说法错误的是( )
A. 该实验是将盐酸滴入氢氧化钠溶液中
B. 该实验说明在蒸馏水中加入微量的酸或碱,溶液的pH会发生较大的变化
C. C点时的溶液能使酚酞试液变红
D. A点时的溶液中的溶质有氯化钠和氢氧化钠两种物质
【答案】C
【解析】溶液的pH小于7,溶液呈酸性,pH越小,酸性越强;溶液的pH大于7,溶液呈碱性,pH越大碱性越强;pH等于7,溶液呈中性。A. 由图中信息可知,反应中溶液的pH由大于7逐渐减小至小于7,故该实验是将盐酸滴入氢氧化钠溶液中,正确;B. pH为7的前后溶液的pH变化特显著,说明在蒸馏水中加入微量的酸或碱,溶液的pH会发生较大的变化,正确;C. C点时,酸过量,溶液的溶质是氯化钠和氯化氢,溶液显酸性,不能使酚酞试液变红,错误;D. A点时,酸不足,氢氧化钠有剩余,溶液中的溶质有生成氯化钠和剩余的氢氧化钠两种物质,正确。故选C。
4.为验证 Ba(OH)2的化学性质做如图所示的四个实验:
(1) 实验一中能够观察到的明显现象是 。
(2) 实验二、三验证了 Ba(OH)2能和某些 (填物质类别)发生化学反应。
(3) 实验四中发生反应的化学方程式为 。
(4) 将上述实验后四支试管中的所有物质倒入同一个烧杯,充分混合后过滤,得到白色固体和溶液 A。取一定量溶液 A,加入少量 Ba(OH)2溶液,振荡后只得到无色溶液。综上分析,溶液A 中除酚酞外,一定还含有的溶质是________________________。
【答案】 溶液由无色变红;盐;Ba(OH)2+2HCl=BaCl2+2H2O;NaCl、HCl和MgCl2
【解析】
(1)氢氧化钡是碱性溶液,故能使酚酞溶液由无色变红;
(2)由题可知,实验2、3都是氢氧化钡与盐发生的反应;
(3)实验4是稀盐酸和氢氧化钡反应生成氯化钡和水,反应方程式为Ba(OH)2+2HCl=BaCl2+2H2O;
(4)上述实验后四支试管中的所有物质倒入同一个烧杯,充分混合后过滤,得到白色固体和溶液A,向溶液A中加入氢氧化钡,得到无色溶液,而混合溶液中有酚酞,说明溶液A中一定有稀盐酸与氢氧化钡发生了反应而导致溶液没有变红,溶液A中有稀盐酸,则溶液中一定不可能有氢氧化钡,则一定会与实验3中生成的氢氧化钠反应生成氯化钠,与实验2中的生成的氢氧化镁反应生成氯化镁,加入氢氧化钡后没有沉淀生成,说明溶液A中一定没有硫酸钠,故溶液A一定含有的溶质是NaCl、HCl和MgCl2
5.(嘉兴)复方碳酸氢钠片是一种常用的抗酸剂药物,口服后能迅速中和胃酸,用于缓解胃酸过多引起的胃痛等症状。复方碳酸氢钠片的主要成分是碳酸氢钠(其他成分可溶于水但不参与反应),碳酸氢钠与盐酸反应的化学方程式为:NaHCO3+HCl===NaCl+H2O+CO2↑。
某科学兴趣小组为了测定药片中碳酸氢钠的含量做了以下实验:先将复方碳酸氢钠片制成粉末,取 10 克分多次放入盛有 100 克稀盐酸的烧杯中充分反应。测出加入的粉末质量和反应后的溶液质量,两者质量关系如图所示。
(1)实验后,兴趣小组又往烧杯中加入少量粉末,观察到______________,说明上述实验结束时稀盐酸过量。
(2)计算复方碳酸氢钠片中碳酸氢钠的含量。
(3)计算 10 克粉末与稀盐酸反应后所得氯化钠溶液的溶质质量分数。(计算结果精确到 0.1%)
【考点】有关溶质质量分数的简单计算;根据化学反应方程式的计算.
【专题】溶质质量分数与化学方程式相结合的计算.
【分析】(1)根据质量守恒定律和图象分析、计算生成二氧化碳的质量;
(2)根据碳酸氢钠和盐酸反应生成氯化钠、水和二氧化碳分析回答;
(3)根据二氧化碳的质量及反应的化学方程式可计算碳酸氢钠的含量、生成的氯化钠的质量,再计算复方碳酸氢钠片中碳酸氢钠的含量;
(4)根据溶质质量分数的计算公式计算。
3.常见的盐
任务一:完成表格填空
{5C22544A-7EE6-4342-B048-85BDC9FD1C3A}?名称
化学式
俗称
氯化钠
碳酸钠
碳酸氢钠
碳酸钙
NaCl
Na2CO3
食盐
纯碱、苏打
NaHCO3
CaCO3
小苏打
大理石、石灰石的主要成分
任务二:用化学方程式解决问题
1. 不能用铁桶配制农药波尔多液(含有硫酸铜); 2. 泡沫灭火器的灭火原理(原材料是盐酸和碳酸钠); 3. 工业上用熟石灰和纯碱反应制取烧碱; 4. 硫酸铜溶液和氯化钡溶液反应生成不溶于酸的白色沉淀。
1.Fe+CuSO4=FeSO4+Cu
2.Na2CO3+2HCl=2NaCl+CO2↑+H2O
3.Na2CO3+Ca(OH)2=CaCO3 ↓+2NaOH
4.CuSO4+BaCl2=BaSO4↓+CuCl2
任务三:盐的性质
1.根据任务二总结盐的化学性质;
2.仿照“酸+碱→盐+水”的形式,再次总结碱的化学性质;
(1)盐+金属→新盐+新金属
(2)盐+酸→新盐+新酸
(3)盐+碱→新盐+新碱
(4)盐+盐→新盐1+新盐2
3.在你总结的盐的性质中,说明每一条性质的注意事项;
任务四:复分解反应
1.观察任务二中的四条化学方程式,其中属于复分解反应的有哪些?
2. 总结复分解反应的通式和发生条件;
3.根据总结的复分解反应条件,判断下列物质间是否能发生反应,并简单说明理由;
{5C22544A-7EE6-4342-B048-85BDC9FD1C3A}?
H2SO4
BaCl2
NaOH
Na2CO3
H2SO4
×
BaCl2
×
NaOH
×
Na2CO3
×
同课章节目录
