2.1.1 物质的分离提纯 课件(共42张PPT) 2023-2024学年高一化学苏教版(2029)必修第一册
文档属性
| 名称 | 2.1.1 物质的分离提纯 课件(共42张PPT) 2023-2024学年高一化学苏教版(2029)必修第一册 |

|
|
| 格式 | ppt | ||
| 文件大小 | 2.2MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-11-21 00:00:00 | ||
图片预览










文档简介
(共42张PPT)
必 修 一
学
化
J
S
第一单元 研究物质的实验方法
课时 1 1.2 物质的分离提纯
日常生活中,我们所接触的各种各样的物质,大多数都是混合物,而化学研究、工业生产中经常要对混合物进行分离和提纯,如:自来水的净化处理、海水通过日晒得到粗盐等。
分离:通过适当的方法,把混合物中的几种物质分开,每种组分都要保留下来并恢复到原状态 (如原来是固体,最后还是固体),得到比较纯的物质。
提纯:通过物理或化学方法,将混合物中的杂质(不需要的物质) 除掉而得到所需物质的过程。
分离和提纯有什么不同?
辨别概念
如果有铁屑和铜屑的混合物,你能用哪些方法将铁屑分离除去?
1、用磁铁
2、加盐酸
物理方法
化学方法
方法2中如何分离出铜屑?
通过怎样的操作可以从溶液中得到固体?
讨论:
问题讨论
原理:利用物质的溶解性差异,将液体和不溶于液体的固体分离开来。
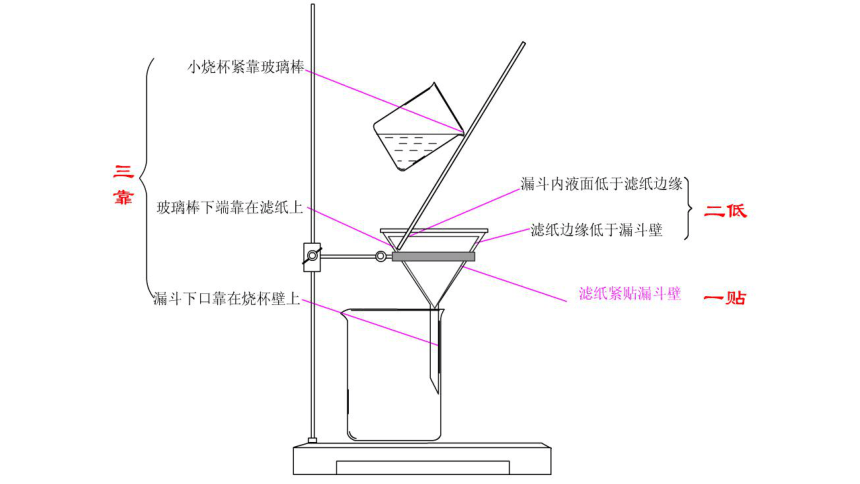
一、过滤
仪器:漏斗、滤纸、铁架台(含铁圈)、烧杯、玻璃棒。
操作要点:一贴、
二低、
三靠。
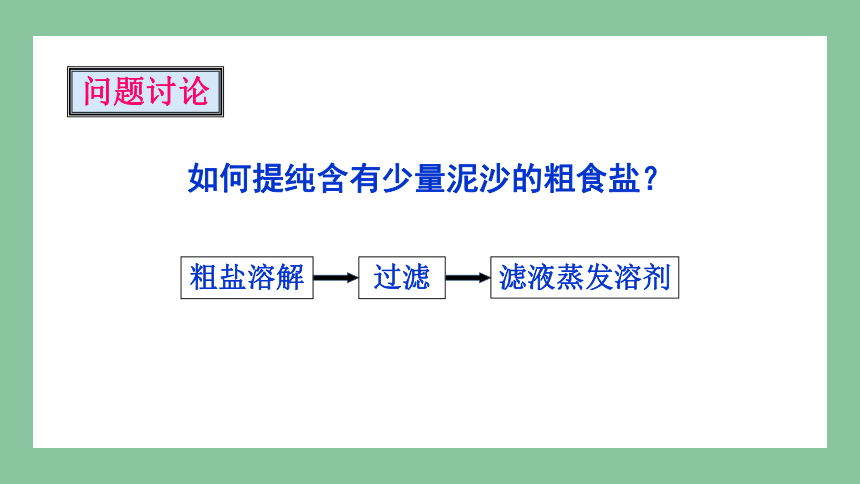
如何提纯含有少量泥沙的粗食盐?
粗盐溶解
过滤
滤液蒸发溶剂
问题讨论
原理:利用加热的方法,使溶液中溶剂不
断挥发而析出溶质(晶体)的过程。
仪器:蒸发皿、铁架台(铁圈)、酒精灯
(1)蒸发结晶
二、结晶
操作注意事项:
1. 蒸发皿中的液体不能超过其容积的2/3。
3. 当出现大量固体时,应停止加热用余热蒸干。
2. 蒸发过程中必须用玻璃棒不断搅拌,防止局部温度过高而使
液体飞溅。
4. 不能把热的蒸发皿直接放在实验台上,应垫上石棉网。
实验室中用 KClO3 在 MnO2 催化下受热分解制取氧气。从反应后的 KCl 和 MnO2 混合物中分离、收回这两种物质,需要使用哪些分离方法?
交流和讨论
原理:首先将溶液加热蒸发浓缩(配成热饱和溶液),再将热的溶液慢慢冷却析出晶体。此法主要用于溶解度随温度变化大的物质。
(2)冷却结晶
现有混有少量氯化钾的硝酸钾粉末,参照课本的溶解度曲线,设计实验方案提纯硝酸钾。
交流和讨论
KCl、KNO3混合物
KCl、KNO3溶液
KNO3(S)、KCl+ KNO3溶液
KNO3(S)
加热溶解
降温结晶
过滤
设计思路
设计方案
1. 溶解:将混合物放入烧杯中,加入热水,使固体完全溶解。(配成热饱和溶液)
2. 结晶:将(1)所得溶液放在实验台上自然冷却到不再有固体析出。
3. 过滤:将(2)所得混合物进行过滤,滤纸上的晶体即为较纯净的KNO3。
4. 重结晶:若需要更纯净的KNO3晶体,可将(3)中所得晶体再结晶「重复(1)-(3)」操作一次。
结晶是溶质从溶液中析出晶体的过程,可以用来分离和提纯几种可溶性固体的混合物。结晶的原理是根据混合物中各成分在某种溶剂里的溶解度的不同,通过蒸发减少溶剂或降低温度使溶解度变小,从而使晶体析出。
总结
原理:利用互溶液体混合物中各组分沸点不同,进行分离提纯的操作。蒸馏一般用于分离沸点相差较大的液体混合物。
过程:将液态物质加热至沸点,使之汽化,然后将蒸气重新冷凝为液体的操作过程称为蒸馏。
用蒸馏原理进行多种混合液体的分离,叫分馏。
三、蒸馏
温度计水银球的顶端与支管下沿处于同一水平线
蒸馏烧瓶中液体的量是烧瓶容量的1/3~1/2
在蒸馏烧瓶内放有沸石,防止暴沸
冷凝管横放时头高尾低保证冷凝液自然下流,冷却水进水通入与被冷凝蒸气流向相反,即下进上出
给蒸馏烧瓶加热要垫石棉网
牛角管
蒸馏烧瓶
水冷凝管
操作要点:
实验模拟
见课本31页【观察思考】
现象:
溴水呈橙色。加CCl4后溶液分层,上层几乎无色,下层呈橙红色。
解释:1、四氯化碳与水互不相溶,出现分层现象。
2、四氯化碳的密度大于水的密度,沉在下层。
3、溴在四氯化碳中的溶解度远大于在水中的溶解度,溴从水中转移到四氯化碳中。
问题讨论
定义:利用物质在互不相溶的溶剂中溶解度的不同,将物质从一种溶剂转移到另一种溶剂中从而实现分离的方法
原溶剂
萃取剂
四、萃取
萃取剂的选择:
①萃取剂与原溶液中的溶剂互不相溶且不反应
②溶质在萃取剂中的溶解度要大于在原溶剂中的溶解度
萃取碘水中的碘,可用的萃取剂是( )
①四氯化碳 ②汽油 ③酒精
A 只有① B ①和② C ①和③ D ①②③
B
分液装置:分液漏斗
实验原理:把两种互不相溶的液体分开
萃取后如何把四氯化碳层与水层分开?
问题讨论
五、分液
分液操作步骤:
1、分液漏斗在洗涤干净后,必须检查上口和玻璃旋塞是否漏水;
2、充分振荡,适当放气,充分静置,然后分液;
3、分液时保持漏斗内外大气压一致;
4、下层溶液下口出,上层溶液上口出;
5、分液漏斗下端管口要紧靠在烧杯内壁上;
6、下层液体恰好流尽时,立即关闭旋塞。
分液操作应注意:
六、层析法
原理:根据混合物中各物质被吸附性能的不同
七、升华法
如:分离I2与NaCl的混合物
八、洗气法
Cl2(HCl)
CO(CO2)
O2(H2O)
饱和NaCl溶液
碱溶液
碱石灰、浓硫酸等
一、过滤 固液分离
操作要点:一贴、二低、三靠。
二、结晶 溶解度的差异
蒸发结晶:容积不超2/3;不断搅拌防止飞溅;余热蒸干。
冷却结晶:溶解度随温度变化大。
课堂小结
四、萃取 溶解性的差异
萃取剂的选择:互不相溶且不反应;萃取剂溶解度大于原溶剂。
五、分液 液液分离
操作要点:检查是否漏水;上层溶液上口倒出。
三、蒸馏 沸点相差较大
操作要点:容积1/3~1/2;沸石防止暴沸;冷凝水下进上出;温度计水银球顶端与支管下沿处于同一水平线。
现需要分离下列物质,请用直线将分离实例、分离方法和选择分离方法的依据连接起来。
课堂练习
实 例
1.除去澄清石灰水中的
碳酸钙
2.用CCl4提取溴水中
溴单质
3.分离醋酸(沸点118℃)
与乙醇(沸点78.5℃)
4.分离汽油和水
5.从含有NaCl的KNO3
溶液中提取KNO3
分离方法
蒸馏
过滤
分液
结晶
萃取
选择的依据
溶解度随温度变化的差异
在不同溶剂中溶解度的差异
沸点的差异较大
两溶剂互不相溶
物质在水中溶解度的不同
现有含少量氯化镁和泥沙等杂质的粗食盐,请你设计实验方案,用粗食盐提纯氯化钠。(已知氢氧化镁难溶于水)
交流和讨论
可以用下列方式来表示:
加水溶解
稍过量NaOH
(除去Mg2+)
过滤
(除沉淀、泥沙)
稍过量
稀HCl
(除去OH-)
蒸发结晶
(除HCl、得NaCl)
2. 现有含Na2SO4、MgCl2、CaCl2和泥沙的粗食盐,请设计实验方案,由粗食盐提纯NaCl。
简单思路步骤
溶解 → BaCl2(过量) → Na0H(过量) →
Na2CO3(过量) → 过滤 → 盐酸(过量) → 蒸发结晶
课堂练习
物质的分离和提纯的注意事项:
1、除杂时所加试剂必须过量;
2、过量的试剂也必须除去;
3、分离和提纯的方法要求最佳。
除去粗盐中可溶性杂质,试剂的加入顺序共有几种?依据是什么?
(1)BaCl2——Na2CO3——NaOH——HCl
(2)BaCl2——NaOH——Na2CO3——HCl
(3)NaOH——BaCl2——Na2CO3——HCl
依据: Na2CO3在BaCl2之后加入,Na2CO3除CaCl2 和BaCl2 ,稀盐酸最后加入。
操作原则“三必须”和“四原则”
1.“三必须”是:
(1) 除杂试剂必须过量
(2) 过量试剂必须除尽(因为过量试剂带入新的杂质)
(3) 除杂途径必须最佳
2.“四原则”是:
(1) 不增 提纯过程中不增加新的杂质
(2) 不减 不减少欲被提纯的物质
(3) 易分离 被提纯物与杂质容易分离
(4) 易复原 被提纯物质要复原
操作原则“三必须”和“四原则”
3. 提纯含有少量硝酸钡杂质的硝酸钾溶液,可以使用的方法为( )
A.加入过量碳酸钠,过滤,除去沉淀,再加适量硝酸
B.加入过量硫酸钾,过滤,除去沉淀,再加适量硝酸
C.加入过量硫酸钠,过滤,除去沉淀,再加适量硝酸
D.加入过量碳酸钾,过滤,除去沉淀,再加适量硝酸
Ba(NO3)2
KNO3
D
提纯原则
①不增 ②不减 ③易分离 ④易复原
课堂练习
课后思考
实验室进行过滤操作时,有经验的实验人员往往会将叠好的滤纸撕去一个小角,为什么这样做?
将滤纸撕去一个小角,使其用水湿润后与漏斗内壁贴合得更好。
看
观
谢
谢
必 修 一
学
化
J
S
第一单元 研究物质的实验方法
课时 1 1.2 物质的分离提纯
日常生活中,我们所接触的各种各样的物质,大多数都是混合物,而化学研究、工业生产中经常要对混合物进行分离和提纯,如:自来水的净化处理、海水通过日晒得到粗盐等。
分离:通过适当的方法,把混合物中的几种物质分开,每种组分都要保留下来并恢复到原状态 (如原来是固体,最后还是固体),得到比较纯的物质。
提纯:通过物理或化学方法,将混合物中的杂质(不需要的物质) 除掉而得到所需物质的过程。
分离和提纯有什么不同?
辨别概念
如果有铁屑和铜屑的混合物,你能用哪些方法将铁屑分离除去?
1、用磁铁
2、加盐酸
物理方法
化学方法
方法2中如何分离出铜屑?
通过怎样的操作可以从溶液中得到固体?
讨论:
问题讨论
原理:利用物质的溶解性差异,将液体和不溶于液体的固体分离开来。
一、过滤
仪器:漏斗、滤纸、铁架台(含铁圈)、烧杯、玻璃棒。
操作要点:一贴、
二低、
三靠。
如何提纯含有少量泥沙的粗食盐?
粗盐溶解
过滤
滤液蒸发溶剂
问题讨论
原理:利用加热的方法,使溶液中溶剂不
断挥发而析出溶质(晶体)的过程。
仪器:蒸发皿、铁架台(铁圈)、酒精灯
(1)蒸发结晶
二、结晶
操作注意事项:
1. 蒸发皿中的液体不能超过其容积的2/3。
3. 当出现大量固体时,应停止加热用余热蒸干。
2. 蒸发过程中必须用玻璃棒不断搅拌,防止局部温度过高而使
液体飞溅。
4. 不能把热的蒸发皿直接放在实验台上,应垫上石棉网。
实验室中用 KClO3 在 MnO2 催化下受热分解制取氧气。从反应后的 KCl 和 MnO2 混合物中分离、收回这两种物质,需要使用哪些分离方法?
交流和讨论
原理:首先将溶液加热蒸发浓缩(配成热饱和溶液),再将热的溶液慢慢冷却析出晶体。此法主要用于溶解度随温度变化大的物质。
(2)冷却结晶
现有混有少量氯化钾的硝酸钾粉末,参照课本的溶解度曲线,设计实验方案提纯硝酸钾。
交流和讨论
KCl、KNO3混合物
KCl、KNO3溶液
KNO3(S)、KCl+ KNO3溶液
KNO3(S)
加热溶解
降温结晶
过滤
设计思路
设计方案
1. 溶解:将混合物放入烧杯中,加入热水,使固体完全溶解。(配成热饱和溶液)
2. 结晶:将(1)所得溶液放在实验台上自然冷却到不再有固体析出。
3. 过滤:将(2)所得混合物进行过滤,滤纸上的晶体即为较纯净的KNO3。
4. 重结晶:若需要更纯净的KNO3晶体,可将(3)中所得晶体再结晶「重复(1)-(3)」操作一次。
结晶是溶质从溶液中析出晶体的过程,可以用来分离和提纯几种可溶性固体的混合物。结晶的原理是根据混合物中各成分在某种溶剂里的溶解度的不同,通过蒸发减少溶剂或降低温度使溶解度变小,从而使晶体析出。
总结
原理:利用互溶液体混合物中各组分沸点不同,进行分离提纯的操作。蒸馏一般用于分离沸点相差较大的液体混合物。
过程:将液态物质加热至沸点,使之汽化,然后将蒸气重新冷凝为液体的操作过程称为蒸馏。
用蒸馏原理进行多种混合液体的分离,叫分馏。
三、蒸馏
温度计水银球的顶端与支管下沿处于同一水平线
蒸馏烧瓶中液体的量是烧瓶容量的1/3~1/2
在蒸馏烧瓶内放有沸石,防止暴沸
冷凝管横放时头高尾低保证冷凝液自然下流,冷却水进水通入与被冷凝蒸气流向相反,即下进上出
给蒸馏烧瓶加热要垫石棉网
牛角管
蒸馏烧瓶
水冷凝管
操作要点:
实验模拟
见课本31页【观察思考】
现象:
溴水呈橙色。加CCl4后溶液分层,上层几乎无色,下层呈橙红色。
解释:1、四氯化碳与水互不相溶,出现分层现象。
2、四氯化碳的密度大于水的密度,沉在下层。
3、溴在四氯化碳中的溶解度远大于在水中的溶解度,溴从水中转移到四氯化碳中。
问题讨论
定义:利用物质在互不相溶的溶剂中溶解度的不同,将物质从一种溶剂转移到另一种溶剂中从而实现分离的方法
原溶剂
萃取剂
四、萃取
萃取剂的选择:
①萃取剂与原溶液中的溶剂互不相溶且不反应
②溶质在萃取剂中的溶解度要大于在原溶剂中的溶解度
萃取碘水中的碘,可用的萃取剂是( )
①四氯化碳 ②汽油 ③酒精
A 只有① B ①和② C ①和③ D ①②③
B
分液装置:分液漏斗
实验原理:把两种互不相溶的液体分开
萃取后如何把四氯化碳层与水层分开?
问题讨论
五、分液
分液操作步骤:
1、分液漏斗在洗涤干净后,必须检查上口和玻璃旋塞是否漏水;
2、充分振荡,适当放气,充分静置,然后分液;
3、分液时保持漏斗内外大气压一致;
4、下层溶液下口出,上层溶液上口出;
5、分液漏斗下端管口要紧靠在烧杯内壁上;
6、下层液体恰好流尽时,立即关闭旋塞。
分液操作应注意:
六、层析法
原理:根据混合物中各物质被吸附性能的不同
七、升华法
如:分离I2与NaCl的混合物
八、洗气法
Cl2(HCl)
CO(CO2)
O2(H2O)
饱和NaCl溶液
碱溶液
碱石灰、浓硫酸等
一、过滤 固液分离
操作要点:一贴、二低、三靠。
二、结晶 溶解度的差异
蒸发结晶:容积不超2/3;不断搅拌防止飞溅;余热蒸干。
冷却结晶:溶解度随温度变化大。
课堂小结
四、萃取 溶解性的差异
萃取剂的选择:互不相溶且不反应;萃取剂溶解度大于原溶剂。
五、分液 液液分离
操作要点:检查是否漏水;上层溶液上口倒出。
三、蒸馏 沸点相差较大
操作要点:容积1/3~1/2;沸石防止暴沸;冷凝水下进上出;温度计水银球顶端与支管下沿处于同一水平线。
现需要分离下列物质,请用直线将分离实例、分离方法和选择分离方法的依据连接起来。
课堂练习
实 例
1.除去澄清石灰水中的
碳酸钙
2.用CCl4提取溴水中
溴单质
3.分离醋酸(沸点118℃)
与乙醇(沸点78.5℃)
4.分离汽油和水
5.从含有NaCl的KNO3
溶液中提取KNO3
分离方法
蒸馏
过滤
分液
结晶
萃取
选择的依据
溶解度随温度变化的差异
在不同溶剂中溶解度的差异
沸点的差异较大
两溶剂互不相溶
物质在水中溶解度的不同
现有含少量氯化镁和泥沙等杂质的粗食盐,请你设计实验方案,用粗食盐提纯氯化钠。(已知氢氧化镁难溶于水)
交流和讨论
可以用下列方式来表示:
加水溶解
稍过量NaOH
(除去Mg2+)
过滤
(除沉淀、泥沙)
稍过量
稀HCl
(除去OH-)
蒸发结晶
(除HCl、得NaCl)
2. 现有含Na2SO4、MgCl2、CaCl2和泥沙的粗食盐,请设计实验方案,由粗食盐提纯NaCl。
简单思路步骤
溶解 → BaCl2(过量) → Na0H(过量) →
Na2CO3(过量) → 过滤 → 盐酸(过量) → 蒸发结晶
课堂练习
物质的分离和提纯的注意事项:
1、除杂时所加试剂必须过量;
2、过量的试剂也必须除去;
3、分离和提纯的方法要求最佳。
除去粗盐中可溶性杂质,试剂的加入顺序共有几种?依据是什么?
(1)BaCl2——Na2CO3——NaOH——HCl
(2)BaCl2——NaOH——Na2CO3——HCl
(3)NaOH——BaCl2——Na2CO3——HCl
依据: Na2CO3在BaCl2之后加入,Na2CO3除CaCl2 和BaCl2 ,稀盐酸最后加入。
操作原则“三必须”和“四原则”
1.“三必须”是:
(1) 除杂试剂必须过量
(2) 过量试剂必须除尽(因为过量试剂带入新的杂质)
(3) 除杂途径必须最佳
2.“四原则”是:
(1) 不增 提纯过程中不增加新的杂质
(2) 不减 不减少欲被提纯的物质
(3) 易分离 被提纯物与杂质容易分离
(4) 易复原 被提纯物质要复原
操作原则“三必须”和“四原则”
3. 提纯含有少量硝酸钡杂质的硝酸钾溶液,可以使用的方法为( )
A.加入过量碳酸钠,过滤,除去沉淀,再加适量硝酸
B.加入过量硫酸钾,过滤,除去沉淀,再加适量硝酸
C.加入过量硫酸钠,过滤,除去沉淀,再加适量硝酸
D.加入过量碳酸钾,过滤,除去沉淀,再加适量硝酸
Ba(NO3)2
KNO3
D
提纯原则
①不增 ②不减 ③易分离 ④易复原
课堂练习
课后思考
实验室进行过滤操作时,有经验的实验人员往往会将叠好的滤纸撕去一个小角,为什么这样做?
将滤纸撕去一个小角,使其用水湿润后与漏斗内壁贴合得更好。
看
观
谢
谢
