1.3 物质的分散系 课件(共68张PPT) 2023-2024学年高一化学苏教版(2029)必修第一册
文档属性
| 名称 | 1.3 物质的分散系 课件(共68张PPT) 2023-2024学年高一化学苏教版(2029)必修第一册 |  | |
| 格式 | ppt | ||
| 文件大小 | 4.0MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-11-21 15:52:21 | ||
图片预览








文档简介
(共68张PPT)
必 修 一
学
化
J
S
彩虹与化学有什么关系呢?
彩虹是一种光学现象
第三单元 物质的分散系
课时 1 3.1 常见的分散系
3.2 胶体
一、分散系
1、定义:一种或几种物质分散到另一种物质中形成的混合物。
分散系
分散质
分散剂
①分散系:混合物
②相对多少:分散剂>分散质
被分散成微粒的物质
起容纳分散质作用的物质
注:
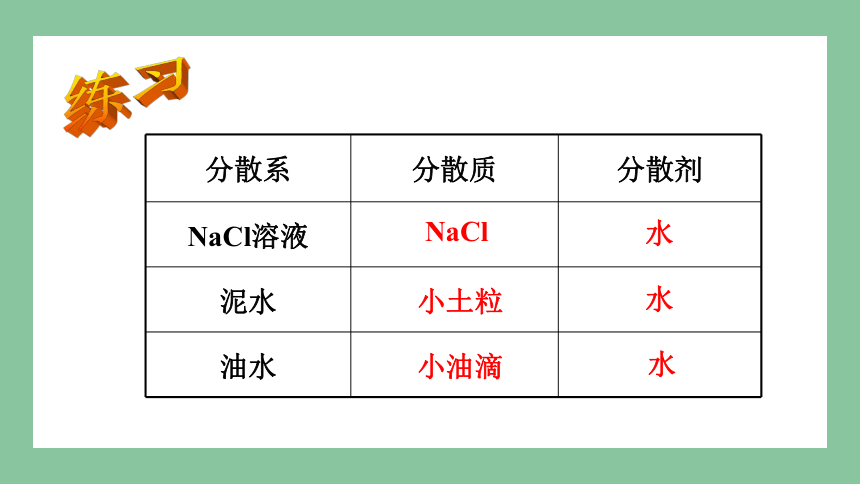
油水
泥水
NaCl溶液
分散剂
分散质
分散系
NaCl
小土粒
小油滴
水
水
水
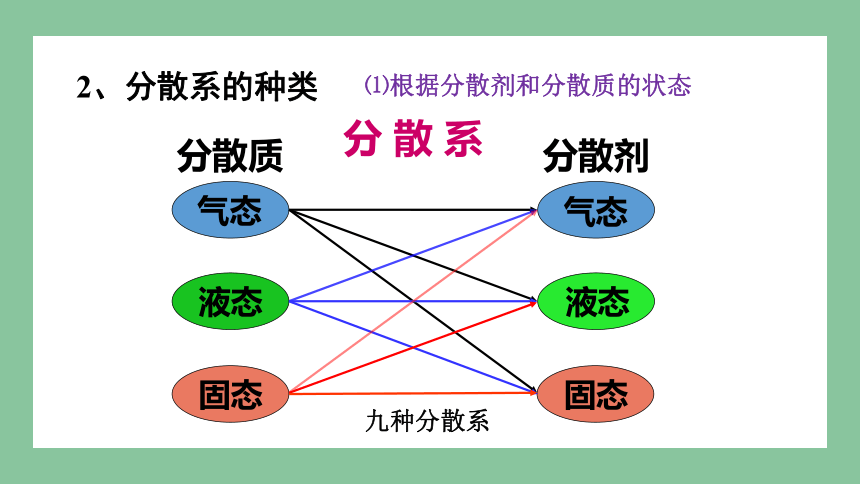
分 散 系
分散质
分散剂
气态
液态
固态
固态
液态
气态
2、分散系的种类
⑴根据分散剂和分散质的状态
九种分散系
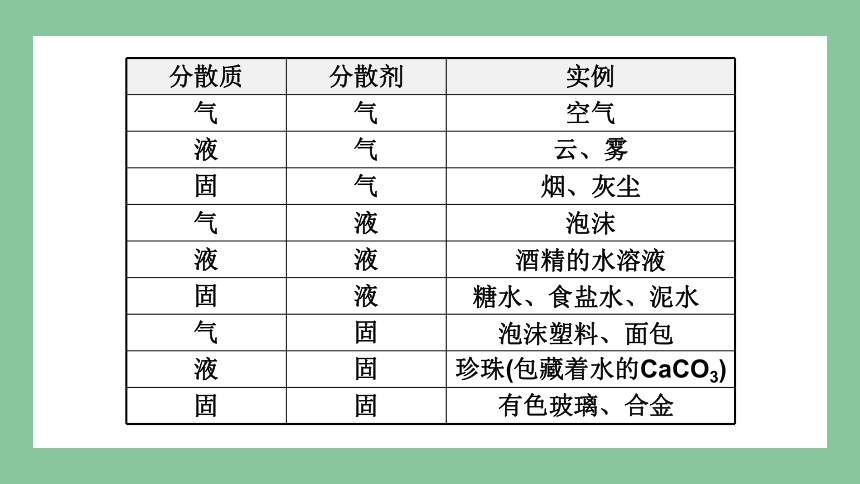
空气
云、雾
烟、灰尘
泡沫
酒精的水溶液
糖水、食盐水、泥水
有色玻璃、合金
分散质 分散剂 实例
气 气
液 气
固 气
气 液
液 液
固 液
气 固
液 固
固 固
泡沫塑料、面包
珍珠(包藏着水的CaCO3)
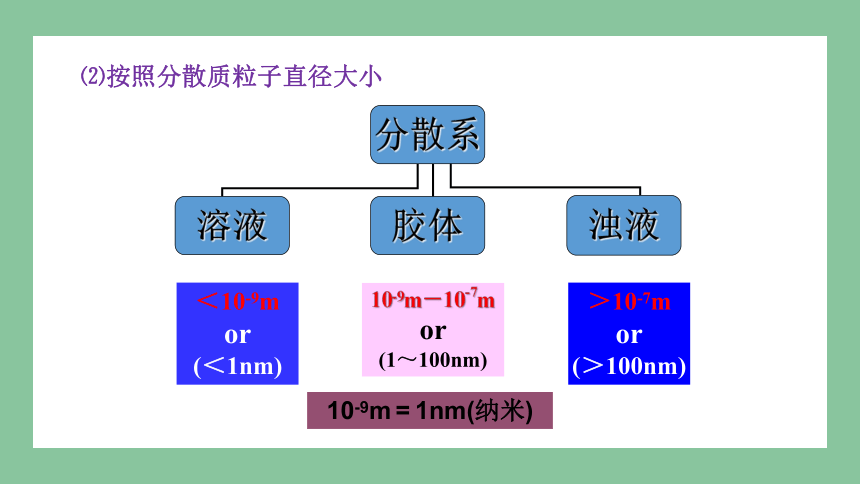
⑵按照分散质粒子直径大小
<10-9m or
(<1nm)
10-9m-10-7m or
(1~100nm)
>10-7m or
(>100nm)
10-9m = 1nm(纳米)
分散系
溶液
浊液
胶体
均一稳定的混合物,其本质特征是分散质微粒的直径小于10-9m(1nm)。
溶液的性质:均一、稳定、能透过滤纸。
溶液
a.悬浊液:
固体小颗粒分散在液体中,其本质特征是分散质粒子的直径大于10-7m(100nm)
悬浊液的性质:不均一、不稳定、不能透过滤纸。
浊液
b.乳浊液:
小液滴分散在液体中,其本质特征是分散质粒子的直径大于10-7m(100nm)
乳浊液的性质:不均一、不稳定,静止后,小液滴由于密度不同,会上浮或下沉。
1、定义:分散质微粒直径大小在10-9~10-7m之间的分散系。
烟、云、雾、豆浆、血液、肥皂水、墨水、有色玻璃、含有灰尘颗粒的空气
几种常见的胶体
二、胶体
胶体的分类
淀粉溶液、豆浆、墨水、
牛奶、血液、氢氧化铁胶体
大气中的飘尘、工厂废气中固体悬浮物、
矿山开采的粉尘、烟、云、雾
有色玻璃、烟水晶、一些纳米材料
液溶胶
气溶胶
固溶胶
2、胶体的分类
晨雾
烟
白云
烟水晶
有色玻璃
3、氢氧化铁胶体的制备:
探究实验1:
(1)制备原理:
FeCl3 + 3H2O Fe(OH)3(胶体) + 3HCl
(2)实验步骤:取一只烧杯加入20mL蒸馏水,加热至沸腾,然后向沸水中滴加饱和FeCl3溶液1~2mL。继续煮沸,待溶液变成红褐色后,停止加热。
(3)实验现象:生成红褐色胶体。
探究性实验2:
(1)胶体与溶液的区别:
①实验步骤:
将盛有硫酸铜溶液和氢氧化铁胶体的两只小烧杯分别置于暗处,用聚光手电筒(或激光笔)照射,从垂直于光线的方向观察实验现象。
②实验现象:
从垂直于光线的方向观察到氢氧化铁胶体中有 一条光亮的通路 (丁达尔效应),而硫酸铜溶液中则没有。
③实验结论:
溶液和胶体对光的作用是不同的。
CuSO4溶液 Fe(OH)3胶体
丁达尔效应:光束通过胶体时出现一条明亮的光路的现象(用来鉴别溶液和胶体的物理方法)
胶体的鉴别(丁达尔效应)
自然界的丁达尔现象
刚打扫过的房间
正在放映的电影
夜晚的探照灯
①实验步骤:将Fe(OH)3胶体和泥水分别进行过滤。
探究性实验3 (2)胶体与浊液的区别:
过滤后的现象
Fe(OH)3胶体
泥水
没得到滤渣,滤液还是红褐色。
在滤纸上得到泥沙,滤液澄清、透明。
③实验结论:胶体能通过滤纸。
②实验现象:
胶体的净化(渗析)
渗析:利用半透膜把胶体中混有的离子或分子从胶体溶液里分离出来。
半透膜:指一类可以让小分子物质 (离子) 透过而大分子物质不能通过的多孔性薄膜。由鸡蛋壳膜或羊皮纸、胶棉薄膜、玻璃纸、动物肠衣膜等制成。
滤纸可将胶体和沉淀分离;半透膜可将胶体和溶液分离
淀粉胶体和NaCl溶液置于半透膜内
蒸馏水
应用:胶体净化、提纯 (使胶体和溶液分离)
探究性实验4:
(3)胶体性质的探究:
①实验步骤:
在两只烧杯中分别加入相同量的含有悬浮颗粒物的浑浊的水,再向其中一只烧杯中加入适量氢氧化铁胶体,搅拌后静止片刻,比较两只烧杯中液体的浑浊程度。
②实验现象:
加入氢氧化铁胶体的烧杯中的液体变得澄清。
③实验结论:
氢氧化铁胶体具有吸附性,能吸附水中的悬浮颗粒并沉降,可以用于净水。
4、胶体的性质:
(3)胶体表面积大,吸附能力强——用于净水
(1)丁达尔现象——鉴别胶体和溶液
半透膜有:动物肠衣、鸡蛋壳膜、玻璃纸等
胶体中的分散质粒子直径介于10-9m-10-7m 之间,能通过滤纸,但不能通过半透膜。常用半透膜分离胶体中的杂质分子、离子。
(2)渗析——胶体的净化
分散系 溶液 浊液 胶体
分散系粒子的直径
分散质粒子的组成
5、不同分散系的比较
< 1nm
> 100nm
1nm - 100nm
分子或离子
很多分子集合体
分子集合体或大分子
分散系 溶液 浊液 胶体
外观稳定性
能否透过半透膜
能否透过滤纸
光速通过能否形成光路
均一、透明、稳定
不均一、不透明、不稳定
均一、透明、
较稳定
能
不能
能
能
不能
不能
不能
不能
能
一. 分散系
分散系
分散质
分散剂
胶体 1~100nm
浊液 >100nm
溶液 <1nm
种类
组成
分散质微粒直径
课堂小结
二. 胶体
胶体的分类
液溶胶
气溶胶
固溶胶
氢氧化铁胶体的制备
FeCl3 + 3H2O Fe(OH)3(胶体) + 3HCl
胶体的性质
渗析-胶体的净化
丁达尔现象-胶体的鉴别
吸附性-净水
1.下列分散系不发生丁达尔效应的是( )
A. 雾 B. 碘溶于酒精配成碘酒
C. 氢氧化铁胶体 D. 含有灰尘颗粒的空气
B
课堂练习
2.用特殊方法把固体物质加工到纳米级(1-100nm,1nm=10-9m)的超细粉末粒子,然后制得纳米材料。下列分散系中的分散质的微粒直径和这种粒子具有相同数量级的是( )
A. 溶液 B. 悬浊液 C. 胶体 D. 乳浊液
C
3.根据中央电视台报道,近年来,我国的一些沿江或沿海城市多次出现大雾天气,致使高速公路关闭,航班停飞,雾属于下列分散系中的( )
A. 溶液 B. 乳浊液 C. 悬浊液 D. 胶体
D
4.胶体的最本质的特征是( )
A. 丁达尔效应
B. 可以通过滤纸
C. 分散质粒子的直径在1nm~100nm之间
D. 均一、透明、较稳定
C
5.下列各种物质中,常用渗析法分离的是( )
A. CaCO3和Na2CO3
B. I2和K2CO3
C. CCl4和水
D. Fe(OH)3胶体和FeCl3溶液
D
6.既能透过半透膜,又能通过滤纸的是( )
A. FeCl3 溶液 B. Fe(OH)3 胶体
C. 医用酒精 D. Cu(OH)2 悬浊液
AC
7.医学上治疗由肾功能弱等引起的血液中毒时,最常用的血液净化方法是血液透析。透析时病人的血液通过浸在透析液中的透析膜进行循环和透析。透析原理同胶体的( )类似,透析膜同( )类似,透析膜的孔径应( )血液内毒性物质粒子直径,毒性物质才可能扩散到透析液中而被除去。
渗析
半透膜
大于
课后思考
现有氯化铁溶液,氢氧化铁悬浊液和氢氧化铁胶体三种颜色接近的混合物,参照课本中的“活动与探究”栏目,设计方案加以鉴别。
第三单元 物质的分散系
课时 2 3.3 电解质溶液
溶液的导电性实验
三、电解质与非电解质
结论:氯化钠、硝酸钾、氢氧化钠、磷酸的水溶液能够
导电,蔗糖、酒精的水溶液不能导电。
溶液导电性不同的原因
氯化钠溶解的微观过程
蔗糖溶解的微观过程
电解质:在水溶液中或熔融状态下能导电的化合物。
1、电解质、非电解质的定义
酸:HNO3、H2SO4、HCl ……
碱:NaOH、Mg(OH)2、NH3 H2O ……
大部分盐:NaCl、MgSO4、BaSO4 ……
活泼金属氧化物:Na2O、MgO、Al2O3 ……
水 H2O
非电解质:在水溶液中和熔融状态下都不能导电的化合物。
大多数有机化合物:CH4、CH3CH2OH、C6H12O6 ……
大多数非金属氧化物:CO2、CO、SO2 ……
非酸性气态氢化物:NH3、PH3 ……
注意:
(1)电解质、非电解质都是化合物。Cu、石墨(C)与NaCl溶液既不是电解质也不是非电解质;
(2)水溶液里或熔融状态下能导电。如:BaSO4(难溶于水)虽然其水溶液几乎不导电,但在熔融状态下导电,因此它是电解质;
(3)电解质本身不一定导电,能导电的不一定是电解质。如:NaCl固体并不能导电,NaCl溶液才能导电,但是NaCl溶液属于混合物。
(4)电解质必须是本身能电离出自由移动的离子而导电。一些物质溶于水后与水反应生成的化合物能电离出自由移动的离子而导电,像CO2、SO2等,但这些物质本身不能电离出自由移动的离子,故不是电解质。
判断下列说法是否正确
1、Cu单质可以导电,所以Cu是电解质
2、NaCl溶液有很好的导电性,所以NaCl溶液是电解质
3、SO2溶于水得到H2SO3(亚硫酸),也具有导电性所以是电解质
4、CaCO3,BaSO4在水中溶解性很小,导电性也不好,所以是
非电解质
×
×
×
×
①定义:电解质在水溶液中或熔融状态下产生自由移动的离子的过程。
②表示方法:电离方程式
NaCl = Na+ + Cl-
KNO3 = K+ + NO3-
NaOH = Na+ + OH-
注意:电离与是否通电无关
2、电离
③书写时注意事项:
1、适用范围:电解质的电离。
2、用的是等号(或可逆号)。
3、根据化合价写离子符号
4、根据右下角系数写离子个数。
原子团不能拆开写
写出下列物质的电离方程式:
HCl =
Al2(SO4)3 =
BaCl2 =
AgNO3 =
H+ + Cl-
2Al3+ + 3SO42-
Ba2+ + 2Cl-
Ag+ + NO3-
NaHSO4 =
NaHCO3 =
H2SO4 =
Ba(OH)2 =
Na+ + H+ + SO42-
Na+ + HCO3-
2H+ + SO42-
Ba2+ + 2OH-
H2SO4是强酸,
H2CO3是弱酸。
强酸可以完全电离!
电解质的溶液中所有阳离子所带的正电荷数与所有阳离子所带的负电荷数相等,故显电中性,常称电荷守恒。
3、电解质溶液不显电性(电荷守恒)
由硫酸钾、硫酸铝和硫酸组成的混合1L溶液,其中n(Al3+) = 0.4mol、n(SO42-) = 0.8mol、 n(H+) = 0.1mol,则 n(K+)为
A. 0.15 mol B. 0.2 mol
C. 0.3 mol D. 0.4 mol
4、酸、碱、盐
电离方程式:
HNO3 = H+ + NO3-
HCl = H+ + Cl-
H2SO4 = 2H+ + SO42-
酸:电解质电离时生成的阳离子全部是氢离子(H+)的化合物叫做酸。
KOH = K+ + OH-
Ba(OH)2 = Ba2+ + 2OH-
NaOH = Na+ + OH-
碱:电离时生成的阴离子全部是氢氧根离子(OH-)的化合物叫做碱。
电离方程式:
Na2CO3 = 2Na+ + CO32-
MgSO4 = Mg2+ + SO42-
BaCl2 = Ba2+ + 2Cl-
盐:电离时生成金属离子和酸根离子的化合物叫做盐。
电离方程式:
三. 电解质与非电解质
电解质:在水溶液中或熔融状态下能导电的化合物。
非电解质:在水溶液中和熔融状态下都不能导电的化合物。
电离:电解质在水溶液中或熔融状态下产生自由移动的离子的过程。
电解质溶液不显电性-电荷守恒
课堂小结
酸:电解质电离时生成的阳离子全部是氢离子(H+)的化合物。
碱:电离时生成的阴离子全部是氢氧根离子(OH-)的化合物。
盐:电离时生成金属离子和酸根离子的化合物。
1、下列说法正确的是( )
A.硫酸钡不溶于水,所以硫酸钡是非电解质
B.二氧化碳溶于水可以导电,所以二氧化碳是电解质
C.硫酸是电解质,所以硫酸在熔融时或溶于水时都能导电
D.液态氯化氢不能导电,但氯化氢是电解质
D
课堂练习
【解析】硫酸钡虽不溶于水,但它在熔融状态下能导电,故硫酸钡是电解质,A错;二氧化碳在熔融状态下不导电,溶于水生成碳酸可以导电,即二氧化碳的水溶液导电的原因是碳酸能电离出带电粒子,故二氧化碳不是电解质,B错;硫酸是电解质,因其溶于水时能导电,但熔融状态下的硫酸仅存在硫酸分子,不存在自由移动的离子,故熔融状态下的硫酸不导电,C错;液态氯化氢不能导电,但在水溶液中能导电,所以氯化氢是电解质,D正确。
2、下列物质的水溶液能导电,但属于非电解质的是( )
A.HNO3 B.Cl2 C.SO2 D.NH4NO3
【解析】选C。HNO3、NH4NO3均是电解质,Cl2是单质,既不是电解质也不是非电解质。SO2自身不能电离出自由移动的离子,所以是非电解质。
C
3、下列物质中属于电解质的是( )
属于非电解质的是( )
③碳酸氢钠
②氢氧化钠
④酒精
①醋酸
⑤铜
⑥二氧化硫
⑦生石灰
⑧硫酸钡
⑨氯化氢
①
②
③
⑧
⑨
⑦
⑥
④
课后思考
酸和碱都有强弱之分,弱酸弱碱是由于在水中不能完全电离出H+或OH-,而部分以分子的形式存在。这就会导致这些弱酸弱碱所对应的盐类的水溶液也会水解为弱酸弱碱的分子,那么NaCO3溶液中存在哪几种粒子呢?
CO32 + H2O HCO3 + OH
HCO3 + H2O H2CO3 + OH
看
观
谢
谢
必 修 一
学
化
J
S
彩虹与化学有什么关系呢?
彩虹是一种光学现象
第三单元 物质的分散系
课时 1 3.1 常见的分散系
3.2 胶体
一、分散系
1、定义:一种或几种物质分散到另一种物质中形成的混合物。
分散系
分散质
分散剂
①分散系:混合物
②相对多少:分散剂>分散质
被分散成微粒的物质
起容纳分散质作用的物质
注:
油水
泥水
NaCl溶液
分散剂
分散质
分散系
NaCl
小土粒
小油滴
水
水
水
分 散 系
分散质
分散剂
气态
液态
固态
固态
液态
气态
2、分散系的种类
⑴根据分散剂和分散质的状态
九种分散系
空气
云、雾
烟、灰尘
泡沫
酒精的水溶液
糖水、食盐水、泥水
有色玻璃、合金
分散质 分散剂 实例
气 气
液 气
固 气
气 液
液 液
固 液
气 固
液 固
固 固
泡沫塑料、面包
珍珠(包藏着水的CaCO3)
⑵按照分散质粒子直径大小
<10-9m or
(<1nm)
10-9m-10-7m or
(1~100nm)
>10-7m or
(>100nm)
10-9m = 1nm(纳米)
分散系
溶液
浊液
胶体
均一稳定的混合物,其本质特征是分散质微粒的直径小于10-9m(1nm)。
溶液的性质:均一、稳定、能透过滤纸。
溶液
a.悬浊液:
固体小颗粒分散在液体中,其本质特征是分散质粒子的直径大于10-7m(100nm)
悬浊液的性质:不均一、不稳定、不能透过滤纸。
浊液
b.乳浊液:
小液滴分散在液体中,其本质特征是分散质粒子的直径大于10-7m(100nm)
乳浊液的性质:不均一、不稳定,静止后,小液滴由于密度不同,会上浮或下沉。
1、定义:分散质微粒直径大小在10-9~10-7m之间的分散系。
烟、云、雾、豆浆、血液、肥皂水、墨水、有色玻璃、含有灰尘颗粒的空气
几种常见的胶体
二、胶体
胶体的分类
淀粉溶液、豆浆、墨水、
牛奶、血液、氢氧化铁胶体
大气中的飘尘、工厂废气中固体悬浮物、
矿山开采的粉尘、烟、云、雾
有色玻璃、烟水晶、一些纳米材料
液溶胶
气溶胶
固溶胶
2、胶体的分类
晨雾
烟
白云
烟水晶
有色玻璃
3、氢氧化铁胶体的制备:
探究实验1:
(1)制备原理:
FeCl3 + 3H2O Fe(OH)3(胶体) + 3HCl
(2)实验步骤:取一只烧杯加入20mL蒸馏水,加热至沸腾,然后向沸水中滴加饱和FeCl3溶液1~2mL。继续煮沸,待溶液变成红褐色后,停止加热。
(3)实验现象:生成红褐色胶体。
探究性实验2:
(1)胶体与溶液的区别:
①实验步骤:
将盛有硫酸铜溶液和氢氧化铁胶体的两只小烧杯分别置于暗处,用聚光手电筒(或激光笔)照射,从垂直于光线的方向观察实验现象。
②实验现象:
从垂直于光线的方向观察到氢氧化铁胶体中有 一条光亮的通路 (丁达尔效应),而硫酸铜溶液中则没有。
③实验结论:
溶液和胶体对光的作用是不同的。
CuSO4溶液 Fe(OH)3胶体
丁达尔效应:光束通过胶体时出现一条明亮的光路的现象(用来鉴别溶液和胶体的物理方法)
胶体的鉴别(丁达尔效应)
自然界的丁达尔现象
刚打扫过的房间
正在放映的电影
夜晚的探照灯
①实验步骤:将Fe(OH)3胶体和泥水分别进行过滤。
探究性实验3 (2)胶体与浊液的区别:
过滤后的现象
Fe(OH)3胶体
泥水
没得到滤渣,滤液还是红褐色。
在滤纸上得到泥沙,滤液澄清、透明。
③实验结论:胶体能通过滤纸。
②实验现象:
胶体的净化(渗析)
渗析:利用半透膜把胶体中混有的离子或分子从胶体溶液里分离出来。
半透膜:指一类可以让小分子物质 (离子) 透过而大分子物质不能通过的多孔性薄膜。由鸡蛋壳膜或羊皮纸、胶棉薄膜、玻璃纸、动物肠衣膜等制成。
滤纸可将胶体和沉淀分离;半透膜可将胶体和溶液分离
淀粉胶体和NaCl溶液置于半透膜内
蒸馏水
应用:胶体净化、提纯 (使胶体和溶液分离)
探究性实验4:
(3)胶体性质的探究:
①实验步骤:
在两只烧杯中分别加入相同量的含有悬浮颗粒物的浑浊的水,再向其中一只烧杯中加入适量氢氧化铁胶体,搅拌后静止片刻,比较两只烧杯中液体的浑浊程度。
②实验现象:
加入氢氧化铁胶体的烧杯中的液体变得澄清。
③实验结论:
氢氧化铁胶体具有吸附性,能吸附水中的悬浮颗粒并沉降,可以用于净水。
4、胶体的性质:
(3)胶体表面积大,吸附能力强——用于净水
(1)丁达尔现象——鉴别胶体和溶液
半透膜有:动物肠衣、鸡蛋壳膜、玻璃纸等
胶体中的分散质粒子直径介于10-9m-10-7m 之间,能通过滤纸,但不能通过半透膜。常用半透膜分离胶体中的杂质分子、离子。
(2)渗析——胶体的净化
分散系 溶液 浊液 胶体
分散系粒子的直径
分散质粒子的组成
5、不同分散系的比较
< 1nm
> 100nm
1nm - 100nm
分子或离子
很多分子集合体
分子集合体或大分子
分散系 溶液 浊液 胶体
外观稳定性
能否透过半透膜
能否透过滤纸
光速通过能否形成光路
均一、透明、稳定
不均一、不透明、不稳定
均一、透明、
较稳定
能
不能
能
能
不能
不能
不能
不能
能
一. 分散系
分散系
分散质
分散剂
胶体 1~100nm
浊液 >100nm
溶液 <1nm
种类
组成
分散质微粒直径
课堂小结
二. 胶体
胶体的分类
液溶胶
气溶胶
固溶胶
氢氧化铁胶体的制备
FeCl3 + 3H2O Fe(OH)3(胶体) + 3HCl
胶体的性质
渗析-胶体的净化
丁达尔现象-胶体的鉴别
吸附性-净水
1.下列分散系不发生丁达尔效应的是( )
A. 雾 B. 碘溶于酒精配成碘酒
C. 氢氧化铁胶体 D. 含有灰尘颗粒的空气
B
课堂练习
2.用特殊方法把固体物质加工到纳米级(1-100nm,1nm=10-9m)的超细粉末粒子,然后制得纳米材料。下列分散系中的分散质的微粒直径和这种粒子具有相同数量级的是( )
A. 溶液 B. 悬浊液 C. 胶体 D. 乳浊液
C
3.根据中央电视台报道,近年来,我国的一些沿江或沿海城市多次出现大雾天气,致使高速公路关闭,航班停飞,雾属于下列分散系中的( )
A. 溶液 B. 乳浊液 C. 悬浊液 D. 胶体
D
4.胶体的最本质的特征是( )
A. 丁达尔效应
B. 可以通过滤纸
C. 分散质粒子的直径在1nm~100nm之间
D. 均一、透明、较稳定
C
5.下列各种物质中,常用渗析法分离的是( )
A. CaCO3和Na2CO3
B. I2和K2CO3
C. CCl4和水
D. Fe(OH)3胶体和FeCl3溶液
D
6.既能透过半透膜,又能通过滤纸的是( )
A. FeCl3 溶液 B. Fe(OH)3 胶体
C. 医用酒精 D. Cu(OH)2 悬浊液
AC
7.医学上治疗由肾功能弱等引起的血液中毒时,最常用的血液净化方法是血液透析。透析时病人的血液通过浸在透析液中的透析膜进行循环和透析。透析原理同胶体的( )类似,透析膜同( )类似,透析膜的孔径应( )血液内毒性物质粒子直径,毒性物质才可能扩散到透析液中而被除去。
渗析
半透膜
大于
课后思考
现有氯化铁溶液,氢氧化铁悬浊液和氢氧化铁胶体三种颜色接近的混合物,参照课本中的“活动与探究”栏目,设计方案加以鉴别。
第三单元 物质的分散系
课时 2 3.3 电解质溶液
溶液的导电性实验
三、电解质与非电解质
结论:氯化钠、硝酸钾、氢氧化钠、磷酸的水溶液能够
导电,蔗糖、酒精的水溶液不能导电。
溶液导电性不同的原因
氯化钠溶解的微观过程
蔗糖溶解的微观过程
电解质:在水溶液中或熔融状态下能导电的化合物。
1、电解质、非电解质的定义
酸:HNO3、H2SO4、HCl ……
碱:NaOH、Mg(OH)2、NH3 H2O ……
大部分盐:NaCl、MgSO4、BaSO4 ……
活泼金属氧化物:Na2O、MgO、Al2O3 ……
水 H2O
非电解质:在水溶液中和熔融状态下都不能导电的化合物。
大多数有机化合物:CH4、CH3CH2OH、C6H12O6 ……
大多数非金属氧化物:CO2、CO、SO2 ……
非酸性气态氢化物:NH3、PH3 ……
注意:
(1)电解质、非电解质都是化合物。Cu、石墨(C)与NaCl溶液既不是电解质也不是非电解质;
(2)水溶液里或熔融状态下能导电。如:BaSO4(难溶于水)虽然其水溶液几乎不导电,但在熔融状态下导电,因此它是电解质;
(3)电解质本身不一定导电,能导电的不一定是电解质。如:NaCl固体并不能导电,NaCl溶液才能导电,但是NaCl溶液属于混合物。
(4)电解质必须是本身能电离出自由移动的离子而导电。一些物质溶于水后与水反应生成的化合物能电离出自由移动的离子而导电,像CO2、SO2等,但这些物质本身不能电离出自由移动的离子,故不是电解质。
判断下列说法是否正确
1、Cu单质可以导电,所以Cu是电解质
2、NaCl溶液有很好的导电性,所以NaCl溶液是电解质
3、SO2溶于水得到H2SO3(亚硫酸),也具有导电性所以是电解质
4、CaCO3,BaSO4在水中溶解性很小,导电性也不好,所以是
非电解质
×
×
×
×
①定义:电解质在水溶液中或熔融状态下产生自由移动的离子的过程。
②表示方法:电离方程式
NaCl = Na+ + Cl-
KNO3 = K+ + NO3-
NaOH = Na+ + OH-
注意:电离与是否通电无关
2、电离
③书写时注意事项:
1、适用范围:电解质的电离。
2、用的是等号(或可逆号)。
3、根据化合价写离子符号
4、根据右下角系数写离子个数。
原子团不能拆开写
写出下列物质的电离方程式:
HCl =
Al2(SO4)3 =
BaCl2 =
AgNO3 =
H+ + Cl-
2Al3+ + 3SO42-
Ba2+ + 2Cl-
Ag+ + NO3-
NaHSO4 =
NaHCO3 =
H2SO4 =
Ba(OH)2 =
Na+ + H+ + SO42-
Na+ + HCO3-
2H+ + SO42-
Ba2+ + 2OH-
H2SO4是强酸,
H2CO3是弱酸。
强酸可以完全电离!
电解质的溶液中所有阳离子所带的正电荷数与所有阳离子所带的负电荷数相等,故显电中性,常称电荷守恒。
3、电解质溶液不显电性(电荷守恒)
由硫酸钾、硫酸铝和硫酸组成的混合1L溶液,其中n(Al3+) = 0.4mol、n(SO42-) = 0.8mol、 n(H+) = 0.1mol,则 n(K+)为
A. 0.15 mol B. 0.2 mol
C. 0.3 mol D. 0.4 mol
4、酸、碱、盐
电离方程式:
HNO3 = H+ + NO3-
HCl = H+ + Cl-
H2SO4 = 2H+ + SO42-
酸:电解质电离时生成的阳离子全部是氢离子(H+)的化合物叫做酸。
KOH = K+ + OH-
Ba(OH)2 = Ba2+ + 2OH-
NaOH = Na+ + OH-
碱:电离时生成的阴离子全部是氢氧根离子(OH-)的化合物叫做碱。
电离方程式:
Na2CO3 = 2Na+ + CO32-
MgSO4 = Mg2+ + SO42-
BaCl2 = Ba2+ + 2Cl-
盐:电离时生成金属离子和酸根离子的化合物叫做盐。
电离方程式:
三. 电解质与非电解质
电解质:在水溶液中或熔融状态下能导电的化合物。
非电解质:在水溶液中和熔融状态下都不能导电的化合物。
电离:电解质在水溶液中或熔融状态下产生自由移动的离子的过程。
电解质溶液不显电性-电荷守恒
课堂小结
酸:电解质电离时生成的阳离子全部是氢离子(H+)的化合物。
碱:电离时生成的阴离子全部是氢氧根离子(OH-)的化合物。
盐:电离时生成金属离子和酸根离子的化合物。
1、下列说法正确的是( )
A.硫酸钡不溶于水,所以硫酸钡是非电解质
B.二氧化碳溶于水可以导电,所以二氧化碳是电解质
C.硫酸是电解质,所以硫酸在熔融时或溶于水时都能导电
D.液态氯化氢不能导电,但氯化氢是电解质
D
课堂练习
【解析】硫酸钡虽不溶于水,但它在熔融状态下能导电,故硫酸钡是电解质,A错;二氧化碳在熔融状态下不导电,溶于水生成碳酸可以导电,即二氧化碳的水溶液导电的原因是碳酸能电离出带电粒子,故二氧化碳不是电解质,B错;硫酸是电解质,因其溶于水时能导电,但熔融状态下的硫酸仅存在硫酸分子,不存在自由移动的离子,故熔融状态下的硫酸不导电,C错;液态氯化氢不能导电,但在水溶液中能导电,所以氯化氢是电解质,D正确。
2、下列物质的水溶液能导电,但属于非电解质的是( )
A.HNO3 B.Cl2 C.SO2 D.NH4NO3
【解析】选C。HNO3、NH4NO3均是电解质,Cl2是单质,既不是电解质也不是非电解质。SO2自身不能电离出自由移动的离子,所以是非电解质。
C
3、下列物质中属于电解质的是( )
属于非电解质的是( )
③碳酸氢钠
②氢氧化钠
④酒精
①醋酸
⑤铜
⑥二氧化硫
⑦生石灰
⑧硫酸钡
⑨氯化氢
①
②
③
⑧
⑨
⑦
⑥
④
课后思考
酸和碱都有强弱之分,弱酸弱碱是由于在水中不能完全电离出H+或OH-,而部分以分子的形式存在。这就会导致这些弱酸弱碱所对应的盐类的水溶液也会水解为弱酸弱碱的分子,那么NaCO3溶液中存在哪几种粒子呢?
CO32 + H2O HCO3 + OH
HCO3 + H2O H2CO3 + OH
看
观
谢
谢
